Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
FeSO4+KClO3+h3SO4=Fe2(SO4)3+KCl+h3O
Решено
Аспирин(ацетилсалициловая кислота) имеет следующий состав:4,5%. ..
..
тепловой эффект химических реакций
Решено
1) Na2O+….=NaOH 2) K2O+…=KCL+h3O 3) Ph4+…=P2O5+h3O 4) SO3+….=Na2SO4+….
Fe HNO3(конц ) → Fe2O3…
Пользуйтесь нашим приложением
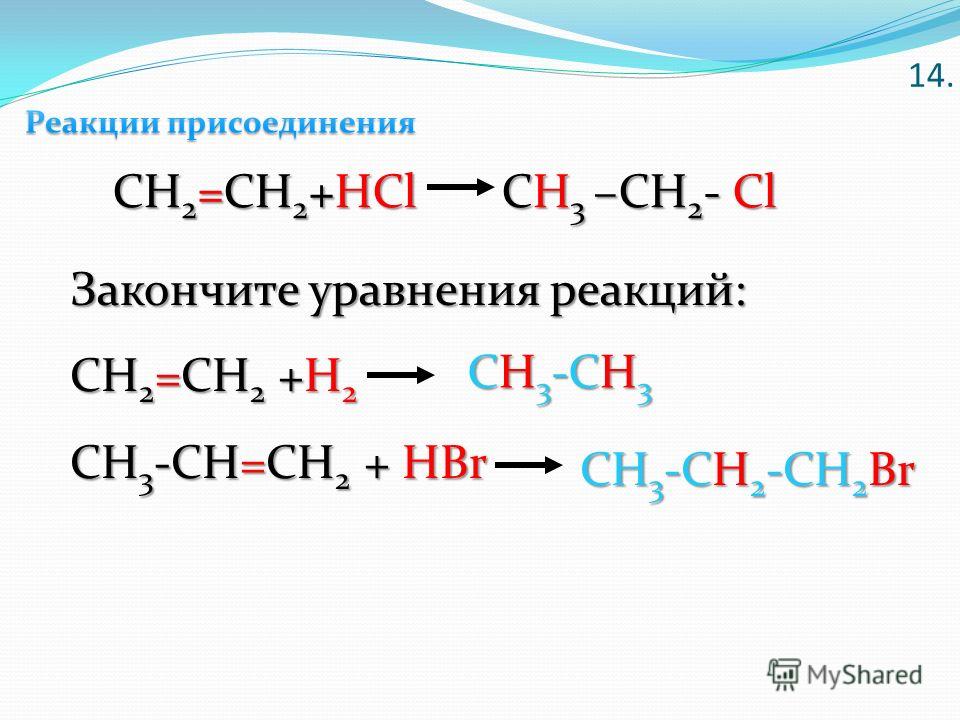
\\[C{H_3} — CH = C{H_2} + C{l_2}\\xrightarrow{{773K
Дата последнего обновления: 30 декабря 2022 г. Просмотров сегодня: 17.00k
Ответ
Проверено
170.7k+ просмотров
Подсказка: Реагент, присутствующий здесь, представляет собой алкен, вступающий в реакцию с хлором при очень высокой температуре. Это процесс аллильного замещения алкена при очень высокой температуре в газовой фазе.
Полный пошаговый ответ:
Аллильное положение – это положение, промежуточно примыкающее к двойной связи. Аллильное положение представляет характерные химические свойства. Некоторые аллильные соединения специально стабилизированы за счет соседних двойных связей.
Некоторые аллильные соединения специально стабилизированы за счет соседних двойных связей.
Специфика аллильных систем проявляется в их химических реакциях. Обычно при комнатной температуре хлор и бром присоединяются к двойным связям алкенов. При более высокой температуре реакция присоединения все больше вытесняется аллильным замещением, особенно при низкой концентрации галогена.
Реакция замещения, также известная как реакция одиночного замещения, представляет собой химическую реакцию, в ходе которой одна функциональная группа в химическом соединении заменяется другой функциональной группой. Реакции замещения бывают электрофильными или нуклеофильными. От используемого реагента зависит, является ли он карбокатионом, карбанионом или свободным радикалом, а также от того, является ли субстрат алифатическим или ароматическим.
Когда при высокой температуре происходит аллильное замещение, молекулы хлора гомолитически расщепляются тепловой энергией на два радикала хлора. Затем они подвергаются аллильному замещению без разрыва двойной связи. Хлор замещает водород альфа-атома углерода и образует следующий продукт:
Хлор замещает водород альфа-атома углерода и образует следующий продукт:
\[C{H_3} — CH = C{H_2} + C{l_2} \to ClC{H_2} — CH = C{H_2}\]
Примечание:
Нуклеофильное и электрофильное замещение различаются по типу атом, присоединенный к исходной молекуле. В нуклеофильной реакции говорят, что атом является частицей, богатой электронами, тогда как в электрофильной реакции атом является частицей с дефицитом электронов.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
Галогенирование алканов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 864
- Уильям Ройш
- Университет штата Мичиган
Хлорирование метана путем замещения
Галогенирование представляет собой замену одного или нескольких атомов водорода в органическом соединении галогеном (фтором, хлором, бромом или йодом). В отличие от сложных превращений горения, галогенирование алкана, по-видимому, представляет собой простую реакцию замещения , в которой разрывается связь С-Н и образуется новая связь С-Х. Хлорирование метана, показанное ниже, представляет собой простой пример этой реакции.
В отличие от сложных превращений горения, галогенирование алкана, по-видимому, представляет собой простую реакцию замещения , в которой разрывается связь С-Н и образуется новая связь С-Х. Хлорирование метана, показанное ниже, представляет собой простой пример этой реакции.
CH 4 + Cl 2 + энергия → CH 3 Cl + HCl
Поскольку разрываются только две ковалентные связи (C-H и Cl-Cl) и образуются две ковалентные связи (C-Cl и H-Cl), эта реакция кажется идеальным случаем для изучения механизмов и предположений. Однако одна сложность заключается в том, что все атомы водорода алкана могут подвергаться замещению, что приводит к смеси продуктов, как показано в следующем несбалансированном уравнении 
CH 4 + Cl 2 + энергия → CH 3 Cl + CH 2 Cl 2 + CHCl 3 + CCl 4 + HCl
Эмпирические соображения
Следующие факты должны учитываться любым разумным механизмом реакции галогенирования.
- Реакционная способность галогенов уменьшается в следующем порядке: F 2 > Cl 2 > Br 2 > I 2 .
- Мы ограничим наше внимание хлором и бромом, так как фтор настолько взрывоопасн, что его трудно контролировать, а йод вообще нереакционноспособен.
- Хлорирование и бромирование обычно экзотермичны.
- Энергия в виде тепла или света необходима для инициирования этих галогенирований.
- Если для инициирования галогенирования используется свет, тысячи молекул реагируют на каждый поглощенный фотон света.
- Реакции галогенирования могут проводиться как в газовой, так и в жидкой фазе.

- При хлорировании в газовой фазе присутствие кислорода (ловушки радикалов) тормозит реакцию.
- В жидкофазном галогенировании радикальные инициаторы, такие как пероксиды, облегчают реакцию.
Наиболее вероятным механизмом галогенирования является цепная реакция с участием нейтральных промежуточных соединений, таких как свободные радикалы или атомы. Самой слабой ковалентной связью в реагентах является связь галоген-галоген (Cl-Cl = 58 ккал/моль; Br-Br = 46 ккал/моль), поэтому инициирующей стадией является гомолитический разрыв этой связи под действием тепла или света, обратите внимание, что хлор и бром поглощают видимый свет (они окрашены). Описан механизм цепной реакции хлорирования метана. Бромирование алканов происходит по аналогичному механизму, но более медленно и более селективно, поскольку атом брома является менее реактивным агентом отщепления водорода, чем атом хлора, что отражает более высокая энергия связи H-Cl, чем H-Br.
Селективность
При галогенировании алканов крупнее этана образуются изомерные продукты.
\[CH_3CH_2CH_3 + 2Cl_2 \rightarrow \text{Четыре} \; C_3H_6Cl_2 \; \text{изомеры} + 2 HCl\]
Галогенирование пропана раскрывает интересную особенность этих реакций. Все атомы водорода в сложном алкане не обладают одинаковой реакционной способностью . Например, пропан имеет восемь атомов водорода, шесть из которых структурно эквивалентны первичным , а два других — вторичным . Если бы все эти атомы водорода были одинаково реакционноспособны, галогенирование должно давать моногалогенированные продукты 1-галогенпропана и 2-галогенпропана в соотношении 3:1, отражая первичные/вторичные числа.
CH 3 -CH 2 -CH 3 + CL 2 → 45% CH 3 -CH 2 -CH 2 CL + 55% CH 3 -CHCL -Ch 3
Результаты бромирования (индуцированного светом при 25 ºC) еще более удивительны: 2-бромпропан составляет 97% монобромсодержащего продукта.
CH 3 -CH 2 -CH 3 + Br 2 → 3% CH 3 -CH 2 -CH 2 Br + 97% CH 3 -CHBr-CH 3
Эти результаты убедительно свидетельствуют о том, что 2°-водороды по своей природе более реакционноспособны, чем 1°-водороды, примерно в 3:1 раза. Дальнейшие эксперименты показали, что 3º-водороды еще более реакционноспособны по отношению к атомам галогенов. Так, светоиндуцированное хлорирование 2-метилпропана дало преимущественно (65%) 2-хлор-2-метилпропан, продукт замещения единственного 3º-водорода, несмотря на присутствие в молекуле девяти 1º-водородов.
(Ch 3 ) 3 CH + CL 2 → 65% (CH 3 ) 3 CCL + 35% (CH 3 ) 2 CCH 2 CL
Из обзора двух стадий свободнорадикальной цепной реакции галогенирования должно быть ясно, что первая стадия (отщепление водорода) является стадией определения продукта . После образования углеродного радикала последующее связывание с атомом галогена (на втором этапе) может происходить только в месте радикала. Следовательно, понимание предпочтительности замещения у 2-х и 3-х атомов углерода должно исходить из анализа этого первого шага.
Первый этап: R 3 CH + X · → R 3 C · + H-X
Вторая ступень: R 3 C · + X 2 → R 3 CX + X ·
Поскольку продукт H-X является общим для всех возможных реакций, различия в реакционной способности можно объяснить только различиями в энергиях диссоциации связи C-H. В нашем предыдущем обсуждении энергии связи мы предполагали средние значения для всех связей данного типа, но теперь мы видим, что это не совсем так. В случае углерод-водородных связей существуют значительные различия, и были измерены удельные энергии диссоциации (энергия, необходимая для гомолитического разрыва связи) для различных видов связей С-Н. Эти значения приведены в следующей таблице.
В нашем предыдущем обсуждении энергии связи мы предполагали средние значения для всех связей данного типа, но теперь мы видим, что это не совсем так. В случае углерод-водородных связей существуют значительные различия, и были измерены удельные энергии диссоциации (энергия, необходимая для гомолитического разрыва связи) для различных видов связей С-Н. Эти значения приведены в следующей таблице.
| R (в R–H) | метил | этил | изопропил | т-бутил | фенил | бензил | аллил | винил |
|---|---|---|---|---|---|---|---|---|
| Энергия диссоциации связи (ккал/моль) | 103 | 98 | 95 | 93 | 110 | 85 | 88 | 112 |
Разница в энергиях диссоциации связи C-H, указанная для первичных (1º), вторичных (2º) и третичных (3º) центров, согласуется с наблюдениями за галогенированием, приведенными выше, в том смысле, что мы ожидаем, что более слабые связи будут разрываться легче, чем являются прочными связями. Исходя из этого, мы ожидаем, что бензильные и аллильные центры будут исключительно реакционноспособными при свободнорадикальном галогенировании, как показали эксперименты. Метильная группа толуола, C 6 H 5 CH 3 , легко хлорируется или бромируется в присутствии свободнорадикальных инициаторов (обычно пероксидов), а этилбензол аналогичным образом хлорируется исключительно в бензильном положении. Водороды, связанные с ароматическим кольцом (упомянутые выше как фенильные атомы водорода), имеют относительно высокие энергии диссоциации связи и не являются замещенными.
Исходя из этого, мы ожидаем, что бензильные и аллильные центры будут исключительно реакционноспособными при свободнорадикальном галогенировании, как показали эксперименты. Метильная группа толуола, C 6 H 5 CH 3 , легко хлорируется или бромируется в присутствии свободнорадикальных инициаторов (обычно пероксидов), а этилбензол аналогичным образом хлорируется исключительно в бензильном положении. Водороды, связанные с ароматическим кольцом (упомянутые выше как фенильные атомы водорода), имеют относительно высокие энергии диссоциации связи и не являются замещенными.
Поскольку двойные углерод-углеродные связи быстро присоединяют хлор и бром в жидкофазных растворах, реакции свободнорадикального замещения алкенов этими галогенами необходимо проводить в газовой фазе или другими способами галогенирования. реагенты. Одним из таких реагентов является N-бромсукцинимид (NBS), показанный во втором уравнении ниже. При использовании NBS в качестве бромирующего агента аллильное бромирование легко достигается в жидкой фазе.
реагенты. Одним из таких реагентов является N-бромсукцинимид (NBS), показанный во втором уравнении ниже. При использовании NBS в качестве бромирующего агента аллильное бромирование легко достигается в жидкой фазе.
Гомолизы ковалентных связей, которые определяют перечисленные выше энергии диссоциации связи, могут быть описаны общим уравнением:
Энергии диссоциации связи C-H обычно интерпретируются с точки зрения стабильности радикалов. Однако эта интерпретация была поставлена под сомнение Гронертом. Самое главное, с точки зрения селективности свободнорадикальных реакций, имеет значение энергия связей, а не то, почему они такие, какие они есть.
Авторы
- Уильям Ройш, почетный профессор (штат Мичиган, Университет штата Мичиган), Виртуальный учебник органической химии
Эта страница под названием «Галогенирование алканов» распространяется по незаявленной лицензии, автором, ремиксом и/или куратором которой является Уильям Ройш.

 01.15
01.15