Вариант 8 1 Определите молярную массу эквивалента вещества Cr(OH)2NO3 в реакции
Вариант 8
1. Определите молярную массу эквивалента вещества Cr(OH)2NO3 в реакции:
Cr(OH)2NO3 + 2HNO3 → Cr(NO3)3 + 2h3O.
Решение:
Две гидрокси-группы в веществе Cr(OH)2NO3 замещаются на два атома водорода, следовательно, эквивалент вещества Cr(OH)2NO3 равен 2 (Э = 2), а молярная масса эквивалента равна
, где – молярная масса дигидроксонитрата хрома (III).
Ответ:
2. Через раствор, содержащий 5г едкого натра, пропустили 6,5 л сероводорода (н.у.). Какая соль и в каком количестве образовалась?
Решение:
Возможные реакции:
1) NaOH + h3S = NaHS + h3O
2) 2NaOH + h3S = Na2S + 2h3O
Чтобы определить, по какому пути пойдёт реакция, найдём количества веществ едкого натра и сероводорода
Видно, что едкого натра большой недостаток, поэтому пойдёт реакция №1, и именно ею будут определяться продукты. Следовательно, образовалась кислая соль гидросульфида натрия, n(NaHS) = 0,125 моль.
3. Вывести простейшую формулу кристаллогидрата, если после прокаливания 2,03г его получилось 0,95г MgCl2.
Решение:
Найдём количество вещества хлорида магния
В результате прокаливания из кристаллогидрата испаряется вода. Рассчитаем массу испарившейся воды.
Найдём количество вещества выделившейся воды
Напишем простейшую формулу кристаллогидрата
Следовательно, простейшая формула кристаллогидрата имеет вид .
Ответ: .
4. Осуществите следующие превращения. Записать уравнения реакций в ионной форме (полной и сокращённой):
Al2O3 → Al2(SO4)3 → Al(OH)3 → AlOHCl2 → Al(OH)3
Решение:
Al2O3 → Al2(SO4)3 → Al(OH)3 → AlOHCl2 → Al(OH)3
– молекулярное уравнение
– полное ионное уравнение
– сокращённое ионное уравнение
– молекулярное уравнение
– полное ионное уравнение
– сокращённое ионное уравнение
– молекулярное уравнение
– полное ионное уравнение
– сокращённое ионное уравнение
– молекулярное уравнение
– полное ионное уравнение
– сокращённое ионное уравнение
Вариант 8
Сколько мл концентрированного раствора хлористоводородной кислоты (плотность 1,15 г/см3) нужно взять для приготовления 0,5 л 0,1 н раствора?
Решение:
Нормальность раствора – это отношение эквивалентного количества растворенного вещества, моль-экв.
 , к объему раствора, л.
, к объему раствора, л.Сн = nэ / V [моль-экв./л].
nэ – количество вещества эквивалента, nэ = n/f.
f – фактор эквивалентности, т.е. число, показывающее, какая часть молекулы (молярной массы) соответствует одному эквиваленту.
Поскольку nэ = m/Mr·f,
Сн = m/(Mr·V·f)
Найдём объём раствора хлористоводородной кислоты
Ответ:
Вычислить нормальность рабочего раствора соляной кислоты, если на титрование 25,00 мл 0,1006 н раствора карбоната натрия израсходовано 25,44 мл раствора кислоты.
Из закона эквивалентов, C1V1 = C2V2.
Ответ: .
Вычислить pH начала и конца скачка титрования при титровании 100 мл 0,5 н раствора гидроксида аммония 0,5 н раствором хлористоводородной кислоты без учёта разбавления.
Решение:
Нормальности растворов одинаковы, значит на титрование 100 мл раствора гидроксида аммония понадобится ровно 100 мл раствора хлористоводородной кислоты.
При ручном титровании (из бюретки или пипетки) объем 1 капли составляет от 0,025 до 0,05 мл (зависит от диаметра наконечника).
 Для определенности примем объем 1 капли 0,05 мл. Значит 100 мл составят 100/0,05=2000 капель. Когда прилито 99,95 мл (1999 капель) концентрация гидроксида аммония (без учета разбавления) составит 1/2000 от начальной, т. е 0,5·(1/2000)=0,00025 экв/л. В этот момент pH=14 + lg(0,00025) = 10,4. При приливании последней (2000-й) капли pH=7, а при приливании 2001-й капли концентрация ионов Н+ станет равна 0,00025 экв/л. В этот момент pH=-lg(0,00025) = 3,6.
Для определенности примем объем 1 капли 0,05 мл. Значит 100 мл составят 100/0,05=2000 капель. Когда прилито 99,95 мл (1999 капель) концентрация гидроксида аммония (без учета разбавления) составит 1/2000 от начальной, т. е 0,5·(1/2000)=0,00025 экв/л. В этот момент pH=14 + lg(0,00025) = 10,4. При приливании последней (2000-й) капли pH=7, а при приливании 2001-й капли концентрация ионов Н+ станет равна 0,00025 экв/л. В этот момент pH=-lg(0,00025) = 3,6.Таким образом, рН начала скачка 10,4, конца 3,6, а скачок будет равен 10,4-3,6 =6,8.
Ответ: рН начала скачка 10,4, конца 3,6.
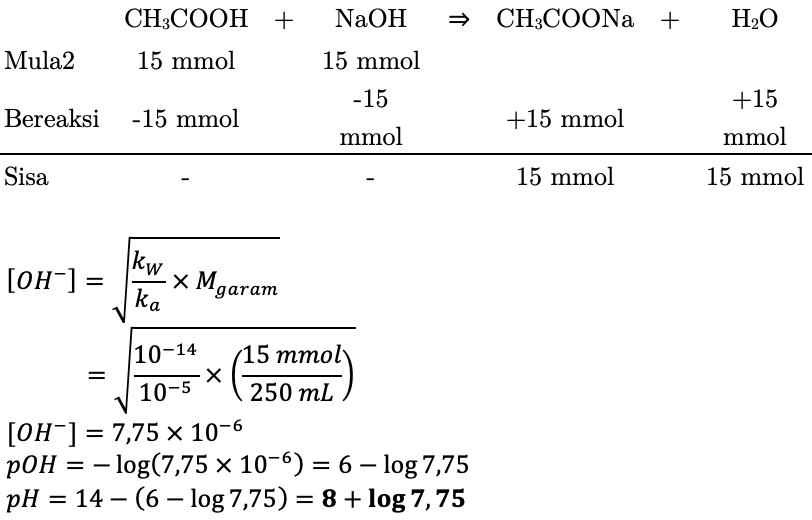
Вычислить концентрацию ионов водорода в точке эквивалентности при титровании 200 мл 0,2 н раствора уксусной кислоты 0,2 н раствором гидроксида натрия с учётом разбавления.
Решение:
В точке эквивалентности выполняется закон эквивалентов.
n(1/z HCOOH) = n(1/z NaOH)
Сн(НСООН)·V(HCOOH) = Сн(NaOH)·V(NaOH)
Отсюда эквивалентный объем гидроксида натрия.
V(NaOH) = Сн (НСООН)·V(HCOOH)/Сн(NaOH) = 0,2·0,2/0,2 = 0,2 л = 200 мл
В точке эквивалентности в результате реакции нейтрализации образуется ацетат натрия Ch4COONa – соль, образованная сильным основанием NaOH и слабой кислотой Ch4COOH, гидролизуемая в водном растворе по аниону.

Ch4COONa + h3O ↔ Ch4COOH + NaOH
Ch4COO- + h3O ↔ Ch4COOH + OH- (рН > 7 – среда щелочная)
По закону эквивалентов количество вещества эквивалента ацетата натрия.
n(1/zCh4COONa) = n(1/zCh4COOH) = Сн(Ch4СООН)·V(Ch4COOH) = 0,2·0,2 = 0,04 моль/экв
Нормальная концентрация ацетата натрия в растворе в точке эквивалентности
Сн(Ch4COONa) = n(1/z Ch4COONa)/[V(NaOH) + V(Ch4COOH)] = 0,04/(0,2 + 0,2) = 0,1н
Эквивалентное число ацетата натрия Ch4COONa
z(Ch4COONa) = z(Na)·x(Na) = 1·1 = 1
z(Na) = 1 – валентность натрия в ацетате натрия Ch4COONa
x(Na) = 1 – число атомов натрия в ацетате натрия Ch4COONa
Молярная концентрация ацетата натрия в точке эквивалентности
См(Ch4COONa) = Сн(Ch4COONa)/z(Ch4COONa) = 0,1/1 = 0,1М
Водородный показатель раствора в точке эквивалентности.
pH = 7 – 0,5*lg[Kd(Ch4COOH)/См (Ch4COONa)] = 7 – 0,5·lg[1,74·10-4/0,1] = 8,38 > 7 – среда щелочная
Как видим, точка эквивалентности не совпадает с точкой нейтральности (рН = 7) и лежит в области щелочной среды (рН > 7).
Концентрация ионов водорода в точке эквивалентности.
Ответ:
Какой из перечисленных ниже индикаторов пригоден для условий титрования, приведённых в пункте 3.
Интервал перехода
Бромкрезоловый зелёный 3,8 – 5,4
Тропеолин 0 11,0 – 13,0
Амуариновый жёлтый ЖЖ 10,0 – 12,0
Фенолфталеин 8,0 – 9,6
Решение:
Скачок титрования для условий титрований, приведённых в пункте 3, наблюдается в интервале рН = 10,4 – 3,6. В этот скачок титрования частично укладываются интервалы перехода окраски бромкрезолового зелёного (3,8 – 5,4) и фенолфталеина (8,0 – 9,6).
Ответ: бромкрезоловый зелёный, фенолфталеин.
2-бромпропан, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Рассчитайте массу ацетата натрия (Ch4COONa), необходимого для приготовления 500 мл воды.
0,375 М раствор означает 0,375 моль в 1 л раствора.
1000 мл раствора содержит 0,375 молей
1 мл раствора. 375/1000.moles
500 мл раствора 0,375/1000 x 500 ÿ 0,1875
№ молей = масса/молярная масса
0,1875mol = Mass /82.0245 GMOL’1
0,1875MOL = Mass /82.0245.0015 ˆ´ Масса соединения = 15,37 г.
72
Поделиться
7 студентов задали один и тот же вопрос в Filo
Узнайте из их индивидуальной беседы с преподавателями Filo.
4 мин.
Загружено: 22.09.2022
, преподавая
Мгновенно подключить с этим репетитором
Connect Now
106
Share
2 мин.
Преподает
Мгновенное подключение к этому репетитору
Connect Now
135
Share
5 мин.
Загружено: 05.10.2022
.
Загружено по телефону: 22.09.2022
, преподаваемого
Мгновенно подключить с этим репетитором
Connect Now
147
Share
5 мин
Загружено на: 9/17/2022
Tophate By
.0003
Подключите мгновенно с этим репетитором
Connect Now
82
Share
9 МИНС
Загружено на: 17.09.2022
, преподаваемой
Mongenlly с этим репетитором
Connect Now
3999999999
.
Акция
6 мин
Загружено по телефону: 18.09.2022
, преподававшегося
СООБЩЕНИЕ Мгновенно с этим репетитором
Connect
79
Акция
Connect с 50000+ экспертов за 60 секунд, 24×7.
Спросите преподавателя
Связанные книги с вопросами по некоторым основным понятиям химии
New Pattern JEE Problems Chemistry for JEE Main and Advance (Master Problem Package)
Arihant
Dr R K Gupta
Physical in Chests and Solutions для JEE (Main and Advanced)
Pearson
Neeraj Kumar
IIT JEE Advanced Comprehensive Chemistry
McGraw Hill Education (India) Private Limited
K.L.Kapoor
Проблема продвижения в органической химии
GRB
Himanshu Pandey
Физическая химия I для IIT JEE Main и Advanced
McGraw Hill Education (India) Private Limited
Ranveer Singh
Органическая химия для IIT JEE
Pearh
Органическая химия для IIT JEE
Pearhs
Органическая химия для IIT JEE
Pearh.
Атул Сингхал
Дополнительные задачи по органической химии для JEE
Шри Баладжи
M.S. Chouhan
Химия Часть I
NCERT
Рассчитайте массу ацетата натрия (Ch4COONa), необходимую для приготовления 500 мл 0,375-молярного водного раствора.
 Молярная масса ацетата натрия 82,0245 г моль–1. : Кейсонс Образование
Молярная масса ацетата натрия 82,0245 г моль–1. : Кейсонс ОбразованиеВидеолекции
Доступ к более чем 500 часам видеолекций в режиме 24/7, охватывающих полную программу подготовки к ЕГЭ.
Онлайн-поддержка
Отработайте более 30000+ вопросов, начиная с базового уровня и заканчивая продвинутым уровнем JEE.
Сеанс устранения сомнений в реальном времени
Задавайте свои сомнения в прямом эфире каждый день. Присоединяйтесь к нашему сеансу устранения сомнений в прямом эфире, проводимому нашими экспертами.
Национальные пробные тесты
Проведите тесты, чтобы проанализировать свой прогресс и оценить, на каком уровне вы находитесь с точки зрения подготовки к ЕГЭ.
Организованное обучение
Правильное планирование завершения учебного плана является ключом к получению достойного рейтинга в JEE.
Серия тестов/Ежедневные задания
Проведите тесты, чтобы проанализировать свой прогресс и оценить, на каком уровне вы находитесь с точки зрения подготовки к ЕГЭ.
ПОГОВОРИТЬ С КОНСУЛЬТАНТОМ? НАЖМИТЕ ЗДЕСЬ
Загрузить вопросник и решение JEE Загрузить Важные вопросы JEE Загрузить полную программу по математике, физике и химии
Рассчитайте массу ацетата натрия (CH 3 COONa), необходимую для приготовления 500 мл 0,375-молярного водного раствора. Молярная масса ацетата натрия составляет 82,0245 г моль –1 .
15,380 г
11 420 г
9,340 г
12,380 г
легкий
Раствор
Правильный вариант
15,380 г
0,375 М водного раствора означает, что 100 мл раствора содержат ацетат натрия = 0,375 моль
∴ 500 мл раствора должны содержать ацетат натрия
Молярная масса ацетата натрия = 82,0245 г моль –1
Загрузить вопросник и решение JEE Загрузить Важные вопросы JEE Загрузить полную программу по математике, физике, химии
ПОХОЖИЕ ВОПРОСЫ
Q1
Рассчитайте молекулярную массу молекулы глюкозы (C 6 H 12 O 6 ).
легкий Посмотреть решение
Q2
Раствор готовят добавлением 2 г вещества А к 18 г воды. Рассчитайте массовую долю растворенного вещества.
легкий Посмотреть решение
3 квартал
Плотность 3 М раствора NaCl – 1,25 г·мл –1 . Рассчитайте моляльность раствора.
легко Посмотреть решение
4 квартал
Сколько граммов NaOH нужно растворить, чтобы получить 100 см –3 0,15 М раствора NaOH?
легкий Посмотреть решение
Q5
Рассчитайте количество молекул щавелевой кислоты в 100 мл 0,02 н. раствора щавелевой кислоты.
легкий Посмотреть решение
Q6
Рассчитайте молярность воды, если ее плотность равна 100 кг/м 3
легко Посмотреть решение
Q7
Рассчитайте процентное содержание катиона в бихромате аммония.
легкий Посмотреть решение
Q8
Рассчитайте процент кристаллизационной воды в образце медного купороса (CuSO 4 .
