Сведения об образовательной организации МГАВМиБ
Нормативная правовая база, регламентирующая представление информации об образовательной организации в открытых источниках с учетом соблюдения требований законодательства в сфере образования для образовательных организаций высшего образования
- Статья 29 Федерального закона “Об образовании в Российской Федерации” от 29.12.2012 № 273-ФЗ
- Приказ Федеральной службы по надзору в сфере образования и науки от 14.08.2020 № 831 «Об утверждении Требований к структуре официального сайта образовательной организации в информационно-телекоммуникационной сети «Интернет» и формату представления информации
- Постановление Правительства Российской Федерации от 20.10.2021 № 1802 «Об утверждении Правил размещения на официальном сайте образовательной организации в информационно-телекоммуникационной сети «Интернет» и обновления информации об образовательной организации, а также о признании утратившими силу некоторых актов и отдельных положений некоторых актов Правительства Российской Федерации»
- Основные сведения
Информация о дате создания образовательной организации, об учредителе, о месте нахождения образовательной организации и ее филиалов, режиме, графике работы, контактных телефонах и об адресах электронной почты.

- Структура и органы управления образовательной организацией
Данный раздел содержит информацию о структуре и об органах управления образовательной организации, в том числе о наименовании структурных подразделений, руководителях структурных подразделений, местах нахождения структурных подразделений, адресах официальных сайтов, адресах электронной почты структурных подразделений (при наличии), сведения о наличии положений о структурных подразделениях.
- Документы
Данный раздел содержит копии следующий документов: устав образовательной организации, лицензия на осуществление образовательной деятельности (с приложениями), свидетельство о государственной аккредитации (с приложениями), план финансово-хозяйственной деятельности, правила внутреннего распорядка, коллективный договор, отчет о результатах самообследования, документ о порядке оказания платных образовательных услуг (в том числе образец договора об оказании платных образовательных услуг), приказы об утверждении стоимости обучения по каждой образовательной программе, предписания органов, осуществляющих государственный контроль (надзор) в сфере образования, отчеты об исполнении таких предписаний.

- Образование
Информация о реализуемых уровнях образования, о формах обучения, нормативных сроках обучения, сроке действия государственной аккредитации образовательной программы, об описании образовательной программы с приложением ее копии, об учебном плане с приложением его копии, об аннотации к рабочим программам дисциплин с приложением их копий, о календарном учебном графике с приложением его копии и т.д.
- Образовательные стандарты
Информация о федеральных государственных образовательных стандартах и об образовательных стандартах.
- Руководство. Педагогический (научно-педагогический) состав
Информация о руководителе образовательной организации, его заместителях, руководителях филиалов, о персональном составе педагогических работников.
- Материально-техническое обеспечение и оснащенность образовательного процесса
Информация о материально-техническом обеспечении образовательной деятельности
- Стипендии и иные виды материальной поддержки
Информация о наличии и предоставления стипендий, о наличии общежития, количестве жилых помещений в общежитии, формировании платы за проживание в общежитии и иных видов материальной поддержки обучающихся, о трудоустройстве выпускников
- Платные образовательные услуги
Информация о порядке оказания платных образовательных услугах
- Финансово-хозяйственная деятельность
Информация об объеме образовательной деятельности, финансовое обеспечение которой осуществляется за счет бюджетных ассигнований федерального бюджета, бюджетов субъектов РФ, местных бюджетов, по договорам об образовании за счет средств физических и (или) юридических лиц, о поступлении финансовых и материальных средств и об их расходовании по итогам финансового года.

- Вакантные места для приема (перевода)
Информация о количестве вакантных мест для приема (перевода) по каждой образовательной программе, профессии, специальности, направлению подготовки.
- Международное сотрудничество
Информация о договорах с иностранными и (или) международными организациями по вопросам образования и науки.
- Доступная среда
Информация об условиях созданных для инвалидов и лиц с ограниченными возможностями здоровья в Академии.
Концентрация растворов
Способы выражения концентрации растворов
Существуют
различные способы выражения состава раствора. Наиболее часто используют
массовую долю растворённого вещества, молярную и нормальную
концентрацию.
Массовая доля растворённого вещества w(B) — это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:
w(B)= m(B) / m
Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах.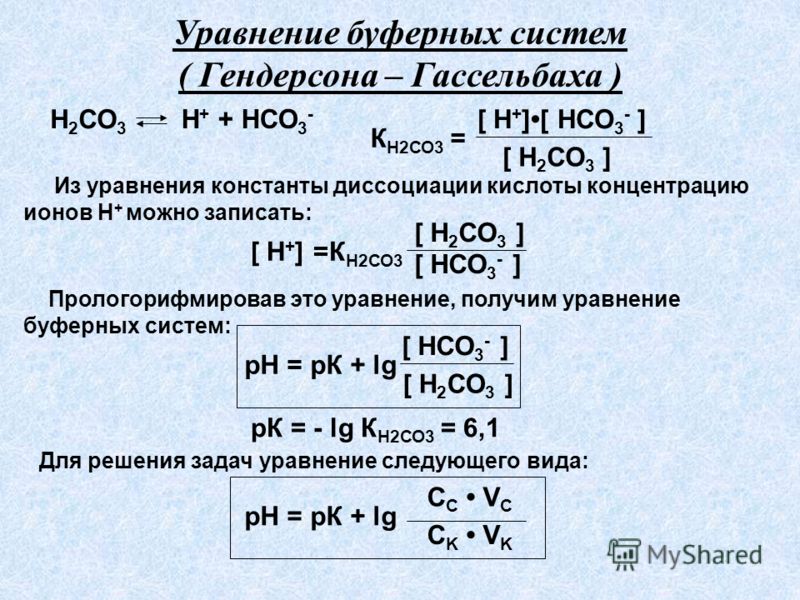 Например, массовая доля растворённого вещества — CaCl2
в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция
массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Например, массовая доля растворённого вещества — CaCl2
в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция
массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Пример
Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение
m(Na2SO4) = w(Na2SO4) / 100 = (5300) / 100 = 15 г
где w(Na2SO4) — массовая доля в %,
m — масса раствора в г
m(H2O) = 300 г — 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4 и 285 г воды.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B)V),
где М(B) — молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается «M». Например, 2 MNaOH — двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Пример
Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение M(K2CrO4) = C(K2CrO4)
V M(K2CrO4) = 0,1 моль/л 1,2 л 194 г/моль = 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
Концентрацию раствора можно выразить
количеством молей растворённого вещества в 1000 г растворителя. Такое
выражение концентрации называют моляльностью раствора.
Нормальность
раствора обозначает число грамм-эквивалентов данного вещества в одном
литре раствора или число миллиграмм-эквивалентов в одном миллилитре
раствора.
Грамм — эквивалентом вещества
называется количество граммов вещества, численно равное его
эквиваленту. Для сложных веществ — это количество вещества,
соответствующее прямо или косвенно при химических превращениях 1 грамму
водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
Пример
Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия.
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г
Э Al2(SO4)3 = М Al2(SO4)3 / (23) = 342 / 2= 57 г
Величины нормальности обозначают буквой «Н». Например, децинормальный раствор серной кислоты обозначают «0,1 Н раствор H2SO4«.
Так как нормальность может быть определена только для данной реакции,
то в разных реакциях величина нормальности одного и того же раствора
может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO 4.
Например, децинормальный раствор серной кислоты обозначают «0,1 Н раствор H2SO4«.
Так как нормальность может быть определена только для данной реакции,
то в разных реакциях величина нормальности одного и того же раствора
может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO 4.
Пример
Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение
Для вычисления молярности и нормальности надо знать число граммов H2SO4 в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 701000 / 61,92 = 1130,49 г H2SO4
Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M
Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H
Пересчет концентраций растворов из одних единиц в другие
При пересчете процентной
концентрации в молярную и наоборот, необходимо помнить, что процентная
концентрация рассчитывается на определенную массу раствора, а молярная
и нормальная — на объем, поэтому для пересчета необходимо знать
плотность раствора.
M = (cp 10) / m
N = (cp 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
Пример 1
Какова молярная и нормальная концентрация 12%-ного раствора серной кислоты, плотность которого р = 1,08 г/см3?
Решение
Мольная масса серной кислоты равна 98. Следовательно,
m(H2SO4) = 98 и э(H2SO4) = 98 : 2 = 49.
Подставляя необходимые значения в формулы, получим:
а) Молярная концентрация 12% раствора серной кислоты равна
M = (121,08 10) / 98 = 1,32 M
б) Нормальная концентрация 12% раствора серной кислоты равна
N = (121,08 10) / 49 = 2,64 H.
Иногда в лабораторной практике
приходится пересчитывать молярную концентрацию в нормальную и наоборот.
Если эквивалентная масса вещества равна мольной массе (Например, для
HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации.
Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором.
Однако для большинства соединений эквивалентная масса не равна мольной
и, следовательно, нормальная концентрация растворов этих веществ не
равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
M = (NЭ) / m
N = (Mm) / Э
Пример
Нормальная концентрация 1 М раствора серной кислоты N = (198) / 49 = 2 H.
Пример
Молярная концентрация 0,5 н. Na2CO3
M = (0,553) / 106 = 0,25 M.Упаривание, разбавление, концентрирование,
смешивание растворов
Имеется mг исходного раствора с массовой долей растворенного вещества w1 и плотностью r1.
Упаривание раствора
В результате упаривания исходного раствора его масса уменьшилась на Dm г. Определить массовую долю раствора после упаривания w2
Решение
Исходя из определения массовой доли, получим выражения для w1 и w2 (w2 > w1):
w1 = m1 / m
(где m1 — масса растворенного вещества в исходном растворе)
m1 = w1m
w2 = m1 / (m — Dm) = (w1m) / (m — Dm)
Пример
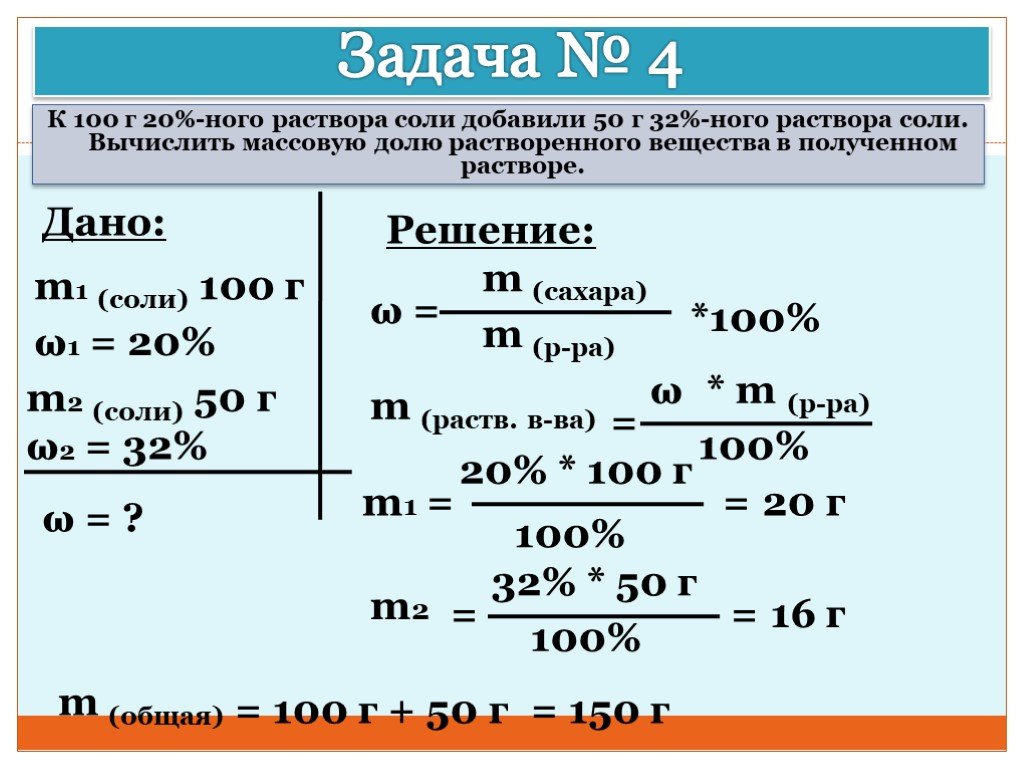
Упарили 60 г 5%-ного раствора сульфата меди до 50 г. Определите массовую долю соли в полученном растворе.
m = 60 г; Dm = 60 — 50 = 10 г; w1 = 5% (или 0,05)
w2 = (0,0560) / (60 — 10) = 3 / 50 = 0,06 (или 6%-ный)
Концентрирование раствора
Какую массу вещества (X г) надо
дополнительно растворить в исходном растворе, чтобы приготовить раствор
с массовой долей растворенного вещества w2?
Решение
Исходя из определения массовой доли, составим выражение для w1 и w2:
w1 = m1 / m2, (где m1 — масса вещества в исходном растворе).
m1 = w1m
w2 = (m1+x) / (m + x) = (w1m + x) / (m+x)
Решая полученное уравнение относительно х получаем:
w2m + w2 x = w1 m + x
w2m — w1 m = x — w2 x
(w2 — w1)
m = (1 — w2) x
x = ((w2 — w1)m) / (1 — w2)
Пример
Сколько граммов хлористого калия надо растворить в 90 г 8%-ного раствора этой соли, чтобы полученный раствор стал 10%-ным?
m = 90 г
w1 = 8% (или 0,08), w2 = 10% (или 0,1)
x = ((0,1 — 0,08) 90) / (1 — 0,1) = (0,02 90) / 0,9 = 2 г
Смешивание растворов с разными концентрациями
Смешали m1 граммов раствора №1 c массовой долей вещества w1 и m2 граммов раствора №2 c массовой долей вещества w2. Образовался раствор (№3) с массовой долей растворенного вещества w3. Как относятся друг к другу массы исходных растворов?
Образовался раствор (№3) с массовой долей растворенного вещества w3. Как относятся друг к другу массы исходных растворов?
Решение
Пусть w1 > w2, тогда w1 > w3 > w2. Масса растворенного вещества в растворе №1 составляет w1
m1, в растворе №2 — w2 m2. Масса образовавшегося раствора (№3) — (m1 — m2). Сумма масс растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся растворе (№3):
w 1m1 + w 2 m2 = w3 (m1 + m2)
w1m1 + w 2 m2 = w3 m1 + w3 m2
w 1m1 — w 3 m1 = w3 m2 — w2 m2
(w1— w3)m1 = (w3— w2) m2
m1 / m2 = (w3— w2 ) / (w1— w3)
Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания).
(Правило смешивания).
Для облегчения использования правила смешивания применяют правило креста :
| w1 \ |
|
(w3 — w2) / |
m1 |
| |
w3 | |
|
| / w2 |
|
\ (w1 — w3) |
m2 |
m1 / m2 = (w3 — w2) / (w1 — w3)
Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 — w3), w1 > w3 и (w3 — w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют.
Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют.
Пример
Определите массы исходных растворов
с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании
образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.
| 40% \ |
|
5% / |
m1 |
| |
10% | |
|
| / 5% |
|
\ 30% |
m2=210-m1 |
5 / 30 = m1 / (210 — m1)
1/6 = m1 / (210 — m1)
210 — m1 = 6m1
7m1 = 210
m1 =30 г; m2 = 210 — m1 = 210 — 30 = 180 г
Разбавление раствора
Исходя из определения массовой доли,
получим выражения для значений массовых долей растворенного вещества в
исходном растворе №1 (w1) и полученном растворе №2 (w2):
w1 = m1 / (r1V1) откуда V1= m1 /( w1 r1)
w2 = m2 / (r2V2)
m2 = w2r2 V2
Раствор №2 получают, разбавляя раствор №1, поэтому m1 = m2. В формулу для V1 следует подставить выражение для m2. Тогда
В формулу для V1 следует подставить выражение для m2. Тогда
V1= (w2r2 V2) / (w1 r1)
m2 = w2 • r2 • V2
или
| w1 • r1 • V1 | = | w2 • r2 • V2 |
| m1(раствор) | |
m2(раствор) |
m1(раствор) / m2(раствор) = w2 / w1
При одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу.
Пример
Определите массу 3%-ного раствора пероксида водорода, который можно получить разбавлением водой 50 г его 3%-ного раствора.
m1(раствор) / m2(раствор) = w2 / w1
50 / x = 3 / 30
3x = 50
30 = 1500
x = 500 г
Последнюю задачу можно также решить, используя «правило креста»:
| 30% \ |
|
3% / |
50 |
| |
3% | |
|
| / 0% |
|
\ 27% |
X |
3 / 27 = 50 / x
x = 450 г воды
450 г + 50 г = 500 г
Молярность концентрированных кислот и оснований
Молярность концентрированных кислот и оснований Молярность концентрированных кислот и основанийДля вашего удобства мы принимаем Mastercard, Кредитные карты VISA и American Express.

| Дом | Идеибук | Заказов | Цена/приложение | Цена/Продавец | Протоколы |
Концентрированные реактивы | Плотность | Молярность | Нормальный | Объем (мл) | |
1М | 1Н | ||||
| Уксусная кислота кислота 99,5% | 1,05 | 17,4 | 17,4 | 57,5 | 57,5 |
| Аммиак 35% | 0,880 | 18,1 | 18,1 | 55,3 | 55,3 |
| Аммиак 25% | 0,910 | 13,4 | 13,4 | 74,6 | 74,6 |
| Соляная кислота 36% | 1,18 | 11,65 | 11,65 | 85,8 | 85,8 |
| Соляная кислота 32% | 1,16 | 10,2 | 10,2 | 98,0 | 98,0 |
| Гидрофтористый кислота 40% | 1,13 | 22,6 | 22,6 | 44,2 | 44,2 |
| Азотная кислота 70% | 1,42 | 15,8 | 15,8 | 63,3 | 63,3 |
| Перхлорная кислота кислота 60% | 1,54 | 9,2 | 9,2 | 108,7 | 108,7 |
| Перхлорная кислота 70% | 1,67 | 11,6 | 11,6 | 86,2 | 86,2 |
| Ортофосфорные кислота 85% | 1,7 | 15,2 | 45,6 | 65,8 | 21,9 |
| Натрий гидроксид 47% | 1,5 | 17,6 | 17,6 | 56,7 | 56,7 |
| Серная кислота 98% | 1,84 | 18,4 | 36,8 | 54,3 | 27,2 |
| концентрированный Реагент | Формула | Плотность | Прибл. | Молярность | Нормальный | Объем (мл) | |
1 М | 1 Н | ||||||
| Уксусная кислота (CH 3 COOH) | 60.052 | 1,05 | 99,8% | 17,4 | 17,4 | 57,5 | 57,5 |
| Муравьиная кислота (HCOOH) | 46.026 | 1,13 | 90% | 23,6 | 23,6 | 42,5 | 42,5 |
| Соляная кислота (HCl) | 36. | 1,18 | 37,2% | 12,1 | 12,1 | 82,5 | 82,5 |
| Плавиковая кислота (HF) | 20.006 | 1,19 | 49% | 28,9 | 28,9 | 34,5 | 34,5 |
| Азотная кислота (HNO 3 ) | 63.013 | 1,41 | 69,6% | 15,6 | 15,6 | 64 | 63 |
| Хлорная кислота (HClO 4 ) | 100,46 | 1,67 | 70,5% | 11,7 | 11,7 | 85,5 | 85,5 |
| Хлорная кислота (HClO 4 ) | 100,46 | 1,67 | 61,3% | 9,5 | 9,5 | 105,5 | 105,5 |
| Фосфорная кислота (H 3 PO 4 ) | 97,995 | 1,71 | 85,5% | 14,8 | 44,4 | 67,5 | 22,5 |
| Серная кислота (H 2 SO 4 ) | 98. | 1,84 | 96% | 18 | 36 | 55,5 | 28 |
| Гидроксид аммония (NH 4 OH) | 35.046 | 0,90 | 56,6% 4 | 14,5 | 14,5 | 69 | 69 |
| Гидроксид натрия (NaOH) | 39,997 | 1,53 | 50,5% | 19,4 | 19,4 | 51,5 | 51,5 |
| Гидроксид калия (KOH) | 56.105 | 1,45 | 45% | 11,7 | 11,7 | 85,5 | 85,5 |
1. На основе таблицы атомного веса (32 C = 12).
2. Репрезентативное значение, мас./мас.%.
3. Округлено до 0,5 мл.
4. Эквивалентно 28,0% масс./масс. NH 3 .
The Nest Group, Inc.™ 17 Hayward St., Ipswich, MA 01938-2041 США
Тел.: 1-508-481-6223 Факс: 1-508-485-5736
Для вашего удобства мы принимаем Mastercard, Кредитные карты VISA и American Express.
| Дом | Идеибук | Заказ | Цена/приложение | Цена/Продавец | Протоколы |
 08.21
08.21 Видео с вопросами: Расчет концентрации раствора соляной кислоты с использованием экспериментальных данных
Стенограмма видео
Учащиеся находят, что 15.30 миллилитров водного раствора гидроксида натрия нейтрализует 20,00 миллилитров раствор соляной кислоты. Водный раствор гидроксида натрия раствор имеет концентрацию 0,095 моль/л. Что такое неопознанный концентрация водного раствора соляной кислоты? Дайте ответ до трех знаков после запятой места. (A) 0,073 моль на литр, (B) 0,146 моль на литр, (В) 0,037 моль на литр, (Г) 0,938 моль на литр, (Е) 0,469 моль на литр.
В этом вопросе мы должны определить
концентрация водного раствора соляной кислоты из опытных
данные. Во-первых, нам нужно написать сбалансированный
химическое уравнение реакции нейтрализации гидроксида натрия с
соляная кислота.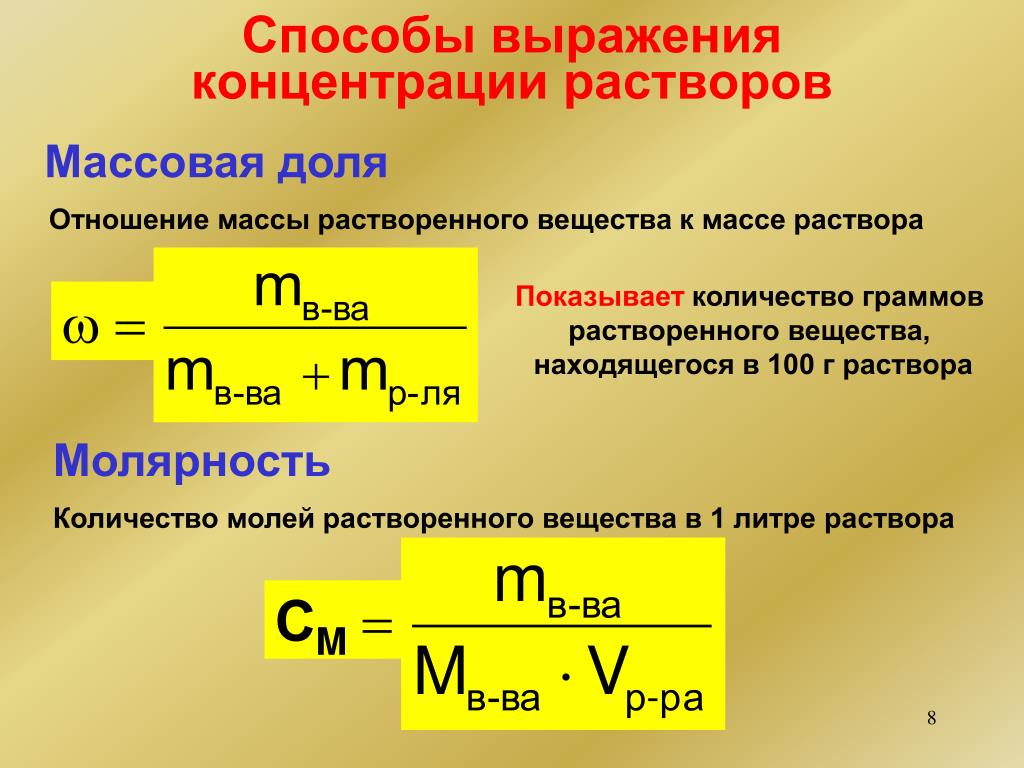
Реакция нейтрализации с участием сильные кислоты и основания следуют общей схеме, показанной здесь. Таким образом, в сбалансированном химическом уравнение, растворы соляной кислоты и гидроксида натрия реагируют с образованием водного хлорид натрия и вода. В задаче сказано, что 15,30 миллилитров основания гидроксида натрия нейтрализуют 20,00 миллилитров соляная кислота. Мы также знаем, что концентрация раствора гидроксида натрия 0,095 молей на литр.
Определение концентрации
раствор соляной кислоты будет включать три стадии. Во-первых, нам нужно рассчитать
количество молей прореагировавшего основания. Затем нам нужно преобразовать моли
основания к молям кислоты, используя молярное соотношение из сбалансированного химического уравнения. Наконец, на третьем шаге мы
рассчитать молярную концентрацию кислоты.
Единицы молярной концентрации это моль на литр. Итак, прежде чем приступить к первому шагу, мы должны преобразовать наши измерения объема из миллилитров в литры. Чтобы сделать преобразование из миллилитров в литры, мы должны разделить каждое измерение на 1000. Давайте на минутку запишем эти значения на нашем графике.
Для расчета количества молей основания гидроксида натрия, воспользуемся следующим уравнением. Увеличим концентрацию основания, составляющего 0,095 моль на литр, на объем основания, составляющий 0,01530 л.
Теперь, когда у нас есть число
молей основания, нам нужно использовать молярное соотношение из сбалансированного уравнения, чтобы найти
число молей кислоты, вступившей в реакцию. Молярное соотношение соляной
кислоты к гидроксиду натрия в реакции один к одному. Следовательно, число молей
количество прореагировавшей кислоты равно количеству молей основания.



 2
2  461
461 073
073 На основе таблицы атомного веса (32 C = 12).
На основе таблицы атомного веса (32 C = 12).