Изотопы хлора | это… Что такое Изотопы хлора?
Толкование
- Изотопы хлора
Изотопы хлора — разновидности атомов (и ядер) химического элемента Хлора, имеющие разное содержание нейтронов в ядре.
Таблица изотопов хлора
Символ
нуклидаZ(p) N(n) Масса изотопа[1]
(а. е. м.)Период
полураспада[2]
(T1/2)Спин и чётность
ядра[2]Энергия возбуждения 28Cl 17 11 28,02851 1+ 29Cl 17 12 29,01411 20,0 нс 3/2+ 30Cl 17 13 30,00477 30 нс 3+ 31Cl 17 14 30,99241 150 мс 3/2+ 32Cl 17 15 31,985690 298,0 мс 1+ 33Cl 17 16 32,9774519 2,511 с 3/2+ 34Cl 17 17 33,97376282 1,5264 s 0+ 34mCl 146,36 кэВ 32,00 мин 3+ 35Cl 17 18 34,96885268 стабилен 3/2+ 36Cl 17 19 35,96830698 301 тыс.  лет
лет2+ 37Cl 17 20 36,96590259 стабилен 3/2+ 38Cl 17 21 37,96801043 37,24 мин 2- 38mCl 671,361 кэВ 715,0 мс 5- 39Cl 17 22 38,9680082 55,6 мин 3/2+ 40Cl 17 23 39,97042 1,35 мин 2- 41Cl 17 24 40,97068 38,4 с 1/2+ 42Cl 17 25 41,97325 6,8 с 43Cl 17 26 42,97405 3,07 с 3/2+ 44Cl 17 27 43,97828 560 мс 45Cl 17 28 44,98029 400 мс 3/2+ 46Cl 17 29 45,98421 232 мс 47Cl 17 30 46,98871 101 мс 3/2+ 48Cl 17 31 47,99495 100 мс 49Cl 17 32 49,00032 50 мс 3/2+ 50Cl 17 33 50,00784 20 мс 51Cl 17 34 51,01449 2 мс 3/2+ Примечания
- ↑ Данные приведены по G.
 Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003.
Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003. - ↑ 1 2 Данные приведены по G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
Изотопы серы • Периодическая таблица по изотопам элементов • Изотопы аргона
- ↑ Данные приведены по G.
Wikimedia Foundation. 2010.
Игры ⚽ Нужно сделать НИР?
- Изотопы хассия
- Изотопы хрома
Полезное
Изотопы элементов | Задачи 206
Задача 206.
Символ одного из изотопов элемента . Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
Решение:
Заряд ядра атома искомого элемента 24 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №24 – хром (Cr).
N = A — Z = 28, где
N — число нейтронов в ядре, A — массовое число элемента (округленная масса атома), Z — заряд ядра.
Число электронов равно заряду ядра; в данном случае число электронов равно 24.
Ответ: Cr
Задача 207.
Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома — 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
Решение:
Количество электронов в атоме численно равно заряду атома. В данном случае заряд ядра атома равен +15. Заряд ядра атома искомого элемента 15 численно совпадает с номером элемента в периодической системе химических элементов. Элемент №15 – фосфор — символ – Р.
Элемент №15 – фосфор — символ – Р.
A = N + Z = 16 + 15 + 31
Символ изотопа фосфора будет иметь вид:
Ответ: .
Задача 208.
Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение:
Количество электронов в атоме равно количеству протонов. В данном случае число протонов равно 73. Число нейтронов в данном ядре равно 108:
N = A — Z = 181 — 73 = 108, где
N — число нейтронов, A — массовое число атома, Z — заряд ядра.
Заряд ядра атома искомого элемента 73 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №73 –тантал, символ – +73Ta.
Ответ: +73Та.
Задача 209.
В природных соединениях хлор находится в виде изотопов 35Cl [75,5% (масс.)] и 37Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора.
Решение:
Рассчитаем содержание 35Cl в природном хлоре, т.е. долю его в атомной массе из пропорции:
Теперь рассчитаем массу 37Cl, содержащуюся в природном хлоре из пропорции:
Вычисляем среднюю массу природного хлора, состоящего из двух изотопов
214,5 + 9,065 = 35,49.
Ответ: 35,49.
Задача. 210.
Природный магний состоит из изотопов: 24Mg, 25Mg, 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Решение:
Вычислим атомную массу изотопов, содержащихся в природном магнии
а) (24 . 78,6)/100 = 18,864;
78,6)/100 = 18,864;
б) (25 .10,1)/100 = 2,525;
в) (26 . 11,3)/100 = 2,938.
Находим среднюю массу атома магния:
18,864 + 2,525 + 2,938 = 24, 327.
Ответ: Ar(Mg) = 24,327.
Задача 211.
Природный галлий состоит из изотопов 71Ga, 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
Решение:
Для решения задач применим алгебраический метод расчёта:
Обозначим процентное содержание изотопа 69Ga через x. Тогда процентное содержание изотопа  (x/100).
(x/100).
В сумме масса обоих изотопов будет равняться атомной массе галлия:
Освобождаемся от знаменателя и получим уравнение:
69x — 71x + 7100 = 69,72
Решаем его и, получаем:
-2x = -128x; x = 64
Значит, процент изотопа 69Ga составляет 64%, а процент изотопа 71Ga – 36% (100 – 64 = 100).
Теперь находим, в каком количественном соотношении находятся эти изотопы в природном галлии:
Ответ: 1,8 : 1.
Задача 212.
Найти массу изотопа 81Sr(T1/2 = 8,5ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг.
Решение:
За время хранения радиоактивного изотопа прошло 3 периода полураспада (25,5/8,5 = 32). Массу нераспавшегося изотопа, оставшаяся после 25,5ч хранения, рассчитаем из уравнения:
mi = 2-n – m0, где
mi — масса изотопа, оставшаяся после хранения, m0 — исходная масса изотопа, n — период полураспада.
Тогда
Ответ: 25мг.
Задача 213.
Вычислить процент атомов изотопа 128I(T1/2 = 25ч), оставшихся не распавшимися после его хранения в течение 2,5 ч.
Решение:
За время хранения радиоактивного изотопа прошло 6 периодов полураспада [(2,5 . 60)/25 = 6)]. Тогда процент атомов изотопа, оставшихся после радиоактивного распада, находим из формулы:
N% = 2-n. N0. 100%, где
N% — процент атомов изотопа, N0 — первоначальное число ядер изотопа, n — число периодов полураспада.
Отсюда
Ответ: 1,56%.
Задача 214.
Период полураспада — радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.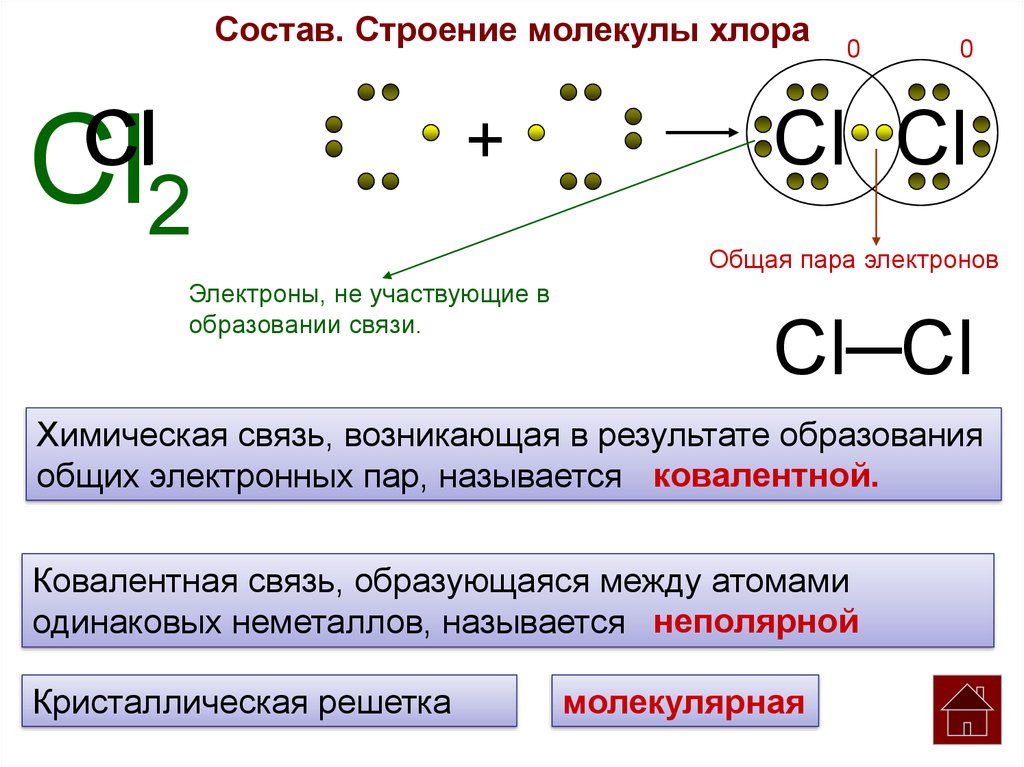
Решение:
— распаду предшествует процесс , протекающий в ядре; таким образом,
при испускании электрона заряд ядра увеличивается на единицу, а массовое число не изменяется. Дочернее ядро – изобар исходного — принадлежит элементу, стоящему следующим после исходного в таблице периодической системы химических элементов:
Уравнение радиоактивного распада должны удовлетворять правилу равенства сумм индексов.
Запишем уравнение реакции распада:
За время хранения 24Na прошло 2 периода полураспада (29,6/14,2 = 2). Массу не распавшегося изотопа, оставшуюся после 14,8ч хранения находим по формуле:
mi = 2-n – m0, где
mi — масса изотопа, оставшаяся после хранения, m0 — исходная масса изотопа, n — период полураспада.
Тогда
Таким образом, радиоактивному распаду подверглось 18г 24Na и столько же образовалось 24Mg (24 – 6 = 18).
Ответ: 18 г.
Как рассчитать количество нейтронов, протонов и электронов в атоме хлора?
Обогатите свои знания с помощью наших информативных блогов
- Забронировать демонстрационный класс
Атомы обычно состоят из мельчайших частиц, известных как нейтроны, электроны и протоны. Нейтроны и протоны находятся в центре атома, из которого состоит ядро.
Протон имеет положительный заряд, тогда как электроны заряжены отрицательно. Однако заряды электронов и протонов одинаковы, но противоположны.
Прежде чем двигаться дальше, познакомимся с определением всех трех терминов.
- Протон
Протоны — положительно заряженные субатомные частицы, входящие в состав ядра атома. Он также определяет атомный номер элемента и весит одну а.е.м.
- Нейтрон
Нейтроны – незаряженные субатомные частицы, входящие в состав ядра атома. Его масса равна массе протона и весит одну а.е.м.
Его масса равна массе протона и весит одну а.е.м.
- Электрон
Электроны — это отрицательно заряженные частицы, окруженные ядром. Они весят 0 а.е.м.
Основные сведения о протонах, электронах и нейтронах
| Частица | Символ | Зарядка | Масса |
| Электрон | е – | -1 | 0,0005486 а.е.м. |
| Протон | р + | +1 | 1,007276 а.е.м. |
| Нейтрон | нет 0 | 0 | 1,008665 а.е.м. |
Как известно, протоны несут заряд +1
Электроны несут заряд -1
Общий заряд атома равен 0
Следовательно, в атоме должно быть равное количество электронов и протонов, чтобы заряды компенсировались.
Следовательно, если мы возьмем хлор,
Расчет количества нейтронов, протонов и электронов в атоме хлора содержит 17 протонов и также должен иметь 17 электронов.
Ядро атома содержит нейтроны и протоны. Ядро вносит основной вклад в массу атома, а это означает, что массовое число может идентифицировать количество нейтронов и протонов, присутствующих в атоме.
Каждый нейтрон и протон имеют относительную массу 1 единицу.
Таким образом, к числу нейтронов мы можем вычесть число протонов из атомного массового числа.
Число нейтронов в хлоре = атомное массовое число хлора – число протонов
т. е. число нейтронов = 35-17
Следовательно, число нейтронов в хлоре = 18
Теперь, когда мы знаем число протонов в хлоре = 17
Число нейтронов в хлоре = 3
0
Давайте проверим электроны
Как было сказано ранее, если у хлора 17 протонов, то и электронов должно быть столько же.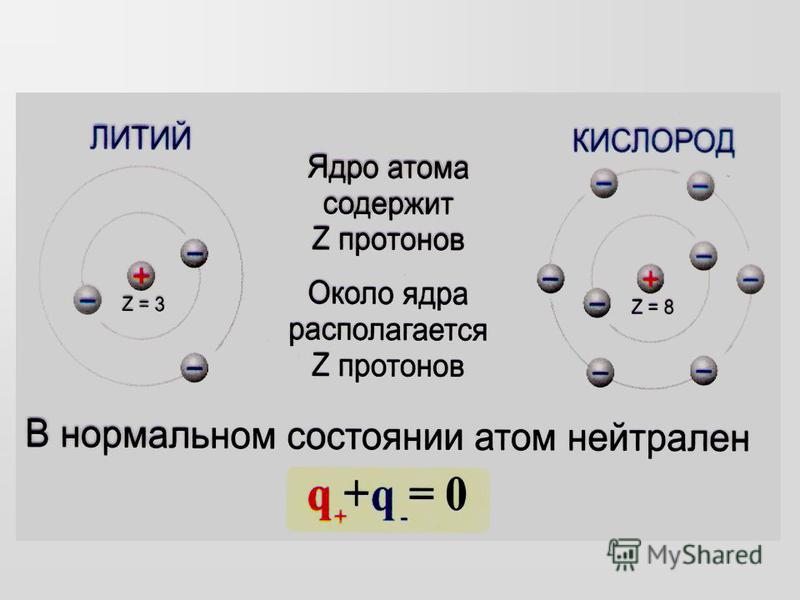
Таким образом,
Число электронов = 17 + 1
Теперь вы, должно быть, думаете о том, почему здесь добавлена единица; ну, это потому, что он имеет один отрицательный заряд, что означает усиление электронов.
Таким образом, количество электронов = 18.
Заключение
После расчета протонов, электронов и нейтронов мы, наконец, пришли к окончательным значениям всех. Сюда входит
- Количество протонов = 17
- Количество нейтронов = 18
- & Количество электронов = 18
Подробнее – Вопросы по химии
Подробнее – Полезные ссылки для развития вашего ребенка
Узнайте точную логику реакций!
Получите более глубокое понимание всех возможных взаимодействий между атомами, молекулами и элементами простым и веселым способом.
Забронировать демо-класс
Как считать моли в химии?
Найдите точное значение sin (75°).
 Дайте ответ в самой простой форме.
Дайте ответ в самой простой форме.
Забронируйте 60-минутный БЕСПЛАТНЫЙ урок сегодня! Зарегистрируйтесь сейчас
Откройте для себя новый способ обучения с TEL Gurus. 93% детей уже продемонстрировали невероятный прогресс в учебе и чувствуют себя более уверенно благодаря веселым и интерактивным онлайн-классам TEL Gurus.
Книга A Демонстрационный класс
1.2: Изотопы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 46526
Хотя все атомы элемента имеют одинаковое количество протонов, атомы могут различаться по количеству нейтронов (таблица 1-2). Эти разные атомы одного и того же элемента называются изотопа . Четыре изотопа гелия (He) показаны на рис. 1-1. Все атомы хлора (Cl) имеют 17 протонов, но есть изотопы хлора, имеющие от 15 до 23 нейтронов. В природе в значительных количествах существуют только два изотопа хлора: с 18 нейтронами (75,53% всех атомов хлора, встречающихся в природе) и с 20 нейтронами (24,47%). Чтобы написать символ изотопа, поместите атомный номер в качестве нижнего индекса и массовое число (протоны плюс нейтроны) в качестве верхнего индекса слева от атомного символа. Тогда символы двух встречающихся в природе изотопов хлора будут Cl и Cl. Строго говоря, нижний индекс излишен, так как все атомы хлора имеют 17 протонов. Поэтому символы изотопов обычно пишут без нижнего индекса: 35 кл. и 37 кл. При обсуждении этих изотопов мы используем . термины хлор-35 и хлор-37. Чтобы ядро было стабильным, количество нейтронов (для первых нескольких элементов) должно равняться или немного превышать количество протонов.
Эти разные атомы одного и того же элемента называются изотопа . Четыре изотопа гелия (He) показаны на рис. 1-1. Все атомы хлора (Cl) имеют 17 протонов, но есть изотопы хлора, имеющие от 15 до 23 нейтронов. В природе в значительных количествах существуют только два изотопа хлора: с 18 нейтронами (75,53% всех атомов хлора, встречающихся в природе) и с 20 нейтронами (24,47%). Чтобы написать символ изотопа, поместите атомный номер в качестве нижнего индекса и массовое число (протоны плюс нейтроны) в качестве верхнего индекса слева от атомного символа. Тогда символы двух встречающихся в природе изотопов хлора будут Cl и Cl. Строго говоря, нижний индекс излишен, так как все атомы хлора имеют 17 протонов. Поэтому символы изотопов обычно пишут без нижнего индекса: 35 кл. и 37 кл. При обсуждении этих изотопов мы используем . термины хлор-35 и хлор-37. Чтобы ядро было стабильным, количество нейтронов (для первых нескольких элементов) должно равняться или немного превышать количество протонов. Чем больше протонов, тем больше отношение нейтронов к протонам для обеспечения стабильности. Ядра, содержащие слишком много фундаментальных частиц любого типа, нестабильны и радиоактивно распадаются способами, которые обсуждаются в главе 23.
Чем больше протонов, тем больше отношение нейтронов к протонам для обеспечения стабильности. Ядра, содержащие слишком много фундаментальных частиц любого типа, нестабильны и радиоактивно распадаются способами, которые обсуждаются в главе 23.
Рисунок 1-1 Четыре изотопа гелия (He). Все атомы гелия имеют два протона (следовательно, два электрона), но количество нейтронов может варьироваться. Большинство атомов гелия в природе имеют два нейтрона (гелий-4), и менее одного атома гелия на миллион в природе имеют только один нейтрон (гелий-3). Другие изотопы гелия, гелий-5, гелий-6 и гелий-8 (не показаны), нестабильны и лишь ненадолго проявляются в ядерных реакциях (см. главу 23). Размер ядра здесь сильно преувеличен. Если бы ядро имело показанный размер, диаметр атома был бы полкилометра.
Пример 1.2.1
Сколько протонов, нейтронов и электронов содержится в атоме наиболее стабильного изотопа урана, урана-238? Напишите обозначение этого изотопа. См. рисунок. 1-1.
рисунок. 1-1.
Раствор
Атомный номер урана (см. внутреннюю сторону обложки) равен 92, а массовое число изотопа равно 238. Следовательно, он имеет 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. . Его символ U (или 238 U).
Полная масса атома называется его атомным весом, и это почти, но не совсем сумма масс составляющих его протонов, нейтронов и электронов. * Когда протоны, нейтроны и электроны объединяются в атом, часть их массы преобразуется в энергию и выделяется. (Это источник энергии в реакциях ядерного синтеза.) Поскольку атом не может быть расщеплен на основные частицы, если только энергия недостающей массы не поступает извне, эта энергия называется энергия связи ядра.
Примечание: Атомный вес по сравнению с атомной массой
Термины атомный вес и молекулярный вес повсеместно используются работающими учеными и будут использоваться в этой книге, даже если технически это массы, а не веса.
| Электроны | протонов | Нейтроны | Атомный Номер | Атомный вес (а.е.м.) | Общий заряд (электронные единицы) | |
|---|---|---|---|---|---|---|
| Атом водорода, 1 H или H | 1 | 1 | 0 | 1 | 1,008 | 0 |
| Атом дейтерия, 2 H или D | 1 | 1 | 1 | 1 | 2,014 | 0 |
| Атом трития, 3 H или T | 1 | 1 | 2 | 1 | 3,016 | 0 |
| Ион водорода, H + | 0 | 1 | 0 | 1 | 1,007 | +1 |
| Атом гелия, 4 He | 2 | 2 | 2 | 2 | 4. 003 003 | 0 |
| Ядро гелия или альфа-частица, He 2+ или α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| Атом лития, 7 Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Атом углерода, 12 Ca | 6 | 6 | 6 | 6 | 12. 000 000 | 0 |
| Атом кислорода, 16 O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| Атом хлора, 35 Cl | 17 | 17 | 18 | 17 | 34,969 | 0 |
| Атом хлора, 37 Cl | 17 | 17 | 20 | 17 | 36,966 | 0 |
| Встречающаяся в природе смесь хлора | 17 | 17 | 18 или 20 | 17 | 35. 453 453 | 0 |
| Атом урана, 234 U | 92 | 92 | 142 | 92 | 234,04 | 0 |
| Атом урана, 235 U | 92 | 92 | 143 | 92 | 235,04 | 0 |
| Атом урана, 238 U | 92 | 92 | 146 | 92 | 238,05 | 0 |
| Встречающаяся в природе смесь урана | 92 | 92 | разнообразный | 92 | 238,03 | 0 |
Пример 1. 2.2
2.2
Рассчитайте массу, которая теряется при образовании атома углерода-12 из протонов, электронов и нейтронов.
Решение
Поскольку атомный номер каждого атома углерода равен 6, углерод-12 имеет 6 протонов и, следовательно, 6 электронов. Чтобы найти количество нейтронов, вычтем из массового числа количество протонов: 12 — 6 = 6 нейтронов. Мы можем использовать данные в таблице 1-1 для расчета общей массы этих частиц:
Протоны: 6 х 1,00728 а.е.м. = 6,04368 а.е.м. Нейтроны: 6 х 1,00867 а.е.м. = 6,05202 а.е.м. Электроны: 6 X 0,00055 а.е.м. = 0,00330 а.е.м. Общая масса частиц: 12,09900 а.е.м.
Но по определению шкалы единиц атомной массы масса одного атома углерода-12 составляет ровно 12 а. е.м. Следовательно, в процессе построения атома из его частиц исчезло 0,0990 а.е.м. массы.
е.м. Следовательно, в процессе построения атома из его частиц исчезло 0,0990 а.е.м. массы.
Пример 1.2.3
Рассчитайте ожидаемый атомный вес изотопа хлора с 20 нейтронами. Сравните это с фактическим атомным весом этого изотопа, указанным в таблице 1-2.
Раствор
Изотоп хлора имеет 17 протонов и 20 нейтронов:
Протоны: 17 х 1,00728 а.е.м. = 17.1238 а.е.м. Нейтроны: 20 х 1,00867 а.е.м. = 20,1734 а.е.м. Электроны: 17 х 0,00055 а.е.м. = 0,0094 а.е.м. Общая масса частиц: 37,3066 а.  е.м.
е.м.Фактический наблюдаемый атомный вес: 36,966 а.е.м. Потеря массы: 0,341 а.е.м.
Каждый изотоп элемента характеризуется атомным номером (общее количество протонов), массовым числом (общее количество протонов и нейтронов) и атомным весом (масса атома в атомных единицах массы). Поскольку потери массы при образовании атома невелики, массовое число обычно равно атомному весу, округленному до ближайшего целого числа. (Например, атомный вес хлора-37 равен 36,966, что округляется до 37.) Если в природе существует несколько изотопов элемента, то, конечно, экспериментально наблюдаемый атомный вес (естественный атомный вес) будет средневзвешенным значением весов изотопов. Среднее значение взвешивается в соответствии с процентным содержанием изотопов. Хлор встречается в природе в виде 75,53% хлора-35 (34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение массы изотопа составляет
Среднее значение взвешивается в соответствии с процентным содержанием изотопов. Хлор встречается в природе в виде 75,53% хлора-35 (34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение массы изотопа составляет
\[(0,7553 х 34,97 а.е.м.) + (0,2447 х 36,97\; а.е.м.) = 35,46\; аму\]
Все атомные массы, указанные на задней обложке этой книги, представляют собой средневзвешенные значения всех изотопов, встречающихся в природе, и именно эти цифры мы будем использовать в дальнейшем, если только мы не обсуждаем конкретно какой-то один изотоп. Все изотопы элемента химически ведут себя по большей части одинаково. Их поведение будет различаться в отношении чувствительных к массе свойств, таких как скорость диффузии, которые мы рассмотрим позже в этой книге.
Пример 1.2.4
Магний (Mg) имеет три важных природных изотопа: 78,70% всех атомов магния имеют атомный вес 23,985 а.е.м., 10,13% имеют атомный вес 24,986 а.е.м. и 11,17% имеют атомный вес 25,983 а. е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Как мы пишем символы для каждого изотопа? Наконец, каково средневзвешенное значение атомных весов?
е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Как мы пишем символы для каждого изотопа? Наконец, каково средневзвешенное значение атомных весов?
Раствор
Во всех изотопах магния 12 протонов. Изотоп с атомным весом 23,985 а.е.м. имеет массовое число 24 (протонов и нейтронов), поэтому 24 — 12 протонов дают 12 нейтронов. Символ этого изотопа 24Mg. Точно так же изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, 13 нейтронов и 25 Мг в качестве символа. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, 14 нейтронов и 26 Мг в качестве символа. Рассчитаем средний атомный вес следующим образом:
- (0,7870 х 23,985) + (0,1013 х 24,986) + (0,1117 х 25,983) = 24,31 а.е.м.
Пример 1.2.5
Бор имеет два встречающихся в природе изотопа, 10 В и 11 В. Мы знаем, что 80,22% его атомов составляют 11 В, атомный вес 11,009 а.

 лет
лет Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003.
Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003. Дайте ответ в самой простой форме.
Дайте ответ в самой простой форме. Состав типичных атомов и ионов
Состав типичных атомов и ионов  е.м.
е.м.