Строение атома серы и схема электронной оболочки
4.6
Средняя оценка: 4.6
Всего получено оценок: 255.
4.6
Средняя оценка: 4.6
Всего получено оценок: 255.
Сера (S) – неметалл, относящийся к группе халькогенов. Строение атома серы легко определить, обратившись к периодической таблице Менделеева.
Строение
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
Рис. 1. Положение в периодической таблице.Природная сера имеет несколько изотопов:
- 32S;
- 33S;
- 34S;
- 36S.
Кроме этого, искусственно получено 20 радиоактивных изотопов.
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s22s22p63s23p4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму.
Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
Взаимодействие | Продукты реакции | Пример |
С металлами | Сульфиды | Cu + S → CuS |
С кислородом при 280°С | Оксид серы | – S + O2 → SO2; – 2S + 3O2 → 2SO3 |
С водородом при нагревании | Сероводород | H2 + S → H2S |
С фосфором при нагревании в отсутствии воздуха | Сульфид фосфора | 2P + 3S → P2S3 |
С фтором | Фторид серы | S + 3F2 → SF6 |
С углеродом | Сероуглерод | 2S + C → CS2 |
С кислотами | Кислота | S + 2HNO3 → 2NO + H2SO4 |
Со щёлочью | Сульфиды и сульфиты | 3S + 6KOH → K2SO3 + 2K2S + 3H2O |
Сера входит в состав белков. Большое количество серы накапливается в волосах.
Большое количество серы накапливается в волосах.
Что мы узнали?
Сера – кристаллический неметалл жёлтого цвета. Схема строения атома – +16 S)2)8)6. Проявляет три степени окисления: -2, +4, +6. Известно 24 изотопа серы. Это активный элемент, вступающий в реакцию с металлами и неметаллами. Образует соли – сульфиты и сульфиды, а также серную кислоту. Сера нерастворима в воде и соляной кислоте. Входит в состав живых организмов. В природе находится в свободном и связанном виде.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 255.
А какая ваша оценка?
Физические и химические свойства серы. Оксиды серы
Билет № 16
1.
 Сера: положение этого химического элемента в периодической системе, строение его атома. Физические и химические свойства серы. Оксиды серы, их химические свойства
Сера: положение этого химического элемента в периодической системе, строение его атома. Физические и химические свойства серы. Оксиды серы, их химические свойстваПоложение в периодической системе: сера находится в 3 периоде, VI группе, главной (А) подгруппе.
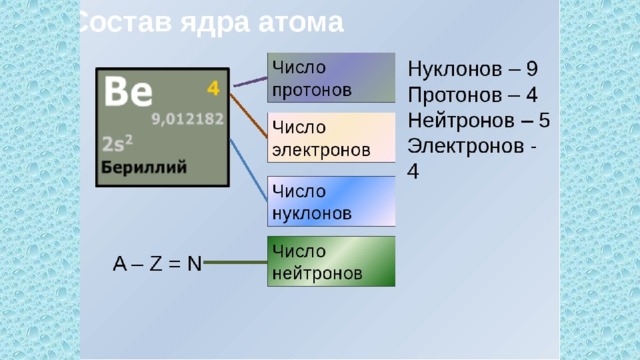
Атомный номер серы 16, следовательно, заряд ядра атома серы равен +16, число электронов 16. Три электронных уровня (равно периоду), на внешнем уровне 6 электронов (равно номеру группы для главных подгрупп).
Схема расположения электронов по уровням:
16S ) ) )
2 8 6
Ядро атома серы 32S содержит 16 протонов (равно заряду ядра) и 16 нейтронов (атомная масса минус число протонов: 32 − 16 = 16).
Сера как простое вещество образует аллотропные модификации: кристаллическая сера и пластическая.
Кристаллическая сера — твердое вещество желтого цвета, хрупкое, легкоплавкое (температура плавления 112° С), нерастворима в воде. Сера и многие руды, содержащие серу, не смачиваются водой.
На этом основан метод обогащения руд под названием флотация: измельченная руда погружается в емкость с водой, через которую продувается воздух. Частички полезной руды подхватываются пузырьками воздуха и выносятся наверх, а пустая порода (например, песок) оседает на дно.
Пластическая сера темного цвета и способна растягиваться, как резина.
Это отличие в свойствах связано со строением молекул: кристаллическая сера состоит из кольцевых молекул, содержащих 8 атомов серы, а в пластической сере атомы соединены в длинные цепи. Пластическую серу можно получить, если нагреть серу до кипения и вылить в холодную воду.
В уравнениях для простоты записывают серу без указания числа атомов в молекуле: S.
Химические свойства:
- В реакциях с восстановителями: металлами, водородом, — сера проявляет себя как окислитель (степень окисления −2,валентность II).
 При нагревании порошков серы и железа образуется сульфид железа:
При нагревании порошков серы и железа образуется сульфид железа:
Fe + S = FeS
Со ртутью, натрием порошок серы реагирует при комнатной температуре:
Hg + S = HgS - При пропускании водорода через расплавленную серу образуется сероводород:
H2 + S = H2S - В реакциях с сильными окислителями сера окисляется. Так, сера горит, образуется оксид серы (IV) — серни́стый газ:
S + O2 = SO2
Оксид серы (IV) — кислотный оксид. Реагирует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO 3
Эта реакция происходит в атмосфере при сжигании каменного угля, который обычно содержит примеси серы. В результате выпадают кислотные дожди, поэтому очень важно подвергать очистке дымовые газы котельных.
В присутствии катализаторов оксид серы (IV) окисляется до оксида серы (VI):
2SO2 + O2 2SO3 (реакция обратима)
Оксид серы (VI) реагирует с водой с образованием серной кислоты:
SO3 + H2O = H2SO4
SO3 — бесцветная жидкость, кристаллизуется при 17° С, переходит в газообразное состояние при 45° С
2.
 Опыт. Проведение реакций, подтверждающих свойства гидроксида кальция.
Опыт. Проведение реакций, подтверждающих свойства гидроксида кальция.- Гидроксид кальция (гашеная известь) — малорастворимое вещество. Взбалтываем немного извести в 2 мл воды (около 2 см по высоте пробирки), даем постоять несколько минут. Большая часть извести не растворится, осядет на дно.
- Сливаем раствор, фильтруем (если нет фильтра, ждем пока отстоится). Прозрачный раствор гидроксида кальция называется
Ca(OH)2 Ca2+ + 2OH− - Во вторую пробирку пропускаем углекислый газ, известковая вода мутнеет в результате образования нерастворимого карбоната кальция (это качественная реакция для обнаружения углекислого газа):
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Если придется делать эти реакции на практике, углекислый газ можно получить в пробирке с газоотводной трубкой, добавив соляную или
азотную кислоту в мел или соду.
Можно несколько раз пропустить выдыхаемый воздух через трубочку от коктейля или сока, принесенную с собой. Не стоит шокировать комиссию — дуть в трубку из лабораторного оборудования — в кабинете химии ничего нельзя пробовать на вкус!
автор: Владимир Соколов
1.16: Элементы, определяемые количеством их протонов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 206531
Цели обучения
- Дать определение атомному номеру.
- Определить массовое число.
- Определить количество протонов, нейтронов и электронов в атоме.
Важно уметь отличать атомы одного элемента от атомов другого элемента.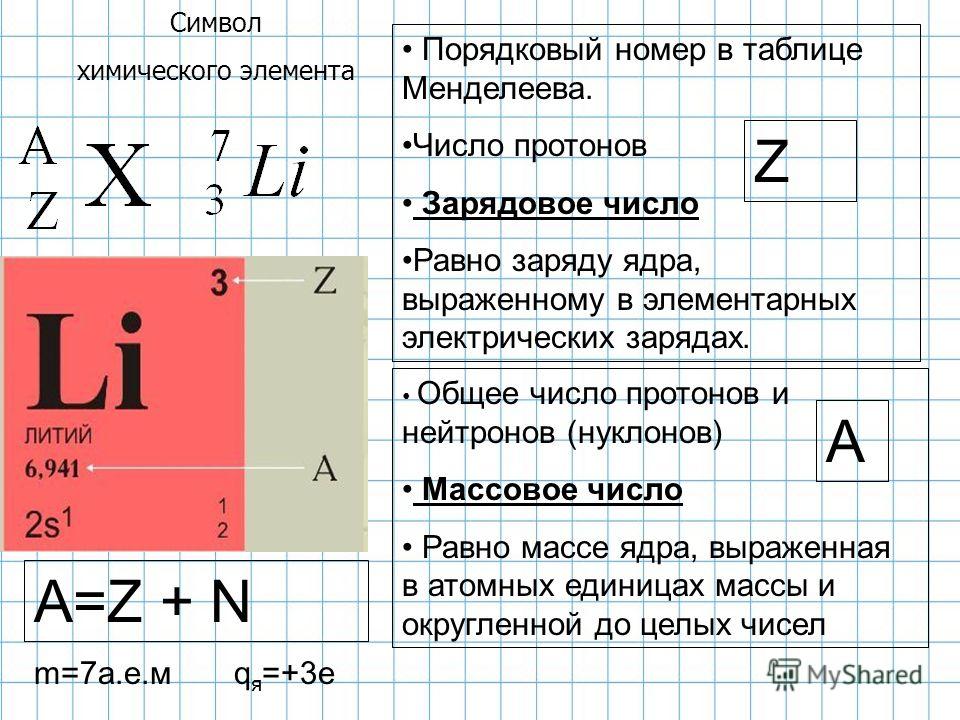 Элементы — это чистые вещества, из которых состоит вся остальная материя, поэтому каждому из них дается уникальное имя. Названия элементов также представлены уникальными одно- или двухбуквенными символами, такими как \(\ce{H}\) для водорода, \(\ce{C}\) для углерода или \(\ce{He }\) для гелия. Однако было бы более убедительно, если бы эти имена можно было использовать для определения количества протонов и нейтронов в атомах. Вот где атомный номер и массовое число полезны.
Элементы — это чистые вещества, из которых состоит вся остальная материя, поэтому каждому из них дается уникальное имя. Названия элементов также представлены уникальными одно- или двухбуквенными символами, такими как \(\ce{H}\) для водорода, \(\ce{C}\) для углерода или \(\ce{He }\) для гелия. Однако было бы более убедительно, если бы эти имена можно было использовать для определения количества протонов и нейтронов в атомах. Вот где атомный номер и массовое число полезны.
Атомный номер
Ученые различают разные элементы, подсчитывая количество протонов в ядре (таблица \(\PageIndex{1}\)).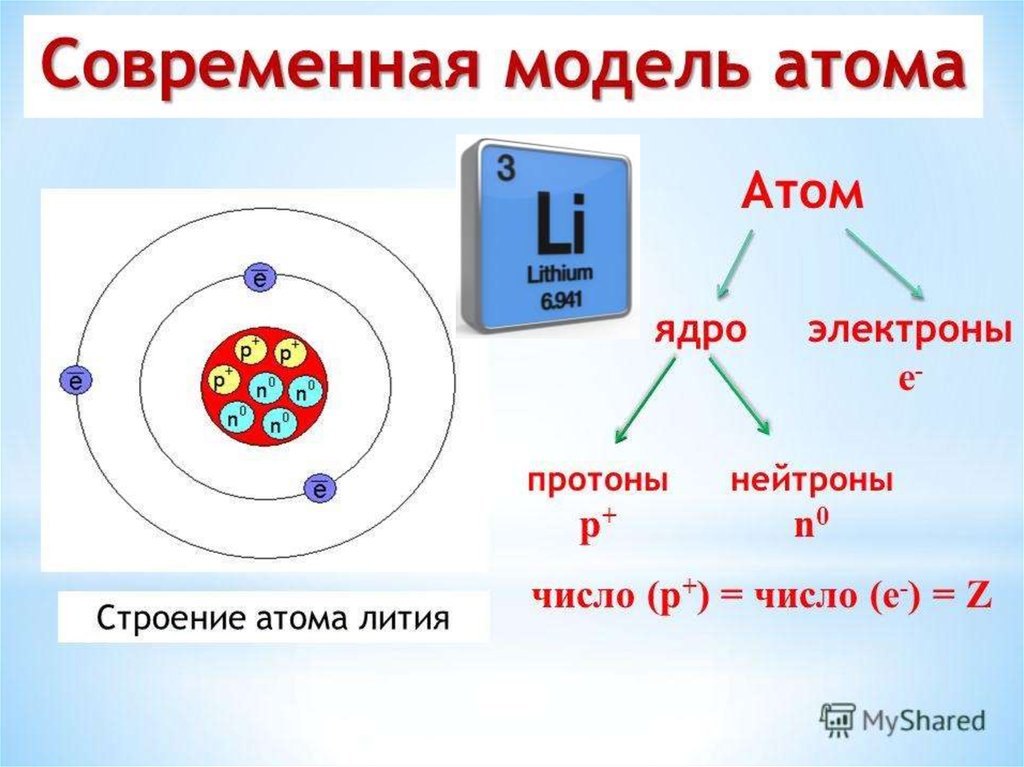 Если у атома есть только один протон, мы знаем, что это атом водорода. Атом с двумя протонами всегда является атомом гелия. Если ученые насчитывают четыре протона в атоме, они знают, что это атом бериллия. Атом с тремя протонами — это атом лития, атом с пятью протонами — это атом бора, атом с шестью протонами — это атом углерода. . . список можно продолжить.
Если у атома есть только один протон, мы знаем, что это атом водорода. Атом с двумя протонами всегда является атомом гелия. Если ученые насчитывают четыре протона в атоме, они знают, что это атом бериллия. Атом с тремя протонами — это атом лития, атом с пятью протонами — это атом бора, атом с шестью протонами — это атом углерода. . . список можно продолжить.
Поскольку атом одного элемента можно отличить от атома другого элемента по количеству протонов в его ядре, ученых всегда интересует это число и то, как это число отличается у разных элементов. Число протонов в атоме называется его атомным номером (\(Z\)). Это число очень важно, потому что оно уникально для атомов данного элемента. Все атомы элемента имеют одинаковое количество протонов, и каждый элемент имеет разное количество протонов в своих атомах. Например, все атомы гелия имеют два протона, и никакие другие элементы не имеют атомов с двумя протонами.
| Имя | Протоны | Нейтроны | Электроны | Атомный номер (Z) | Массовый номер (А) |
|---|---|---|---|---|---|
| Водород | 1 | 0 | 1 | 1 | 1 |
| Гелий | 2 | 2 | 2 | 2 | 4 |
| Литий | 3 | 4 | 3 | 3 | 7 |
| Бериллий | 4 | 5 | 4 | 4 | 9 |
| Бор | 5 | 6 | 5 | 5 | 11 |
| Углерод | 6 | 6 | 6 | 6 | 12 |
Конечно, поскольку нейтральные атомы должны иметь один электрон на каждый протон, атомный номер элемента также говорит вам, сколько электронов находится в нейтральном атоме этого элемента. {-27}\) килограммов, что является чрезвычайно малой массой. Масса нейтрона лишь чуть-чуть больше массы протона, но его массу также часто принимают равной одной атомной единице массы. Поскольку у электронов практически нет массы, практически вся масса атома приходится на его протоны и нейтроны. Следовательно, общее количество протонов и нейтронов в атоме определяет его массу в атомных единицах массы (таблица \(\PageIndex{1}\)).
{-27}\) килограммов, что является чрезвычайно малой массой. Масса нейтрона лишь чуть-чуть больше массы протона, но его массу также часто принимают равной одной атомной единице массы. Поскольку у электронов практически нет массы, практически вся масса атома приходится на его протоны и нейтроны. Следовательно, общее количество протонов и нейтронов в атоме определяет его массу в атомных единицах массы (таблица \(\PageIndex{1}\)).
Снова рассмотрим гелий. Большинство атомов гелия имеют два нейтрона в дополнение к двум протонам. Следовательно, масса большинства атомов гелия равна 4 атомным единицам массы (\(2 \: \text{аму}\) для протонов + \(2 \: \text{аму}\) для нейтронов). Однако некоторые атомы гелия имеют больше или меньше двух нейтронов. Атомы с одинаковым числом протонов, но разным числом нейтронов называются изотопами. Поскольку количество нейтронов может варьироваться для данного элемента, массовые числа различных атомов элемента также могут различаться. Например, некоторые атомы гелия имеют три нейтрона вместо двух (они называются изотопами и подробно обсуждаются позже).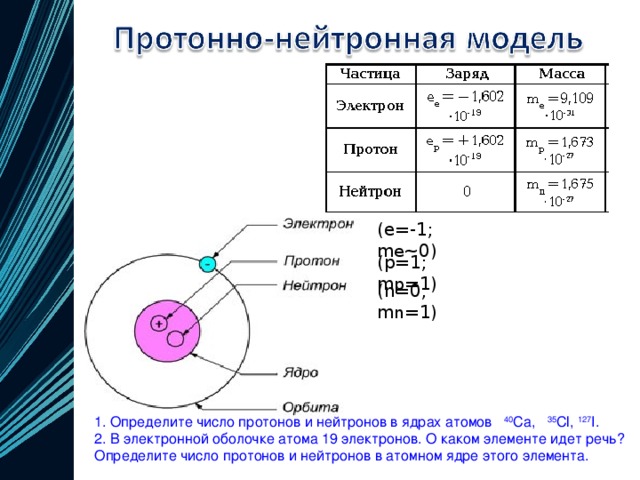
Как вы думаете, почему в «массовое число» входят протоны и нейтроны, но не электроны? Вы знаете, что большая часть массы атома сосредоточена в его ядре. Масса атома зависит от количества протонов и нейтронов. Вы уже узнали, что масса электрона очень и очень мала по сравнению с массой протона или нейтрона (как масса пенни по сравнению с массой шара для боулинга). Подсчет количества протонов и нейтронов сообщает ученым об общей массе атома.
\[\text{массовое число} \: A = \left( \text{число протонов} \right) + \left( \text{количество нейтронов} \right) \nonumber \]
Масса атома число очень легко вычислить, при условии, что вы знаете количество протонов и нейтронов в атоме.
Пример 4.5.1
Каково массовое число атома гелия, содержащего 2 нейтрона?
Решение
\(\left( \text{число протонов} \right) = 2\) (Помните, что атом гелия всегда имеет 2 протона.)
\(\left( \text{количество нейтронов} \right) = 2\)
\(\text{массовое число} = \left( \text{количество протонов} \right) + \left( \ text{число нейтронов} \right)\)
\(\text{массовое число} = 2 + 2 = 4\)
Химический символ представляет собой одно- или двухбуквенное обозначение элемента .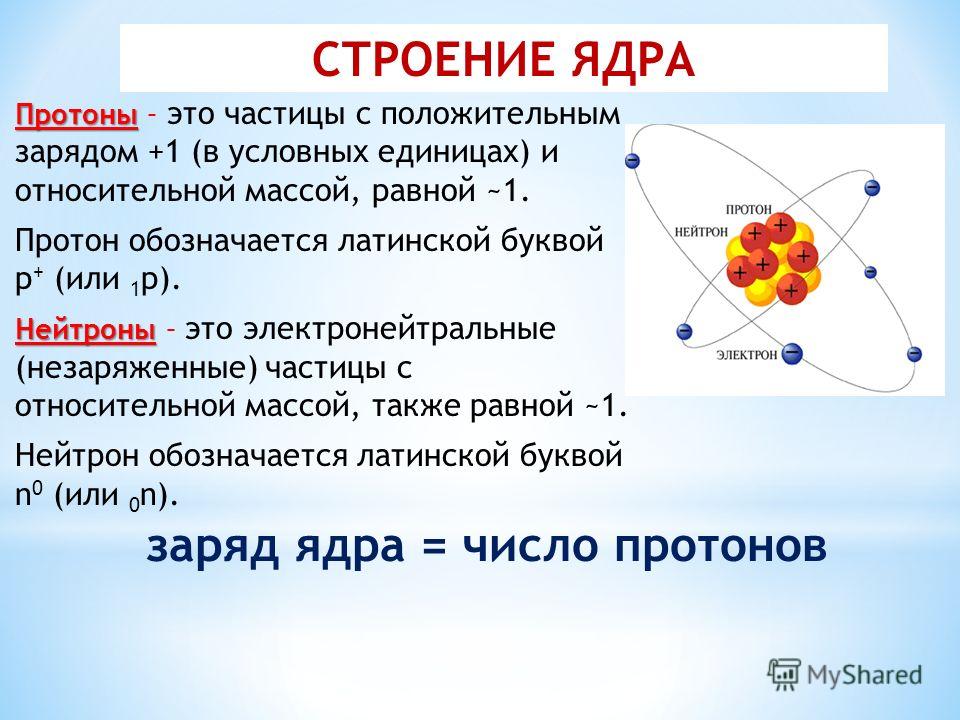 Некоторые примеры химических символов: \(\ce{O}\) для кислорода, \(\ce{Zn}\) для цинка и \(\ce{Fe}\) для железа. Первая буква символа всегда заглавная. Если символ состоит из двух букв, вторая буква является строчной. Большинство элементов имеют символы, основанные на их английских названиях. Однако некоторые элементы, известные с древних времен, сохранили символы, основанные на их латинских названиях, как показано в таблице \(\PageIndex{2}\).
Некоторые примеры химических символов: \(\ce{O}\) для кислорода, \(\ce{Zn}\) для цинка и \(\ce{Fe}\) для железа. Первая буква символа всегда заглавная. Если символ состоит из двух букв, вторая буква является строчной. Большинство элементов имеют символы, основанные на их английских названиях. Однако некоторые элементы, известные с древних времен, сохранили символы, основанные на их латинских названиях, как показано в таблице \(\PageIndex{2}\).
| Химический символ | Имя | Латинское название |
|---|---|---|
| \(\ce{Na}\) | Натрий | Натрий |
| \(\се{К}\) | Калий | Калиум |
| \(\ce{Fe}\) | Железо | Феррум |
| \(\ce{Cu}\) | Медь | Купрум |
| \(\ce{Ag}\) | Серебро | Аргентум |
| \(\ce{Sn}\) | Олово | Станнум |
| \(\ce{Sb}\) | Сурьма | Стибиум |
| \(\ce{Au}\) | Золото | Аурум |
| \(\ce{Pb}\) | Свинец | Пламбум |
Резюме
- Элементы — это чистые вещества, из которых состоит вся материя, поэтому каждому из них дается уникальное имя.

- Имена элементов также представлены уникальными одно- или двухбуквенными символами.
- Каждый элемент имеет уникальное количество протонов. Атомный номер элемента равен количеству протонов в ядрах любого из его атомов.
- Массовое число атома равно сумме протонов и нейтронов в атоме.
- Изотопы — это атомы одного и того же элемента (одинаковое количество протонов), имеющие разное количество нейтронов в атомных ядрах.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Включено
- да
- Метки
- источник[1]-хим-47471
Сера — Центр научного обучения
Добавить в коллекцию
Сера — химический элемент. Его официальный символ — S, а его атомный номер — 16, что означает, что каждый атом серы имеет 16 протонов в своем ядре. Элементарная сера имеет бледно-желтый цвет. При комнатной температуре представляет собой мягкий порошок, рассыпающийся при прикосновении. Элементарная сера не имеет запаха, когда она сама по себе, но когда она образует соединение — например, с водородом — она может вонять!
Его официальный символ — S, а его атомный номер — 16, что означает, что каждый атом серы имеет 16 протонов в своем ядре. Элементарная сера имеет бледно-желтый цвет. При комнатной температуре представляет собой мягкий порошок, рассыпающийся при прикосновении. Элементарная сера не имеет запаха, когда она сама по себе, но когда она образует соединение — например, с водородом — она может вонять!
Залежи серы находятся естественным образом в вулканических районах, таких как Роторуа и остров Вакаари-Уайт, а также в больших количествах глубоко под землей в США, Польше и на Сицилии. По массе сера является пятым по распространенности элементом на Земле.
Черный порох, сера и несколько вариантов написания
Сера — один из немногих элементов, встречающихся в чистом виде, поэтому люди знали и использовали «чистую» элементарную серу очень давно. Записи показывают, что китайцы использовали серу в традиционной медицине более 2600 лет назад. К 7 веку нашей эры они научились смешивать серу с древесным углем и нитратом калия для создания черного пороха (пороха). Древние индийская, греческая и египетская культуры также использовали серу в медицине, для окуривания и отбеливания тканей.
Древние индийская, греческая и египетская культуры также использовали серу в медицине, для окуривания и отбеливания тканей.
Сера также фигурирует в религиозных писаниях, которым 2600 лет. В английских переводах Библии сера упоминается как «сера», чтобы описать разрушение (на которое способна вулканическая активность) и неприятный запах, связанный с соединениями серы.
Перенесемся на 2300 лет вперед, в 1777 год. После длительных экспериментов Антуан Лавуазье обнаружил, что не может разложить серу на более простые вещества, и объявил ее элементом.
В последнее время споры были не о химии, а о правописании. Первоначальный латинский термин был «сера». Со временем оно стало «серой», а в 3 веке превратилось в «серу». Английский сохранил написание «ph», в то время как другие языки использовали «f» — например, zolfo в итальянском и schwefel в немецком. Международный союз теоретической и прикладной химии официально принял слово «сера» в 1990.
Сера – необходимая для жизни (и вонючих выделений)
Сера присутствует во всех живых тканях растений и животных. Он составляет около 0,3% человеческого тела. Он входит в состав некоторых белков. Он также помогает нашему организму противостоять бактериям, способствует выработке инсулина и помогает поддерживать здоровье наших суставов, кожи, волос, ногтей и соединительных тканей.
Он составляет около 0,3% человеческого тела. Он входит в состав некоторых белков. Он также помогает нашему организму противостоять бактериям, способствует выработке инсулина и помогает поддерживать здоровье наших суставов, кожи, волос, ногтей и соединительных тканей.
Сбалансированная диета должна удовлетворять потребности организма в сере. Богатые белком продукты — яйца, мясо, птица, рыба, молочные и соевые продукты — являются хорошими источниками диетической серы. Капустные (брокколи и капуста), лук, чеснок и спаржа также содержат пищевую серу.
Когда организм переваривает продукты, богатые серой, в качестве побочного продукта образуется сероводород. Это газ, из-за которого пукает запах тухлых яиц, и он придает Роторуа его знаменитый запах.
Сера необходима для роста растений. Помимо того, что сера важна для некоторых растительных белков, она способствует развитию хлорофилла и фиксации азота в бобовых. Большая часть серы в почве поступает из органических веществ и из выветрившихся пород. Мы используем удобрения, чтобы дополнить почву важными элементами.
Мы используем удобрения, чтобы дополнить почву важными элементами.
С другой стороны, сера может остановить жизнь. Люди уже давно используют серу для борьбы с насекомыми, плесенью и бактериями. Высокие концентрации сероводорода (намного выше, чем то, что вырабатывается в нашем кишечнике) могут вызвать паралич дыхания, ведущий к смерти. Это просто показывает, что все дело в дозе.
Другие виды применения
Сера наиболее широко используется для производства серной кислоты для производства фосфатов для удобрений. Он также используется для упрочнения резины, чтобы сделать такие продукты, как шины, обувь и шланги, более прочными.
Другое распространенное применение серы — спички. Многие спички состоят из хлората калия, серы, порошкового стекла и желатина (который удерживает все материалы на дереве). Проведение спичечной головкой по поверхности удара вызывает трение и нагревание, а затем пламя. Хлорат калия выделяет кислород, а сера соединяется с кислородом и поддерживает горение огня.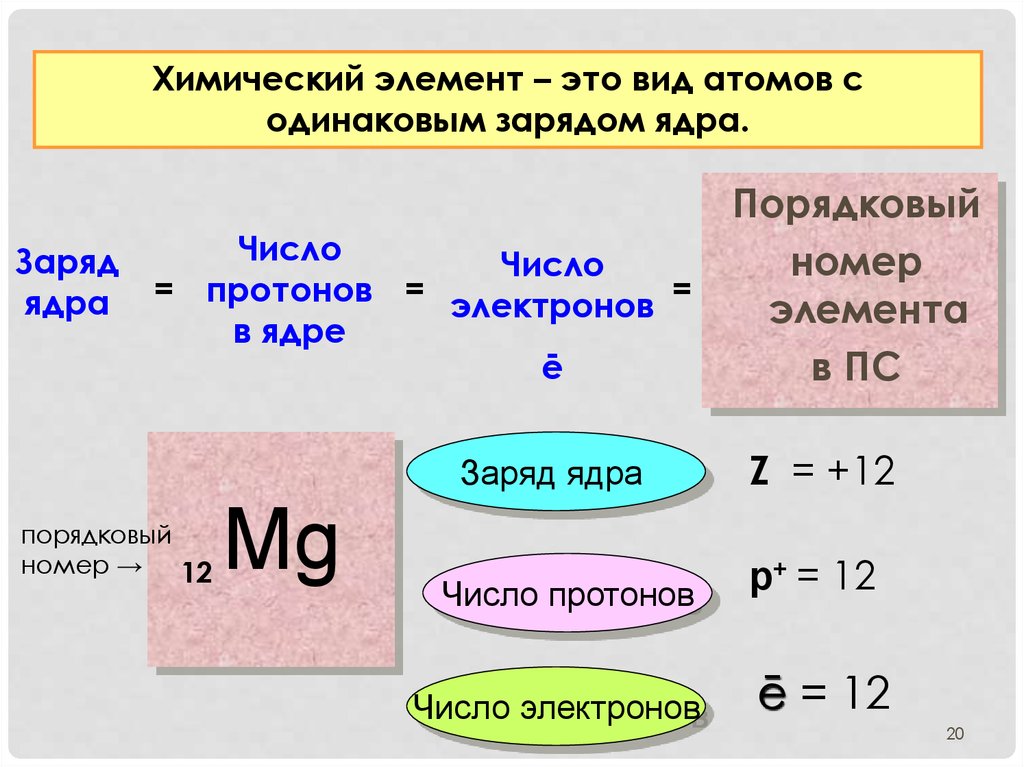 Деревянная спичка также служит источником топлива. Характерный запах горящей спички исходит от серы.
Деревянная спичка также служит источником топлива. Характерный запах горящей спички исходит от серы.
Природный газ, используемый для отопления и приготовления пищи, не имеет запаха, цвета и вкуса. Соединения серы добавляются в природный газ, поэтому мы можем обнаружить даже малейшую утечку. Скунсы также используют серу для защиты. Они используют спрей на основе серы, который достаточно силен, чтобы отогнать медведей. Он настолько силен, что с подветренной стороны люди могут почувствовать запах брызг за несколько километров!
Похожие материалы
Узнайте больше о минералах.
Для здоровья человека сера является макроминералом. О витаминах и минералах, необходимых для здорового питания, читайте в статье Микронутриенты.
Полезные ссылки
Узнайте больше о сере на этих веб-сайтах:
- Наука для детей – факты о сере
- ThoughtCo – 10 интересных фактов о сере
- Живая наука – факты о сере
Загрузите2 эту бесплатную электронную книгу 90 .

 При нагревании порошков серы и железа образуется сульфид железа:
При нагревании порошков серы и железа образуется сульфид железа: