Молярная масса — Учебник по Химии. 8 класс. Григорович
Учебник по Химии. 8 класс. Григорович — Новая программа
Этот учебник можно скачать в PDF формате на сайте тут.
Вспомните: физический смысл понятий «количество вещества» и «моль» (§ 24).
Взаимосвязь между массой и количеством вещества
Молекулы — это частицы с определенной, но очень маленькой массой. И если непосредственно измерить число молекул или количество вещества невозможно, то массу одного моля вещества измерить вполне реально. Такую массу называют молярной массой вещества.
Если мы знаем количество вещества п, которое содержится в том или ином образце, и массу образца т, то, разделив массу на количество вещества, получаем массу одного моля вещества, т. е. молярную массу:
Молярная масса — это физическая величина, равная отношению массы вещества к его количеству.
Молярную массу обозначают буквой М и измеряют в граммах на моль (г/моль).
Поскольку для образца вещества количеством 1 моль масса будет равна молярной массе, то:
Молярная масса — это масса вещества количеством 1 моль.
Определение молярной массы вещества
Молярная масса М, выраженная в г/моль, численно равна относительной молекулярной массе Мr. Для простых веществ атомного строения молярная масса численно равна относительной атомной массе.
Хотя молярная масса М и относительная молекулярная масса Мr имеют одинаковые численные значения, между ними есть два существенных различия:
• молярная масса характеризует массу одного моля вещества, тогда как относительная молекулярная масса — массу одной молекулы;
• молярная масса не является относительной величиной и, в отличие от относительной молекулярной массы, имеет единицу измерения — г/моль.
Различные вещества состоят из разных молекул, имеющих разные массы. Если взять разные вещества в количестве 1 моль, легко заметить, что у них разная масса и они занимают разные объемы (рис.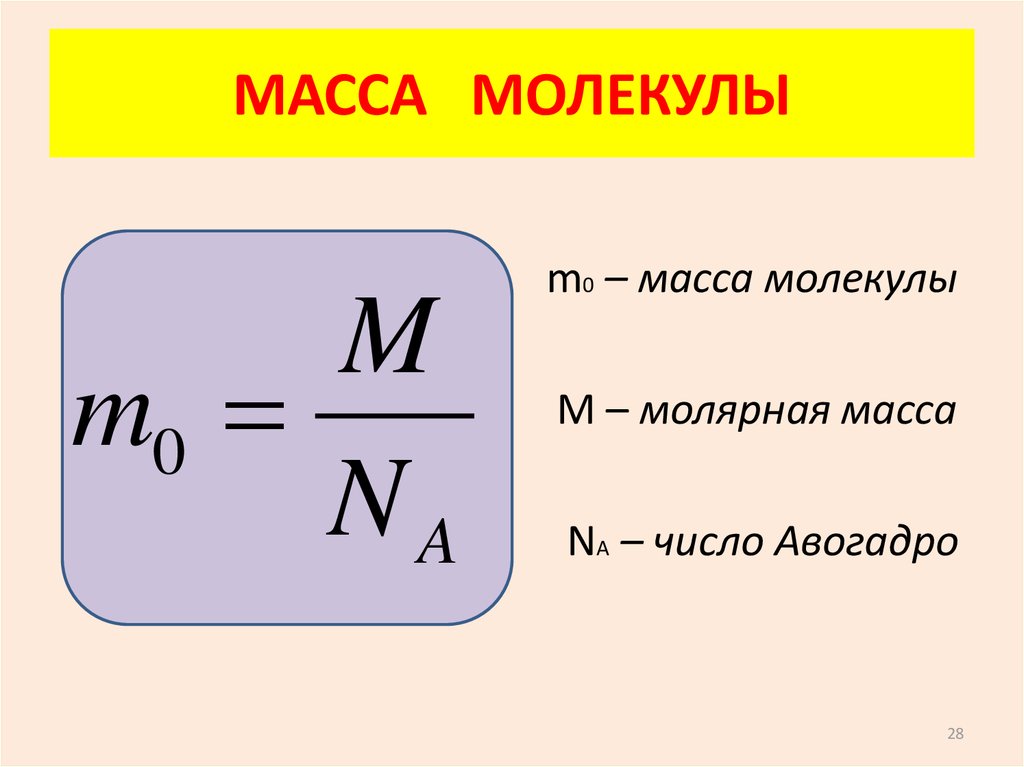 25.1). Так, масса одного моля сахара — 342 г, а одного моля воды — 18 г. Это всего лишь две неполные столовые ложки. В чем же тогда сходство этих образцов веществ? В них содержится приблизительно одинаковое число молекул, из которых они состоят. В двух столовых ложках (18 г) воды содержится столько же молекул воды Н2O, сколько молекул сахарозы С12Н22O11 в 342 г сахарного песка, а именно 6,02 • 1023 молекул.
25.1). Так, масса одного моля сахара — 342 г, а одного моля воды — 18 г. Это всего лишь две неполные столовые ложки. В чем же тогда сходство этих образцов веществ? В них содержится приблизительно одинаковое число молекул, из которых они состоят. В двух столовых ложках (18 г) воды содержится столько же молекул воды Н2O, сколько молекул сахарозы С12Н22O11 в 342 г сахарного песка, а именно 6,02 • 1023 молекул.
Рис. 25.1. Некоторые вещества, взятые в количестве 1 моль: а — вода; б — поваренная соль; в — сульфатная кислота; г — сахар
Очевидно, что чем больше масса одной молекулы, тем больше молярная масса вещества.
Используя число Авогадро, легко доказать, что относительная молекулярная масса и молярная масса численно должны быть одинаковыми. Вещество количеством 1 моль содержит 6,02 • 1023 молекул, поэтому молярная масса (масса одного моля вещества) равна массе одной молекулы (в граммах), умноженной на постоянную Авогадро:
М = mмолекулы • NA
Массу молекулы можно также вычислить, зная относительную молекулярную массу Мr вещества:
mмолекулы = Мr • 1 а. е. м.
е. м.
М = (Мr • 1 а. е. м) • NA =Мr (1 а. е. м. • NА) = Мr 1 г/моль
Среди известных веществ самая большая молекулярная масса у белка титина, молекулярная формула которого С132983Н211861N36149О40883S693. Его молярная масса равна 2 993 442 г/моль, т. е. 1 моль вещества весит почти 3 тонны.
Расчеты с использованием молярной массы
Для того чтобы вычислить количество вещества, достаточно знать массу т этого вещества и его молярную массу М:
По этой формуле можно вычислить массу вещества в граммах:
Наконец, если известны и масса, и количество вещества, то можно определить его молярную массу:
Если объединить эти два уравнения, помня, что произведение атомной единицы массы и числа Авогадро равно единице, получаем:
Все эти формулы используют для химических расчетов.
Задача 1. Вычислите молярную массу натрий карбоната Na2CO3.
Решение:
Находим относительную молекулярную массу вещества:
Mr(Na2CO3) = 2 • Ar(Nа) + Ar(С) + 3 • Ar(O) = 2 • 23 + 12 + 3 • 16 = 106.
Молярная масса численно равна относительной молекулярной массе, следовательно: M(Na2CO3) = 106 г/моль.
Ответ: M(Na2CO3) = 106 г/моль.
Задача 2. Вычислите массу кальцинированной соды количеством вещества 0,5 моль.
Задача 3. Какое количество вещества содержится в воде массой 1 кг?
Задача 4. Сколько атомов Сульфура содержится в образце серы массой 8 г?
Выводы
1. Молярная масса — это физическая величина, равная отношению массы вещества к его количеству. Молярная масса — это масса вещества количеством 1 моль.
2. Молярная масса вещества численно равна относительной молекулярной массе. Ее обозначают буквой М и измеряют в граммах на моль (г/моль).
Контрольные вопросы
1. Дайте определение молярной массы вещества.
Дайте определение молярной массы вещества.
2. В каких единицах измеряют молярную массу?
3. Как по химической формуле вещества определить его молярную массу?
4. Что общего и различного у понятий «молярная масса» и «относительная молекулярная масса»? Объясните на конкретных примерах.
Задания для усвоения материала
1. Молярная масса кислорода равна: а) 16 г/моль; б) 32 г/моль; в) 48 г/моль.
2. Вычислите массу; а) водорода количеством 2 моль; б) кислорода количеством 3 моль; в) воды количеством 5 моль.
3. Вычислите массу; а) 1,204 • 1022 атомов Цинка; б) 1,806 • 1024 молекул кислорода; в) 6,02 • 1021 молекул сульфатной кислоты H2SO4.
4. Вычислите молярные массы веществ по их формулам: H2S, NH3, F2, СаСO3, SO2, NaOH, K2SO4, Fe(NO3)3, NaAl(OH)4, CuSO4 • 5H2O.
5. Вычислите количество вещества: а) в 7 г железа; б) 21 г азота; в) 500 г мела СаСO3; г) 10 кг пищевой соды NaHCO3.
6. Какие массы воды, сахара С12Н22O11 золота необходимо взять, чтобы каждого вещества было по 5 моль?
7. Вычислите молярную массу простого вещества, если: а) масса 7 моль его равна 444,5 г; б) масса 3,5 моль — 84 г; в) масса 0,25 моль — 8 г. Назовите эти вещества.
8. Определите, масса какого из образцов веществ больше: а) 3 моль кислорода или 2 моль азота; б) 5 моль воды или 1,4 моль хлора; в) 1 моль негашеной извести СаО или 1 моль жженой магнезии МgО?
9. Сколько молекул воды содержится в стакане объемом 200 мл?
10. Вычислите количество вещества и число атомов Оксигена, которые содержатся: а) в 3 моль сернистого газа SO2; б) 40 г медной окалины СuО.
11. Образец нитратной кислоты ΗΝO3 имеет массу 122 г. Вычислите в этом образце количество вещества: а) нитратной кислоты; б) атомов Нитрогена; в) атомов Гидрогена; г) атомов Оксигена.
12. Образец соединения Карбона с Гидрогеном массой 0,8 г содержит 0,05 моль вещества. Вычислите молярную массу этого вещества и определите его формулу.
Попередня
СторінкаНаступна
СторінкаЗміст
Расчет молярной массы Солнца | Статья в журнале «Юный ученый»
Автор: Кононенко Олег Алексеевич
Научный руководитель: Акопов Вачакан Ваграмович
Рубрика: Физика
Опубликовано в
Юный учёный
№6 (58) июнь 2022 г.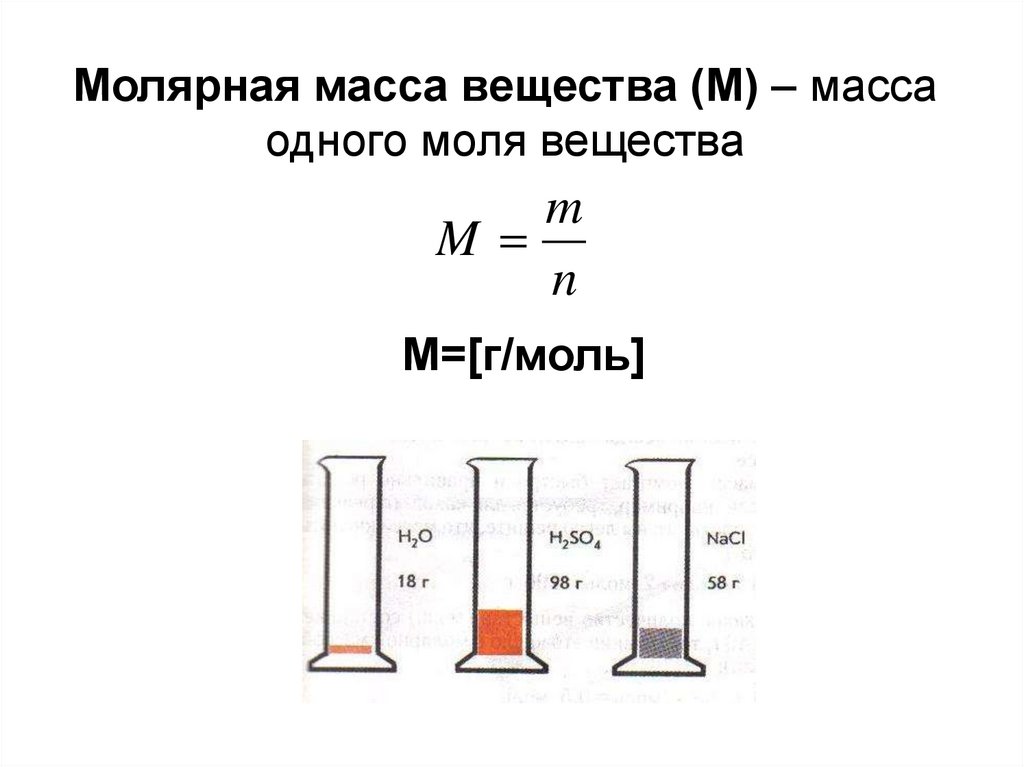
Дата публикации: 29.05.2022 2022-05-29
Скачать электронную версию
Библиографическое описание:Кононенко, О. А. Расчет молярной массы Солнца / О. А. Кононенко, В. В. Акопов. — Текст : непосредственный // Юный ученый. — 2022. — № 6 (58). — С. 82-86. — URL: https://moluch.ru/young/archive/58/3089/ (дата обращения: 05.03.2023).
Численное значение молярной массы Солнца, полученное в данной статье расчетным путем, можно использовать при астрофизических исследованиях Солнца, а также на уроках астрономии, физики, химии при решении задач в школе и внеурочной деятельности.
Ключевые слова: Солнце, молярная масса, число атомов, масса, число Авогадро, универсальная газовая постоянная, температура, плотность, давление.
В физике и химии широко используется молярная масса M. Молярной массой называют массу вещества, взятого в количестве одного моля. В системе СИ измеряется в , [1, с. 152].
На сегодня молярная масса Солнца фактически неизвестна. Попытаемся её вычислить двумя способами и затем сравнить.
А) Молярную массу Солнца вычислим по известной формуле:
(1) |
где — число Авогадро,
кг
N — число атомов Солнца.
Из различных источников в сети Интернет известно, что число атомов в Солнце в среднем составляет атомов.
Для убедительности попытаемся рассчитать число атомов в Солнце сами.
Для расчета числа атомов в Солнце, воспользуемся известной формулой:
(2) |
где, m — масса химического элемента;
— число Авогадро;
M — молярная масса химического элемента.
Из источников интернета, состав минеральных веществ в Солнце представлены в таблице 1.
Таблица 1
Элементный состав Солнца [2, с. 11]
№ п/п | Химический элемент | Водород | Гелий | Кислород | Углерод | Железо | Неон | Азот | Кремний | Магний | Сера | Всего |
1 | % от общей массы | 71,1 | 27,14 | 0,97 | 0,40 | 0,019 | 0,058 | 0,096 | 0,099 | 0,042 | 100 | |
2 | Масса, | 1,422 | 0,5428 | 0,0194 | 0,008 | 0,00038 | 0,00116 | 0,00192 | 0,00198 | 000152 | 0,00084 | 2 |
Согласно так называемой стандартной солнечной модели (ССМ), Солнце состоит из трех зон, отличающихся составом, температурой, плотностью и процессом передачи энергии. Центральная зона (или ядро), радиационная зона и конвективная зона. Из всей массы Солнца ядро составляет около 50 %, радиационная зона — 48 % и конвективная зона — около 2 %. Масса Солнца
кг. Они представлены в таблице 2.
Центральная зона (или ядро), радиационная зона и конвективная зона. Из всей массы Солнца ядро составляет около 50 %, радиационная зона — 48 % и конвективная зона — около 2 %. Масса Солнца
кг. Они представлены в таблице 2.
Таблица 2
Строение Солнца по массе [3, с. 11]
№ п/п | Солнце, | Ядро, | Радиационная зона, | Конвективная зона, |
1 | 2 | 1 | 0,96 | 0,04 |
Известно, что Солнце состоит из различных веществ.
Таблица 3
Молярная масса химических элементов. [4, Таблица Менделеева]
№ п/п | Химический элемент | Водород | Гелий | Кислород | Углерод | Железо | Неон | Азот | Кремний | Магний | Сера | Всего |
1 | Молярная масса, | 0,6 | 2 | 12 | 56 | 20,2 | 14 | 28 | 24 | 32 | — |
Используя формулу (2) и данные таблиц 1, 2, 3, найдём:
- Для водорода
- Для гелия
- Для кислорода
- Для углерода
- Для железа
- Для неона
- Для азота
- Для кремния
- Для магния
- Для серы
Сложив все значения числа атомов химических элементов, получим
N =
.
Таким образом, мы убедились, что число атомов в Солнце, известное из сети Интернета и рассчитанные нами, не совпадают.
Считаем, что более точное будет число атомов в Солнце, рассчитанное нами.
Используя выражение (1), подставив численные значения, получим:
Вывод: молярная масса Солнца, рассчитанная первым способом, равна .
Б) Для вычисления молярной массы Солнца другим способом, воспользуемся уравнением Менделеева-Клапейрона.
«Известно, что плотность любого идеального газа, согласно определению равна отношению массы газа к его объёму:
(3) |
Из уравнения Менделеева-Клайперона
, следует:
(4) |
Используя выражения (3) и (4), получим
(5) |
где: p — давление, R — универсальная газовая постоянная, T — абсолютная температура» [5, с. 193].
193].
Для вычисления молярной массы Солнца, сначала вычислим молярные массы его частей (областей). Для этого воспользуемся выражением (5) и таблицей 4 «Строение Солнца по плотности, температуре, давлении».
Таблица 4
Строение Солнца по плотности, температуре и давлении [6]
№ п/п | Зона | R | Температура T, К | Давление p , Па | Плотность ρ, |
1 | Ядро | 0 | 15500000 | 149 | |
2 | 0,1 | 13100000 | 87,4 | ||
3 | 0,2 | 9420000 | 35,3 | ||
4 | Радиационная | 0,3 | 6810000 | 12,1 | |
5 | 0,4 | 5140000 | 3,94 | ||
6 | 0,5 | 3980000 | 1,32 | ||
7 | 0,6 | 3130000 | 0,50 | ||
8 | Конвективная | 0,7 | 2340000 | 0,20 | |
9 | 0,8 | 1380000 | 0,09 | ||
10 | 0,9 | 602000 | 0,02 | ||
11 | 0,98 | 99600 | 0,001 |
- Рассчитаем молярную массу ядра Солнца.

- Для радиуса Солнца R = 0.
- Для радиуса Солнца R = 0,1
- Для радиуса Солнца R = 0,2
Найдем среднее арифметическое:
Таким образом, молярная масса M ядра Солнца равна .
- Рассчитаем молярную массу лучистой зоны Солнца
- Для радиуса R = 0,3.
- Для радиуса Солнца R = 0,4.
- Для радиуса Солнца R = 0,5.
- Для радиуса Солнца R = 0,6.
Найдем среднее арифметическое:
Таким образом, молярная масса лучистой зоны Солнца равна .
- Рассчитаем молярную массу конвективной зоны Солнца.
- Для радиуса Солнца R = 0,7.
- Для радиуса Солнца R = 0,8.

- Для радиуса Солнца R = 0,9.
- Для радиуса Солнца R = 0,98.
Найдем среднее арифметическое.
Таким образом, молярная масса конвективной зоны Солнца равна .
- Рассчитаем молярную массу Солнца.
Составим уравнение:
отсюда
(6) |
Подставив численные значения в выражение (6), получим:
Таким образом, молярная масса M Солнца равна .
Сравним молярные массы Солнца, рассчитанные двумя способами. Для сравнения необходимо воспользоваться отношением:
Таким образом, значение молярной массы Солнца, полученное первым способом в 1,06 больше. Предполагаем, что молярная масса Солнца, полученная вторым способом более точно, т. е.
.
е.
.
Литература:
- Мякишев Г. Я., Буховцев Б. Б., Сотский Н. Н. Учебник 10 класса общеобразовательных учреждений. Просвещение. Москва. 2008.
- Тимохин Александр. Из чего состоит Солнце? Таблица элементного состава. Опубликовано 3.05.2021г.
- Источник: НАСА — Центр космических полетов Годдарда.
- Мирошниченко Л. И. Физика Солнца и солнечно-земных связей. Москва. Университетская книга. 2011.
- Пёрышкин А. В., Е. М. Гутник. Физика, 9 кл. М.:Дрофа, 2011.
- Савченко Н. Е. Физика. Москва. Айрис — Пресс. 2005.
- Кононович Э. В. Солнце — дневная звезда: Пособие для учащихся. М. Просвещение, 1982.
плотность, солнце, температура, масса, давление, молярная масса, число атомов, число Авогадро, универсальная газовая постоянная
Солнце, молярная масса, число атомов, масса, число Авогадро, универсальная газовая постоянная, температура, плотность, давление
- Как издать спецвыпуск?
- Правила оформления статей
- Оплата и скидки
Руководство по изучению молярной массы | Inspirit
Инструменты для творчества скоро появятся, чтобы вдохновить!
Присоединяйтесь к списку рассылки, чтобы узнать, когда мы запустимся.
Химия
Общая химия
Крот
Учебное пособие по молярной массе
Гаятри Мани
HS-PS1-3
Масса/молярная масса может быть определена как наименьшая единица массы соединения. одной углеродной массы- 12 атомов. Читайте дальше, чтобы узнать больше.
ВВЕДЕНИЕ
Задумывались ли вы когда-нибудь, сколько молекул содержится в футбольном мяче, которым вы играете, или в воде, которую вы пьете? Мы уже знаем, что атомы или молекулы являются наименьшими единицами с точки зрения как массы, так и размера. Вес одного моля образца является молярной массой. Молярная масса рассчитывается путем сложения всех атомных масс каждого атома в молекуле. Как тогда можно определить молярную массу?
ЧТО ТАКОЕ МОЛЬНАЯ МАСА В ХИМИИ?
Молярная масса любого вещества определяется как наименьшая единица массы этого соединения с одной двенадцатой массы одного углерода, что составляет 12 атомов. В любом веществе количество присутствующих сущностей всегда можно определить как моль.
В любом веществе количество присутствующих сущностей всегда можно определить как моль.
ЧТО ТАКОЕ ЕДИНИЦА МОЛЯРНОЙ МАССЫ?
В качестве стандартной единицы можно использовать г моль⁻¹, а в системе СИ – кг моль⁻¹. Количество атомов, которое наблюдается в 12 г изотопа 12С, равно количеству частиц, которое вы также наблюдали бы в 1 моле вещества. Помните, что независимо от вещества, моль любого вещества всегда будет содержать один и тот же номер сущности.
С помощью спектрометра была измерена масса атомов углерода-12, которая оказалась равной 1,992648x 10⁻³g. Количество объектов в одном моле имеет решающее значение при расчете массы в химии и известно как число Авогадро, которое равно 6,02214076 x 10²³.
Периодическая таблица и молярная масса
Как мы уже знаем, молярная масса – это масса в г 1 моля, что составляет 6,02 x 1023 частиц. Поэтому в большинстве случаев вам просто нужен атомный вес элемента в периодической таблице, чтобы узнать молярную массу.
Чтобы лучше понять это, вы найдете атомный вес, указанный под названием элемента и символом элемента.
Например, если вы посмотрите на углерод, его атомный вес равен 12,01. Следовательно, его молярная масса составляет 12,01 г/моль.
Однако есть некоторые исключения. Это исключение относится к элементам, которые присутствуют в разных формах, а не к одному несвязанному атому. В периодической сказке есть 7 двухатомных элементов. Эти элементы включают H, O, N, I, Br, F и CL. Это специальные, здесь нужно умножить атомный вес на 2.
Кроме того, есть некоторые элементы, которые имеют более 2 атомов. Например, у фосфора 4 атома, у серы 8 атомов, у селена тоже 8 атомов.
МАССА И ФОРМУЛА МОЛЯРНОЙ МАССЫ
Может показаться, что легко вычислить формулу массы молекул, атомов и других подобных соединений; однако нахождение индивидуальных весов этих частиц не служит никакой полезной цели. Они должны быть выражены на более макроскопическом уровне, и связующим звеном между этой частицей и макроскопическим уровнем считается молярная масса.
Молярная масса = масса/моль = г/моль
Расчет молярной массы по атомным массам
Молярная масса — Масса 1 моля данного вещества.
Вы можете вычислить молярную массу любого соединения, суммируя атомные веса присутствующих атомов.
Например: вычислим Молярную массу h3O
Молярную массу h3O = 2(Атомный вес водорода) + 1(Атомный вес кислорода) = 2 х 1 + 1 х 16 = 18 г/моль
КАК МОЖНО ЛЕГКО ОПРЕДЕЛИТЬ МОЛЯРНУЮ МАССУ РАЗЛИЧНЫХ СОЕДИНЕНИЙ?
Давайте рассмотрим пример, чтобы понять, как рассчитать молярную массу NaCl.
- Используя периодическую таблицу, найдите атомные массы: Для каждого элемента вы должны определить атомную массу, используя периодическую таблицу. Для любого элемента число в левом верхнем углу представляет собой атомную массу. Атомная масса натрия будет 22,98976 г/моль, а хлора — 35,453 г/моль.
- Подсчитайте количество атомов, присутствующих в каждом элементе: Поскольку нижние индексы отсутствуют, это означает, что в этом соединении есть только один атом натрия и один атом хлора.

- Теперь найдите молярную массу: Теперь, когда вы знаете атомную массу и количество атомов соединения, вы можете найти молярную массу, как показано в примере.
ЗАКЛЮЧЕНИЕ
- Молярная масса может быть определена как наименьшая единица массы любого соединения и составляет двенадцатую часть одной массы углерода — 12 атомов.
- Стандартная единица – г моль⁻¹, а единица СИ – кг моль⁻¹.
- Вы можете найти молярную массу, если знаете атомную массу и число атомов, входящих в состав каждого элемента.
Часто задаваемые вопросы
1. Масса равна молярной массе?
Молярная масса считается равной массе формулы.
2. Что понимают под молярной массой?
Молярная масса может быть определена как наименьшая единица массы любого соединения и составляет двенадцатую часть массы углерода – 12 атомов.
Мы надеемся, что вам понравился этот урок, и вы узнали что-то интересное о Молярная масса ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на любые вопросы и пообщаться с другими студентами, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности — мы обещаем, это делает учебу намного веселее! 😎
Молярная масса — wikidoc
Молярная масса — это масса одного моля химического элемента или химического соединения. [1] Обычно используется в стехиометрических расчетах сыпучих веществ в химии. Его основная цель — использовать в качестве коэффициента преобразования между количеством граммов чистого вещества, которое можно измерить непосредственно, и количеством молей этого вещества, которое имеет большее химическое значение. Это позволяет использовать соответствующее количество молекул вещества независимо от массы. Например, если для реакции требуется равное количество молекул двух веществ, но молярная масса одного вещества в два раза больше массы другого, то этого вещества потребуется в два раза больше граммов, чтобы получить такое же количество молекул.
[1] Обычно используется в стехиометрических расчетах сыпучих веществ в химии. Его основная цель — использовать в качестве коэффициента преобразования между количеством граммов чистого вещества, которое можно измерить непосредственно, и количеством молей этого вещества, которое имеет большее химическое значение. Это позволяет использовать соответствующее количество молекул вещества независимо от массы. Например, если для реакции требуется равное количество молекул двух веществ, но молярная масса одного вещества в два раза больше массы другого, то этого вещества потребуется в два раза больше граммов, чтобы получить такое же количество молекул.
Молярная масса химического вещества может быть рассчитана по стандартным атомным весам, указанным для элементов в стандартной периодической таблице. Моль вещества определяется как приблизительно 6,023×10 23 ( см. число Авогадро ) частиц вещества. Таким образом, молярная масса равна массе 6,023×10 23 частиц вещества. Молярная масса отличается от молекулярной массы, которая равна массе одной молекулы .
Молярная масса отличается от молекулярной массы, которая равна массе одной молекулы .
В химии единицей молекулярной массы является г/моль из-за химической полезности. В физике молярная масса обычно определяется в килограммах на моль (кг/моль), поскольку базовой единицей массы в системе СИ является килограмм.
В линейных полимерах не каждая полимерная цепь состоит из одинакового количества повторяющихся звеньев. Говорят, что данный образец полимера состоит из смеси макромолекул с определенным распределением молярной массы. [2]
Содержимое
- 1 Пример
- 2 Молярная масса в зависимости от молекулярной массы
- 3 Каталожные номера
- 4 См. также
- 5 Внешние ссылки
Пример
Посмотрим примерно, сколько граммов содержится в 2,3 молях столового сахара с химической формулой C 12 Н 22 О 11 . Стандартные атомные массы углерода, водорода и кислорода составляют примерно 12,011 , 1,008 и 15,999 г/моль соответственно. Таким образом, молярная масса сахарозы равна ее сумме: (12,011 * 12) + (1,008 * 22) + (15,999 * 11) = 342,297 г/моль. Тогда масса 2,3 моля сахара равна 2,3 моль * 342,297 г/моль = 787,2831 г.
Таким образом, молярная масса сахарозы равна ее сумме: (12,011 * 12) + (1,008 * 22) + (15,999 * 11) = 342,297 г/моль. Тогда масса 2,3 моля сахара равна 2,3 моль * 342,297 г/моль = 787,2831 г.
(Примечание: для простоты в этом примере игнорируется правильное использование значащих цифр)
Молярная масса в зависимости от молекулярной массы
Молярную массу иногда путают с родственной, но отличной молекулярной массой. Это во многом связано с тем, что когда молярная масса и молекулярная масса выражаются в г/моль и u соответственно, они почти всегда будут иметь близкие, но не идентичные числовые значения. Молярная масса обычно вычисляется из изотопно-взвешенных средних, тогда как молекулярная масса представляет собой массу одной молекулы, состоящей из четко определенных изотопов. Изотопно-взвешенные средние значения, использованные для вычисления молярных массы встречаются в большинстве версий периодической таблицы и являются числами, рекомендованными ИЮПАК. Они представляют собой наиболее вероятные веса веществ, обнаруженных в лаборатории. При усреднении учитывается естественное содержание изотопов, обычно более тяжелых, а также вариации их естественного содержания в разных местах на Земле. Кроме того, достоверность или количество значащих цифр после запятой отличается. Значащие цифры стандартных атомных весов и, таким образом, вычисленные молярные массы часто ограничены естественными вариациями изотопного распределения и не обязательно нашей способностью точно измерять. Уверенность в массах изотопов и результирующих молекулярных массах ограничена только точностью измерения неизменных масс изотопов.
Они представляют собой наиболее вероятные веса веществ, обнаруженных в лаборатории. При усреднении учитывается естественное содержание изотопов, обычно более тяжелых, а также вариации их естественного содержания в разных местах на Земле. Кроме того, достоверность или количество значащих цифр после запятой отличается. Значащие цифры стандартных атомных весов и, таким образом, вычисленные молярные массы часто ограничены естественными вариациями изотопного распределения и не обязательно нашей способностью точно измерять. Уверенность в массах изотопов и результирующих молекулярных массах ограничена только точностью измерения неизменных масс изотопов.
Даже среди профессиональных химиков принято использовать эти термины как взаимозаменяемые, поскольку для наиболее распространенных применений разница незначительна. Однако иногда это может привести к существенной путанице. Из-за этой распространенной практики некоторые области химии разработали свои собственные более конкретные термины, такие как моноизотопная масса и средняя масса.
