Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Структурная формула всех изомеров С7Н16
Массовая доля углерода в соединении равна 83. 3%, водорода — 16.7%. Определите строение вещества, если известно, что при его бромировании образуется только одно монобромпроизводное.
3%, водорода — 16.7%. Определите строение вещества, если известно, что при его бромировании образуется только одно монобромпроизводное.
Решено
Реакция изомеризации пентана.
Гидролиз NA3PO4
идет ли гидролиз у Bi(NO3)3…
Пользуйтесь нашим приложением
Кислоты хлора | Дистанционные уроки
29-Окт-2012 | Нет комментариев | Лолита Окольнова
Хлор — самый богатый на кислоты элемент!
5 кислот — таким рекордом может похвастаться не каждый!
Хлор — элемент 7-й группы главной подгруппы и к тому же 3-го периода.
Что это означает?
Это означает много степеней окисления! 🙂
- Т.к. элемент находится в 7-й группе, то ему не хватает всего 1 электрона до завершения электронной оболочки — минимальная степень окисления хлора = -1.

- Т.к. хлор находится в 3-ем периоде, то он может распаривать электроны с p-подуровня на d-подуровень — степени окисления +1, +3, +5 и +7.
- HCl — хлороводородная или соляная кислота.
Степень окисления хлора= -1.
Сильная кислота. Едкая жидкость, дымит на воздухе. В воде практически полностью диссоциирует на ионы:HCl = H(+) + Cl(-) .
Соли — хлориды.
Ей присущи все свойства кислот: взаимодействие с металлами до водорода, взаимодействие с основными оксидами, с основаниями, с солями.
При взаимодействии с окислителями окисляется до Cl2:
2HCl + h3SO4 = SO2 + Cl2↑ + 2h3O
2. HClO — хлорноватистая кислота.
Степень окисления хлора = +1.
Бесцветный раствор. Это очень слабая кислота. Неустойчивая. Небольшая степень диссоциации. Ей соответствует кислотный оксид Cl2O.
Получение:
Сl2 + h3O = HCl + HClO
Cl2O + h3O = 2HClO
НО: это сильная кислота-окислитель: 2HClO + h3S = S + Cl2 + h3O
Cоли — гипохлориты.
3. HClO2 — хлористая кислота.
Степень окисления хлора = +3.
Бесцветная. Кислота средней силы. Неустойчивая. Ей соответствует кислотный оксид Cl2O3.
Проявляет окислительные свойства.
Соли — хлориты.
4. HClO3 — хлорноватая кислота.
Степень окисления хлора = +5
В свободном виде она не получена, «живет» только в растворах. Сильное вещество как просто кислота, и как кислота-окислитель. Кислотный оксид — Cl2O5.
Сильная кислота — окислитель: HClO3 + S + h3O= h3SO4 + HCl
Соли — хлораты.
5. HClO4 — хлорная кислота.
Степень окисления хлора= +7
Одна из самых сильных кислот, одна из самых сильных окислителей.
Взрывоопасна. Бесцветная, летучая, парит на воздухе.
Кислотный оксид — Cl2O7.
Соли — перхлораты.
Обратите внимание на изменение свойств кислот с изменением степени окисления:
- хлор в минимальной степени окисления дает сильную кислоту, но не окислитель;
- с увеличением степени окисления увеличивается сила кислот и окислительные свойства
- Подписка на рассылку
(Правила комментирования)
What, How to Balance & FAQs —
By Pratham Shah
Процесс Дикона представляет собой процесс реакции соляной кислоты с атмосферным кислородом при температуре от 400 до 500 o C в присутствии различных катализаторов. Рассмотрим подробно реакцию.
Рассмотрим подробно реакцию.
Соляная кислота присутствует в жидкой и газообразной формах, обычно ее получают путем растворения хлористого водорода в воде. Кислород, окислитель, является высокореакционноспособным неметаллом и используется в различных целях, включая производство стали, текстиля, систем жизнеобеспечения и т. д.
В этой статье рассматриваются метод балансировки, процедура титрования и подробный механизм реакции.
Что является продуктом HCl и O 2 ?Соляная кислота (HCl) реагирует с кислородом (O 2 ) с образованием хлора и воды. Водород вытесняется из HCl атомом кислорода, образуя воду и производя хлор.
4HCl + O 2 → 2Cl 2 + 2H 2 O
Какой тип реакции HCl + O 2 ? HCl + O 2 является эндотермической, окислительно-восстановительной реакцией и реакцией с одним замещением. Поскольку солеобразования не происходит, это не реакция нейтрализации, а кислотно-щелочная реакция в отсутствие основания.
Поскольку солеобразования не происходит, это не реакция нейтрализации, а кислотно-щелочная реакция в отсутствие основания.
Для уравновешивания химической реакции необходимо выполнить следующие шаги
Этап 1:The unbalanced chemical reaction is written down as follows:
HCl + O 2 → Cl 2 + H 2 O
Step 2:Write down the number молей каждого элемента на стороне реагента и на стороне продукта, как указано в таблице ниже :
| Соединения | Сторона реагента | 9 Сторона продукта1 |
|---|---|---|
| C | 1 | 2 |
| O | 2 | 1 |
| H | 1 | 2 |
Шаг 3:
Чтобы сбалансировать реакцию, количество молей, присутствующих в каждом элементе на стороне реагента, должно быть равно количеству молей, присутствующих в каждом элементе на стороне продукта.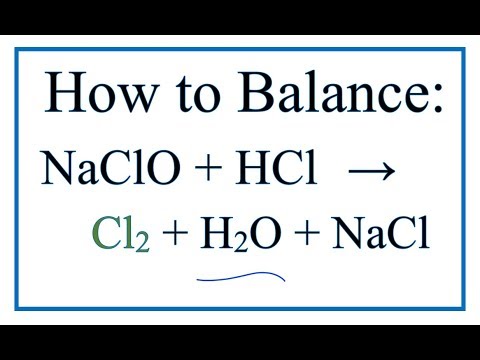 Здесь моли всех трех элементов хлора, кислорода и водорода неуравновешены.
Здесь моли всех трех элементов хлора, кислорода и водорода неуравновешены.
Шаг 4
Следующие три вещи, которые должны быть сделаны, чтобы сбалансировать уравнение :
- HCl на стороне реагента , умножено на 2
- Хлор на стороне продукта — Умнозируется на Условие
- . 2
- Вода на стороне продукта умножается на 2
Этап 5
Наконец, Сбалансированная химическая реакция – Сбалансированная химическая реакция
HCl + O 2 Титрование. является аналитом и, кроме того, не является кислотно-щелочной реакцией . HCl + O 2 Суммарное ионное уравнениеСуммарное ионное уравнение для HCl + O 2 реакция равна
4H + (aq) + 4Cl — (aq) + o 2 (g) + = 2Cl 2- (aq) + 2o 2+ (aq) + 2H 2 (aq) + 2o 2+ (aq) + 2H 2 (g)
HCl + O 2 conjugate pairsIn HCl + O 2 reaction,
- HCl conjugate base = Cl –
- H 2 O сопряженное основание = OH –
Межмолекулярные силы, действующие на HCL и O 2 AS-
- ГВРЕДНА соляной кислоты, так как это полярное ковалентное соединение.

- London Dispersion Forces действует на кислород, так как это неполярная молекула.
HCl реагирует с O 2 , дает 185,04 кДж/моль, энтальпия реакции, рассчитывается следующим образом :
- Сведите в таблицу количество энтальпией соответствующего реагирующего вещества side and product side as shown below
| Compounds | Number of moles | Enthalpy (KJ/mol) |
|---|---|---|
| HCl | 4 | -167.15 |
| O 2 | 1 | 0 |
| Cl 2 | 2 | 0 |
| H 2 O | 2 | -241. 8 8 |
- Энтальпия реакции рассчитывается следующим образом:
- Изменение энтальпии = [2*(-241,8) + 2*(0)] – [4*(-167,15) + 1*(0)] = 185,04 кДж/моль.
HCl + O 2 реакция не является буферным раствором из-за присутствия HCl, которая является сильной кислотой. Буферный раствор представляет собой смесь сопряженной кислоты и слабого основания или сопряженного основания и слабой кислоты.
Является ли HCl + O 2 полной реакцией?HCl + O 2 является полной реакцией, поскольку полные моли реагента превращаются и расходуются в продукте в состоянии равновесия.
Является ли реакция HCl + O 2 экзотермической или эндотермической?HCl + O 2 является эндотермической реакцией, поскольку энтальпия реакции составляет 185,04 кДж/моль, что снижает температуру .
Является ли HCl + O 2 окислительно-восстановительной реакцией?
HCl + O 2 реакция может быть классифицирована как окислительно-восстановительная реакция из-за восстановления молекулы кислорода и окисления молекулы хлора. Окислительно-восстановительная реакция
Является ли HCl + O 2 реакцией осаждения?HCl + O 2 не является реакцией с образованием осадка, поскольку в ходе реакции не происходит образования солей.
Является HCl + O 2 обратимая или необратимая реакция?HCl + O 2 является необратимой реакцией и не может быть обращена вспять, если не произойдет резкого изменения давления или температуры.
Является ли HCl + O 2 реакцией замещения?HCl + O 2 представляет собой реакцию одиночного замещения (замещения), когда HCl взаимодействует с O 2 .
Заключение В этой реакции водород обменивается с кислородом с образованием воды, вытесняя соляную кислоту в виде хлора.
В этой реакции водород обменивается с кислородом с образованием воды, вытесняя соляную кислоту в виде хлора. В результате реакции HCl с O 2 образуется хлор различного назначения. Произведенный хлор используется в качестве дезинфицирующего и отбеливающего агента, используется для очистки питьевой воды, уничтожения бактерий, очистки бассейнов и т. д.
- Транг чо
Тим Ким Пхонг Трин Хоа Хок
Hãy nhập vào chất tham gia hoặc/và chất sản phẩm để bắt đầu tìm kiemТим Ким Нхом Хок Мьен Пхи Онлайн Facebook Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: h3 O2 Tổng hợp đầy đủ và chi tiết nhất can bằng phương trình điều chế từ hcl+o2 ra cl2+h3o.
 Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học.
Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học. Đề Cương Ôn Thi & Bài Tập Trắc nghiệm
(версия 1.204.214, полная загрузка)Những Điều Thú Vị Chỉ 5% Ngời Biet
Реклама
4HCl + O
2 → 2Cl 2 + 2H 2 ONhiệt độ: Nhiệt độ — Xúc tác: CuCl2
Xem trạng thái chất và chi tiết của phương trình HCl + O2 => Cl2 + h3O
Có 1 kết quả được tìm thấy — Hiển thị kết quả từ 1 đến 1
Trang 1Thông tin thêm về phương trình hóa học
Phản ứng cho HCl (axit clohidric) tác dụng vói O2 (oxi) tạo thành Cl2 (clo) ,trong điều kiện nhiệt độ Nhiệt độ — ,trong điều kiện chất xúc tác CuCl2
Phương trình để tạo ra chất HCl (axit clohidric) (хлористый водород)
Cl 2 + C 3 H 8 → HCl + C 3 H 7 CL CO + H 2 O + PDCL 2
4 2 9018 2
4 + HCL3 9046.
 9046. 9046.
9046. 9046.. để tạo ra chất O2 (oxi) (oxygen)
2KNO 3 → 2KNO 2 + O 2 2CaOCl 2 → O 2 + 2CaCl 2 2H 2 O → 2H 2 + O 2
Phương trình để tạo ra chất Cl2 (clo) (хлор)
2H 2 o + 2nacl → CL 2 + H 2 + 2NAOH BACL 2 → CL 2 + BA CUCL 2 → CL 2 + CU
019 → CL
2 + CU6001010101H -nG ể ể ể ể ể ể ể ể ể ể rì rì ể ể ể ể ể ể ể ể ể rì rì ể ể rì ể ể ể ể ể ể rì chất h3O (nước) (water)
24HNO 3 + FeCuS 2 → Cu(NO 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 18NO 2 + Fe(NO 3 ) 3 HCl + NaOH → H 2 O + NaCl 10FeO + 18H 2 SO 4 + 2KMNO 4 → 5FE 2 (SO 4 ) 3 + 18H 2 O + 2MNSO 4 + K 2 SO 4 4 + K 2 SO 4 4 .


 10.16
10.16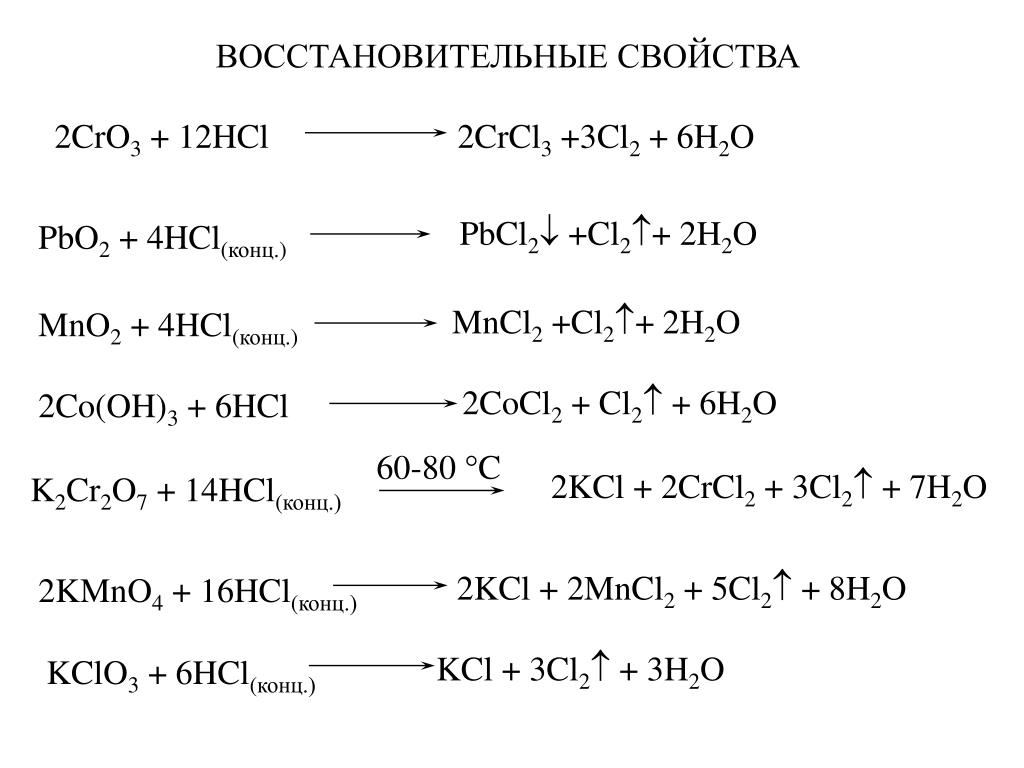


 В этой реакции водород обменивается с кислородом с образованием воды, вытесняя соляную кислоту в виде хлора.
В этой реакции водород обменивается с кислородом с образованием воды, вытесняя соляную кислоту в виде хлора.  Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học.
Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học. 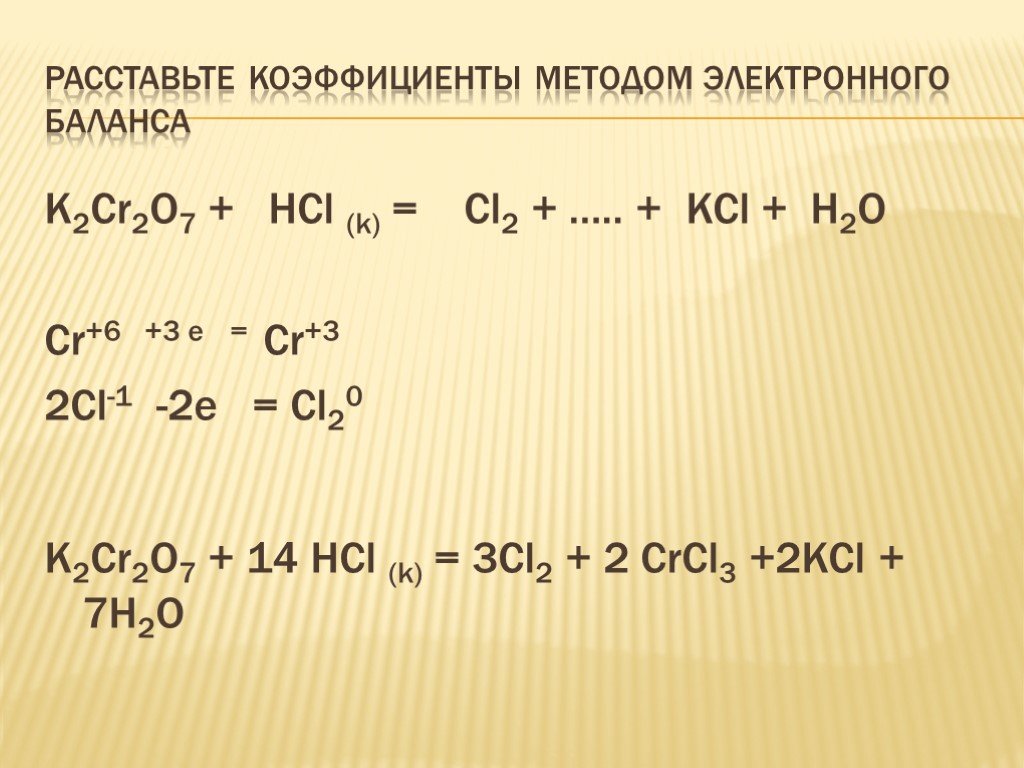 9046. 9046.
9046. 9046.