H3S + CL2 + H3O → H3SO4 + HCL
H3S + CL2 + H3O → H3SO4 + HCl Là Phương trình phản ứng oxi hóa khi sục h3s vào dung dịc nước cl2, ược hửc hcn s so hc n -s so n -gn h3s h3s h3s h3s h3s h3s dung hửc вьет ва кан бонг фан унг мут ках чи тит. Mời cac bạn tham khảo.
nội Dung
Связанные статьи
- 1 1. Phương trình phản ứng h3s tạo ra h3so4
- 1,1 H3S + 4Cl2 + 4H3O → H3SO4 + 8HCl
- 2 2. h3SO4 + 8HCl
- 4.1 a. Tính axit yếu
- 4.2 б. Tính khử mạnh
H
2 S + 4Cl 2 + 4H 2 O → H 2 SO 4 + 8HClS -2 → S +6 + 8e
→ S -2 nhường e → chất khử.
Bạn đang xem: h3S + Cl2 + h3O → h3SO4 + HCl
Cl 2 + 2e → 2Cl – .
→ CL 2 Nhận e → Chất oxi hóa
2. điều kiện phản ứng H 2 S RA H 2 SO 4NHI HI .3333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333.31. Phản ứng H 2 S to ra H 2 SO 4
Sục khí H 2 S vào dung dịch nước Clo
4. Tính chất hóa học của H 2 S 9. Tính axit yếuHiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên la axit sunfuhiđric (H 2 S).
axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như na 2 s chứa ion s 2- và muối axit như nahs chứa hs-.
Н 2 9b. Tính Khử Mạnh
Là chất Khử Mửnh Vì trong H 2 S lưu huỳnh có số oxi hoá thấp nhất (-2).
KHI THAM GIA PHảN ứng hóa học, tùy thuộc vào bản chất và nồng ộ của chất oxi hóa, nhiệt ộ,… mà nguyên tốu huỳnh có so xi hó hó hrị hó hó hó hrị hu thành (S 0 ), (S +4 ), (S +6 ).
Tác dụng với oxi có thể tạo S hoặc SO 2 tùy lượng ôxi và cách tiến hành phản ứng.
2H 2 S + 3O 2 Dư → 2H 2 O + 2SO 2
2H 2 S + O 2 → 2H 2 33393
.HệHH.Hệ.Hệ.Hệ.Hệ.Hệ.Hệ.Hệ.Hệ.Hệ.Hệ.Hệ 39 , Khí H 2 S Cháy Trong Không Khí với ngọn lửa xanh nhạt, h3s bị oxi hóa thành so 2 :tác dụng với clo có tạo s haly h 2 So So 9.0033 tùy điều kiện phản ng.
H 2 S + 4CL 2 + 4H 2 O → 8HCl + H 2 SO 4
H 2 S + CL 2 → 2HCL + S (KHí Clo Gặ CLO Gặ CLO Gặ CLO. H 2 S)
H 2 S)
Câu 1. Cho phản ứng hoá học sau: H 2 S + 4Cl 2 + 4H 2 O → H 2 SO 4 + 8HCl
Câu nào dưới đây phát biểu đúng:
A. H 2 S là Chất oxi Hoá, CL 2 Là Chất Khử
B. H 2 S Là Chất Khử, CL 2 Là CHấT Oxi Hoá
C. H 2 333 S là Chất Khử, H 2 o là chất oxi hoá
D. H 2 S là Chất oxi Hoá, H 2 O là Chất KHử
đAp án B
9000 2 9003 . Cho phản ng: H 2 S + Cl 2 + h3O → H 2 SO 4 + HCltổng hệ số cân bằng trong phản ứng oxi hóa khử là:
A. 17
B. 18
C. 1
D. 20
đap án B
Câl 3. 9.nhà 3. 9. 1. các thí nghiệm sau:
(а). Sục H 2 S vào dung dịch nước Clo
Sục H 2 S vào dung dịch nước Clo
(b). Sục khí SO 2 vào dung dịch KMnO 4
(c). Cho H 2 S vào dung dịch Ba(OH) 2
(d). Thêm H 2 SO 4 loãng vào NaClO
(д). Đốt H 2 Strong oxi không khí.
(ф). Sục khí Cl 2 vào Ca(OH) 2 huyền phù
Nhưng thí nghiệm nào xảy ra phản ứng oxi hoá – khửlà 90), (f) 023 A.90), (f) 023 A.90
Б. (а), (в), (г), (д)
В. (а), (в), (г), (е)
Г. (б), (г), (e), (f)
Đáp án A
(a). Sục H 2 S vào dung dịch nước Clo
(b). Sục khí SO 2 vào dung dịch KMnO 4
(д). Đốt H 2 Strong oxi không khí.
(ф). Sục khí Cl 2 vào Ca(OH) 2 huyền phù
Câu 4. Dãy chất nào trong các dãy sau đây gồm các chất đều thể hiện tính oxi hóa khi phản ứng với SO 2 ?
A.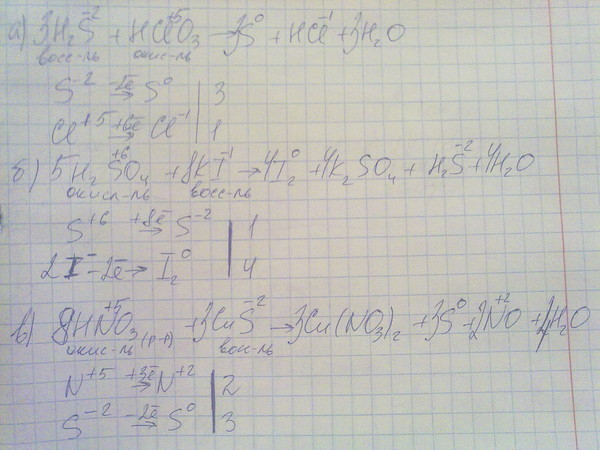 H 2 S, O 2 , NướC Brom
H 2 S, O 2 , NướC Brom
B. O 2 , NướC Brom, Dung Dịch Kmno 4
C. Dung Dịch Naoh, O 2 , Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dung Dunch. КМnО 4
D. Dung Dịch Bacl 2 , CAO, NướC BROM
đAP án B
A. H 2 S, O 2 , NướC Brom.
Sai vì H 2 S thể hiện tính khử
B. O 2 , nước brom, dung dịch KMnO 4
2..
Sai.vì Naoh Không thể tính tính oxh hoặc khử khi tác dụng với so 2
D. Dung dịch Bacl 2 , H 2 S, NướC Brom.
SAI.Vì Có Bacl 2
Câu 5. Dẫn 8,96 Lít (đktc) hỗn hợp khí a gồm h 2 s và co 2 và n -g 2 s và 2 vào lượg dung drư gh h 2 с 2 Và ng h 2 s và 2 v gm h 2 3 ) 2 , чт được 23,9 gam kết tủa. Thành phần phần tram thể tích của H 2 S trong A la
A. 25%
B. 50%
C. 60%
D. 75%
đap án A
N HH A = 0,4 моль
N PBS = 0 , 1 моль
Phương trình phản ứng
H 2 S + Pb (№ 3 ) 2 → PBS + 2HNO 3
0,1 ← 0,1
9003 %V 3933 333 3333.323.323.323.323.932. .0,1 ← 0,19000 3 9003 %против
0,1 ← 0,1 0003 %против
0,1 → 0,19000 3 V
0,1. = 25%
= 25%
……………………………….
Trên đay THPT Sóc Trăng đã đưa ra nội dung chi tiết phương trình phản ứng khi sục khí H 2 S vào dung dịch Cl2: H 2 S + Cl 2 + H 2 O → H 2 SO 4 + HCl tới các bạn. Hy vọng cac bạn học sinh nắm được nội dung từ đó áp dụng giải cac dạng bài tập câu hỏi tương tự.
ể Có kết quả học tập tốt và hiệu quả hơn, thp souc trăng xin giới thiệu tới các bạn học 10, chuy ề whà hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê hê i quhy tập Toán 10. Tài liệu học tập lớp 10 mà THPT Sóc Trăng tổng hợp bien soạn và đăng tải.
ngoài ra, thpt souc trăng đ thành lập group chia sẻ tài liệu học tập cũng như các bài giảng hay vềp 10 miễn phí trên faceb thể cập nhật thêm nhiều tài liệu mới nhất.
Đăng bởi: THPT Sóc Trăng
Chuyên mục: Giáo dục
Bản quyền bài viết thuộc trường THPT thàng Trđnh. Mọi hành vi sao chép đều la gian lận!
Mọi hành vi sao chép đều la gian lận!
Nguồn chia sẻ: Trường THPT Sóc Trăng (thptsoctrang.edu.vn)
4Cl2 + 4h3O + h3S → h3SO4 + 8HCl
Кл2 | кло | хи + h3O | nước | длинный + h3S | сероводород | хи = h3SO4 | аксит серный | дд + HCl | ось клоэдрическая | дд, Жиукин
Đề Cương Ôn Thi & Bài Tập Trắc nghiệm
(версия 1.204.214, полная загрузка)
những điều thú vị chỉ 5% người biết
Реклама
Mục lục
- Cách Viết phương trình đ cân bằng
- Thông tin chi tiết về phương trình 4Cl 2 + 4H 2 O + H 2 S → H 2 SO 4 + 8HCl
- Điều kiện phản ứng để Cl2 (clo) tác dụng h3O (nước) tác dụng H3S (hidro sulfua) là gì ?
- Làm cách nào để Cl2 (clo) tác dụng h3O (nước) tác dụng h3S (гидросульфуа)?
- hiện tượng nhận biết nếu phản ứng xảy ra 4cl 2 + 4H 2 O + H 2 S → H 2 SO 4 + 8HCL Là Gì?
- Thông tin nào cần phải lưu ý thêm về phương trình phản ứng 4Cl 2 + 4H 2 O + H 2 S → H 2 SO 4 + 8HCl ?
- giải thích chi tiết về các phân loại của phương trình 4cl 2 + 4H
- Phản ứng oxi-hoá khửlà gì ?
- Chuỗi phương trình hoa học co sử dụng 4Cl 2 + 4H 2 O + H 2 S → H 2 9082Cl 3
Английская версия Тим Ким Мо Ронг
Phương Trình Hoá Học Lớp 10 Phản ứng oxi-hoá khử
Cách viết phương trình đã cân bằng
| png» substance-weight=»70.9060″> 4Cl 2 | + | 4H 2 O | + | H 2 S | → | H 2 SO 4 | + | 8HCl | |
| clo | nước | hidro sulfua | axit sulfuric | axit clohidric | |||||
| Chlorine | Hydro sulfid, hydro sulfua, sunfan | Серная кислота; | |||||||
| (khí) | (lỏng) | (khí) | (dd) | (dd) | |||||
| (vàng lục) | (хонгмау) | (хонгмау) | (хонгмау) | (хонгмау)11 | |||||
| Axit | Axit | Axit | |||||||
| 71 | 18 | 34 | 98 | 36 | |||||
| 4 | 4 | 1 | 1 | 8 | Хо Со | ||||
| Nguyên — Phân tử khối (g/mol) | |||||||||
| Số mol | |||||||||
| KHốI LượNG (G) |
XIN HãAY Kéo Xuống dưới ể xem và -hành các céo hỏci zhi quanh quanh qrắci quanh quanh
☟☟☟
Тонг тин чи тьют ву пхонг трэн 4Cl
2 + 4H 2 O + H 2 S → H 2 SO 3 4 8003 4CL 2 + 4H 2 O + H 2 S → H 2 SO 4 + 8HCL Là Phản ứng Oxi-Hoá Khử, Cl2 (Clo) phản ứng với h3o (nước) phng vng vng vng vng vng vng vng vng vng vớn (hidro sulfua) để tạo ra H3SO4 (Axit Sulfuric), Hcl (Axit clohidric) dười điều kiện phản ứng là không cóđiều kiện phản ứng cl2 (clo) tác dụng h3o (nước) tác dụng h3s (hidro dụng h3o (nước) tác dụg h3s (hidro h3o (nước) tác h3s (hidro) tác dụng h3o (nước) tác h3s (hid) tác dụng h3o (nước) tác h3s (hid)
Không có
Làm cách nào để Cl2 (clo) tác dụng h3O (nước) tác dụng h3S (hidro sulfua) xảy ra phản ng?
khí Cl2 hoàn tan trong dung dịch h3S .
Nếu đang làm bài tập các bạn có thể viết ơn giản là cl2 (clo) tác dụng h3o (nước) tác dụng h3s (hidro sulfua) và tạ ra chất h3so4 (axit sulfuric), hclfua) và tạo ra chất h3so4 (axit sulfuric). biết nếu phản ứng xảy ra 4Cl 2 + 4H 2 O + H 2 S → H 2 SO 4 + 8HCl ла жи ?
Khí màu vàng lục Clorua (Cl2) mất mau khi hoàn tan trong nước tạo thành dung dịch.
Thông tin nào cần phải lưu ý thêm về phương trình phản ứng 4cl
2 + 4H 2 O + H 2 S → H 2 SO 4 + 8HI.G → H . thêm bất kỳ thong tin nào thêm về phương trình này. Bạn có thể kéo xuống dưới bạn click vào nút báo lỗi / đóng góp để đưa thêm thong tinРеклама
Phương Trình Điều Chế Từ Cl2 Ra h3SO4
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Cl2 (кло) ра h3SO4 (аксит серный)
Xem tất cả phương trình điều chế từ Cl2 (clo) ra h3SO4 (аксит серный)
Phương Trình Điều Chế Từ Cl2 Ra HCl
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từ Cl2 (кло) ра HCl (экситкловодородная)
Xem tất cả phương trình điều chế từ Cl2 (clo) ra HCl (axit clohidric)
Phương Trình Điều Chế Từ h3O Ra h3SO4
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế tế h3O (nước) ra h3SO4 (аксит серный)
Xem tất cả phương trình điều chế từ h3O (nước) ra h3SO4 (аксит серный)
Phương Trình Điều Chế Từ h3O Ra HCl
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế t h3O (nước) ra HCl (экситкловодородная)
Xem tất cả phương trình điều chế từ h3O (nước) ra HCl (axit clohidric)
Phương Trình Điều Chế Từ h3S Ra h3SO4
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế tế h3S (гидро сульфуа) ра h3SO4 (аксит серный)
Xem tất cả phương trình điều chế từ h3S (гидросульфуа) ra h3SO4 (аксит серный)
Phương Trình Điều Chế Từ h3S Ra HCl
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế t h3S (гидро сульфуа) ра HCl (экситкловодородная)
Xem tất cả phương trình điều chế từ h3S (hidro sulfua) ra HCl (axit clohidric)
giải thích chi tiết về các phân loại của phương trình 4cl
2 + 4h 2 O + H 2 S → H 2 SO 4 + 8HCL94914.
 ?
?Phản ứng oxi hoa khử thường liên quan đến việc chuyển giao điện tử (электрон) giữa cac đối tượng hóa học. Để hiểu được trọn vẹn phản ung oxi hoá khử bạn cần hiểu Chất khử: chất khử ла chụt чо электрон, nói cách khac, chất khử sẽ có số oxi hoá tăng sau khi phản ứng xảy ra. Trong định Nghĩa của chương trình phổ thong, chất khử cung được gọi la chất bị oxi hoá. Chất oxi hoá: ngược lại với chất khử, là chất nhận электрон. Chất oxi hoá có số oxi hoá tăng sau phản ung. Chất oxi hoá, trong định nghia của chương trình phổ thong con được gọi la chất bị khừ.
Xem tất cả phương trình Phản ứng oxi-hoá khử
Advertisement
Câu hỏi bài tập trắc nghiệm và tư luận có sử dụng phương trình 4Cl
2 + 4H 2 O + H 2 S → H 2 SO 4 + 8HClНажмите ể ể xem tất cả câu hỏi có liên quan tới phương trình 4cl 2 + 4h 2 O + H 2 S → H 2 SO 4 + 8HCL
COGUE 1. HALEGE 1. HALEGE 1. HALEGE 1. HALEGE 1. HALEGE 1. HALEN.
HALEGE 1. HALEGE 1. HALEGE 1. HALEGE 1. HALEGE 1. HALEN. Чо Какак Пхон Унг:
(1) O3 + кизяк KI →
(2) F2 + h3O (t0)→
(3) MnO2 + HCl đặc (t0)→
(4) Cl2 + навоз h3S →
Các phản ứng tạo ra đơn chất la:
A. (1), (2), (3).
Б. (1), (3), (4).
С. (2), (3), (4).
Д. (1), (2), (4).
Xem đáp án câu 1
Câu 2. Phản ứng hóa học
Чо Как Пхонг Трин Пхан Унг Сау:
(1) C4h20 + F2
(2) AgNO3 —t0—>
(3) h3O2 + KNO2
(4) Điện phân dung dịch NaNO3
(5) Mg + FeCl dư
(6) h3S + дд Cl2
Số phản ứng tạo ra đơn chất la:
А. 2
Б. 3
В. 4
Г. 5
Xem đáp án câu 2
Câu 3. Chất tác dụng được với khí h3S
Cho khí h3S tác dụng lần lượt với: dung dịch NaOH, khí clo, nước clo,
навозная мука KMnO4/H+; khí oxi dư đun nóng, навоз dịch FeCl3, навоз dịch
 Số trường hợp xảy ra phản ứng là
Số trường hợp xảy ra phản ứng là A. 4
B. 5
C. 6
Д. 7
Xem đáp án câu 3
Câu 4. Phản ứng tạo đơn chất
Чо Какак Пхон Унг:
(1) O3 + кизяк KI →
(2) F2 + h3O (t0)→
(3) MnO2 + HCl đặc (t0)→
(4) Cl2 + навоз h3S →
Các phản ứng tạo ra đơn chất la:
A. (1), (2), (3).
Б. (1), (3), (4).
С. (2), (3), (4).
Д. (1), (2), (4).
Xem đáp án câu 4
Câu 5. Cặp chất không phản ứng trực tiếp với nhau
Cho các chất sau: (1) h3S, (2) Cl2, (3) SO2, (4) O2. Trong điều kiện thích
hợp, cặp chất nào sau đây không phản ứng trực tiếp với nhau?
A. 2 và 4
B. 2 và 4
C. 1 và 3
D. 1 và 2
Xem đáp án câu 5
Câu 6. Phản ứng tạo đơn chất
Чо Какак Пхон Унг:
(1) O3 + навоз KI →
(2) F2 + h3O (t0)→
(3) MnO2 + HCl đặc (t0)→
(4) Cl2 + навозная мука h3S →
Cac phản ứng tạo ra đơn chất la
А. (1), (2), (3)
(1), (2), (3)
Б. (1), (3), (4)
В. (2), (3), (4)
Г. (1), (2), (4)
Xem đáp án câu 6
Câu 7. Chất tạo ra h3SO4 bằng một phản ng
Прочный состав: Cl2, CuSO4, S, SO2, h3S, Fe2(SO4)3, SO3. Số chất có
thể tạo ra h3SO4 bằng một phản ứng là:
A. 3
B. 5
C. 7
D. 6
Xem đáp án câu 7
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xac. Hãy click vào nút bên dưới để thông báo Чо Чунг Мин Бит Нэ
Щелкните vào đây để báo lỗi
Chuỗi phương trình hóa học có sử dụng 4cl
2 + 4H 2 O + H 2 S → H 2 SO 4 + 8HCL.HU 9003I
. +) S-2 → s0: ốt cháy khí h3s trong điều kiện thiếu oxi sản phẩm thu ược kết tủa vàng là s.
+) s0 → s-2: cho s phản ứng với hidro sản phm ch khí mùng тот ра.
+) S0 → S+4: Đốt cháy lưu huỳnh trong không khí thu được khí SO2 không màu.
