Как из карбида получить ацетилен?
Ответы (1)
jinjer2006
16.04.2023
Для получения ацетилена из карбида необходимо применить процесс гидролиза. Карбид кальция (CaC2) реагирует с водой (h3O), образуя ацетилен (C2h3) и гидроксид кальция (Ca(OH)2). Реакция протекает при нагревании и образовании углекислого газа (CO2).
Уравнение химической реакции:
CaC2 + 2h3O → C2h3 + Ca(OH)2 + CO2
Для проведения реакции необходимо поместить карбид кальция в специальное устройство – генератор ацетилена, и добавить воду. При нагревании карбида кальция с помощью факела, образуется ацетилен, который может быть использован для сварки, резки металла, освещения и других промышленных целей.
При работе с ацетиленом необходимо соблюдать меры безопасности, так как это взрывоопасный газ. Он должен храниться в специальных цилиндрах, которые подвергаются регулярным проверкам и испытаниям.
Популярные вопросы в категории химия
WishMaster
11.
Как из h3o получить o2?
frau-muller
11.04.2023
Как из c2h3 получить c2h5?
Pikowaya
11.04.2023
Какой индекс у натрия в фосфате натрия?
JUTKI
16.04.2023
Как из нитрата магния получить оксид магния?
katisha-stile
15.04.2023
Где используют соединения азота и фосфора?
Kondrat
12.04.2023
P mg что за формула?
IgLove
15.04.2023
Золото в таблице менделеева название как читается?
5573
11.04.2023
Nh5hco3 какая соль?
Muhomorov
12.04.2023
Как из красок получить желтый цвет?
k3n
15.04.2023
Как получить муравьиную кислоту?ozernin
12. 04.2023
04.2023
В какой реакции сера является окислителем?
GoLdEnBoY333
14.04.2023
Как отстирать жижу от вейпа с одежды?
M-I-L-A
12.04.2023
Медный купорос какого цвета?
RocaWear
12.04.2023
Как разделить этанол и воду?
highway77
12.04.2023
Nabr какая химическая связь?
zolotoy
16.04.2023
Nahso4 как получить?
Demon32
13.04.2023
Как из этана получить бутан?
Nikulya88
15.04.2023
Какие оксиды реагируют с серной кислотой?
Dansesgirl
16.04.2023
Как почистить чайник от накипи кока колой?
crystallll
16.04.2023
Почему соль растворяется в воде?
Новые вопросы в категории химия
ElenAndrevna
12. 04.2023
04.2023
Как получить caso4?
metaxa
12.04.2023
Как из углерода получить метан?
DitaBentley
14.04.2023
Какой газ образуется при сжигании?
Allo
13.04.2023
Как получить гидроксид кальция из оксида кальция?
curlytasja
14.04.2023
Сколько хим связей в молекуле пропана?
Lakec
14.04.2023
Зачем нужен никель?
scandinavja
11.04.2023
Какой объем занимает 0 2 моль азота?
KatyaChay
15.04.2023
Какой объем займут 2 моль кислорода о2?
Squall
13.04.2023
Что будет если в масло налить воды?
Simon79
15.04.2023
Как получить сульфат железа 3?
JustMary
11. 04.2023
04.2023
Какая масса сульфата бария образуется при взаимодействии?
Shatenka3112
15.04.2023
Как разбавить уксус 9 процентный?
All-EyezOn-Me
11.04.2023
Сколько энергетических уровней у калия?
DJ-Alex
14.04.2023
Почему у фтора валентность 1?
kalista
15.04.2023
Что не растворяется в воде?
Pavlas
15.04.2023
Сколько протонов в натрии?
Semicvetik
14.04.2023
1s2 2s2 2p2 какой элемент?
nightkitten
15.04.2023
Жидкий порошок для стирки куда заливать?
Grif
14.04.2023
1s22s22p4 что за элемент?
kaprizna9
15.04.2023
Сколько протонов содержит атом углерода?
Acetyl.
 Интерактивный портал по химии
Интерактивный портал по химии1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Реакция диоксида углерода с известковой водой
В этой статье мы подробно обсудим и ответим на все вопросы, связанные с реакцией оксида меди и серной кислоты. Но прежде чем перейти к вопросам и соответствующим ответам на них, сначала позвольте познакомить вас с серной кислотой и оксидом меди. Серная кислота — сильная кислота, образующаяся при окислении растворов диоксида серы. Формула серной кислоты. Эта кислота в больших количествах используется в промышленности и лабораториях в качестве реагента. Концентрированная форма серной кислоты является плотной, маслянистой и коррозионно-активной. Другой сложный оксид меди представляет собой соединение, которое образуется, когда два элемента, медь и кислород, реагируют друг с другом. Его формула CuO.
Реакция оксида меди с серной кислотой
Смешивание оксида меди и серной кислоты представляет собой эксперимент, включающий нерастворимый оксид металла , который реагирует с разбавленной кислотой с образованием растворимой соли .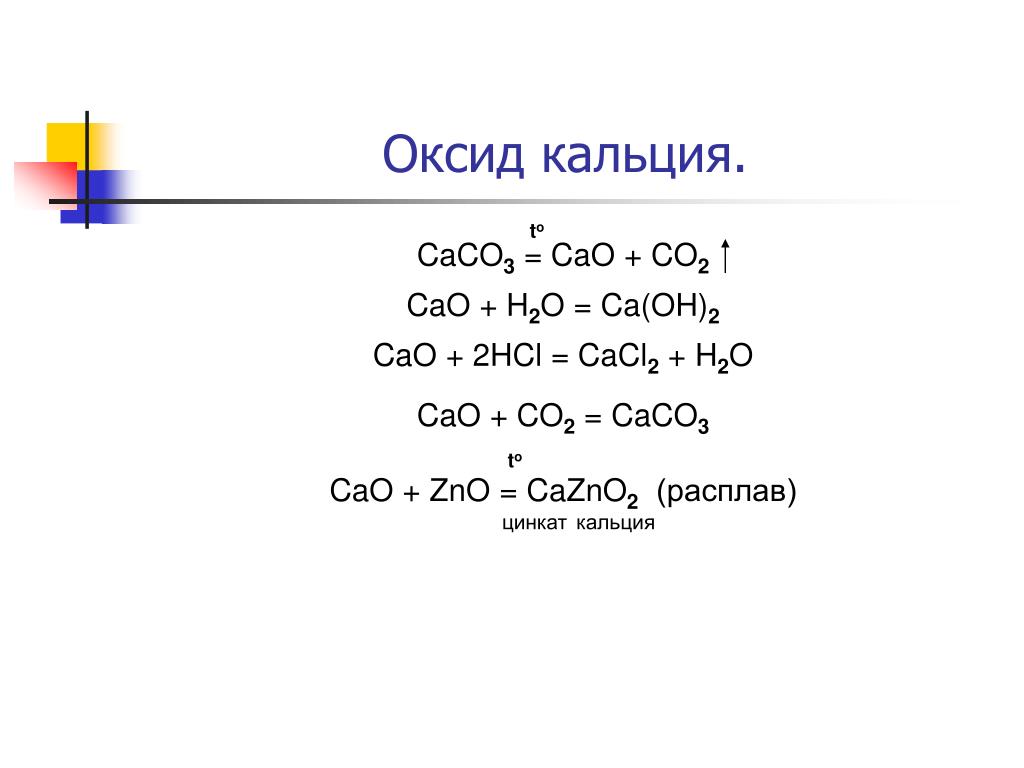 Оксид меди (II) представляет собой черное твердое вещество, которое при реакции с серной кислотой образует химическое вещество голубовато-голубого цвета, называемое сульфатом меди II. Оксид меди (II) реагирует с серной кислотой с образованием воды и сульфата меди (II). Эту реакцию можно классифицировать как реакцию двойного замещения или реакцию нейтрализации. Сульфат меди приобретает ярко-синий цвет
Оксид меди (II) представляет собой черное твердое вещество, которое при реакции с серной кислотой образует химическое вещество голубовато-голубого цвета, называемое сульфатом меди II. Оксид меди (II) реагирует с серной кислотой с образованием воды и сульфата меди (II). Эту реакцию можно классифицировать как реакцию двойного замещения или реакцию нейтрализации. Сульфат меди приобретает ярко-синий цвет
Написание уравнения оксида меди + серная кислота
Эту химическую реакцию можно записать следующим образом: ) Чтобы узнать, как сделать сульфат меди в домашних условиях, ознакомьтесь с этой статьей.
Что происходит, когда медь реагирует с концентрированной серной кислотой?
Восстановительный потенциал разбавленной серной кислоты выше, чем у водорода. Медь не способна вытеснять водород из неокисляющих кислот, например соляной или разбавленной серной кислоты. Другими словами, можно сказать, что медь не реагирует с разбавленной серной кислотой. Однако он реагирует с концентрированной серной кислотой, потому что серная кислота в концентрированной форме является окислителем. При нагревании меди с концентрированной серной кислотой происходит окислительно-восстановительная реакция, и кислота превращается в диоксид серы. Уравнение этой химической реакции приведено ниже:
Однако он реагирует с концентрированной серной кислотой, потому что серная кислота в концентрированной форме является окислителем. При нагревании меди с концентрированной серной кислотой происходит окислительно-восстановительная реакция, и кислота превращается в диоксид серы. Уравнение этой химической реакции приведено ниже:
Какое сбалансированное уравнение для оксида меди и серной кислоты?
Балансное уравнение оксида меди и серной кислоты приведено ниже:
Почему оксид меди и серная кислота окрашиваются в синий цвет?
Все мы знаем, что реакция оксида меди + серная кислота приводит к химическому веществу синего цвета. Но задумывались ли вы когда-нибудь, почему реакция оксида меди с серной кислотой приводит к химическому веществу синего цвета? Что ж, мы подробно ответим на этот вопрос здесь. Оксид меди представляет собой твердое вещество черного цвета. Когда он реагирует с серной кислотой, он производит химическое вещество голубовато-синего цвета, известное как сульфат меди. Синий цвет обусловлен образованием растворимой соли. Ионы меди и сульфата диссоциируют, когда сульфат меди растворяется в воде. Хотя эффект не меняется, однако характер расщепления между t2g и eg-орбиталями в этом новом комплексе таков, что он поглощает красновато-оранжевый свет. Из-за этого поглощения вы увидите раствор голубоватого цвета.
Синий цвет обусловлен образованием растворимой соли. Ионы меди и сульфата диссоциируют, когда сульфат меди растворяется в воде. Хотя эффект не меняется, однако характер расщепления между t2g и eg-орбиталями в этом новом комплексе таков, что он поглощает красновато-оранжевый свет. Из-за этого поглощения вы увидите раствор голубоватого цвета.
Растворяет ли серная кислота медь?
Нет, серная кислота не может растворить медь. Однако, если наблюдается растворение, это может быть вызвано одной из следующих двух причин:
- Существует вероятность того, что поверхность порошка металлической меди частично окислена до . Серная кислота может растворить окисленную поверхность меди
- Образование вихря при перемешивании. Небольшое количество воздуха (кислорода), введенное в выщелачивающий раствор, действовало как окислитель.
Какая соль образуется при взаимодействии оксида меди с соляной кислотой?
Реакция меди и соляной кислоты невозможна. Однако оксид меди может реагировать с этой кислотой. Когда металл реагирует с кислотой, происходит окислительно-восстановительная реакция. Из-за более высокого восстановительного потенциала меди по сравнению с водородом она не может реагировать с неокисляющими кислотами, такими как серная кислота и соляная кислота.
Однако оксид меди может реагировать с этой кислотой. Когда металл реагирует с кислотой, происходит окислительно-восстановительная реакция. Из-за более высокого восстановительного потенциала меди по сравнению с водородом она не может реагировать с неокисляющими кислотами, такими как серная кислота и соляная кислота.
Но оксид меди — это не металл, а оксид металла. Оксиды металлов являются основными веществами, которые могут реагировать с кислотами с образованием соли и воды. Эти кислотно-щелочные реакции также известны как нейтрализация и не являются окислительно-восстановительными по своей природе.
Будучи слабым основанием, оксид меди легко реагирует с HCl с образованием растворимого хлорида меди и воды. Уравнение этой химической реакции приведено ниже:
Каково уравнение Ca OH 2 CO2? – Gzipwtf.com
Каково уравнение Ca OH 2 CO2?
Это кислотно-щелочная реакция (нейтрализация): Ca(OH) 2 является основанием, CO 2 является кислотой. ; Белый порошок без запаха. [Примечание: легко поглощает CO2 из воздуха с образованием карбоната кальция.]…
; Белый порошок без запаха. [Примечание: легко поглощает CO2 из воздуха с образованием карбоната кальция.]…
| 1 | CO2 + Ca(OH)2 → h3O + CaCO3 |
|---|---|
| 2 | CO2 + Ca(OH)2 → Ca(HCO3)2 |
| 3 | CO2 + Ca(OH)2 → Ca(OH)(HCO3) |
| 4 | CO2 + Ca(OH)2 → CaCO3CO2h3O |
Что является продуктом Ca OH 2 CO2?
Двуокись углерода реагирует с гидроксидом кальция с образованием карбоната кальция и воды. Ca(OH)2 + CO2 → CaCO3 + h3O Эта реакция известна как .
Реагирует ли Ca OH 2 с CO2?
Двуокись углерода вступает в реакцию с известковой водой (раствор гидроксида кальция, Ca(OH) 2) с образованием белого осадка (выглядящего как молочный) карбоната кальция, CaCO 3. Добавление большего количества двуокиси углерода приводит к растворению осадка с образованием бесцветный раствор гидрокарбоната кальция.
Как еще называется Ca Oh 2?
гашеная известь
соединения кальция Гидроксид кальция, также называемый гашеной известью, Ca(OH)2, получают действием воды на оксид кальция. При смешивании с водой небольшая часть его растворяется, образуя раствор, известный как известковая вода, а остальная часть остается в виде суспензии, называемой известковым молоком.
При смешивании с водой небольшая часть его растворяется, образуя раствор, известный как известковая вода, а остальная часть остается в виде суспензии, называемой известковым молоком.
Что такое CA CO2?
н. (Элементы и соединения) белая кристаллическая соль, встречающаяся в известняке, меле, мраморе, кальците, коралле и жемчуге: используется в производстве извести и цемента. Формула: CaCO3.
Как сбалансировать CA HCO3 2?
Ca(HCO3)2 → CaCO3 + CO2 + h3O – Сбалансированное уравнение | Химические уравнения онлайн!
Является ли caoh3 CO2 экзотермическим?
Реакция носит экзотермический характер.
Как называется CO?
Монооксид углерода
Монооксид углерода/IUPAC ID
Как называется соединение с формулой CA CN 2?
Цианамид кальция
Цианамид кальция представляет собой неорганическое соединение с формулой CaCN2. Это кальциевая соль аниона цианамида (CN2-2). Это химическое вещество используется в качестве удобрения и известно как нитролим. Впервые он был синтезирован в 1898 году Адольфом Франком и Никодемом Каро (процесс Франка-Каро).
Это химическое вещество используется в качестве удобрения и известно как нитролим. Впервые он был синтезирован в 1898 году Адольфом Франком и Никодемом Каро (процесс Франка-Каро).
CaOh 2 водный или твердый?
Гидроксид кальция, обычно называемый гашеной известью, имеет химическую формулу Ca(OH)2. Это неорганическое соединение, имеющее белый порошкообразный вид в твердом состоянии.
Как называется соединение с формулой Ca OH?
Гидроксид кальция. Гидроксид кальция (традиционно называемый гашеной известью) представляет собой неорганическое соединение с химической формулой Ca (OH) 2 . Это бесцветный кристалл или белый порошок, который получают при смешивании или гашении оксида кальция (называемого известью или негашеной известью) с водой. У него много названий, в том числе гашеная известь, каустическая известь,…
Каково химическое название гидроксида кальция?
Гидроксид кальция, обычно называемый гашеной известью, имеет химическую формулу Ca(OH) 2 .
