Карбонат магния, Mg Карбонат MgCO3 Производители и поставщики порошков — Цена
Карбонат магния, Mg Карбонат MgCO3 Порошок
Наименование продукта: Карбонат магния, карбонат магния MgCO3
Количество CAS:
5145-48-2 (дигидрат магния карбоната MgCO3)
14457-83-1 (магний карбонат MgCO3 тригидрат)
61042-72-6 (Карбонат магния MgCO3 пентагидрат)
Характеристики: Белый порошок.
Чистота (анализ): 99% Мин.
Молекулярная формула: MgCO3
Пакет:
25 кг / бумажно-пластиковый мешочек, или Jumbo Bag, 1Mt.
КЛЮЧЕВЫЕ слова:
Карбонат магния, карбонат магния MgCO3
Описание:
Карбонат магния, Mg Карбонат MgCO3 (архаическое имя magnesia alba), является неорганической солью, которая является белым твердым веществом. В качестве минералов также существуют несколько гидратированных и основных форм карбоната магния.
Карбонат магния, Mg Карбонат MgCO3 представляет собой белый моноклинный кристаллический или аморфный порошок, нетоксичный, без запаха, нерастворим в воде. Относительная плотность равна 2,16, слабо растворяется в воде. Водный раствор является щелочи. Растворимость в воде составляет 0,02% (15 градусов). Растворимый в растворе соли кислоты и аммония, выделяя углекислый газ при взаимодействии с разбавленной кислотой, выделяет воду, диоксид углерода и оксид магния при нагревании более 300 градусов.
Приложения:
Карбонат магния, Mg Карбонат MgCO3 является отличным наполнителем из резиновых изделий и активного наполнителя. Он может использоваться как теплоизоляция, огнестойкий теплоизоляционный материал. Асбест легкий магний карбонат является отличным изоляционным материалом. Карбонат магния, карбонат магния MgCO3 также широко применяется в отделе судостроения и производства котлов и т. Д. Его также можно использовать для производства высококачественных изделий из стекла, магниевой соли, пигментов, красок и ежедневных химических веществ и т. Д. В медицине карбонат магния , Mg Карбонат MgCO3 можно использовать в качестве осушителя, средства для защиты цвета, носителя, средства против слеживания
Д. В медицине карбонат магния , Mg Карбонат MgCO3 можно использовать в качестве осушителя, средства для защиты цвета, носителя, средства против слеживания
Другая основная информация:
Имя: | Карбонат магния (MgCO3) |
Номер CAS: | 12125-28-9 |
Внешность: | белый порошок |
Удельный вес: | 2,16 г / см 3 |
Использование и применение:
Обычно считается безопасным FDA, карбонат магния, карбонат магния MgCO3 разрешается использовать как в пищевых продуктах, так и в медикаментах. Это форма магния, которую вам нужно в небольших количествах для хорошего здоровья. Взрослые должны потреблять от 310 до 420 миллиграммов в день этого основного минерала в зависимости от их возраста и пола, так как это важно для формирования белков, регулирующих кровяное давление, уровень сахара в крови и нервно-мышечную функцию.
1. Карбонат магния, Mg Карбонат MgCO3 можно использовать добавку:
Хотя хлорид магния, оксид и цитрат могут быть более заметными формами магниевых добавок на полках магазинов, вы также можете приобрести Карбонат магния, Mg Carbonate MgCO3, содержащий добавки, чтобы увеличить уровень магния. Это соединение используется для увеличения содержания магния в определенных продуктах питания.
2. Карбонат магния, карбонат магния MgCO3 можно использовать в качестве пищевой добавки:
Он используется в качестве пищевых добавок. Это поможет сохранить порошкообразные или гранулированные продукты, образуя комки, регулировать кислотность в продуктах и помогать пищевым продуктам поддерживать их цвета. Продукты, которые могут содержать карбонат магния, карбонат магния MgCO3, включают соль, порошкообразные сахара, сухое молоко, молочные продукты, обработанные фрукты и овощи, мясо и морепродукты, супы, соусы, приправы, хлебобулочные изделия, конфеты, готовые продукты, алкогольные напитки, спорт и энергетические напитки и крупы.
Другие первичные способы использования карбоната магния, карбоната магния MgCO3 включают в себя производство оксида магния путем прокаливания. Магнезитовые и доломитовые минералы используются для производства огнеупорных кирпичей. Карбонат магния, Mg Карбонат MgCO3 также используется в полах, огнестойкости, огнегасящих композициях, косметике, порошке для пыли и зубной пасте. Другие применения — в качестве наполнителя, дымоподавителя в пластмассах, усиливающего агента в неопреновом каучуке, средства для сушки, слабительного для ослабления кишечника и сохранения цвета в пищевых продуктах. Кроме того, карбонат магния высокой чистоты используется в качестве антацида и в качестве добавки в поваренной соли для поддержания ее свободного протекания. Карбонат магния может это сделать, потому что он не растворяется в воде, а только в кислоте, где он будет испаряться (пузырь).
Из-за своей низкой растворимости в воде и гигроскопических свойств карбонат магния, карбонат магния MgCO3 был впервые добавлен к соли в 1911 году, чтобы сделать его более свободно. Компания Morton Salt приняла лозунг «Когда идет дождь», ссылаясь на то, что ее карбонат магния, карбонат магния MgCO3 не будет слипаться во влажной погоде. Карбонат магния, который чаще всего называют «мелом», также используется в качестве сушильного агента на ладонях спортсменов в скалолазании, гимнастике и тяжелой атлетике.
Компания Morton Salt приняла лозунг «Когда идет дождь», ссылаясь на то, что ее карбонат магния, карбонат магния MgCO3 не будет слипаться во влажной погоде. Карбонат магния, который чаще всего называют «мелом», также используется в качестве сушильного агента на ладонях спортсменов в скалолазании, гимнастике и тяжелой атлетике.
В качестве пищевой добавки карбонат магния, карбонат магния MgCO3 известен как E504, для которого единственным известным побочным эффектом является то, что он может работать как слабительное в высоких концентрациях.
Он также используется в таксидермии для отбеливания черепов. Карбонат магния, Mg Карбонат MgCO3 можно смешать с перекисью водорода, чтобы создать пасту, которая затем распространяется на черепе, чтобы дать ей белую отделку. Его также можно использовать в качестве матового белого покрытия для проекционных экранов. [15] a
-Supplements
Карбонат магния, Mg Карбонат MgCO3 используется в качестве пероральной добавки для людей с низким содержанием магния в крови, что происходит чаще всего, когда кто-то использует диуретики или, например, потерял жидкости из-за диареи или рвоты.
-Antacids
Высокочистый карбонат магния, Mg Carbonate MgCO3 является распространенным антацидом, но в больших дозах также действует как слабительное. Антациды часто содержат гидроксид алюминия для равновесия, поскольку он имеет запорный эффект.
-Чел-Мел
Большинство ручных мелов, которые спортсмены, такие как гимнасты, скалолазы и тяжелоатлеты, используют, чтобы высушить руки, — это карбонат магния, карбонат магния MgCO3. Этот мел легко поглощает воду и не то же самое, что мел мелко, это карбонат кальция.
-Insulation
Его изоляционные свойства, а также тот факт, что он является нетоксичным, довольно легким и негорючим веществом, делают карбонат магния, карбонат магния MgCO3 идеальным для прочной изоляции. Сюда входят судостроение, котельное производство, а также тяжелая техника, например, печи и посудомоечные машины.
-Desiccant
Из-за своих водопоглощающих свойств некоторые производители добавляют пищевой карбонат магния, карбонат магния MgCO3 в соль и муку в качестве анти-сгущающего агента.
Fengchen Group является ведущим поставщиком Карбонат магния, Mg Carbonate MgCO3 Powder из Китая. Мы специализируемся на оптовых и массовых количествах, гарантируя, что у всех наших клиентов есть правильный поставщик порошка магния, карбонат магния MgCO3, когда он в этом нуждается. Когда вы собираетесь купить или купить Карбонат магния, Mg Carbonate MgCO3 Powder, пожалуйста, обратитесь к Fengchen Group.
Сертификат анализа (TDS):
Пункт | Индекс | |
Премиум класс | Класс первого класса | |
Содержание MgO% ≥ | 45,0 | 41,0 |
Содержание CaO /% ≤ | 0,43 | 0. |
Содержание нерастворимой в соляной кислоте% ≤ | 2,0 | 3.0 |
Содержание SO4% ≤ | 0,10 | 0,15 |
Потери при воспламенении% | 54-58 | 54-58 |
Содержание Fe% ≤ | 0.02 | 0,05 |
Содержание Cl% ≤ | 0,10 | 0,15 |
Содержание Mn% ≤ | 0,004 | 0,004 |
Остаток на сите (150 мкм / 75 мкм)% ≤ | 0,025 / 1,0 | 0,03 / |
Явная плотность / (г / мл) ≤ | 0,120 | 0,140 |
Содержание воды% ≤ | 2,0 | 3. |
Внешность | Белый светлый порошок | |
Побочные эффекты и взаимодействия:
Карбонат магния, Mg Карбонат MgCO3 вряд ли вызовет побочные эффекты в небольших количествах, используемых в пищевых продуктах, но это может вызвать побочные эффекты у некоторых людей при использовании в качестве дополнения или лекарства. К ним относятся тошнота, диарея и метеоризм.
Магниевые добавки могут взаимодействовать с некоторыми лекарствами, включая ингибиторы протонного насоса, диуретики, лекарства от остеопороза и антибиотики
Верхнее качество, чистый карбонат магния, Mg Carbonate MgCO3 Порошок / вещество завод в Китае; Китай Карбонат магния, Mg Carbonate MgCO3 Поставщики сырья в Китае. Китай Карбонат магния, Mg Карбонат MgCO3 Производители порошка в Китае.
Сопутствующие товары:
Если вы ищете карбонат магния, мг карбонатного порошка mgco3, добро пожаловать, свяжитесь с нами. Мы являемся одним из ведущих и профессиональных китайских производителей и поставщиков в этой области. Конкурентоспособная цена и хорошее послепродажное обслуживание доступны.
Мы являемся одним из ведущих и профессиональных китайских производителей и поставщиков в этой области. Конкурентоспособная цена и хорошее послепродажное обслуживание доступны.
горячая этикетка : карбонат магния, мг карбонат mgco3 порошок, производители, поставщики, цена
Структура и характеристики MgCO3 Льюиса: 17 полных фактов
MgCO3 представляет собой белую или бесцветную неорганическую соль с молекулярной массой 84.3139 г/моль и плотностью 2.96 г/см3. Давайте рассмотрим больше, связанное с его структурой и свойствами Льюиса.
MgCO3 представляет собой твердое кристаллическое ионное соединение треугольной формы, содержащее два противоположно заряженных иона ( Mg2+ и СО32-). Но он также включает ковалентную связь (в CO32-). Он растворяется в воде, кислоте и водном диоксиде углерода, и его водный раствор скорее слабощелочной, чем кислый.
Давайте обсудим структурные свойства MgCO. 3.
3.
Структура Льюиса представляет собой структурное представление любой молекулы, показывающее несвязывающие электроны вокруг соответствующих атомов. Давайте поговорим об этом.
Определение валентных электронов:Компания структура льюиса MgCO3 содержит три типа атомов: магний (Mg), углерод (C) и кислород (O), которые имеют два, четыре и шесть электронов в соответствующих валентных оболочках.
Находим связующие электроны:CO32- в MgCO3 имеет всего четыре ковалентные связи (две одинарные и одну двойную) и есть одна ионная связь между Mg и CO3. Следовательно, всего (5 × 2) = 10 электронов задействовано в качестве связывающих электронов.
Определение несвязывающих электронов:Только СО32- в MgCO3 несут неподеленные пары (неподвижные пары кислорода). Всего 10 электронов остаются несвязывающими электронами.
Всего 10 электронов остаются несвязывающими электронами.
Резонанс структуры Льюиса — это комбинация нескольких структур молекулы, показывающая связи между атомами в этой молекуле. Давайте обсудим это подробнее.
МгСО3 структура резонанса Льюиса показывает три различных резонансных структуры карбонат-иона (CO32-), включающих одинаковое количество ковалентных связей и заряд. Резонансную структуру можно наблюдать только в ковалентных соединениях или ковалентной части. Все три резонансные структуры в CO32- эквивалентны.
Рисование резонансной структуры очень важно в химии, потому что эти структуры помогают определить наиболее стабильную структуру, а также форму молекулы. Он также вносит свой вклад в вычисление формальных зарядов каждого атома.
MgCO3 Резонансная структураMgCO3 Форма структуры ЛьюисаФорму любой молекулы можно определить по гибридизации центрального атома и отталкиванию между неподеленными парами и парами связей. Прокомментируем форму MgCO3.
Прокомментируем форму MgCO3.
MgCO3 Форма структуры Льюиса содержит кристаллографическую структуру треугольной формы. Он содержит магний2+ и СО32- ионы. Карбонат-ион имеет треугольную плоскую форму. Углерод sp2 гибридизуется в CO32-. В этой гибридизации с карбонат-ионом участвуют одна s- и две p-орбитали углерода.
Атом углерода связан с тремя атомами кислорода (два атома кислорода заряжены отрицательно, а один нейтрален) двумя одинарными и одной двойной связью. Но все связи химически эквивалентны, имея одинаковую длину связи.
Таким образом, все резонансные структуры вносят одинаковый вклад в гибридную структуру. Таким образом, геометрия, а также форма этой молекулы являются тригонально-плоскими.
MgCO3 Формальное обвинение структуры ЛьюисаФормальный заряд рассчитывается только в ковалентно связанной молекуле, чтобы определить наиболее стабильный структура льюиса. Рассчитаем формальный заряд по следующему правилу.
Рассчитаем формальный заряд по следующему правилу.
- MgCO3 формальный расчет заряда = общее количество валентных электронов — количество электронов, оставшихся несвязанными — (количество электронов, участвующих в образовании связи / 2)
- Формальный заряд углерода = 4 – 0 – (8/2) = 0
- Формальный заряд каждого из атомов кислорода, присоединенных одинарной связью с углеродом = 6 – 6 – (2/2) = -1
- Формальный заряд атома кислорода, связанного двойной связью с углеродом = 6 – 4 – (4/2) = 0
Ион карбоната в MgCO3 несет два отрицательных заряда, но этот заряд нейтрализуется зарядом +2 Mg2+. Следовательно, это соединение является нейтральным и в целом не несет заряда.
MgCO3 Структурный угол ЛьюисаСтруктурный угол Льюиса обозначает угол между центральным атомом и двумя замещающими атомами или группами. Давайте узнаем об угле в деталях.
Давайте узнаем об угле в деталях.
MgCO3 Угол структуры Льюиса показывает валентный угол 1200, Это содержит ион карбоната, который является sp2 гибридизированных. Это идеальный валентный угол для любой молекулы, имеющей тригонально-плоскую геометрию. Валентный угол в основном зависит от гибридизации, а также от формы молекулы.
Но этот валентный угол может быть отклонен, если в молекуле присутствует какое-либо отталкивание, такое как отталкивание неподеленная пара-одинокая пара, пара связей-одинокая пара и пара связей-связей. Эта молекула свободна от этих факторов отталкивания, потому что центральный атом углерода не имеет несвязывающих электронов.
MgCO3 Правило октета структуры ЛьюисаПравило октета описывает наличие того же количества валентных электронов во внешней оболочке любого атома, что и его ближайший благородный газ. Давайте поймем, если MgCO3 подчиняется правилу октетов или нет.
Компания структура льюиса MgCO3 решает, подчиняется ли он правилу октетов или нет. Mg (блок s) имеет 12 электронов, и в этом соединении он достигает ближайшей конфигурации электронной оболочки валентной оболочки благородного газа. Остальная часть ковалентной части CO32- также удовлетворяет этому правилу, поскольку все они являются основным блочным (s- и p-блоковым) элементом.
В ЦО32-, углерод имеет 4 валентных электрона, и когда он участвует в связывании с 4 атомами кислорода, он получает еще четыре электрона от кислорода, и правило октета выполняется. Отрицательно заряженный кислород связан через ковалентную связь с углеродом, и связывающие электроны взаимно разделены между ними.
Нейтральный атом кислорода связан через одну сигму и одну пи с атомом углерода, и четыре электрона двойной связи (один сигма и один пи) взаимно разделены между ними, и он также получает электронную конфигурацию, подобную ближайшему благородному газу (Ne). .
.
Неподеленные пары указывают на те электроны, которые не участвуют в образовании связи. Поэтому их называют несвязывающими электронами. Прокомментируем неподеленные пары MgCO.3.
МгСО3 структура льюиса одинокие пары можно определить с помощью простого расчета, подобного следующему:
- Формула расчета несвязанный электрон = общее количество валентных электронов — количество связанных электронов.
- Несвязывающие электроны углерода = 4 – 4 = 0
- Несвязывающие электроны отрицательно заряженного атома кислорода = 6 – 0 = 6
- Несвязывающие электроны нейтрального атома кислорода = 6 – 2 = 4
- Следовательно, общее количество несвязывающих электронов в MgCO3 = (2×6) + 4 = 16 или 8 одиночных пар.
Валентные электроны указывают на электроны самой внешней оболочки любого атома, и они наиболее реактивны по отношению к электронам внутренней оболочки. Давайте подробно обсудим это.
Давайте подробно обсудим это.
Валентные электроны MgCO3 можно определить по электронной конфигурации каждого из составляющих атомов. Mg является щелочноземельный металл и имеет 2 электрона на валентной оболочке. Углерод и кислород, будучи блочным элементом, имеют четыре и шесть валентных электронов соответственно.
Mg представляет собой блочный щелочноземельный металл с электронной конфигурацией [Ne] 3s2. Углерод и кислород являются p-блочными элементами с электронной конфигурацией [He] 2s.2 2p2 и [Он] 2s2 2p4. Из конфигурации это ясно, что Mg, углерод и кислород имеют 2, 4 и 6 электронов соответственно.
MgCO3 ГибридизацияГибридизация — это смешение двух или более атомных орбиталей с образованием новой гибридной орбитали. Давайте узнаем больше о гибридизации MgCO.3.
При гибридизации MgCO3, мы видим, что центральным атомом углерода карбонат-иона является sp2 гибридизированный. В этой гибридизации с тремя атомами кислорода участвуют четыре электрона одной s- и три p-орбитали углерода. Эта гибридизация придает молекуле треугольную плоскую форму.
В этой гибридизации с тремя атомами кислорода участвуют четыре электрона одной s- и три p-орбитали углерода. Эта гибридизация придает молекуле треугольную плоскую форму.
В центральном атоме нет неподеленной пары, таким образом, геометрия позорна, как его форма, тригональная плоскость и валентный угол, 1200 в карбонат-ион.
MgCO3 ковалентная или ионная?к знать, является ли MgCO3 ковалентным или ионный, принципиальная разница между ними должна быть устранена. Давайте поговорим об этом подробно.
MgCO3 такое соединение, которое включает в себя как ковалентную, так и ионную связь в своей структуре. мг2+ связан с карбонат-ионом посредством ионного взаимодействия. А вот углерод связан с тремя атомами кислорода ковалентными связями.
Почему MgCO3 является ковалентным, а также ионным соединением?Наличие ковалентного, а также ионного взаимодействия делает его ковалентным, а также ионным соединением.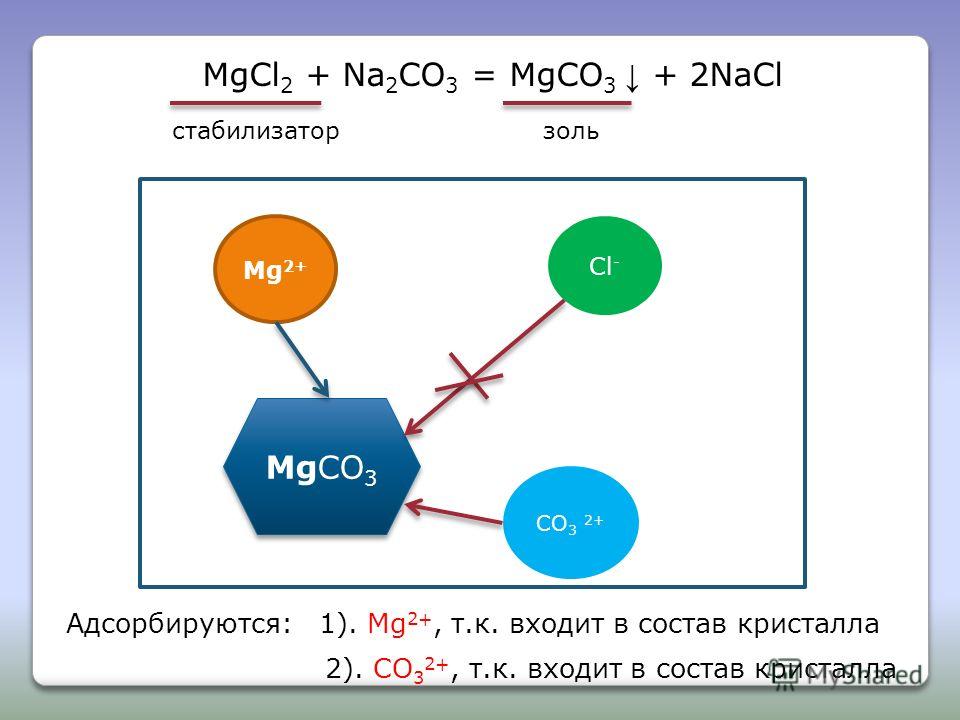 Давайте рассмотрим его вкратце.
Давайте рассмотрим его вкратце.
MgCO3 является ковалентным, а также ионным, потому что он содержит два противоположно заряженных атома и между ними присутствует ионное взаимодействие (коломбическое). С другой стороны, атом углерода в CO32- связан с тремя атомами кислорода четырьмя ковалентными связями (три сигма и одна пи).
Как MgCO3 является ковалентным, а также ионным соединением?Ковалентность возникает из-за взаимного обмена, но ионное взаимодействие возникает из-за постоянного переноса электронов. Давайте обсудим это.
Связывающие электроны в CO32- взаимно распределяются между атомами, образующими связь, углеродом и кислородом. Таким образом, все эти четыре связи в CO32- рассматриваются как ковалентные связи. Но взаимодействие между Mg2+ и СО32- определяется как ионное взаимодействие из-за двух противоположно заряженных ионов.
По температуре кипения можно определить, является ли какая-либо молекула твердой, жидкой или газообразной. Давайте поговорим об этом.
MgCO3 представляет собой белое твердое вещество в условиях окружающей среды. Это кристаллографическая решетчатая структура треугольной формы.
Почему и как MgCO3 является твердым соединением?MgCO3 имеет температуру плавления 9900 C, что указывает на его твердую фазу. Давайте обсудим, почему и как это твердо.
MgCO3 является твердым, потому что существует сильное ионное взаимодействие между Mg2+ и СО32-. Элементарные ячейки его плотно скреплены друг с другом. Поэтому для превращения его в жидкость требуется огромное количество тепловой энергии. Таким образом, он выглядит как твердое вещество при комнатной температуре.
Твердый MgCO3.
Изображение Фото: Wikimedia Commons.MgCO3 растворим в воде?
Растворимость любого соединения зависит от природы вещества, а также от энергии решетки. Давайте узнаем это подробно.
MgCO3 мало растворим в воде, водный раствор имеет слабощелочную природу. Причиной низкой растворимости является высокая энергия решетки карбонат магния.
Почему MgCO3 растворяется в воде?Если природа растворенного вещества и растворителя аналогична, то растворенное вещество будет растворяться в этом конкретном растворителе. Давайте исследуем это.
MgCO3 растворим в воде, потому что MgCO3 представляет собой ионное и полярное соединение, а вода также является полярным растворителем. Следовательно, MgCO3 растворим в воде из-за сходного типа взаимодействия.
Как MgCO3 растворяется в воде?Из-за полярной природы MgCO3 можно растворить в воде. Давайте поговорим об этом.
Давайте поговорим об этом.
MgCO3 растворим в воде, потому что составляющие атомы, Mg2+ и СО32- гидратируются молекулами воды. Водородный конец находится в окружении отрицательно заряженного заместителя, карбонат-иона, а кислородный конец будет гидратировать Mg.2+ конец MgCO3. Для этого взаимодействия MgCO3 растворяется в воде.
MgCO3 полярный или неполярный?Молекула полярна или неполярна, можно определить по ее заместителям. Давайте исследовать об этом.
MgCO3 является ионным, а также полярным соединением. Из-за присутствия двух противоположно заряженных ионов MgCO3 полярен и растворим в полярном растворителе.
Почему и как MgCO3 является полярным соединением?Ионное взаимодействие в MgCO3 делает его полярным соединением. Давайте обсудим это.
MgCO3 является ионогенным веществом. Между магнием и ионом карбоната действует ионное взаимодействие, которое делает его полярным твердым веществом. MgCO3 может быть растворим в воде (полярный растворитель) из-за гидратации атомов молекулами воды.
Между магнием и ионом карбоната действует ионное взаимодействие, которое делает его полярным твердым веществом. MgCO3 может быть растворим в воде (полярный растворитель) из-за гидратации атомов молекулами воды.
Карбонат магния, содержащий Mg2+ и СО32- ионы представляют собой полярное и твердое соединение. Он используется в процессе прокаливания для образования оксида кальция. Он также находит широкое применение в пожаротушении, настиле полов и производстве зубной пасты, косметики и т. д.
MgCO3 (Mg[CO3]) Кристаллическая структура — SpringerMaterials
Получить доступ СИФ Скачать справку (pdf)
У вас нет доступа к этому содержимому
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Просмотр трехмерной интерактивной структуры
Цитировать эту страницу
- Цитата
Кристаллографические данные
Параметры ячейки
Стандартизированные данные | ||||
|---|---|---|---|---|
| Космическая группа | У вас нет доступа к этому контентуОпции доступаДополнительные опции доступа
| |||
| и | ||||
| б | ||||
| с | ||||
| α | ||||
| β | ||||
| γ | ||||
| а/б | ||||
| б/к | ||||
| к/с | ||||
| В | ||||
Координаты атома
Стандартизированный
У вас нет доступа к этому контентуОпции доступаДополнительные опции доступа
| |||||||||
Детали эксперимента
У вас нет доступа к этому контенту
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Ссылка
У вас нет доступа к этому контенту
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
3D интерактивная структура
У вас нет доступа к этому контенту
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Об этом контенте
PAULING FILE Multinaries Edition – 2012 г.
sd_1023983
© Springer и система данных о фазах материалов (MPDS), Швейцария и Национальный институт материаловедения (NIMS), Япония, 2016 г.
Пьер Виллар, Система данных о фазах материалов (MPDS), CH-6354 Вицнау, Швейцария
вилларс[email protected]
Цитировать этот контент
Пьер Виллар (главный редактор), PAULING FILE in: Inorganic Solid Phases,
SpringerMaterials (онлайн-база данных), Springer, Гейдельберг (ред. )
SpringerМатериалы
Кристаллическая структура MgCO3 (Mg[CO3])
sd_1023983 (Springer-Verlag GmbH, Гейдельберг, © 2016)
)
SpringerМатериалы
Кристаллическая структура MgCO3 (Mg[CO3])
sd_1023983 (Springer-Verlag GmbH, Гейдельберг, © 2016)
Скачать эту цитату
Цитата скопирована
sd_1023983
Модификация поверхности кристаллов гидроксиапатита двойными гидроксидами Mg-Al-CO3 в нанокомпозите HA/Mg-Al-CO3-LDH
Модификация поверхности кристаллов гидроксиапатита Mg-Al-CO
3 -слоистые двойные гидроксиды в HA/Mg-Al-CO 3 – нанокомпозит LDH†Зольфагар Резвани* и и Масуме Акбари и
Принадлежности автора
* Соответствующие авторы
и Кафедра химии, Факультет фундаментальных наук, Азербайджанский университет Шахида Мадани, Тебриз, Иран
Электронная почта: zrezvani@azaruniv.
Аннотация
В этой статье описан новый подход к модификации поверхности гидроксиапатита (ГА) двойными гидроксидами со слоями Mg-Al (LDH). Композит на основе ГА, армированный нанокристаллами СДГ, был синтезирован путем выращивания in situ СДГ на ГА. Исследовано влияние условий эксперимента на формирование нанокомпозита ГА/Mg–Al–CO 3 –СДГ, включая рН водного раствора и температуру реакции. Нанокомпозит был охарактеризован XRD, FTIR, TGA, SEM и EDX. Для определения твердости и плотности нанокомпозита, а также исследования его микроструктуры и морфологии образцы спекали при 500, 600, 800, 900, 1000, 1100 и 1200 °С. Твердость увеличилась с 50 HV для чистого ГА до 180 HV для нанокомпозита, спеченного при 800 °C. Изменения морфологии и структуры при повышении температуры спекания свидетельствуют об образовании оксида металла (MgO) и шпинели MgAl 2 O 4 , что подтверждено рентгеноструктурным анализом.

 7
7 0
0