Гидроксид хрома (III) | CHEMEGE.RU
Гидроксид хрома (III)Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета.
Способы получения
1. Гидроксид хрома (III) можно получить действием раствора аммиака на соли хрома (III).
Например, хлорид хрома (III) реагирует с водным раствором аммиака с образованием гидроксида хрома (III) и хлорида аммония:
CrCl3 + 3NH3 + 3H2O → Cr(OH)3 + 3NH4Cl
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор гексагидроксохромата калия:
K3[Cr(OH)6] + 3CO2 → Cr(OH)3↓ + 3KHCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III).
Например, хлорид хрома (III) реагирует с недостатком гидроксида калия с образованием гидроксида хрома (III) и хлорида калия:
CrCl3 + 3KOH(недост) → Cr(OH)3↓ + 3KCl
4. Также гидроксид хрома (III) образуется при взаимодействии растворимых солей хрома (III) с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты хрома (III) необратимо гидролизуются в водном растворе.
Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия:
2CrBr3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + CO2↑ + 6NaBr
Хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства
1. Гидроксид хрома (III) реагирует с растворимыми кислотами. При этом образуются средние соли.
Например, гидроксид хрома (III) взаимодействует с соляной кислотой с образованием нитрата хрома (III):
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O
Cr(OH)3 + 3HBr → CrBr3 + 3H2O
2. Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот.
Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид хрома (III) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (III):
2Cr(OH)3 + 3SO3 → Cr2(SO4)3 + 3H2O
3. Гидроксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в растворе образуются комплексные соли. При этом гидроксид хрома (III) проявляет кислотные свойства.
Например, гидроксид хрома (III) взаимодействует с избытком гидроксидом натрия с образованием гексагидроксохромата:
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6]
4. Гидроксид хрома (III) разлагается при нагревании:
2Cr(OH)3 → Cr2O3 + 3H2O
5. Под действием окислителей в щелочной среде переходит в хромат.
Под действием окислителей в щелочной среде переходит в хромат.
Например, при взаимодействии с бромом в щелочной среде гидроксид хрома (III) окисляется до хромата:
2Cr(OH)3 + 3Br2 + 10KOH → 2K2CrO4 + 6KBr + 8H2O
Понравилось это:
Нравится Загрузка…
Гидроксид хрома(III) | это… Что такое Гидроксид хрома(III)?
Гидроксид хрома (III) — сложное неорганическое вещество с химической формулой Cr(OH)3.
Гидроксид хрома (III) — амфотерный гидроксид. Серо-зеленого цвета, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид CrO(OH). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака. Применяется для синтеза соединений хрома(III).
Молярная электропроводность при бесконечном разведении при 25 °C равна 795,9 см2/моль. Получают в виде студнеобразного зеленого осадка при обработке солей хрома (III) щелочами, при гидролизе солей хрома (III) с карбонатами щелочных металлов или сульфидом аммония.
Получают в виде студнеобразного зеленого осадка при обработке солей хрома (III) щелочами, при гидролизе солей хрома (III) с карбонатами щелочных металлов или сульфидом аммония.
Растворимость кислот, оснований и солей в воде
| H+ | K+ | Na+ | NH4+ | Ba2+ | Ca2+ | Mg2+ | Sr2+ | Al3+ | Cr3+ | Fe2+ | Fe3+ | Ni2+ | Co2+ | Mn2+ | Zn2+ | Ag+ | Hg2+ | Hg22+ | Pb2+ | Sn2+ | Cu+ | Cu2+ | ||
| OH− | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F− | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I− | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO32− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO42− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2− | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO43− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO32− | М | Р | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — | |
| CH3COO− | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN− | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO32− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Соединения хрома
Бихромат аммония ((NH4)2Cr2O7) • Борид хрома (CrB) • Бромид хрома(II) (CrBr2) • Бромид хрома(III) (CrBr3) • Гексагидроксохромат (III) натрия (Na3[Сr(OH)6]) • Гексакарбонил хрома (Cr(CO)6) • Гидроксид хрома (III) (Cr(OH)3) • Гидроксид хрома(II) (Cr(OH)2) • Двухромовая кислота (H2Cr2O7) • Диоксид-дихлорид хрома (CrO2Cl2) • Дихромат калия (K2Cr2O7) • Дихромат лития (Li2Cr2O7) • Дихромат натрия (Na2Cr2O7) • Дихромат рубидия (Rb2Cr2O7) • Дихромат цезия (Cs2Cr2
Гидроксид хрома: структура, свойства и применение
He гидроксид хрома представляет собой неорганическое соединение, продукт реакции основания с солью хрома.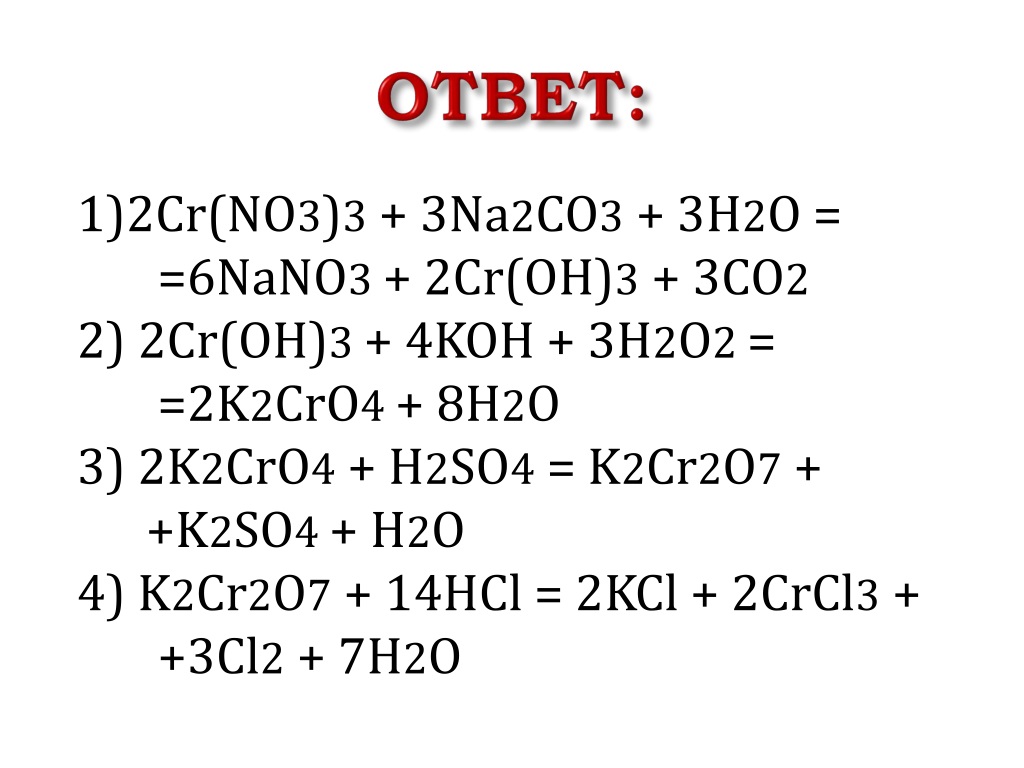
По электронным причинам Cr 2+ более нестабилен, чем Cr 3+ , поэтому Cr (OH) 2 является восстановителем (он теряет электрон, чтобы перейти к +3). Таким образом, хотя оба гидроксида могут быть получены в виде осадков, преобладающим соединением является Cr(OH) 3 , также называемый гидроксидом хрома.
В отличие от гидроксидов, получаемых простым растворением оксидов металлов в воде, Cr (OH) 3 не синтезируется этим путем из-за плохой растворимости оксида хрома (Cr 2 ИЛИ 3 , верхнее изображение). Однако Cr (OH) 3 считается Cr 2 OR 3 · XH 2 Или используется как изумрудно-зеленый пигмент (зеленый Guinet).
В лаборатории часть металлического хрома, который растворяют в растворе кислоты с образованием комплекса [Cr (OH 2 ) 6 ] 3+ . Этот водный комплекс затем реагирует с основанием (NaOH или KOH) с образованием соответствующего гидроксида хрома.
Если предыдущие этапы выполняются в условиях, обеспечивающих отсутствие кислорода, то в реакции возникает Cr(OH) 2 (гидроксид хрома). Затем требуется разделение и обезвоживание осажденного твердого вещества. В результате «настоящий» (ОН) «рождается» 3 , зеленый порошок с полимерной структурой и неопределенный.
Индекс
- 1 Структура
- 1.1 Октаэдр и полимеризация
- 2 Физические и химические свойства
- 2.1 Анфотеризм
- 3 Синтез гидроксида хрома в промышленности
- 4 Применение
- 5 Ссылки
Верхнее изображение представляет собой простейшее представление Cr (OH) 3 в газообразной фазе и изолировано. Аналогичным образом и при допущении чисто ионного характера их взаимодействий в твердых телах катионы Cr можно визуализировать 3+ взаимодействует с утроенным количеством анионов ОН — .
Аналогичным образом и при допущении чисто ионного характера их взаимодействий в твердых телах катионы Cr можно визуализировать 3+ взаимодействует с утроенным количеством анионов ОН — .
Однако природа связи Cr-OH является более ковалентной из-за координационного химического состава Cr 3+ . Например, комплекс [Cr (OH 2 ) 6 ] 3+ указывает на то, что металлический центр хрома координирован с шестью молекулами воды; Поскольку они нейтральны, комплекс демонстрирует положительный заряд исходного катиона Cr 3+ .
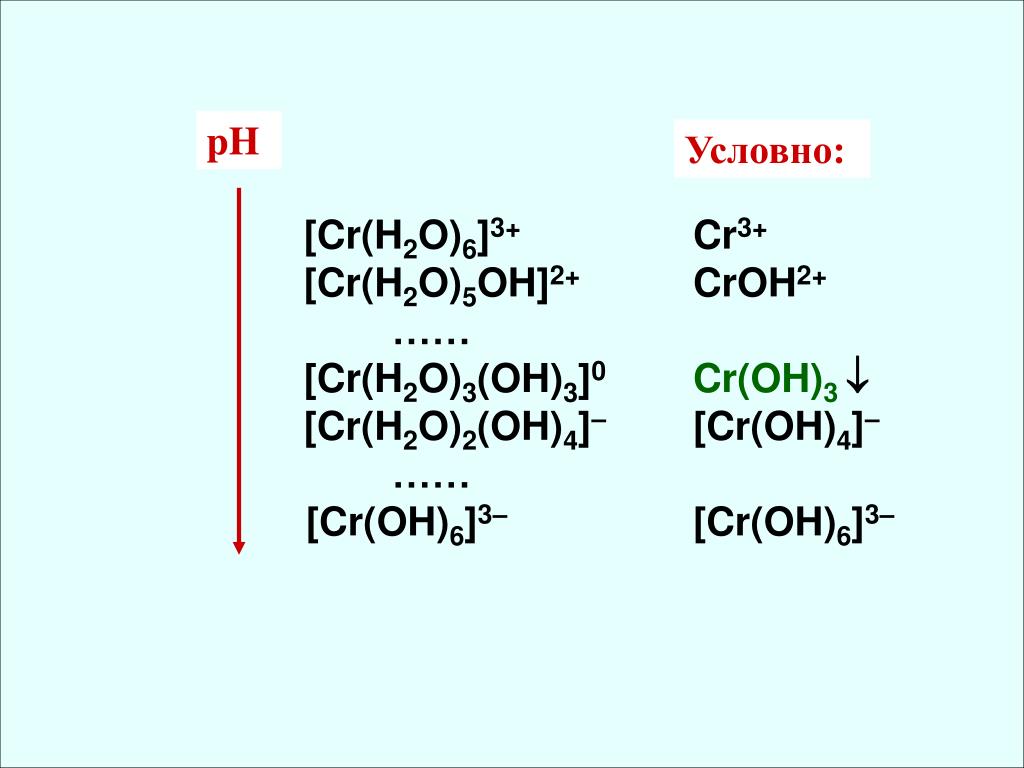
Октаэдр и полимеризацияНа верхнем изображении структура комплекса [Cr (OH 2 ) 6 ] 3+ . Ионы Cl — могут поступать, например, из соляной кислоты, если она использовалась для растворения соли или оксида хрома.
При добавлении NaOH (или KOH) в реакционную среду ион OH — депротонирует молекулу этого комплекса, образуя [Cr(OH 2 ) 5 (OH)] 2+ (Теперь имеется пять молекул воды, потому что шестая потеряла протон). Этот новый комплекс последовательно дегидратирует другой водный комплекс, образуя димеры, связанные гидроксидными мостиками: увеличивается среда (повышается рН) образуется комплекс [Cr (OH 2 ) 4 (OH) 2 ] + , а также увеличивают вероятность образования новых гидроксидных мостиков для создания студенистых полимеров. На самом деле этот «серо-зеленый кисель» отказывается нестись упорядоченно.
Этот новый комплекс последовательно дегидратирует другой водный комплекс, образуя димеры, связанные гидроксидными мостиками: увеличивается среда (повышается рН) образуется комплекс [Cr (OH 2 ) 4 (OH) 2 ] + , а также увеличивают вероятность образования новых гидроксидных мостиков для создания студенистых полимеров. На самом деле этот «серо-зеленый кисель» отказывается нестись упорядоченно.
Наконец, Cr (OH 2 ) 3 (OH) 3 состоит из октаэдра с Cr 3+ в центре и связан с тремя молекулами воды и тремя OH — , которые нейтрализуют его положительный заряд; это без учета полимеризации.
При дегидратации Cr (OH 2 ) 3 (OH) 3 вода, координированная с Cr, удаляется 3+ , а поскольку этот катион координирован с шестью видами (лигандами), полимерные структуры возникают, в которых могут участвовать связи Cr-Cr.
Также в обезвоженном состоянии его структура может рассматриваться как тип Cr 2 OR 3 · 3H 2 OR; другими словами, тригидратированный оксид хрома. Однако именно физико-химические исследования твердого тела могут пролить свет на истинную структуру Cr(OH)9.0005 3 в этой точке.
Однако именно физико-химические исследования твердого тела могут пролить свет на истинную структуру Cr(OH)9.0005 3 в этой точке.
Cr (OH) 3 Имеет вид сине-зеленого порошка, но при контакте с водой образует желеобразный серо-зеленый осадок.
Нерастворим в воде, но растворим в сильных кислотах и основаниях. Кроме того, при нагревании он разлагается с образованием паров оксида хрома.
AnfoterismoПочему гидроксид хрома растворим в кислых и щелочных растворах? Причина связана с его амфотерным характером, что позволяет ему реагировать как с кислотами, так и с основаниями. Это свойство характерно для Cr 3+ .
При взаимодействии с кислотами Cr (OH 2 ) 3 (OH) 3 растворяется, так как разрушаются гидроксильные мостики, что приводит к гелеобразному виду осадка.
С другой стороны, когда добавляется больше основания, OH — продолжают замещать молекулы воды, образуя отрицательный комплекс [Cr (OH 2 ) 2 (OH) 4 ] — . Этот комплекс придает раствору светло-зеленую окраску, которая усиливается по мере протекания реакции.
Этот комплекс придает раствору светло-зеленую окраску, которая усиливается по мере протекания реакции.
Когда весь Cr (OH 2 ) 3 (OH) 3 После реакции образуется конечный комплекс, как показано химическим уравнением: (OH) 3 + 3 OH — [Cr (OH) 6 ] 3- + 3 H 2 OR
Этот отрицательный комплекс связан с окружающими катионами (Na + 90 основание – NaOH), а после выпаривания воды выпадает в осадок хромитнатриевая соль (NaCrO 2 , изумрудно-зеленый). Таким образом, и кислая, и основная среда способны растворять гидроксид хрома.
Синтез гидроксида хрома в промышленностиВ промышленности его получают осаждением сульфата хрома растворами гидроксида натрия или гидроксида аммония. Аналогично, гидроксид хрома получают по схематизированной реакции:
CrO 7 2- + 3 SO 2 + 2H + => 2 CR 3+ + 3 SO 4 2- + H 2 или
CR 3+ + 3OH — => CR (OH) 3
Как показано в предыдущей процедуре, восстановление хрома VI до хрома III имеет большое экологическое значение. Хром III относительно безвреден для биоты, тогда как хром VI токсичен и канцерогенен, а также хорошо растворим, поэтому важно исключить его из окружающей среды.
Хром III относительно безвреден для биоты, тогда как хром VI токсичен и канцерогенен, а также хорошо растворим, поэтому важно исключить его из окружающей среды.
Технология очистки сточных вод и почвы включает восстановление Cr (VI) до Cr (III).
Применения— Составление макияжа.
— Средства для окрашивания волос.
— Лак для ногтей.
— Средства по уходу за кожей.
— Чистящие средства.
— В отделке металлов, что составляет 73% его потребления в промышленности.
— В консервации древесины.
Ссылки- Whitten, Davis, Peck & Stanley. Химия. (8-е изд.). CENGAGE Learning, стр. 873, 874.
- PubChem. (2018). Гидроксид хрома. Получено 18 апреля 2018 г. с сайта: pubchem.ncbi.nlm.nih.gov
- N4TR! УМбр. (22 июня 2015 г.). Гидроксид хрома (III). [Фигура]. Получено 18 апреля 2018 г. с сайта: commons.wikimedia.org
- Мартинес Тройя, Д., Мартин-Перес, Х.
 Дж. Исследование по экспериментальному использованию оксидов и гидроксидов хрома в средних классах. BORAX № 2 (1) — Обзор практической химии для среднего и Bachillerato-IES. Зафрамагон-ISSN 2529-9581.
Дж. Исследование по экспериментальному использованию оксидов и гидроксидов хрома в средних классах. BORAX № 2 (1) — Обзор практической химии для среднего и Bachillerato-IES. Зафрамагон-ISSN 2529-9581. - Синтез, характеристика и стабильность гидроксидов Cr (III) и Fe (III). (2014) Papassiopi, N., Vaxevanidou, K., Christou, C., Karagianni, E. and Antipas, GJ Hazard Mater. 264: 490-497.
- PrebChem. (9 февраля 2016 г.). Получение гидроксида хрома (III). Получено 18 апреля 2018 г. с сайта prepchem.com
- Wikipedia. (2018). Гидроксид хрома (III). Получено 18 апреля 2018 г. с: en.wikipedia.org
Загрузка ..
Cr(OH)3·3h3O (Cr[OH]3[h3O]3) Кристаллическая структура – SpringerMaterials
Неорганические твердые фазы
Получить доступ СИФ Скачать справку (pdf)
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.

Цитировать эту страницу
- Цитата
Кристаллографические данные
Параметры ячейки
Стандартизированные данные | ||||
|---|---|---|---|---|
| Космическая группа |
| |||
| и | ||||
| б | ||||
| в | ||||
| α | ||||
| β | ||||
| γ | ||||
| а/б | ||||
| б/к | ||||
| к/с | ||||
| В | ||||
Детали эксперимента
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время COVID-19пандемия,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.

Ссылка
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время COVID-19пандемия,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
Об этом контенте
PAULING FILE Multinaries Edition – 2012 г.
sd_1718925
© Springer и система данных о фазах материалов (MPDS), Швейцария и Национальный институт материаловедения (NIMS), Япония, 2016 г.
Пьер Виллар, Система данных о фазах материалов (MPDS), CH-6354 Вицнау, Швейцария
вилларс[email protected]
Цитировать этот контент
Пьер Виллар (главный редактор), PAULING FILE in: Inorganic Solid Phases,
SpringerMaterials (онлайн-база данных), Springer, Гейдельберг (ред.

 Дж. Исследование по экспериментальному использованию оксидов и гидроксидов хрома в средних классах. BORAX № 2 (1) — Обзор практической химии для среднего и Bachillerato-IES. Зафрамагон-ISSN 2529-9581.
Дж. Исследование по экспериментальному использованию оксидов и гидроксидов хрома в средних классах. BORAX № 2 (1) — Обзор практической химии для среднего и Bachillerato-IES. Зафрамагон-ISSN 2529-9581.

