Структура нитрата меди (Cu (NO3) 2), свойства, применение / химия | Thpanorama
нитрат меди (II) или нитрат меди, химическая формула которого Cu (NO)3)2, Это яркая неорганическая соль и привлекательные сине-зеленые цвета. Он синтезируется в промышленном масштабе в результате разложения медных руд, в том числе минералов герхардит и руаит..
Другие более выполнимые методы с точки зрения сырья и желаемых количеств соли состоят из прямых реакций с металлической медью и ее производными соединениями. Когда медь находится в контакте с концентрированным раствором азотной кислоты (HNO3) происходит окислительно-восстановительная реакция.
В этой реакции медь окисляется, а азот восстанавливается в соответствии со следующим химическим уравнением:
Cu (s) + 4HNO3(конц) => Cu (НЕТ3)2(ac) + 2H2O (l) + 2NO2(G)
Диоксид азота (НЕТ2) коричневый и ядовитый газ; Полученный водный раствор голубоватый. Медь может образовывать ион меди (Cu+) ион меди (Cu2+) или менее распространенный ион Cu3+; однако ион меди не поддерживается в водных средах многими электронными, энергетическими и геометрическими факторами..
Медь может образовывать ион меди (Cu+) ион меди (Cu2+) или менее распространенный ион Cu3+; однако ион меди не поддерживается в водных средах многими электронными, энергетическими и геометрическими факторами..
Стандартный восстановительный потенциал для Cu+ (0,52 В) больше, чем для Cu2+ (0,34 В), что означает, что Cu+ он более нестабилен и имеет тенденцию приобретать электрон, чтобы стать Cu (s). Эта электрохимическая мера объясняет, почему CuNO не существует3 как продукт реакции или, по крайней мере, в воде.
индекс
- 1 Физико-химические свойства
- 1.1 Электронная конфигурация
- 2 Химическая структура
- 3 использования
- 4 риска
- 5 ссылок
Медная селитра встречается безводной (сухой) или гидратированной с различными пропорциями воды. Ангидрид представляет собой голубую жидкость, но после координации с молекулами воды, способными образовывать водородные связи, кристаллизуется в виде Cu (NO)3)2· 3Н2O или Cu (НЕТ3)2· 6H2О.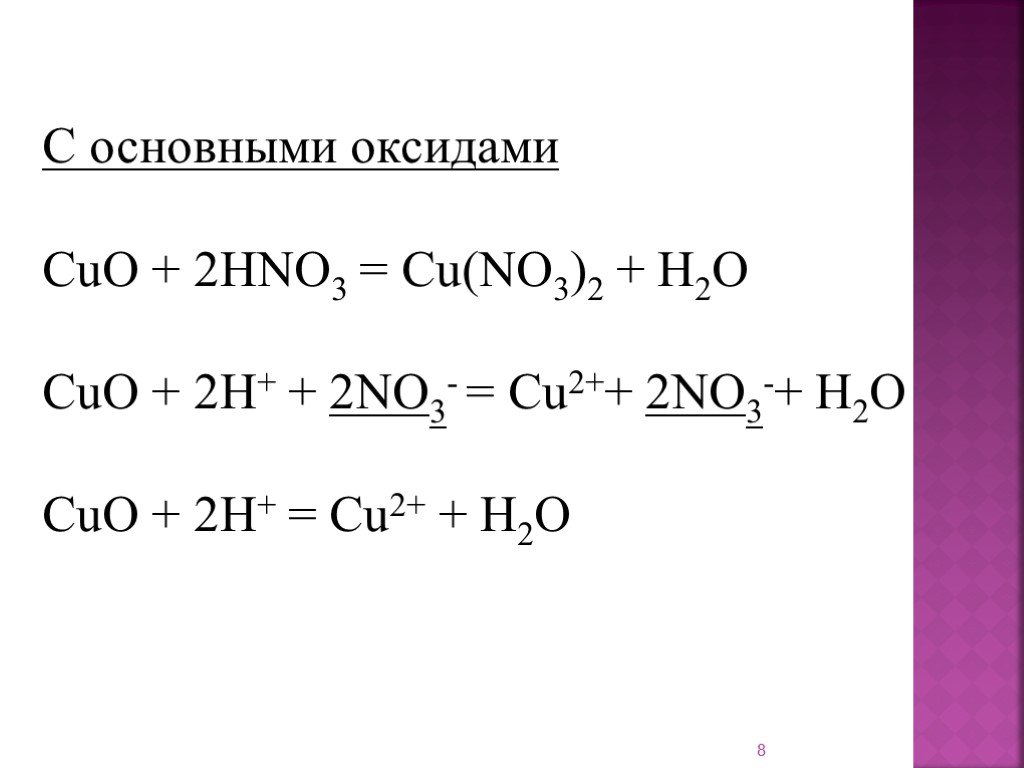 Это три наиболее доступные формы соли на рынке.
Это три наиболее доступные формы соли на рынке.
Молекулярная масса для сухой соли составляет 187,6 г / моль, добавляя к этому значению 18 г / моль для каждой молекулы воды, включенной в соль. Его плотность равна 3,05 г / мл, и это уменьшается для каждой включенной молекулы воды: 2,32 г / мл для тригидратированной соли и 2,07 г / мл для гексагидратированной соли. Не имеет точки кипения, но сублимирует.
Три формы нитрата меди хорошо растворимы в воде, аммиаке, диоксане и этаноле. Его точки плавления снижаются по мере добавления другой молекулы во внешнюю сферу координации меди; после плавления происходит термическое разложение нитрата меди с образованием вредных газов NO2:
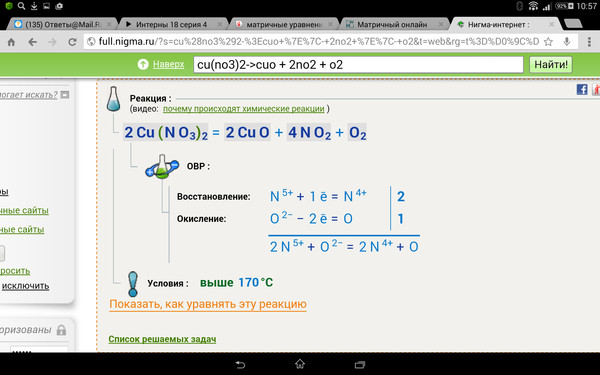
2 Cu (НЕТ3)2(s) => 2 CuO (s) + 4 NO2(г) + О2(G)
Химическое уравнение выше для безводной соли; для гидратированных солей пар также будет производиться в правой части уравнения.
Электронная конфигурацияЭлектронная конфигурация для иона Cu2+ это [Ar] 3d9, представляя парамагнетизм (электрон в 3d-орбитали9 непарный).
Поскольку медь является переходным металлом четвертого периода периодической таблицы и потеряла два своих валентных электрона под действием HNO3, у него все еще есть 4s и 4p орбитали, доступные для формирования ковалентных связей. Более того, Cu2+ может использовать две из своих самых внешних 4d орбиталей, чтобы иметь возможность координировать до шести молекул.
Анионы НЕ3— плоские, и поэтому Cu2+ может координировать с ними должно быть sp гибридизации3d2 это позволяет ему принять восьмигранную геометрию; это мешает анионам НЕ3— они «бьют» друг друга.
Это достигается с помощью Cu2+, поместив их в квадратную плоскость вокруг друг друга. Результирующая конфигурация для атома Cu в соли: [Ar] 3d94s24p6.
Химическая структураИзолированная молекула Cu (NO) представлена на верхнем изображении3)2 в газовой фазе. Атомы кислорода аниона нитрата координируются непосредственно с центром меди (внутренняя координационная сфера), образуя четыре связи Cu-O.
Атомы кислорода аниона нитрата координируются непосредственно с центром меди (внутренняя координационная сфера), образуя четыре связи Cu-O.
Он имеет квадратную плоскую молекулярную геометрию. Плоскость нарисована красными сферами в вершинах и медной сферой в центре. Газофазные взаимодействия очень слабы из-за электростатического отталкивания между группами NO3—.
Однако в твердой фазе медные центры образуют металлические связи -Cu-Cu-, создавая полимерные медные цепи.
Молекулы воды могут образовывать водородные связи с группами NO3—, и они будут предлагать водородные мостики для других молекул воды и так далее, пока не создадут водную сферу вокруг Cu (НЕТ3)2.
В этой сфере может иметь от 1 до 6 внешних соседей; следовательно, соль легко гидратируется, образуя гидратированные соли три и гекса.
Соль образуется из иона Cu2+ и два иона НЕ3—, придание ему характерной кристалличности ионных соединений (орторомбическая для безводной соли, ромбоэдрическая для гидратированных солей). Тем не менее, ссылки более ковалентные.
Тем не менее, ссылки более ковалентные.
Для захватывающих цветов нитрата меди эта соль находит применение в качестве добавки в керамике, на металлических поверхностях, в некоторых фейерверках, а также в текстильной промышленности в качестве протравы..
Это хороший источник ионной меди для многих реакций, особенно тех, в которых она катализирует органические реакции. Он также находит применение, подобное другим нитратам, в качестве фунгицида, гербицида или консерванта для древесины..
Другое его основное и наиболее инновационное применение — синтез катализаторов CuO или материалов с фоточувствительными свойствами..
Он также используется в качестве классического реагента в учебных лабораториях, чтобы показать реакции внутри гальванических элементов.
риски— Это сильно окисляющий агент, вредный для морской экосистемы, раздражающий, токсичный и едкий. Важно избегать любого физического контакта непосредственно с реагентом.
— Не воспламеняется.
— Разлагается при высоких температурах, выделяя раздражающие газы, среди которых NO2.
— В организме человека может вызвать хроническое повреждение сердечно-сосудистой и центральной нервной систем.
— Может вызвать раздражение желудочно-кишечного тракта.
— Будучи нитратом, внутри тела становится нитрит. Нитриты наносят ущерб уровням кислорода в крови и сердечно-сосудистой системе.
ссылки- Дей Р. и Андервуд А. Количественная аналитическая химия (пятое изд.). Пирсон Прентис Холл, р-810.
- MEL Science. (2015-2017). MEL Science. Получено 23 марта 2018 года от MEL Science: melscience.com
- ResearchGate GmbH. (2008-2018). ResearchGate. Получено 23 марта 2018 года от ResearchGate: researchgate.net
- Научная лаборатория. Научная лаборатория. Получено 23 марта 2018 года из научной лаборатории: sciencelab.com
- Уиттен, Дэвис, Пек и Стэнли. (2008).
 химия (Восьмое издание). р-321. CENGAGE Learning.
химия (Восьмое издание). р-321. CENGAGE Learning. - Википедия. Википедия. Получено 22 марта 2018 г. из Википедии: en.wikipedia.org
- Агирре, Джон Маурисио, Гутьеррес, Адамо и Джиральдо, Оскар. (2011). Простой способ синтеза гидроксильных солей меди. Журнал Бразильского химического общества, 22(3), 546-551
Опыт 3. Термическое разложение нитрата меди (II) (Cu(no3)2·2h3o)
а) Цель опыта
б) Теоретическое обоснование
в) Приборы: пробирка, штатив или пробиркодержатель, микрошпатель, спиртовка, лучинка.
г) Реактивы: кристаллы соли Cu(NO3)2·2H2O) — нитрат меди (II)
д) Выполнение опыта и наблюдения.
В
пробирку внести 1-2 микрошпателя кристаллов
нитрата меди Cu(NO3)2·3H2O. Закрепить пробирку в штативе и осторожно
нагреть над пламенем горелки, наблюдая
изменение цвета кристаллов и цвета
выделяющегося газа. Написать уравнение
реакции разложения нитрата меди (II),
учитывая окраску возможных продуктов
реакции (безводный
Закрепить пробирку в штативе и осторожно
нагреть над пламенем горелки, наблюдая
изменение цвета кристаллов и цвета
выделяющегося газа. Написать уравнение
реакции разложения нитрата меди (II),
учитывая окраску возможных продуктов
реакции (безводный
е) Сделать выводы, увязывая их с наблюдениями и теоретическим обоснованием.
8.4. Реакции диспропорционирования (самоокисления, самовосстановления) Опыт 1. Взаимодействие йода со щелочами
а) Цель опыта
б) Теоретическое обоснование
в) Приборы: пробирка, пробиркодержатель, спиртовка.
г) Реактивы: кристаллы йода, 2н раствор гидроксида натрия
д) Выполнение опыта
и наблюдения.
Поместить в пробирку 1…2 кристалла йода, 3…5 капель раствора гидроксида натрия или калия и нагреть. Как меняется цвет раствора? Написать уравнение реакции, учитывая, что продуктом окисления йода в щелочной среде является йодат натрия или, соответственно, калия, а продуктом восстановления – иодиды калия или натрия.
Затем к холодному раствору прибавить по каплям столько разбавленного раствора серной или соляной кислоты, сколько это необходимо для образования кислого раствора (проверить по покраснению универсальной индикаторной бумаги). Что происходит при этом?
Написать уравнение реакции, учитывая, что в кислом растворе реагируют между собой йодат и йодид. Указать окислитель и восстановитель.
е) Сделать выводы, увязывая их с наблюдениями и теоретическим обоснованием.
Опыт 2. Термическое разложение сульфита натрия
а) Цель опыта
б) Теоретическое обоснование
в) Приборы: пробирка, пробиркодержатель, спиртовка
г) Реактивы: кристаллический сульфит натрия
д) Выполнение опыта и наблюдения
В
пробирку поместить один микрошпатель
кристаллов сульфита натрия Na2SO3. Закрепить пробирку в штативе и нагревать
в течение 5…6 мин.
Закрепить пробирку в штативе и нагревать
в течение 5…6 мин.
В остывшую пробирку добавить 8…10 капель дистиллированной воды и растворить продукты реакции.
С помощью раствора сульфата меди CuSO4 обнаружить образовавшиеся сульфид-ионы S2-.
Сравнить действие раствора CuSO4 на раствор исходной соли. Какое еще вещество, кроме сульфида натрия образовалось при термическом разложении сульфита натрия? Как его обнаружить?
Написать уравнение реакции диспропорционирования Na2SO3 при прокаливании.
е) Сделать выводы, увязывая с наблюдениями и теоретическим обоснованием.8.5. Двойственное поведение пероксида водорода в овр Опыт 1. Восстановительные свойства пероксида водорода
а) Цель опыта
б) Теоретическое обоснование
в) Приборы: пробирка, пробиркодержатель, спиртовка, лучинка
г)
Реактивы: раствор перманганат калия
0,5 н, разбавленная серная кислота, 3% -ный
раствор перекиси водорода, лучинка.
д) Выполнение опыта и наблюдения.
К 2…3 каплям раствора перманганата калия добавить столько же разбавленной серной кислоты и З…4 капли раствора пероксида водорода H2O2. Что наблюдаете? Обратите внимание на выделение газа и испытайте его заранее приготовленной тлеющей лучинкой. Привести уравнение реакции.
е) Сделать выводы, увязывая с наблюдениями и теоретическим обоснованием.
Нитрат меди (Cu (NO3) 2): структура, свойства, применение — наука
Video: Reaction of Cu(NO3)2 with ZnContent
- Physical and chemical properties
- Electronic configuration
- Chemical structure
- Applications
- Risks
- Ссылки
Нитрат меди (II) или нитрат меди, химическая формула которого Cu (NO 3 ) 2 , представляет собой блестящую неорганическую соль привлекательного сине-зеленого цвета. Он синтезируется в промышленных масштабах путем разложения медных минералов, в том числе минералов герхардита и руаита.
Он синтезируется в промышленных масштабах путем разложения медных минералов, в том числе минералов герхардита и руаита.
Другие более осуществимые методы, с точки зрения сырья и желаемого количества соли, состоят из прямых реакций с металлической медью и ее производными соединениями. При контакте меди с концентрированным раствором азотной кислоты (HNO 3 ), происходит окислительно-восстановительная реакция.
В этой реакции медь окисляется, а азот восстанавливается в соответствии со следующим химическим уравнением: ) + 2H 2 O (ж) + 2NO 2 (ж)
Двуокись азота (NO 2 ) – вредный коричневый газ; полученный водный раствор имеет голубоватый оттенок. Медь может образовывать ион меди (Cu + ), ион меди (Cu 2+ ) или менее распространенный ион Cu 3+ ; однако ион меди в водной среде не благоприятствует многим электронным, энергетическим и геометрическим факторам.
Стандартный восстановительный потенциал для Cu + (0,52 В) больше, чем для Cu 2+ (0,34 В), что означает, что Cu + более нестабилен и имеет тенденцию приобретать электрон, чтобы стать Cu (с). Это электрохимическое измерение объясняет, почему CuNO не существует 3 в качестве продукта реакции или, по крайней мере, в воде.
Это электрохимическое измерение объясняет, почему CuNO не существует 3 в качестве продукта реакции или, по крайней мере, в воде.
Нитрат меди безводный (сухой) или гидратированный с различными пропорциями воды. Ангидрид представляет собой синюю жидкость, но после координации с молекулами воды, способными образовывать водородные связи, он кристаллизуется в виде Cu (NO 3 ) 2 3H 2 O или Cu (NO 3 ) 2 6H 2 O. Это три самые доступные формы соли на рынке.
Молекулярная масса сухой соли составляет 187,6 г/моль, прибавляя к этому значению 18 г/моль на каждую молекулу воды, включенную в соль. Его плотность равна 3,05 г/мл, и она уменьшается с каждой присоединенной молекулой воды: 2,32 г/мл для тригидратной соли и 2,07 г/мл для гексагидратной соли. Он не имеет температуры кипения, а скорее возгоняется.
Все три формы нитрата меди хорошо растворимы в воде, аммиаке, диоксане и этаноле. Их температуры плавления падают, когда к внешней координационной сфере меди добавляется еще одна молекула; плавление сопровождается термическим разложением нитрата меди с образованием вредных газов NO 2 :
Их температуры плавления падают, когда к внешней координационной сфере меди добавляется еще одна молекула; плавление сопровождается термическим разложением нитрата меди с образованием вредных газов NO 2 :
2 Cu (NO 3 ) 2 (т) => 2 CuO (т) + 4 NO 2 (г) + O 2 (g)
Приведенное выше химическое уравнение относится к безводной соли; для гидратированных солей водяной пар также будет образовываться в правой части уравнения.
Электронная конфигурацияЭлектронная конфигурация для иона Cu 2+ представляет собой [Ar] 3d 9 , что свидетельствует о парамагнетизме (электрон на 3d-орбитали 9 неспарен).
Поскольку медь является переходным металлом четвертого периода таблицы Менделеева, и, потеряв два своих валентных электрона из-за действия HNO 3 , у вас все еще есть 4s- и 4p-орбитали, доступные для образования ковалентных связей. Более того, Cu 2+ он может использовать две свои крайние 4d-орбитали для координации с шестью молекулами.
Более того, Cu 2+ он может использовать две свои крайние 4d-орбитали для координации с шестью молекулами.
Анионы NO 3 – являются плоскими, и для Cu 2+ может координироваться с ними, должен иметь sp-гибридизацию 3 d 2 , что позволяет принимать октаэдрическую геометрию; это препятствует тому, чтобы анионы 3 – «сталкивались» друг с другом.
Это достигается путем размещения Cu 2+ в квадратной плоскости вокруг друг друга. Результирующая конфигурация атома Cu внутри соли: [Ar] 3d 9 4с 2 4п 6 .
Химическая структураНа верхнем изображении изолированная молекула Cu (NO 3 ) 2 в газовой фазе. Атомы кислорода нитрат-аниона координируются непосредственно с медным центром (внутренней координационной сферой), образуя четыре связи Cu–O.
Имеет квадратно-плоскую молекулярную геометрию. Плоскость рисуется красными сферами в вершинах и медной сферой в центре. Взаимодействия в газовой фазе очень слабые из-за электростатического отталкивания между группами NO. 3 – .
Плоскость рисуется красными сферами в вершинах и медной сферой в центре. Взаимодействия в газовой фазе очень слабые из-за электростатического отталкивания между группами NO. 3 – .
Однако в твердой фазе медные центры образуют металлические связи –Cu – Cu–, создавая полимерные цепи меди.
Молекулы воды могут образовывать водородные связи с группами NO 3 – , и они будут предлагать водородные связи для других молекул воды, и так далее до образования водной сферы вокруг Cu (NO 3 ) 2.
В этой сфере можно иметь от 1 до 6 внешних соседей; следовательно, соль легко гидратируется с образованием гидратированных три- и гекса-солей.
Соль образуется из иона Cu 2+ и двух ионов NO 3 – , что придает ей кристалличность, характерную для ионных соединений (ромбическую для безводной соли, ромбоэдрическую для гидратированных солей). Однако связи имеют более ковалентный характер.
Благодаря очаровательному цвету нитрата меди, эта соль находит применение в качестве добавки в керамику, на металлические поверхности, в некоторые фейерверки, а также в текстильной промышленности в качестве протравы.
Это хороший источник ионной меди для многих реакций, особенно тех, в которых она катализирует органические реакции. Он также находит применение, аналогичное другим нитратам, в качестве фунгицида, гербицида или консерванта древесины.
Еще одно из его основных и новейших применений — синтез катализаторов CuO или материалов со светочувствительными свойствами.
Он также используется в качестве классического реагента в учебных лабораториях для демонстрации реакций внутри гальванических элементов.
Риски — Это сильный окислитель, вредный для морской экосистемы, раздражающий, токсичный и коррозионный. Важно избегать прямого физического контакта с реагентом.
— Не воспламеняется.
— Разлагается при высоких температурах с выделением раздражающих газов, включая NO 2 .
— В организме человека может вызывать хронические поражения сердечно-сосудистой и центральной нервной систем.
— Может вызывать раздражение желудочно-кишечного тракта.
— Будучи нитратом, в организме превращается в нитрит. Нитриты разрушают уровень кислорода в крови и сердечно-сосудистую систему.
Ссылки- Day, R. & Underwood, A. Quantitative Analytical Chemistry (пятое изд.). ПИРСОН Прентис Холл, стр. 810.
- MEL Наука. (2015-2017). МЭЛ Наука . Получено 23 марта 2018 г. из MEL Science: melscience.com
- ResearchGate GmbH. (2008-2018). ResearchGate . Получено 23 марта 2018 г. с сайта ResearchGate: researchgate.net
- Science Lab. Научная лаборатория . Получено 23 марта 2018 г. из научной лаборатории: sciencelab.com
- Уиттен, Дэвис, Пек и Стэнли.
 (2008). Химия (восьмое изд.). с-321. CENGAGE Обучение.
(2008). Химия (восьмое изд.). с-321. CENGAGE Обучение. - Википедия. Википедия . Получено 22 марта 2018 г. из Википедии: en.wikipedia.org
- Агирре, Джон Маурисио, Гутьеррес, Адамо и Хиральдо, Оскар. (2011). Простой способ синтеза гидроксисолей меди. Журнал Бразильского химического общества , 22 (3), 546-551
Ассоциация термодинамических параметров для нано-Cu(NO3)2·2,5h3O с лигандами при различных температурах
Термодинамические параметры ассоциации нано Cu(NO
3 ) 2 ·2,5H 2 O с лигандами при разных температурахСамех Г. Санад и и Магди Шебл* и
Принадлежности автора
* Соответствующие авторы
и Кафедра химии, педагогический факультет, Университет Айн-Шамс, Рокси, Каир, Египет
 com
comАннотация
Термодинамические параметры ассоциации важны, поскольку они дают информацию о характере ион-ионного взаимодействия в растворе, диэлектрической проницаемости среды и межмолекулярных водородных связях между молекулами растворителя. Рассчитаны различные термодинамические параметры ассоциации для нано-полупентагидрата нитрата меди( II ) в присутствии 4,6-диацетилрезорцина и 4,6-бис(1-гидразоноэтил)бензол-1,3-диола в качестве лигандов. Измерения электропроводности проводились в различных концентрациях бинарных смешанных растворителей (ДМФА и вода) при различных температурах, 293.15, 303.15, 313.15 и 323.15 K. Сравнение данных термодинамических параметров ассоциации, таких как константы ассоциации (

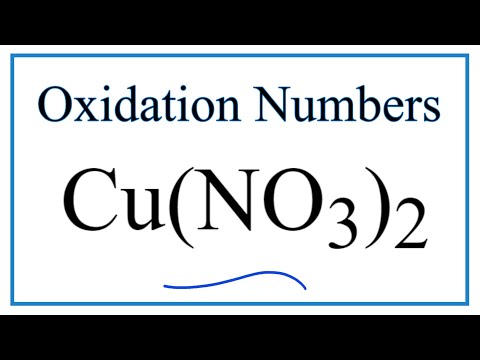 химия (Восьмое издание). р-321. CENGAGE Learning.
химия (Восьмое издание). р-321. CENGAGE Learning.2%20+%20NO%20+%20H2O%20reaction.jpg) (2008). Химия (восьмое изд.). с-321. CENGAGE Обучение.
(2008). Химия (восьмое изд.). с-321. CENGAGE Обучение.