Практическая работа 2. Задача 4 Химия 9 класс Рудзитис, Фельдман Осуществите реакции, схемы которых даны – Рамблер/класс
Практическая работа 2. Задача 4 Химия 9 класс Рудзитис, Фельдман Осуществите реакции, схемы которых даны – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Помогите с практичкой
Осуществите реакции, схемы которых даны:
б) SО32- + 2Н+ → SO2↑ + Н2O
в) ОН— + Н+ → Н2O
г) Аl0 → Аl3+
д) Сu2+ → Сu0
е) 2Н+ → Н20↑
ответы
Можно осуществить следующие превращения:
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н.
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых).
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Составьте уравнения реакций. Химия, 8 класс, параграф 33, 10 вопрос. Рудзитис и Фельдман – Рамблер/класс
Составьте уравнения реакций. Химия, 8 класс, параграф 33, 10 вопрос. Рудзитис и Фельдман – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Привет всем!
Эти схемы сведут с ума меня скоро, помогите дочке решить!!!
Составьте уравнения реакций, схемы которых даны ниже:
а) Са → СаО → Са(ОН)2 → Ca(NO3)2 → CaSO4
б) Аl2О3 → Al2(SO4)3 → Аl(ОН)3 → Аl2О3
в) СаСО3 → СаО → Са(ОН)2 → СаСO3 → Ca(NO3)2
г) Сu →CuO → CuCl2 → Сu(ОН)2→ СuО → Сu → CuSO4 → Сu(ОН)2
д) Mg → MgO → Mg(OH)2 → MgSO4
е) C → CO2 → Na2CO3 →CO
ж) Fe2(SO4)3 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3
з) P →P2O5 → H3PO4 → Ca3(PO4)2 → →H3PO4→Ca(H2PO4)2
и) Al2(SO4)3→ Al(OH)3 → Al2O3→AlCl3 → Al(OH)3 → Al(OH)2Cl
к) SO3 → ZnSO4 → Zn(OH)2 → ZnO
Лучший ответ
верный ответ
а) 2 Са + O2 → 2 СаО
СаО + Н2O → Са(ОН)2
Са(ОН)2 + 2 HNO3 → Ca(NO3)2 + Н2O
Ca(NO3)2 + H2SO4 → CaSO4 + 2 ΗΝO3
б) Аl2O3 + 3 H2SO4 → Al2
Al2(SO4)3 + 6NaOH → 2 Al(OH)3 ↓+3Na2SO4
CaO + H2O → Ca(OH)2
Са(ОН)2 + Н2СO3 → СаСO3 ↓+2 Н2O
СаСO3 + 2 ΗΝO3 → Са(NO3)2 + Н2СO3
г) 2 Сu + O2 →2 СиО
СuО + 2НСl → СuСl2 + Н2O
СuСl2 + 2 NaOH → Сu(ОН)2 ↓ +2 NaCl
CuO + H2 → Сu + Н2O
Сu + 2 H2SO4 → CuSO4 + SO2 ↑ +2 H2O
CuSO4 + 2 КОН → Cu(OH)2 ↓K2SO4
д) 2 Mg + O2 →2 MgO
MgO + H2O → Mg(OH)2
Mg(OH)2 + H2SO4 → MgSO4 + 2 H2O
e) C + O2 → CO2
Na2CO3 + 2 HCl → H2CO3 + 2 NaCl
CO2 + Ca(OH)2 → CaCO3 ↓ +H2O
ж) Fe2(SO4)3 + 6 KOH → 2 Fe(OH)3 ↓ +3 K2SO4
Fe2O3 + 3 H2SO4 → Fe2(SO4)3 + 3 H2O
3) 4 P + 5 O2 → 2 P2O5
P2O5 + 3H2O →2H3PO4
2 H3PO4 + 3 Ca(OH)2 → Ca3(PO4)2 + 6 H2O
Са3(РO4)2 + 6 HCl → 3 СаСl2 + 2 Н3РO4
2 Н3РO4(избыток) + Са(ОН)2 → Са(Н2РO4)2 + 2 Н2O
и) Al2 (SO4)3 + 6КOН → 2 Аl(ОН)3 ↓ +3K2SO4
Аl2O3 + 6 НСl(конц) → 2 АlСl3 + 3 Н2O
АlСl3 + 3 NaOH → Аl(ОН)31 +3 NaCl
Аl(ОН)3 + НСl → Аl(ОН)2Сl + Н2O
к) SO3 + Zn(OH)2 → ZnSO4 + Н2O
ZnSO4 + 2 NaOH → Na2SO4 + Zn(OH)2 ↓
еще ответы
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Психология
ЕГЭ
10 класс
9 класс
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Приготовление раствора сахара и расчёт его массовой доли в растворе. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 5.
Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Здравствуйте.
(Подробнее…)
Химия
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых). ..
..
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
7.10: Классификация химических реакций — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47512
Цели обучения
- Классифицировать химическую реакцию как синтез, разложение, однократное замещение, двойное замещение или реакцию горения.
- Предсказать продукты простых реакций.
Химические реакции, которые мы описали, являются лишь крошечной выборкой из бесконечного числа возможных химических реакций. Как химики справляются с этим огромным разнообразием? Как они предсказывают, какие соединения будут реагировать друг с другом и какие продукты будут образовываться? Ключ к успеху — найти полезные способы классификации реакций. Знакомство с несколькими основными типами реакций поможет вам предсказать продукты, образующиеся при контакте определенных видов соединений или элементов.
Как химики справляются с этим огромным разнообразием? Как они предсказывают, какие соединения будут реагировать друг с другом и какие продукты будут образовываться? Ключ к успеху — найти полезные способы классификации реакций. Знакомство с несколькими основными типами реакций поможет вам предсказать продукты, образующиеся при контакте определенных видов соединений или элементов.
Большинство химических реакций можно разделить на один или несколько из пяти основных типов: кислотно-основные реакции, реакции обмена, реакции конденсации (и наоборот, реакции расщепления) и реакции окисления-восстановления. Общие формы этих пяти видов реакций приведены в таблице \(\PageIndex{1}\) вместе с примерами каждого из них. Однако важно отметить, что многие реакции могут быть отнесены более чем к одной классификации, как вы увидите в нашем обсуждении.
| Название реакции | Общая форма | Примеры |
|---|---|---|
| Окислительно-восстановительный (окислительно-восстановительный) | окислитель + восстановитель → восстановленный окислитель + окисленный восстановитель | C 7 H 16 (л) + 11O 2 (г) → 7CO 2 (г) + 8H 2 O(г) |
| Кислотно-основное | кислота + основание → соль | NaOH(водн. ) + HNO 3 (водн.) → NaNO 3 (водн.) +H 2 O(л) ) + HNO 3 (водн.) → NaNO 3 (водн.) +H 2 O(л) |
| Замена: одиночная замена | АВ + С → АС + В | ZnCl 2 (водн.)+ Mg(тв) → MgCl 2 (водн.)+ Zn(тв) |
| Замена: двойная замена | AB + CD → AD + CB | BaCl 2 (водн.) + Na 2 SO 4 (водн.) → BaSO 4 (тв.) + 2NaCl (водн.) |
| Комбинация (Синтез) | А + В → АВ | CO 2 (г) + H 2 O(ж) → H 2 CO 3 (водн.) № 2 (ж) + 2O 2 (ж)→ 2NO 2 (ж) |
| Разложение | АВ → А + В | CaCO 3 (т) → CaO(т) + CO 2 (г) |
Схема классификации предназначена только для удобства; одну и ту же реакцию можно классифицировать по-разному, в зависимости от того, какая из ее характеристик является наиболее важной. В этом разделе обсуждаются реакции окисления-восстановления, в которых происходит перенос электронов от одного атома к другому, и реакции конденсации. Кислотно-основные реакции — один из видов обменных реакций — образование нерастворимой соли, например сульфата бария, при смешивании растворов двух растворимых солей.
В этом разделе обсуждаются реакции окисления-восстановления, в которых происходит перенос электронов от одного атома к другому, и реакции конденсации. Кислотно-основные реакции — один из видов обменных реакций — образование нерастворимой соли, например сульфата бария, при смешивании растворов двух растворимых солей.
Реакции комбинирования
Реакция комбинирования — это реакция, в которой два или более веществ объединяются с образованием одного нового вещества. Реакции сочетания можно также назвать реакциями синтеза. Общая форма комбинированной реакции:
\[\ce{A} + \ce{B} \rightarrow \ce{AB} \nonumber \]
Одна комбинированная реакция представляет собой соединение двух элементов с образованием соединения. Твердый металлический натрий реагирует с газообразным хлором с образованием твердого хлорида натрия.
\[2 \ce{Na} \left( s \right) + \ce{Cl_2} \left( g \right) \rightarrow 2 \ce{NaCl} \left( s \right) \nonumber \]
Обратите внимание, что для того, чтобы правильно написать и сбалансировать уравнение, важно помнить о семи элементах, существующих в природе в виде двухатомных молекул (\(\ce{H_2}\), \(\ce{N_2}\), \ (\ce{O_2}\), \(\ce{F_2}\), \(\ce{Cl_2}\), \(\ce{Br_2}\) и \(\ce{I_2}\)) .
Одним из часто встречающихся типов комбинированных реакций является реакция элемента с кислородом с образованием оксида. Металлы и неметаллы легко реагируют с кислородом в большинстве условий. Магний быстро и бурно реагирует при воспламенении, соединяясь с кислородом воздуха с образованием тонкого порошка оксида магния:
\[2 \ce{Mg} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{MgO} \left( s \right) \nonumber \]
Сера реагирует с кислородом с образованием диоксида серы:
\[\ce{S} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow \ce{SO_2} \left( g \right) \nonumber \]
Когда неметаллы реагируют друг с другом, продукт представляет собой молекулярное соединение. Часто неметаллические реагенты могут сочетаться в разных соотношениях и давать разные продукты. Сера также может соединяться с кислородом с образованием триоксида серы:
\[2 \ce{S} \left( s \right) + 3 \ce{O_2} \left( g \right) \rightarrow 2 \ce{SO_3} \left( g \right) \nonumber \]
Переходные металлы способны приобретать несколько положительных зарядов в составе своих ионных соединений.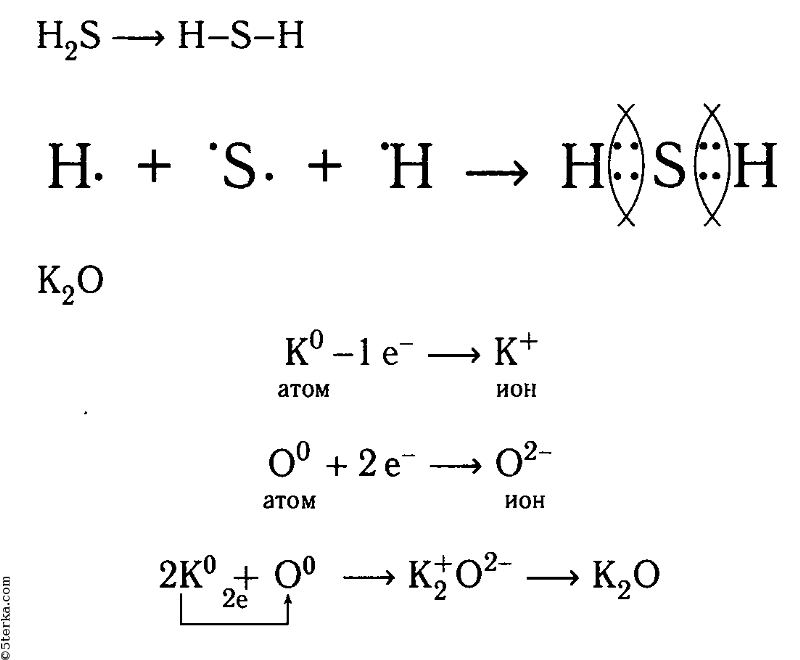 Следовательно, большинство переходных металлов способны образовывать различные продукты в реакции соединения. Железо реагирует с кислородом с образованием как оксида железа (II), так и оксида железа (III):
Следовательно, большинство переходных металлов способны образовывать различные продукты в реакции соединения. Железо реагирует с кислородом с образованием как оксида железа (II), так и оксида железа (III):
\[2 \ce{Fe} \left( s \right) + \ce{O_2} \left( g \right) \ стрелка вправо 2 \ce{FeO} \left( s \right) \nonumber \]
\[4 \ce{Fe} \left( s \right) + 3 \ce{O_2} \left( g \right) \rightarrow 2 \ce{Fe_2O_3} \left( s \right) \nonumber \]
Пример \(\PageIndex{1}\): сжигание твердого калия
Калий — очень активный щелочной металл, который необходимо хранить под маслом, чтобы предотвратить его реакцию с воздухом. Напишите сбалансированное химическое уравнение реакции соединения калия с кислородом.
Решение
| Решить. | Каркасное (несбалансированное) уравнение: \[\ce{K} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow \ce{K_2O} \left( s \right) \nonumber \] Тогда уравнение легко уравновешивается коэффициентами. \[4 \ce{K} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{K_2O} \left( s \right) \nonumber \] |
| Подумайте о своем результате. | Формулы верны, и результирующая реакция объединения уравновешена. |
Реакции сочетания также могут иметь место, когда элемент реагирует с соединением с образованием нового соединения, состоящего из большего числа атомов. Угарный газ реагирует с кислородом с образованием углекислого газа по уравнению:
\[2 \ce{CO} \left( g \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{ CO_2} \left( g \right) \nonumber \]
Два соединения также могут реагировать с образованием более сложного соединения. Очень распространенным примером являются реакции оксидов с водой. Оксид кальция легко реагирует с водой с образованием водного раствора гидроксида кальция:
\[\ce{CaO} \left( s \right) + \ce{H_2O} \left( l \right) \rightarrow \ce{Ca (OH)_2} \left( aq \right) \nonumber \]
Газообразный триоксид серы реагирует с водой с образованием серной кислоты. К сожалению, это обычная реакция, происходящая в атмосфере в некоторых местах, где в качестве загрязнителей присутствуют оксиды серы. Кислота, образовавшаяся в результате реакции, выпадает на землю в виде кислотных дождей.
К сожалению, это обычная реакция, происходящая в атмосфере в некоторых местах, где в качестве загрязнителей присутствуют оксиды серы. Кислота, образовавшаяся в результате реакции, выпадает на землю в виде кислотных дождей.
\[\ce{SO_3} \left( g \right) + \ce{H_2O} \left( l \right) \rightarrow \ce{H_2SO_4} \left( aq \right) \nonumber \]
Рисунок \ (\PageIndex{1}\): Кислотные дожди имеют серьезные последствия как для естественных, так и для искусственных объектов. Кислотный дождь разрушает мраморные статуи, подобные той, что слева (A). Деревья в лесу справа (B) погибли от кислотных дождей.Упражнение \(\PageIndex{1}\)
- Напишите химическое уравнение синтеза бромида серебра \(\ce{AgBr}\).
- Предскажите продукты следующей реакции: \(\ce{CO_2} \left( g \right) + \ce{H_2O} \left( l \right)\)
- Ответ a:
- \(2 \ce{Ag} + \ce{Br_2} \rightarrow 2 \ce{AgBr}\)
- Ответ б:
- \(\ce{CO_2} \left( g \right) + \ce{H_2O} \left( l \right) \rightarrow \ce{H_2CO_3}\)
Реакции разложения
Реакция разложения — это реакция, в которой соединение распадается на два или более простых вещества. Общая форма реакции разложения:
Общая форма реакции разложения:
\[\ce{AB} \rightarrow \ce{A} + \ce{B} \nonumber \]
Большинство реакций разложения требуют ввода энергии в виде тепла, света или электричества.
Бинарные соединения — это соединения, состоящие всего из двух элементов. Самый простой вид реакции разложения — это когда бинарное соединение разлагается на его элементы. Оксид ртути (II), красное твердое вещество, разлагается при нагревании с образованием ртути и газообразного кислорода:
\[2 \ce{HgO} \left( s \right) \rightarrow 2 \ce{Hg} \left( l \ справа) + \ce{O_2} \left( g \right) \nonumber \]
Видео \(\PageIndex{2}\): Оксид ртути (II) представляет собой твердое вещество красного цвета. При нагревании он разлагается на металлическую ртуть и газообразный кислород.
Реакция также считается реакцией разложения, даже если один или несколько продуктов все еще являются соединениями. Карбонат металла разлагается на оксид металла и углекислый газ. Например, карбонат кальция разлагается на оксид кальция и углекислый газ:
Карбонат металла разлагается на оксид металла и углекислый газ. Например, карбонат кальция разлагается на оксид кальция и углекислый газ:
\[\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \ влево( г \вправо) \номер\]
Гидроксиды металлов разлагаются при нагревании с образованием оксидов металлов и воды. Гидроксид натрия разлагается с образованием оксида натрия и воды:
\[2 \ce{NaOH} \left( s \right) \rightarrow \ce{Na_2O} \left( s \right) + \ce{H_2O} \left( g \right) \nonumber \]
Некоторые нестабильные кислоты разлагаются с образованием оксидов неметаллов и воды. Углекислота легко разлагается при комнатной температуре на углекислый газ и воду:
\[\ce{H_2CO_3} \left( aq \right) \rightarrow \ce{CO_2} \left( g \right) + \ce{H_2O} \ влево( л \вправо) \номер\]
Пример \(\PageIndex{2}\): Электролиз воды
Когда электрический ток проходит через чистую воду, она разлагается на составные элементы. Напишите уравнение разложения воды.
Решение
| Ступени | Пример решения |
|---|---|
| Спланируйте задачу. | Вода представляет собой бинарное соединение, состоящее из водорода и кислорода. Газообразные водород и кислород, образующиеся в результате реакции, представляют собой двухатомные молекулы. |
| Решить. | Каркасное (несбалансированное) уравнение: \[\ce{H_2O} \left( l \right) \overset{\text{elec}}{\rightarrow} \ce{H_2} \left( g \right) + \ce{O_2} \left( g \справа) \номер\] Обратите внимание на аббревиатуру «\(\text{elec}\)» над стрелкой, обозначающую прохождение электрического тока для инициирования реакции. \[2 \ce{H_2O} \left( l \right) \overset{\text{elec}}{\rightarrow} 2 \ce{H_2} \left( g \right) + \ce{O_2} \left ( г \право) \номер\] |
| Подумайте о своем результате. | Продукты являются элементами, и уравнение уравновешено. |
Упражнение \(\PageIndex{2}\)
Напишите химическое уравнение разложения:
- \(\ce{Al_2O_3}\)
- \(\ce{Ag_2S}\)
- Ответить на
- \(2 \ce{Al_2O_3} \rightarrow 4 \ce{Al} + 3 \ce{O_2}\)
- Ответ б
- \(\ce{Ag_2S} \rightarrow 2 \ce{Ag} + \ce{S}\)
Реакции одиночного замещения
Третий тип реакции — это реакция одиночного замещения, в которой один элемент заменяет аналогичный элемент в соединении. Общая форма реакции с одним замещением (также называемой с одним смещением):
\[\ce{A} + \ce{BC} \rightarrow \ce{AC} + \ce{B} \nonumber \]
В этой общей реакции элемент \(\ce{A}\) является металлом и заменяет элемент \(\ce{B}\), также металл, в соединении. Когда замещающий элемент является неметаллом, он должен заменить другой неметалл в соединении, и общее уравнение принимает вид:
Когда замещающий элемент является неметаллом, он должен заменить другой неметалл в соединении, и общее уравнение принимает вид:
\[\ce{Y} + \ce{XZ} \rightarrow \ce{XY} + \ce{Z} \nonumber \]
где \(\ce{Y}\) неметалл и заменяет неметалл \(\ce{Z}\) в соединении с \(\ce{X}\).
Замена металла
Магний является более активным металлом, чем медь. Когда полоску металлического магния помещают в водный раствор нитрата меди (II), она заменяет медь. Продуктами реакции являются водный раствор нитрата магния и твердая металлическая медь.
\[\ce{Mg} \left( s \right) + \ce{Cu(NO_3)_2} \left( aq \right) \rightarrow \ce{Mg(NO_3)_2} \left( aq \right ) + \ce{Cu} \left( s \right) \nonumber \]
Эта подкатегория реакций одинарного замещения называется реакцией замещения металла, потому что это замещаемый металл (медь).
Замена водорода
Многие металлы легко реагируют с кислотами, и когда они это делают, одним из продуктов реакции является газообразный водород. Цинк реагирует с соляной кислотой с образованием водного раствора хлорида цинка и водорода (рисунок ниже).
Цинк реагирует с соляной кислотой с образованием водного раствора хлорида цинка и водорода (рисунок ниже).
\[\ce{Zn} \left( s \right) + 2 \ce{HCl} \left( aq \right) \rightarrow \ce{ZnCl_2} \left( aq \right) + \ce{H_2} \влево( г \вправо) \номер\]
В реакции замещения водорода водород в кислоте заменяется активным металлом. Некоторые металлы настолько реакционноспособны, что способны заменить водород в воде. Продуктами такой реакции являются гидроксид металла и газообразный водород. Все металлы группы 1 подвергаются этому типу реакции. Натрий энергично реагирует с водой с образованием водного раствора гидроксида натрия и водорода (см. рисунок ниже).
\[2 \ce{Na} \left( s \right) + 2 \ce{H_2O} \left( l \right) \rightarrow 2 \ce{NaOH} \left( aq \right) + \ce{ H_2} \left( g \right) \nonumber \]
Рисунок \(\PageIndex{2}\): (Первое изображение) Металлический цинк реагирует с соляной кислотой с выделением газообразного водорода в реакции с одним замещением. (Второе изображение) Металлический натрий энергично реагирует с водой, выделяя газообразный водород. Большой кусок натрия часто выделяет столько тепла, что воспламеняется водород.
Большой кусок натрия часто выделяет столько тепла, что воспламеняется водород.Замена галогена
Элемент хлор реагирует с водным раствором бромида натрия с образованием водного раствора хлорида натрия и элементарного брома:
\[\ce{Cl_2} \left( g \right) + 2 \ce{NaBr} \left ( aq \right) \rightarrow 2 \ce{NaCl} \left( aq \right) + \ce{Br_2} \left( l \right) \nonumber \]
Реакционная способность группы галогена (группа 17) уменьшается сверху вниз внутри группы. Фтор является наиболее реакционноспособным галогеном, а йод — наименее. Поскольку хлор выше брома, он более реакционноспособен, чем бром, и может заменить его в реакции замещения галогена.
Пример \(\PageIndex{3}\)
Какие продукты реакции между твердым алюминием (\(\ce{Al}\)) и оксидом железа (III) (\(\ce{Fe_2O_3}\ ))?
Решение
| Ступени | Пример решения |
|---|---|
Спланируйте задачу. | Чтобы предсказать продукты, нам нужно знать, что алюминий заменит железо и образует оксид алюминия (металл заменит ион металла в соединении). Алюминий имеет заряд \(+3\), а кислород имеет заряд \(-2\). Таким образом, соединение, образующееся между алюминием и кислородом, будет \(\ce{Al_2O_3}\). Поскольку железо в соединении заменено алюминием, железо теперь будет единственным элементом в продуктах. |
| Решить. | Неуравновешенное уравнение будет: \[\ce{Al} + \ce{Fe_2O_3} \rightarrow \ce{Al_2O_3} + \ce{Fe} \nonumber \] и сбалансированное уравнение будет: \[2 \ce{Al} + \ce{Fe_2O_3} \rightarrow \ce{Al_2O_3} + 2 \ce{Fe} \nonumber \] |
| Подумайте о своем результате. | Это реакция с одним замещением, и при уравновешивании коэффициенты точно отражают тот факт, что железо и алюминий имеют одинаковый заряд в этой реакции. |
Упражнение \(\PageIndex{3}\)
- Напишите химическое уравнение для простой реакции замещения между твердым цинком и раствором нитрата свинца (II) с образованием раствора нитрата цинка и твердого свинца. (Обратите внимание, что цинк образует ионы с зарядом \(+2\).)
- Предскажите продукты следующей реакции: \(\ce{Fe} + \ce{CuSO_4}\). (Предположим, что в этой реакции железо образует ионы с зарядом \(+2\).)
- Ответ
- \(\ce{Zn} + \ce{Pb(NO_3)_2} \rightarrow \ce{Pb} + \ce{Zn(NO_3)_2}\)
- Ответ б
- \(\ce{Fe} + \ce{CuSO_4} \rightarrow \ce{Cu} + \ce{FeSO_4}\)
Реакции двойной замены
Реакция двойной замены — это реакция, в которой положительные и отрицательные ионы двух ионных соединений меняются местами с образованием двух новых соединений. Общая форма реакции двойного замещения (также называемая двойным замещением):
\[\ce{AB} + \ce{CD} \rightarrow \ce{AD} + \ce{BC} \nonumber \]
В этой реакции \(\ce{A}\) и \( \ce{C}\) — положительно заряженные катионы, а \(\ce{B}\) и \(\ce{D}\) — отрицательно заряженные анионы. Реакции двойного замещения обычно происходят между веществами в водном растворе. Чтобы произошла реакция, одним из продуктов обычно является твердый осадок, газ или молекулярное соединение, такое как вода.
Реакции двойного замещения обычно происходят между веществами в водном растворе. Чтобы произошла реакция, одним из продуктов обычно является твердый осадок, газ или молекулярное соединение, такое как вода.
Образование осадка
Осадок образуется в реакции двойного замещения, когда катионы одного из реагентов объединяются с анионами другого реагента с образованием нерастворимого ионного соединения. При смешивании водных растворов йодида калия и нитрата свинца (II) протекает следующая реакция: 9-}\) и в результате образуется ярко-желтый осадок (рис. \(\PageIndex{3}\)). Другой продукт реакции, нитрат калия, остается растворимым.
Рисунок \(\PageIndex{3}\): Иодид свинца (II) выпадает в осадок при смешивании йодида калия с нитратом свинца (II) (уравнение \ref{eq10}). (CC BY-SA 3.0; PRHaney).Образование газа
Некоторые реакции двойного замещения производят газообразный продукт, который затем выделяется из раствора пузырьками и улетучивается в воздух. При смешивании растворов сульфида натрия и соляной кислоты продуктами реакции являются водный раствор хлорида натрия и сероводородный газ:
\[\ce{Na_2S} \left( aq \right) + 2 \ce{HCl} \left( aq \right) \rightarrow 2 \ce{NaCl} \left( aq \right) + \ce{H_2S } \left( g \right) \nonumber \]
Образование молекулярного соединения
Другой тип реакции двойного замещения — это реакция, при которой в качестве одного из продуктов образуется молекулярное соединение. Многие примеры в этой категории представляют собой реакции, в результате которых образуется вода. При взаимодействии водного раствора соляной кислоты с водным раствором гидроксида натрия образуются водный раствор хлорида натрия и вода:
Многие примеры в этой категории представляют собой реакции, в результате которых образуется вода. При взаимодействии водного раствора соляной кислоты с водным раствором гидроксида натрия образуются водный раствор хлорида натрия и вода:
\[\ce{HCl} \left(водн. \right) + \ce{NaOH} \left( водн. \right) \rightarrow \ce{NaCl} \left( водн. \right) + \ce{H_2O} \ left( l \right) \nonumber \]
Пример \(\PageIndex{4}\)
Напишите полное и сбалансированное химическое уравнение для реакции двойной замены \(\ce{NaCN} \left( aq \right ) + \ce{HBr} \left( aq \right) \rightarrow\) (образуется цианистый водород).
Решение
| Этапы | Пример решения |
|---|---|
| Спланируйте задачу. | Производство газа приводит к реакции. |
| Решить. | Катионы обоих реагентов являются заряженными ионами \(+1\), а анионы — заряженными ионами \(-1\). После обмена партнерами сбалансированное уравнение: \[\ce{NaCN} \left( aq \right) + \ce{HBr} \left( aq \right) \rightarrow \ce{NaBr} \left( aq \right) + \ce{HCN} \left ( г \право) \номер\] |
| Подумайте о своем результате. | Это реакция двойной замены. Все формулы верны, уравнение сбалансировано. |
Упражнение \(\PageIndex{4}\)
Напишите полное и сбалансированное химическое уравнение для реакции двойной замены \(\ce{(NH_4)_2SO_4} \left( aq \right) + \ce{ Ba(NO_3)_2} \left( aq \right) \rightarrow\) (образуется осадок сульфата бария).
- Ответ а:
- \[\ce{(NH_4)_2SO_4} \left( aq \right) + \ce{Ba(NO_3)_2} \left( aq \right) \rightarrow 2 \ce{NH_4NO_3} \left( aq \right) + \ce{BaSO_4} \left( s \right) \nonumber \]
Иногда в результате реакции образуется как газ, так и молекулярное соединение. Реакция раствора карбоната натрия с соляной кислотой дает водный раствор хлорида натрия, газообразный диоксид углерода и воду:
Реакция раствора карбоната натрия с соляной кислотой дает водный раствор хлорида натрия, газообразный диоксид углерода и воду:
\[\ce{Na_2CO_3} \left(водный раствор \right) + 2 \ce{HCl} \left(водный раствор \right) \rightarrow 2 \ce{NaCl} \left(водный раствор \right) + \ce{CO_2 } \left( g \right) + \ce{H_2O} \left( l \right) \nonumber \]
7.10: Classifying Chemical Reactions распространяется по лицензии CK-12, автором, ремиксом и/или куратором выступили Мариса Альвиар-Агнью и Генри Агнью.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- автор@Генри Агнью
- автор@Мариса Альвиар-Агнью
- источник@https://www.ck12.org/c/chemistry/
Химическое соединение | Определение, примеры и типы
молекула метана
Посмотреть все СМИ
- Ключевые люди:
- Антуан Лавуазье Луи Бернар Гайтон де Морво Карл Вильгельм Шееле Мартин Генрих Клапрот Николя-Луи Воклен
- Похожие темы:
- химическая связь химический анализ координационное соединение металлоорганическое соединение химическая реакция
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
Вся материя во Вселенной состоит из атомов более 100 различных химических элементов, которые встречаются как в чистом виде, так и в виде химических соединений. Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы, составляющие углерод, отличаются от атомов, составляющих железо, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно. Символом железа является Fe, от его первоначального латинского названия 9.0037 железо . Фундаментальный принцип науки химии состоит в том, что атомы различных элементов могут соединяться друг с другом, образуя химические соединения. Метан, например, который образуется из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит различные молекулы CH 4 . Формула соединения, такая как CH 4 , указывает типы присутствующих атомов с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не пишется).
Формула соединения, такая как CH 4 , указывает типы присутствующих атомов с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не пишется).
Исследуйте магнитоподобную ионную связь, образующуюся при переносе электронов от одного атома к другому
Просмотреть все видео к этой статьеПосмотрите, как работают молекулярные связи, когда два атома водорода соединяются с атомом серы, образуя сероводород
Просмотреть все видео к этой статье Вода , представляющий собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O. Хлорид натрия представляет собой химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1:1. Хотя формула хлорида натрия — NaCl, соединение не содержит реальных молекул NaCl. Скорее, он содержит равное количество ионов натрия с положительным зарядом (Na + ) и ионы хлорида с отрицательным зарядом единицы (Cl — ). ( См. ниже Тенденции химических свойств элементов для обсуждения процесса превращения незаряженных атомов в ионы [т. соединения: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. Хлорид натрия, с другой стороны, содержит ионы; это ионное соединение.
( См. ниже Тенденции химических свойств элементов для обсуждения процесса превращения незаряженных атомов в ионы [т. соединения: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. Хлорид натрия, с другой стороны, содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются, образуя тысячи слов, атомы элементов могут комбинироваться различными способами, образуя множество соединений. . На самом деле известны миллионы химических соединений, и возможно еще много миллионов, но еще не открытых и не синтезированных. Большинство встречающихся в природе веществ, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества можно разделить на составляющие их соединения физическими методами, то есть методами, которые не изменяют способ агрегации атомов внутри соединений. Соединения можно разложить на составляющие их элементы путем химических превращений. Химическое изменение (то есть химическая реакция) — это изменение организации атомов. Примером химической реакции является горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
Химическое изменение (то есть химическая реакция) — это изменение организации атомов. Примером химической реакции является горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
Викторина «Британника»
Наука: правда или вымысел?
Химические соединения демонстрируют ошеломляющий набор характеристик. При обычных температурах и давлениях некоторые из них являются твердыми, некоторые — жидкими, а некоторые — газообразными. Цвета различных соединений охватывают цвета радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества. Для того чтобы из этого большого разнообразия можно было извлечь некоторый смысл, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также классифицируются как органические или неорганические. Органические соединения ( см. ниже Органические соединения), названные так потому, что многие из них были первоначально выделены из живых организмов, обычно содержат цепочки или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений. Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. ниже Неорганические соединения).
Для того чтобы из этого большого разнообразия можно было извлечь некоторый смысл, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также классифицируются как органические или неорганические. Органические соединения ( см. ниже Органические соединения), названные так потому, что многие из них были первоначально выделены из живых организмов, обычно содержат цепочки или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений. Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. ниже Неорганические соединения).
В широких классификациях органических и неорганических веществ существует множество подклассов, в основном основанных на определенных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат O 2- ионов или атомов кислорода, гидриды содержат ионы Н — или атомы водорода, сульфиды содержат ионы S 2- и так далее. К подклассам органических соединений относятся спирты (содержащие группу «ОН»), карбоновые кислоты (содержащие группу «СООН»), амины (содержащие группу «NH 2 ») и т. д.
К подклассам органических соединений относятся спирты (содержащие группу «ОН»), карбоновые кислоты (содержащие группу «СООН»), амины (содержащие группу «NH 2 ») и т. д.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Различные способности различных атомов объединяться в соединения лучше всего можно понять с точки зрения периодической таблицы. Периодическая таблица была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития науки химии было замечено, что элементы можно группировать в соответствии с их химической реакционной способностью. Элементы со схожими свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. По мере раскрытия деталей строения атома стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента (9). 0037 см. атом). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его самой внешней оболочке. Такие электроны называются валентными электронами.
0037 см. атом). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его самой внешней оболочке. Такие электроны называются валентными электронами.
Например, атомы элементов 1-й группы периодической таблицы имеют один валентный электрон, атомы элементов 2-й группы имеют два валентных электрона и так далее до 18-й группы, элементы которой содержат восемь валентных электронов. , достигается. Самое простое и наиболее важное правило для предсказания того, как атомы образуют соединения, состоит в том, что атомы склонны объединяться таким образом, что позволяют им либо опустошить свою валентную оболочку, либо заполнить ее (т. е. заполнить ее), в большинстве случаев имея в общей сложности восемь электронов. . Элементы в левой части периодической таблицы имеют тенденцию терять свои валентные электроны в химических реакциях. Например, натрий (в группе 1) имеет тенденцию терять свой единственный валентный электрон, образуя ион с зарядом +1. Каждый атом натрия имеет 11 электронов ( e — ), каждый из которых имеет заряд -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает суммарный заряд +1: Na → Na + + e — . Калий, расположенный непосредственно под натрием в группе 1, также образует в своих реакциях ионы +1 (K + ), как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы, как правило, вступают в реакции, в результате которых они получают (или делят) достаточное количество электронов, чтобы завершить свою валентную оболочку. Например, кислород в 16-й группе имеет шесть валентных электронов и, следовательно, нуждается в еще двух электронах, чтобы завершить свою внешнюю оболочку. Кислород достигает такого расположения, реагируя с элементами, которые могут терять или делиться электронами.
Каждый атом натрия имеет 11 электронов ( e — ), каждый из которых имеет заряд -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает суммарный заряд +1: Na → Na + + e — . Калий, расположенный непосредственно под натрием в группе 1, также образует в своих реакциях ионы +1 (K + ), как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы, как правило, вступают в реакции, в результате которых они получают (или делят) достаточное количество электронов, чтобы завершить свою валентную оболочку. Например, кислород в 16-й группе имеет шесть валентных электронов и, следовательно, нуждается в еще двух электронах, чтобы завершить свою внешнюю оболочку. Кислород достигает такого расположения, реагируя с элементами, которые могут терять или делиться электронами. Атом кислорода, например, может реагировать с атомом магния (Mg) (в группе 2), принимая два валентных электрона магния, образуя Mg 9ионы 0704 2+ и О 2– . (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2– .) Образующиеся Mg 2+ и O 2- затем объединяют в соотношении 1:1, чтобы получить ионное соединение MgO (оксид магния). (Хотя сложный оксид магния содержит заряженные частицы, он не имеет суммарного заряда, поскольку содержит равные количества Mg 2+ и O 2– ионов.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксида кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы данной группы имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Атом кислорода, например, может реагировать с атомом магния (Mg) (в группе 2), принимая два валентных электрона магния, образуя Mg 9ионы 0704 2+ и О 2– . (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2– .) Образующиеся Mg 2+ и O 2- затем объединяют в соотношении 1:1, чтобы получить ионное соединение MgO (оксид магния). (Хотя сложный оксид магния содержит заряженные частицы, он не имеет суммарного заряда, поскольку содержит равные количества Mg 2+ и O 2– ионов.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксида кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы данной группы имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное деление элементов на металлы, составляющие большинство элементов, и неметаллы. Типичными физическими свойствами металлов являются блестящий внешний вид, ковкость (способность превращаться в тонкий лист), пластичность (способность вытягиваться в проволоку) и эффективная тепло- и электропроводность. Важнейшим химическим свойством металлов является склонность отдавать электроны с образованием положительных ионов. Медь (Cu), например, является типичным металлом. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко формуются изделия различной формы, такие как трубы для водопроводных систем. Медь содержится во многих ионных соединениях в виде Cu + или ион Cu 2+ .
Металлические элементы находятся слева и в центре таблицы Менделеева. Металлы групп 1 и 2 называются репрезентативными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами.


 Сбалансируйте уравнение.
Сбалансируйте уравнение.