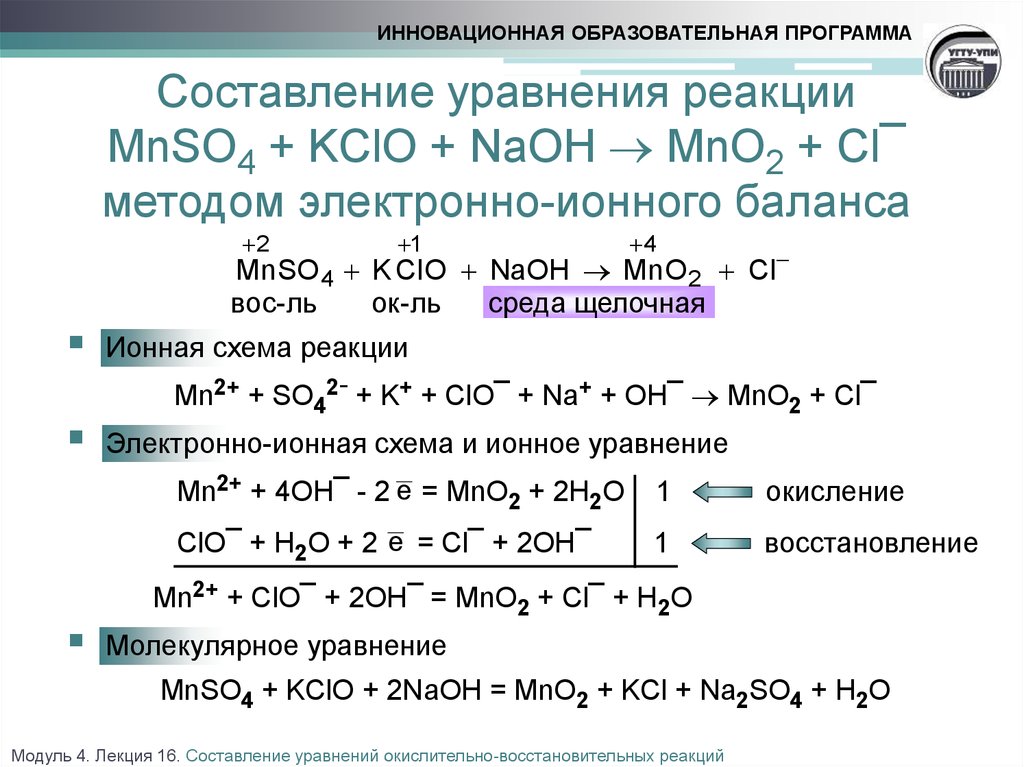
Окислительно-восстановительные реакции — Слайд №7
Перепишите алгоритм в тетрадь (или скопируйте в текстовый документ Word)
Алгоритм составления уравнений ОВР методом электронного баланса
Составить схему реакции.
Al + HCl → AlCl3 + H2
Определить степени окисления элементов в реагентах и продуктах реакции.
Al0 + H+1Cl-1 → Al+3Cl3-1 + H20
Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов.

Эта реакция является ОВР
Подчеркнуть элементы, степени, окисления которых изменяются.
Al0 + H+1Cl-1 → Al+3Cl3-1 + H20
Определить, какой элемент окисляется, (его степень окисления повышается) и какой элемент восстанавливается (его степень окисления понижается), в процессе реакции.

Al0 → Al+3 окисляется
H+1→ H20 восстанавливается
В левой части схемы обозначить с помощью стрелок процесс окисления (смещение электронов от атома элемента) и процесс восстановления (смещение электронов к атому элемента)
Al0 – 3 ē → Al+3 процесс окисление
2H+1 + 2 ē → H20 процесс восстановление
Определить восстановитель и окислитель.

Al0 – 3 ē → Al+3 восстановитель
2H+1+ 2 ē → H20 окислитель
Сбалансировать число электронов между окислителем и восстановителем.
Al0 – 3 ē → Al+3
2H+1+ 2 ē → H20
Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.

Al0 – 3 ē → Al+3
2H+1+ 2 ē → H20
х 2
х 3
Расставить коэффициенты перед формулами окислителя и восстановителя.
2Al +6 HCl → 2AlCl3 + 3H2
Проверить уравнение реакции.
Посчитаем количество атомов справа и слева, если их будет равное количество – коэффициенты мы расставили верно.
Тест 20. Окислительно-восстановительные реакции
Используя метод электронного баланса, расставьте коэффициенты в уравнениях реакций. Определите окислитель и восстановитель
1. HI + H
2SO4 → I2 + H2S + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
8HI + H2SO4 → 4I2 + H2S + 4H2O
3) Указать, что сера в степени окисления +6 является окислителем, а иод в степени окисления −1 — восстановителем.
2. H
2SO4 + Cu2O → CuSO4 + SO2 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3H2SO4 + Cu2O → 2CuSO4 + SO2 + 3H2O
3) Указать окислитель и восстановитель:
H2SO4 (S+6) — окислитель
Cu2O (Cu+) — восстановитель
3.
 HNO3 + FeO → Fe(NO3)3 + NO + H2O
HNO3 + FeO → Fe(NO3)3 + NO + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
10HNO3 + 3FeO → 3Fe(NO3)3 + NO + 5H2O
3) Указать окислитель и восстановитель:
HNO3 (N+5) — окислитель
FeO (Fe+2) — восстановитель
4. H
2S + KClO3 → S + KCl + H2OПоказать решение »
Решение.
1) Составть электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
3H2S + KClO3 → 3S + KCl + 3H2O
3) Указать окислитель и восстановитель:
KClO3 (Cl+5) — окислитель
H2S (S-2) — восстановитель
5. KNO
3 + Al + KOH + H2O → NH3 + K[Al(OH)4]Показать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
3KNO3 + 8Al + 5KOH + 18H2O → 3NH3 + 8K[Al(OH)4]
3) Указать окислитель и восстановитель:
KNO3 (N+5) — окислитель
Al (Al0) — восстановитель
6. SO
2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4Показать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
5SO2 + 2KMnO4 + 2H2O → K2SO4 +2 MnSO4 + 2H2SO4
3) Указать окислитель и восстановитель:
KMnO4 (Mn+7) — окислитель
SO2 (S+4) — восстановитель
7. SO
2 + K2Cr2O7 + H2SO4 → K2SOПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты, составить уравнение реакции:
3SO2 + K2Cr2O7 + H2SO4 → K2SO4 +Cr2(SO4)3 +H2O
3) Указать окислитель и восстановитель:
K2Cr2O7 (Сr+6) — окислитель
SO2 (S+4) — восстановитель
8. NaBr + H
2SO4 → Br2 + SO2 +Na2SO4 +H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты, составить уравнение реакции:
2NaBr + 2H2SO4 → Br2 + SO2 + Na2SO4 + 2H2O
3) Указать окислитель и восстановитель:
H2SO4 (S+6) — окислитель
NaBr (Br-1) — восстановитель
9.
 KI + … + H2SO4 → I2 + … + MnSO4 + H2O
KI + … + H2SO4 → I2 + … + MnSO4 + H2OПоказать решение »
Решение.
1) Определить недостающие вещества и записать полное уравнение реакции:
10KI + 2KMnO4 + 8H2SO4 → 5I2 + 6K2SO4 + 2MnSO4 + 8H2O
2) Коэффициенты расставить с помощью метода электронного баланса:
3) Йод в степени окисления −1 является восстановителем, а марганец — окислителем.
10. Fe(OH)
2 + KClO + …→ … + Fe2(SO4)3 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить недостающие вещества и расставить коэффициенты в уравнении реакции:
2Fe(OH)2 + KClO + 3H2SO4 → KCl + Fe2(SO4)3 + 5H2O
3) Железо в степени окисления +2 является восстановителем, а хлор в степени окисления +1 — окислителем.
11. P + HNO
3 + H2O → H3PO4 + NOПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO
3) Указать окислитель и восстановитьель
HNO3 (N+5) — окислитель
P0 — восстановитель
12. Si + NaOH + H
2O → Na2SiO3 + H2Показать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
Si + 2NaOH + H2O → Na2SiO3 + 2H2
3) Указать окислитель и восстановитель
H+1 — окислитель
Si0 — восстановитель
13. H
2S + Cl2 + H2O → H2SO4 + HClПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
H2S + 4Cl2 + 4H2O → H2SO4 +8 HCl
3) Указать окислитель и восстановитель
S-2 — восстановитель
Cl0 — окислитель
14. S + HNO
2 → H2SO4 + NO + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
S + 6HNO2 → H2SO4 + 6NO + 2H
3) Указать окислитель и восстановитель
S0 — восстановитель
N+3 — окислитель
15. FeCl
3 + H2S → HCl + S + FeCl2Показать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
2FeCl3 + H2S → 2HCl + S + 2FeCl2
3) Указать, что S-2 — восстановитель, а Fe+3 — окислитель
16.
 Zn + HNO3 → Zn(NO3)2 + NO + H2O
Zn + HNO3 → Zn(NO3)2 + NO + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
3) Указать, что Zn0 — восстановитель, а N+5 — окислитель
17. Zn + H
2SO4 (конц.) → ZnSO4 + H2S + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
4Zn + 5H2SO4 (конц.) → 4ZnSO 4 + H2S + 4H2O
3) Указать, что Zn (Zn0) — восстановитель, а H2SO4 (S+6) — окислитель
18. Cu + HNO
3 (разб.) → Cu(NO3)2 + NO + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3Cu + 8HNO3 (разб.) → 3Cu(NO3)2 + 2NO + 4H2O
3) Указать, что Сu0 — восстановитель, а N+5 — окислитель
19. Ca
3(PO4)2 + SiO2 + C → СaSiO3 + P + COПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
Ca3(PO4)2 + 3SiO2 + 5C → 3СaSiO3 + 2P + 5CO
3) Указать, что С0 — восстановитель, а P+5 — окислитель
20. HCl + CrO
3 → Cl2 + CrCl3 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
12HCl + 2CrO3 → 3Cl2 + 2CrCl3 + 6H2O
3) Указать, что Cr+6 — окислитель, а Cl-1 — восстановитель;
21.
 HCl + KClO3 → Cl2 + KCl + H2O
HCl + KClO3 → Cl2 + KCl + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
6HCl + KClO3 → 3Cl2 + KCl + 3H2O
3) Указать окислитель и восстановитель:
окислитель — KClO3 (Cl+5) восстановитель — HCl (Cl-1)
22. KI + KIO
3 + H2SO4 → I2 + K2SO4 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
10KI + 2KIO3 + 6H2SO4 → 6I2 + 6K2SO4 + 6H2O
или
5KI + KIO3 + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O
3) Указать окислитель и восстановитель:
окислитель — KIO3 (I+5) восстановитель — KI (I-1)
23.

Показать решение »
Решение.
1) Составить электронный баланс:
2) Составить уравнение реакции:
6NO + 4KOH → 4KNO2 + N2 + 2H2O
3) Указать, что NO ( за счёт азота в степени окисления +2) является и восстановителем, и окислителем;
24. Ba(OH)
2 + Cl2 → BaCl2 + Ba(ClO3)2 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Составить уравнение реакции:
6Ba(OH)2 + 6Cl2 → 5BaCl2 + Ba(ClO3)2 + 6H2O
3) Указать, что хлор в степени окисления 0 (Сl20) является и восстановителем, и окислителем
25. Ag + HClO
3 → AgCl + AgClO3 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
6Ag + 6HClO3 → AgCl + 5AgClO3 + 3H2O
3) Указать окислитель и восстановитель:
окислитель — HClO3 (Cl+5)
восстановитель — Ag (Ag0)
Используйте метод переноса электрона, чтобы сбалансировать уравнение
Химия
Рафаэль Зевс Л.
спросил 20.05.21Сбалансируйте уравнение, включающее реакцию алюминия с соляной кислотой с получением хлорида алюминия и газообразного водорода.
здесь 6 шагов:
1.) Напишите скелетное уравнение
2.) Присвойте степень окисления
3.) Напишите электронные уравнения для полуреакций окисления и восстановления
4.) Скорректируйте коэффициенты путем умножения
5.) Вставьте окончательные коэффициенты в уравнение скелета
6.) Скорректируйте коэффициенты не окислительно-восстановительных элементов, чтобы сбалансировать обе части уравнения
Пожалуйста, покажите их в это шаги, спасибо 🙂
Подписаться І 1
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
ЖАК Д. ответил 20.05.21
ответил 20.05.21
Репетитор
4.9 (90)
Инженер-химик с образованием в Лиге плюща и Массачусетском технологическом институте с карьерой преподавателя
Об этом репетиторе ›
Об этом репетиторе ›
1) Алюминий + HCl → AlCl 3 + H 2 , который очень легко сбалансировать, но я думаю, что это практика.
2) Al и H 2 имеют OxNo 0, потому что они являются элементами в естественном состоянии
H в HCl равен +1 (правило состояния Ox: H равен +1 при реакции, если только не гидрид)
Al в AlCl 3 обычно считается ионным, поэтому Al +3, так как это ион, который он образует. Вы также можете вывести это из суммы степеней окисления соединения, равного 0, и хлоридов, равного -1, если только кислород или фтор не переводят его в другое состояние)
3) Al → Al 3+ + 3e —
и 2H + + 2e — → H 2 обратите внимание, что H должен быть уравновешен в 1/2-балансе реакции до реакции электронов изменяется степень окисления. Также HCl является сильным, а AlCl 3 растворяется — хлоры являются зрителями
Также HCl является сильным, а AlCl 3 растворяется — хлоры являются зрителями
Кроме того, в этом простом окислительно-восстановительном процессе электроны просто уравновешивают заряд. Часто это не так.
4) Чтобы количество электронов сократилось, вам нужно удвоить уравнение Al и утроить уравнение H и добавить:
5) 2Al + 6H + → 2Al 3+ + 3H 2
6) Балансировка Cl на самом деле не требуется, поскольку она должна балансироваться, если вы связываете HCl с H + и AlCl 30051 с Al 3+
Пожалуйста, подумайте о том, чтобы нанять репетитора, если вам нужна помощь.
Голосовать за 0 голос против
Подробнее
Отчет
Все еще ищете помощь? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн. Никаких пакетов или подписок, платите только за то время, которое вам нужно.
с реакцией нескольких элементов — Lambda Geeks
Соляная кислота — очень сильная кислота, поскольку она способна почти полностью диссоциировать. Рассмотрим некоторые факты, когда соляная кислота (HCl) реагирует с алюминием (Al).
Соляная кислота также называется соляной кислотой. По внешнему виду он кажется бесцветным, а его молярная масса равна 36,458 г/моль. Физические свойства HCl зависят от его концентрации. Алюминий (Al) представляет собой элемент p-блока, обладающий свойствами, подобными металлу серебра.
HCl является одной из наиболее важных кислот, поскольку она используется в качестве реагента в химических лабораториях. Al обладает способностью реагировать как с кислотами, так и с основаниями. В следующих разделах мы изучим множество фактов, основанных на реакции HCl + Al.
Al обладает способностью реагировать как с кислотами, так и с основаниями. В следующих разделах мы изучим множество фактов, основанных на реакции HCl + Al.
При взаимодействии HCl с элементом Al основным образующимся продуктом является хлорид алюминия, и в процессе выделяется газообразный водород. Реакция может происходить при комнатной температуре. Другими словами, можно сказать, что Al растворяется в соляной кислоте.
6HCl(водн.) + 2Al(т) → 2AlCl 3 (водн.) + 3H 2 (г)
Какой тип реакции HCl + Al?Реакцию между HCl и Al можно назвать реакцией замещения. Из реакции видно, что хлор отделяется от молекулы кислоты и связывается с молекулой алюминия. А водород в реакции выделяется в виде газа. Ее также можно назвать окислительно-восстановительной реакцией.
Как сбалансировать HCl + Al?Мы можем легко сбалансировать реакцию HCL + AL, выполнив следующие ниже шаги:
HCL + AL → ALCL 3 + H 2
Шаг 1: . число атомов на стороне реагента и на стороне продукта каждого типа.
число атомов на стороне реагента и на стороне продукта каждого типа. - На этом этапе мы уравняем количество атомов каждого типа с обеих сторон.
| Reactants | Products |
| H → 1×6 = 6 | H→ 2×3 = 6 |
| Al→ 1×2 = 2 | Al→1×2 = 2 |
| Cl→ 1×6 = 6 | Cl→3×6 = 6 |
6HCl + 2Al → 2AlCl 3 + 3H 2
HCl + Al титрование При таком титровании необходимо соблюдать определенные условия, которые обсуждаются ниже.
Бюретка на 50 мл, штатив для бюреток, колба Эрленмейера, химические стаканы, стеклянные палочки и мерная колба.
ИндикаторПри титровании в качестве индикатора используется фенолфталеин, который помогает определить, когда титрование достигает конечной точки (розовая окраска в щелочной среде и обесцвечивание в кислотах).
На что следует обратить вниманиеПри титровании HCl (известной концентрации) является титрантом, что означает, что он будет помещен или добавлен в бюретку. Al помещают в колбу Эрленмейера.
Процедура- Прибор следует тщательно очистить и промыть соответствующими химикатами (во избежание ошибок).
- Бюретку наполняют HCl (должна быть стандартизирована), а раствор Al добавляют в колбу Эрленмейера.

- Добавляется индикатор фенолфталеин (при необходимости добавляется буферный раствор), и раствор тщательно перемешивается.
- Титрование следует проводить, выпуская кислоту из бюретки по каплям до изменения цвета.
- После изменения цвета достигается конечная точка.
- Для получения точных результатов титрование следует повторить трижды, и каждый раз показания следует записывать.
- По формуле N 1 V 1 = N 2 V 2 определяется объем необходимого химиката.
Суммарное ионное уравнение реакции между HCl и Al обсуждается ниже:
- Сначала , запишите сбалансированную молекулярную реакцию между HCl и Al вместе с их состояниями.

- 6HCl (aq) + 2AL (S) → 2ALCL 3 (AQ) + 3H 2 (G)
- Написать.
- 6H + + 6Cl – + 2Al → 2Al 3 + + 6Cl – + 3H 2
- Сократить аналогичные члены с обеих сторон, а оставшиеся члены уравнения дают нам искомое чистое ионное уравнение.
Сопряженная кислота соли алюминия и соответствующее сопряженное основание представляет собой сопряженную пару реакции между Al и HCl . Это указано в приведенном ниже уравнении.
HCl + Al = Cl – + HAl +
Межмолекулярные силы HCl и Al Межмолекулярная сила, наблюдаемая в HCl, представляет собой ионную связь. Хлор, заряженный отрицательно, забирает электрон у протона.
Хлор, заряженный отрицательно, забирает электрон у протона.
Энтальпия реакции между HCl и Al составляет -1049кДж/моль.
Является ли HCl + Al буферным раствором?Реакция между HCl и Al не приводит к образованию буфера, поскольку образующийся продукт представляет собой соль металла, а Al является амфотерным по своей природе.
Является ли HCl + Al полной реакцией?Реакция между Al и HCl является полной реакцией, поскольку единственным образующимся продуктом является хлорид алюминия (наряду с выделением газа H 2 ).
Является ли реакция HCl + Al экзотермической или эндотермической? Реакция между Al и HCl является экзотермической и довольно энергичной. Следовательно, реакцию следует проводить вдали от огня, поскольку H 2 , образующийся в результате реакции, может соединиться с кислородом (атмосферным) и может взорваться.
Реакция между HCl и Al является окислительно-восстановительной реакцией. Окислителем или окислителем в реакции являются ионы водорода из молекулы кислоты, а элемент алюминия является восстановителем.
Является ли HCl + Al реакцией осаждения?Реакция между HCl + Al не является реакцией осаждения, поскольку видно, что металлический алюминий растворяется в HCl с образованием хлорида алюминия, а выделяющийся газ (H 2 ) бесцветен. Также образующийся продукт AlCl 3 растворим в H 2 O.
Является ли реакция HCl + Al обратимой или необратимой?Реакция между HCl + Al необратима по своей природе, потому что продукты хлорид алюминия и газообразный водород не могут реагировать и возвращать первоначальную форму реагентов.
Является ли реакция замещения HCl + Al? Однократная реакция замещения происходит , когда HCl реагирует с Al.