| |||||||||||||
| Специальный поиск | |||||||||||||
|
Физика Теория вероятностей и мат. статистика Гидравлика Теор. механика Прикладн. механика Химия Электроника Витамины для ума |
Главная Поиск по сайту Формулы Все задачи Помощь Контакты Билеты |
||||||||||||
средняя кинетическая энергия поступательного движения молекул Задача 50159 Определить температуру идеального газа, если средняя кинетическая энергия поступательного движения его молекул равна 7,87·10–21 Дж.
Задача 50426 Определить среднюю кинетическую энергию поступательного движения молекул, содержащихся в азоте массой 1 г и энергию вращательного движения молекул при 300 К.
Задача 25222 Найдите среднюю кинетическую энергию поступательного движения молекул азота при температуре t = 27 °С.
Задача 13218 В сосуде объемом 20 л находится смесь водорода и гелия под давлением 2 атм. Общая масса смеси 5 г. Известно, что средняя кинетическая энергия поступательного движения молекул смеси газов равна 0,038 эВ. Во сколько раз отличаются массы водорода и гелия в смеси?
Задача 13224 Двухатомный газ, находившийся в закрытом сосуде при нормальных условиях, нагрели до Т = 400 К.
Задача 14127 Давление идеального газа 10 МПа, концентрация молекул 8·1010 см–3. Определить среднюю кинетическую энергию поступательного движения молекул и температуру газа.
Задача 14128 Давление идеального газа 10 мПа, концентрация молекул 2·1012 см–3. Определить среднюю кинетическую энергию поступательного движения молекул и температуру газа.
Задача 16815 Баллон содержит кислород (М = 0,032 кг/моль) при давлении Р = 2 МПа.
Задача 17037 Найти температуры, при которых средняя кинетическая энергия поступательного движения молекул H2 и N2 равна их вращательной энергии в состоянии с квантовым числом Y = 1.
Задача 17038 Найдите температуру, при которой средняя кинетическая энергия поступательного движения молекул Н2 равна их вращательной энергии в состоянии с квантовым числом Y = 1.
Задача 17040 Найдите температуру, при которой средняя кинетическая энергия поступательного движения молекул N2 равна их вращательной энергии в состоянии с квантовым числом Y = 1.
Задача 17842 Средняя кинетическая энергия поступательного движения молекул при температуре 6000 °С равна 1,6·10–23 Дж. Какова эта энергия при температурах — 200 и 2000°С?
Задача 21282 Давление газа равно 1 МПа, концентрация его молекул равна 1020 см–3. Определить температуру газа и среднюю кинетическую энергию поступательного движения молекул газа.
| |||||||||||||
Средняя кинетическая энергия хаотического движения молекул – формула, определение
4.5
Средняя оценка: 4.5
Всего получено оценок: 81.
4.5
Средняя оценка: 4.5
Всего получено оценок: 81.
Согласно молекулярно-кинетической теории в неподвижном теле, находящемся в состоянии механического покоя, молекулы и атомы находятся в постоянном хаотическом (несогласованном) движении. п_к = Е_1+ Е_2 + Е_3 +…. Е_N$ (2),
п_к = Е_1+ Е_2 + Е_3 +…. Е_N$ (2),
где N — полное число частиц в веществе.
Рис. 1. Хаотически движущиеся с разными скоростями молекулы в веществе.Найти суммарную кинетическую энергию всего вещества с помощью формул (1) и (2), конечно, невозможно: ведь для этого необходимо знать массы и скорости всех частиц, а также их общее количество. Если учесть, что только в одном моле вещества находится огромное число молекул (6,023*1023!), то становится понятно, что для решения этой задачи требуется другой подход.
Наблюдениями и исследованиями процессов передачи тепла ученые занимались задолго до нахождения формул молекулярно-кинетической теории. Для того чтобы придать понятиям “теплый”, “холодный” и т.п. более четкий, числовой вид, были изобретены термометры. Один из первых термометров придумал знаменитый Галилео Галилей, живший в Италии с 1564 г. по 1642 г.
Эксперименты показывали, что чем горячее вещество, тем быстрее (“энергичнее”) двигаются частицы. После изобретения микроскопа появилась возможность визуально наблюдать броуновское движение частиц, которые начинали перемещаться быстрее при нагревании.
После изобретения микроскопа появилась возможность визуально наблюдать броуновское движение частиц, которые начинали перемещаться быстрее при нагревании.
Оказывается в 1 см3 при 00С и 760 мм.рт.ст. находится 2,7*1019 молекул. Чтобы ощутить насколько велико это число приведем такой пример. Предположим, что газ удаляется из крохотного сосуда объемом 1 см
Молекулярно-кинетический подход
Уже к середине ХIX века стало понятно, что пытаться описывать движение каждого атома — дело безнадежное, т.к. ни один прибор не сможет отследить все молекулы и атомы. Вместо такого, “лобового”, подхода системы, состоящие из большого числа частиц стали рассматривать, не пытаясь учесть свойства отдельных атомов, а усредняя эти свойства по большой их совокупности.
В 1859 г. английский физик Максвелл с помощью такого подхода получил для давления p одноатомного газа формулу:
$p = {1\over 3} * n * m * v^2_c$ (3),
где: n — концентрация молекул, m — масса молекул, v2c = <v2>ср — среднее арифметическое квадратов скоростей молекул.
Температура вещества — мера кинетической энергии
Ранее для идеального газа был открыт закон Клапейрона-Менделеева, связавший в единое уравнение такие физические параметры, как давление p, объем V и температуру T (по шкале Кельвина):
$p * V = {m\over μ} * R * T$ (4),
где:
μ — молярная масса газа, R = 8,3157 джоуль/моль/градус — универсальная газовая постоянная.
Рис. 2. Температуры по шкалам Кельвина и Цельсия.В то же время газовая постоянная R равна:
$R = k * N_a$ (5),
где: k =1,38*10-23 Дж/К — постоянная Больцмана, Na — число Авогадро.
Рис. 3. Число Авогадро.Тогда, подставив в уравнение (4) R из уравнения (5), разделив обе части уравнения (4) на объем V и воспользовавшись тем, что:
${m\over μ} * {Na\over V } = n$ — концентрация молекул, получим из формулы (4) выражение для давления в виде:
$p = n * k * T$ (6). 2\over 2} = { 3 \over 2} * k * T$ (8).
2\over 2} = { 3 \over 2} * k * T$ (8).
В левой части уравнения, пользуясь формулой (1), получаем выражение для средней кинетической энергии хаотического движения молекул:
$Е_к = { 3 \over 2} * k * T$ (9).
Последняя формула (9) демонстрирует, что температура является мерой кинетической энергии молекул. Если газ одноатомный, то вся его энергия — это энергия поступательного движения.
Из формулы (9) следует еще один важный вывод: средняя кинетическая энергия поступательного движения для разных газов будет одинаковой не зависимо от массы молекул, и будет зависеть только от величины температуры.
Что мы узнали?
Итак, мы узнали что суммарная кинетическая энергия вещества складывается из кинетических энергий отдельных частиц. Кинетическая энергия движения частиц, усредненная по их числу, определяет температуру вещества. С помощью уравнения Менделеева-Клапейрона (4) и формулы для давления (3) получили соотношение, связывающее среднюю кинетическую энергию хаотического движения молекул с температурой вещества T.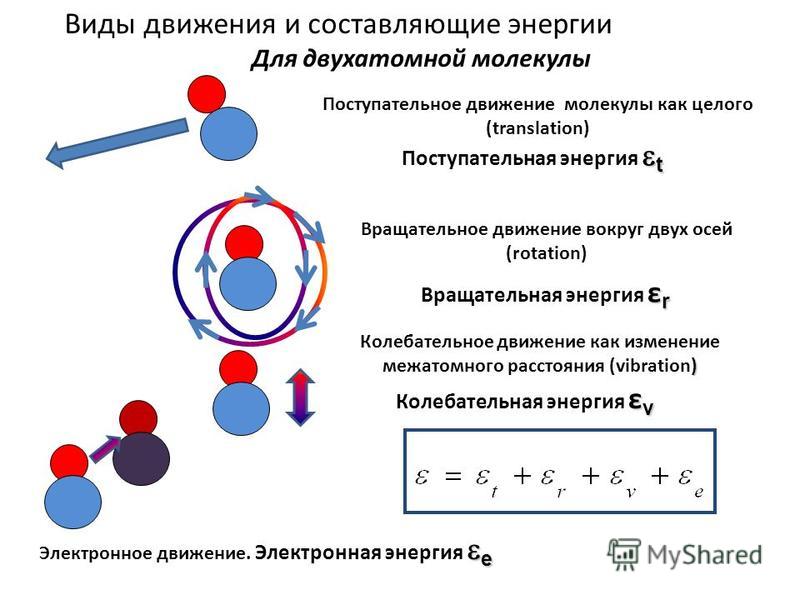
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Кристина Тараканова
11/11
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 81.
А какая ваша оценка?
27.1: Средняя поступательная кинетическая энергия газа
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 14535
Законы, описывающие поведение газов, были хорошо установлены задолго до того, как кто-либо разработал последовательную модель свойств газов. В этом разделе мы вводим теорию, которая описывает, почему газы ведут себя именно так. Теория, которую мы представляем, также может быть использована для вывода таких законов, как закон идеального газа, из фундаментальных принципов и свойств отдельных частиц.
Теория, которую мы представляем, также может быть использована для вывода таких законов, как закон идеального газа, из фундаментальных принципов и свойств отдельных частиц.
Одним из ключевых свойств отдельных частиц является их скорость. Однако в образце, состоящем из многих частиц газа, частицы, вероятно, будут иметь разные скорости. Вместо того, чтобы перечислять скорость каждой отдельной молекулы газа, мы можем комбинировать эти отдельные скорости несколькими способами, чтобы получить «коллективные» скорости, которые описывают образец в целом.
| Собственность | Скорость | Кинетическая энергия |
|---|---|---|
| Наиболее вероятно | \( \sqrt{\dfrac{2k_bT}{m}}\) | \(k_BT\) |
| Среднее | \( \sqrt{\dfrac{8k_bT}{\pi m}}\) | \(\dfrac{4k_BT}{\pi}\) |
| Среднеквадратичное значение | \( \sqrt{\dfrac{3k_bT}{m}}\) | \( \dfrac{3}{2} k_BT\) |
В следующем примере эти три коллективные скорости определены и рассчитаны для образца газа, состоящего всего из восьми молекул.
Пример 27.1.1 : Образец газа с небольшим количеством молекул
Были найдены скорости восьми молекул: 1,0, 4,0, 4,0, 6,0, 6,0, 6,0, 8,0 и 10,0 м/с. Вычислите их среднюю скорость (\(v_{\rm avg}\)) среднеквадратичную скорость (\(v_{\rm rms}\)) и наиболее вероятную скорость (\(v_{\rm mp}\)).
Раствор
Начать с определений:
- средняя скорость (\(v_{\rm avg}\)) = сумма всех скоростей, деленная на число молекул
- среднеквадратическая скорость (\(v_{\rm rms}\)) = квадратный корень из суммы квадратов скоростей, деленный на число молекул
- наиболее вероятная скорость (\(v_{\rm mp}\)) = скорость, с которой движется наибольшее количество молекул 92 \номер\]
- Газ состоит из большого числа частиц, называемых молекулами (одноатомными или многоатомными), которые находятся в постоянном хаотическом движении.
- Поскольку расстояние между молекулами газа намного больше, чем размер молекул, объем молекул пренебрежимо мал.
- Межмолекулярные взаимодействия, как отталкивающие, так и притягивающие, настолько слабы, что ими также можно пренебречь.
- Молекулы газа сталкиваются друг с другом и со стенками сосуда, но эти столкновения абсолютно упругие; то есть они не изменяют среднюю кинетическую энергию молекул.
- Средняя кинетическая энергия молекул любого газа зависит только от температуры, и при данной температуре все молекулы газа имеют точно одинаковую среднюю кинетическую энергию.

- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 52106
- Роберт Белфорд
- Университет Арканзаса в Литл-Роке
- Дать определение энергии и работы
- Дайте определение основным терминам термодинамики, таким как система и окружающая среда
- Описать характер передачи энергии
- Сравните и сопоставьте экзотермические и эндотермические процессы, знаковые соглашения, связанные с этими процессами.

- Колебательное движение атомов в связи, стимулируемое инфракрасным излучением
- Энергия электрона на атомной орбите
- Энергия ковалентной связи
- Вращение молекулы под действием микроволнового излучения
- Ответить на
Кинетик
- Ответ b
Потенциал
- Ответ c
Потенциал
- Ответ d
Кинетик
- Ответить
12,55 МДж
- \(w\) работа
- \(F\) — противодействующая сила
- \(d\) — расстояние, на которое сместился объект.
- Ответить
Формула работы от расширения газа при постоянном давлении
\[w=-P_{ext} \Delta V\номер\]
\[ш=-40\; атм \раз (458\; л — 177\; л) = -11240\; л\; атм \номер\]
Перевести из лат в джоули
\[-11240\; л\; атм \раз 101,325\; \dfrac{J}{L\атм} = -1138893\; J \номер \]
Преобразовать из Дж в кДж и округлить, чтобы получить окончательный ответ
\[-1138893\; Дж \раз \dfrac{1\; кДж} {1000\; J}=-1140\; кДж \номер\]
\[ш=-1140\; кДж \номер\]
Роберт Э.

Важно помнить, что в термализованной пробе газа будет полное распределение молекулярных скоростей. Одни молекулы будут двигаться быстрее, другие медленнее. Также важно признать, что наиболее вероятная, средняя и среднеквадратичная составляющие кинетической энергии, которые могут быть получены из кинетической молекулярной теории, не зависят от массы молекул (таблица 27. 1.1). Таким образом, можно сделать вывод, что средняя кинетическая энергия молекул в термализованной пробе газа зависит только от температуры. Однако средняя скорость зависит от молекулярной массы. Таким образом, при данной температуре легкие молекулы в среднем будут двигаться быстрее, чем более тяжелые.
1.1). Таким образом, можно сделать вывод, что средняя кинетическая энергия молекул в термализованной пробе газа зависит только от температуры. Однако средняя скорость зависит от молекулярной массы. Таким образом, при данной температуре легкие молекулы в среднем будут двигаться быстрее, чем более тяжелые.
Расчеты, выполненные в примере 27.1.1 становятся громоздкими по мере увеличения числа молекул в пробе газа. Таким образом, требуется более эффективный способ определения различных коллективных скоростей для пробы газа, содержащей большое количество молекул.
Молекулярное описание давления и молекулярной скорости
Кинетическая молекулярная теория газов объясняет законы, описывающие поведение газов. Разработан в середине 19 века несколькими физиками, в том числе австрийцем Людвигом Больцманом (1844–1819 гг.).06), немца Рудольфа Клаузиуса (1822–1888) и шотландца Джеймса Клерка Максвелла (1831–1879), эта теория основана на свойствах отдельных частиц, определенных для идеального газа, и фундаментальных понятиях физики.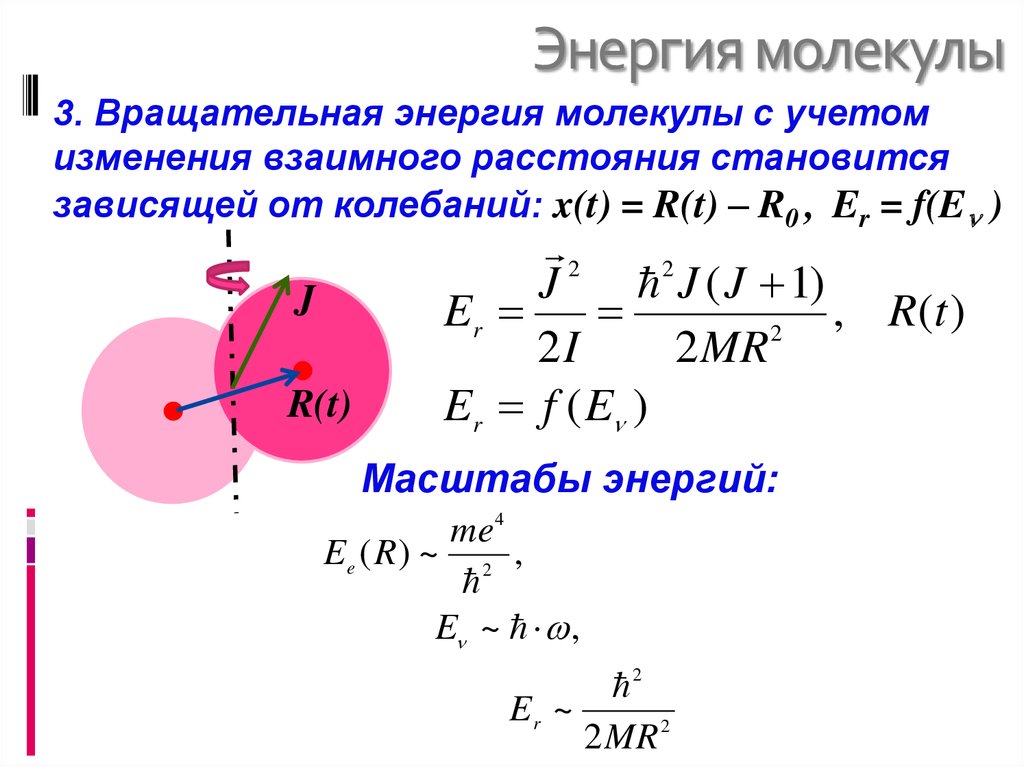
Рисунок 27.1.1 : Визуализация молекулярного движения. Молекулы газа находятся в постоянном движении и сталкиваются друг с другом и со стенкой сосуда.
Хотя молекулы реальных газов имеют ненулевые объемы и действуют как притягивающие, так и отталкивающие силы друг на друга, сейчас мы сосредоточимся на том, как кинетическая молекулярная теория газов связана с обсуждаемыми нами свойствами газов. В Теме 1C мы объясняем, как эту теорию следует модифицировать, чтобы учесть поведение реальных газов.
Постулаты 1 и 4 утверждают, что молекулы газа находятся в постоянном движении и часто сталкиваются со стенками своих сосудов. Столкновение молекул со стенками их контейнера приводит к передаче импульса (импульса) от молекул к стенкам (рис. 27.1.2). ).
Рисунок 27.1.2
: Примечание. На этом рисунке символ \(u\) используется для обозначения скорости. В остальной части этого текста скорость будет представлена символом \(v\). Передача импульса (импульса) от молекулы к стенке контейнера, когда она отскакивает от стенки. Передача импульса (\(\Delta \rho_x\)) при упругом соударении равна m\(\Delta v_x\), где m — масса молекулы, а \(\Delta v_x\) — изменение \ (x\) составляющая молекулярной скорости (\(v_{x_{final}}-v_{x_{initial}})\). Стенка перпендикулярна оси \(x\). Поскольку столкновения упругие, молекула отскакивает с той же скоростью в противоположном направлении, и \(\Delta v_x\) равно \(2v_x\).
Передача импульса (импульса) от молекулы к стенке контейнера, когда она отскакивает от стенки. Передача импульса (\(\Delta \rho_x\)) при упругом соударении равна m\(\Delta v_x\), где m — масса молекулы, а \(\Delta v_x\) — изменение \ (x\) составляющая молекулярной скорости (\(v_{x_{final}}-v_{x_{initial}})\). Стенка перпендикулярна оси \(x\). Поскольку столкновения упругие, молекула отскакивает с той же скоростью в противоположном направлении, и \(\Delta v_x\) равно \(2v_x\).
Передача импульса стенке, перпендикулярной оси \(x\) при попадании молекулы с начальной скоростью \(v_x\) в направлении \(x\), выражается как:
\[\rm импульс \; transfer_x\;= \Delta \rho_x = m\Delta v_x = 2mv_x \label{1.2.1} \]
Частота столкновений , количество столкновений молекул со стенкой на единицу площади и в секунду, увеличивается с молекулярной скоростью и числом молекул в единице объема.
92} \label{1.2.5} \] Поскольку объемами и межмолекулярными взаимодействиями можно пренебречь, постулаты 2 и 3 утверждают, что все газообразные частицы ведут себя одинаково, независимо от химической природы составляющих их молекул. В этом суть закона идеального газа, который рассматривает все газы как совокупность частиц, идентичных во всех отношениях, кроме массы. Постулат 2 также объясняет, почему сжать газ относительно легко; вы просто уменьшаете расстояние между молекулами газа. 92} = \dfrac{2}{3} N \epsilon \label{1.2.7} \]
В этом суть закона идеального газа, который рассматривает все газы как совокупность частиц, идентичных во всех отношениях, кроме массы. Постулат 2 также объясняет, почему сжать газ относительно легко; вы просто уменьшаете расстояние между молекулами газа. 92} = \dfrac{2}{3} N \epsilon \label{1.2.7} \]
Множитель 2/3 в пропорциональности отражает тот факт, что составляющие скорости в каждом из трех направлений вносят вклад ½ kT к кинетической энергии частицы. Средняя поступательная кинетическая энергия прямо пропорциональна температуре:
\[\epsilon = \dfrac{3}{2} kT \label{1.2.8} \]
, в которых известна константа пропорциональности \(k\) как постоянная Больцмана . Подстановка уравнения \(\ref{1.2.8}\) в уравнение \(\ref{1.2.7}\) дает
\[ PV = \left( \dfrac{2}{3}N \right) \left( \dfrac{3}{2}kT \right) =NkT \label{1.2.9} \]
Постоянная Больцмана \(k\) — это просто газовая постоянная на молекулу, поэтому, если N выбрано в качестве числа Авогадро, \(N_A\), тогда \(N_Ak\) — это R, газовая постоянная на моль. Таким образом, для n молей частиц уравнение \(\ref{1.2.9}\) принимает вид
Таким образом, для n молей частиц уравнение \(\ref{1.2.9}\) принимает вид
\[ PV = nRT \label{1.2.10} \]
, что является законом идеального газа.
Как указано в примере 27.1.1 , среднеквадратическая скорость (\(v_{\rm rms}\)) представляет собой квадратный корень из суммы квадратов скоростей, деленной на количество частиц: 92}}=\sqrt{\dfrac{3RT}{M}} \label{1.2.16} \]
В уравнении \(\ref{1.2.16}\), \(v_{\rm rms}\ ) имеет единицы измерения метры в секунду; следовательно, единицами молярной массы \(M\) являются килограммы на моль, температура \(T\) выражается в кельвинах, а постоянная идеального газа \(R\) имеет значение 8,3145 Дж/(К•моль). Уравнение \(\ref{1.2.16}\) показывает, что \(v_{\rm rms}\) газа пропорциональна квадратному корню из его температуры Кельвина и обратно пропорциональна квадратному корню из его молярной массы. Среднеквадратичная скорость газа увеличивается с повышением температуры. При данной температуре более тяжелые молекулы газа имеют меньшую скорость, чем более легкие.
Пример 27.1.2 :
Какова среднеквадратичная скорость для молекул \(\rm O_2\) при 25ºC?
Дано: Температура в ºC, тип молекул, газовая постоянная идеального газа
Запрашиваемый: \(v_{\rm rms}\), среднеквадратическая скорость
Стратегия:
Преобразование температуры в кельвины:
\(\rm T\; (в\; Кельвин) = (25ºC + 273ºC)\dfrac{1\; K}{1\; ºC} = 298\; K\)
Преобразовать молярную массу молекул \(\rm O_2\) в кг на моль:
\(\rm M\; (дюймы\; \dfrac{кг}{моль}) = 32,00\dfrac{г}{моль}\rm x\dfrac{1\; кг}{1000\; g}=0,03200 \dfrac{кг}{моль}\)
Используйте уравнение \(\ref{1.2.16}\) для расчета среднеквадратичной скорости.
Решение
\(v_{\rm rms _{\rm O_2}}= \sqrt{\dfrac{3\rm (8,3145\dfrac{J}{K·моль})(298,15\; K)}{\rm 0,03200\dfrac{кг}{моль}}}=482\dfrac{м}{с}\)
Упражнение 27.1.2
Какова среднеквадратичная скорость для молекул \(\rm Cl_2\) при 25ºC?
\(v_{\rm rms _{\rm Cl_2}}= 324\dfrac{m}{s}\)
Много молекул, много скоростей
При температурах выше абсолютного нуля все молекулы находятся в движении. В случае газа это движение состоит из прямолинейных скачков, длина которых весьма велика по сравнению с размерами молекулы. Хотя мы никогда не можем предсказать скорость конкретной отдельной молекулы, тот факт, что мы обычно имеем дело с огромным их числом, позволяет нам знать, какая часть молекул имеет кинетическую энергию (и, следовательно, скорости), которые лежат в пределах любого данного диапазон.
В случае газа это движение состоит из прямолинейных скачков, длина которых весьма велика по сравнению с размерами молекулы. Хотя мы никогда не можем предсказать скорость конкретной отдельной молекулы, тот факт, что мы обычно имеем дело с огромным их числом, позволяет нам знать, какая часть молекул имеет кинетическую энергию (и, следовательно, скорости), которые лежат в пределах любого данного диапазон.
Траектория отдельной молекулы газа состоит из серии прямолинейных траекторий, прерываемых столкновениями. Что происходит при столкновении двух молекул, зависит от их относительной кинетической энергии; в общем, более быстрая или тяжелая молекула передает часть своей кинетической энергии более медленной или легкой молекуле. Две молекулы, имеющие одинаковые массы и движущиеся в противоположных направлениях с одинаковой скоростью, после столкновения на мгновение останутся неподвижными.
Если бы мы могли измерить мгновенные скорости всех молекул в образце газа при некоторой фиксированной температуре, мы получили бы широкий диапазон значений. Некоторые из них будут нулевыми, а некоторые будут очень высокими скоростями, но большинство попадет в более или менее четко определенный диапазон. У нас может возникнуть соблазн определить среднюю скорость для набора молекул, но здесь нужно быть осторожным: молекулы, движущиеся в противоположных направлениях, имеют скорости противоположных знаков. Поскольку молекулы в газе находятся в случайном тепловом движении, будет примерно столько же молекул, движущихся в одном направлении, сколько и в противоположном направлении, поэтому все векторы скоростей противоположных знаков будут сокращаться, и средняя скорость будет равна нулю. . Поскольку этот ответ не очень полезен, нам нужно провести усреднение немного по-другому.
Некоторые из них будут нулевыми, а некоторые будут очень высокими скоростями, но большинство попадет в более или менее четко определенный диапазон. У нас может возникнуть соблазн определить среднюю скорость для набора молекул, но здесь нужно быть осторожным: молекулы, движущиеся в противоположных направлениях, имеют скорости противоположных знаков. Поскольку молекулы в газе находятся в случайном тепловом движении, будет примерно столько же молекул, движущихся в одном направлении, сколько и в противоположном направлении, поэтому все векторы скоростей противоположных знаков будут сокращаться, и средняя скорость будет равна нулю. . Поскольку этот ответ не очень полезен, нам нужно провести усреднение немного по-другому.
Правильный подход состоит в том, чтобы усреднить квадратов скоростей, а затем извлечь квадратный корень из этого значения, чтобы получить среднеквадратичную скорость (\(v_{\rm rms}\)), что и мы разработали выше. Эта скорость описывает образец газа в целом, но не говорит нам ни о диапазоне возможных скоростей, ни о распределении скоростей. Чтобы получить более полное описание того, сколько молекул газа может двигаться в данном диапазоне скоростей, нам нужно использовать закон распределения Максвелла-Больцмана.
Чтобы получить более полное описание того, сколько молекул газа может двигаться в данном диапазоне скоростей, нам нужно использовать закон распределения Максвелла-Больцмана.
Авторы и авторство
5.1: Энергия — Химия LibreTexts
Цели обучения
Введение
В этой главе мы познакомимся с термодинамикой, наукой об энергии и ее преобразованиях. Энергию можно рассматривать как способность совершать работу или передавать тепло.
Определение: Энергия
Энергия – это способность совершать работу (w) или передавать тепло (q)
В главе 1 мы ввели понятия кинетической и потенциальной энергии, а теперь рассмотрим их более подробно. С макроскопической точки зрения мы воспринимаем объекты как горячие или холодные, как представлено температурой, и понимаем, что тепло будет течь от горячего к холодному, но часто ошибочно принимают это за то, что температура является энергией, а это не так. 9{2}\) — это энергия, связанная с колебательным движением атома, которое можно смоделировать как колеблющуюся пружину, где k — константа закона Гука, а x — смещение от положения равновесия. То есть даже атомы в твердом теле, будь то ковалентная связь или ионная связь (кристаллическая решетка), не являются статичными, и они колеблются взад и вперед вокруг положений равновесия, как в пружине, при этом среднее расстояние равно «расстоянию связи». «. Обратите внимание, что атомы колеблются, потому что на них действуют силы притяжения и отталкивания, которые меняются по мере изменения их положения. Например, в двухатомной водородной связи ядра ускоряются навстречу друг другу, если силы притяжения больше отталкивающих, но по мере их сближения ядерное/ядерное отталкивание становится сильнее, и они начинают отталкиваться. По мере того, как они удаляются все дальше и дальше друг от друга, эти силы ослабевают, и силы притяжения снова начинают преобладать, заставляя их сближаться друг с другом, в результате чего возникает движение, подобное колебанию пружины. Уравнение закона Гука фактически описывает потенциальную энергию осциллятора, когда расстояние максимально от точки равновесия, но поскольку энергия сохраняется, она равна кинетической энергии, которую атомы ощущают в средней точке колебания. Чем горячее вещество, тем выше частота колебаний.
«. Обратите внимание, что атомы колеблются, потому что на них действуют силы притяжения и отталкивания, которые меняются по мере изменения их положения. Например, в двухатомной водородной связи ядра ускоряются навстречу друг другу, если силы притяжения больше отталкивающих, но по мере их сближения ядерное/ядерное отталкивание становится сильнее, и они начинают отталкиваться. По мере того, как они удаляются все дальше и дальше друг от друга, эти силы ослабевают, и силы притяжения снова начинают преобладать, заставляя их сближаться друг с другом, в результате чего возникает движение, подобное колебанию пружины. Уравнение закона Гука фактически описывает потенциальную энергию осциллятора, когда расстояние максимально от точки равновесия, но поскольку энергия сохраняется, она равна кинетической энергии, которую атомы ощущают в средней точке колебания. Чем горячее вещество, тем выше частота колебаний.
 {2}\) , это энергия химического объекта, связанного с вращением, где \(\omega\) — частота вращения (насколько быстро молекула вращается), а I — момент инерции (в некотором смысле ее сопротивление вращению, чем дальше друг от друга водород, тем больше I, чем ближе друг к другу, тем меньше I. Может быть несколько осей вращения Рисунок \(\PageIndex{2}\): Молекула воды вращается вокруг оси, делящей угол H-O-H пополам. (CC BY-SA 4.0 International; Darekk2 через Википедию) Видео 5.1.2 (0:17 мин. YouTube), показывающее, как фигуристка уменьшает момент инерции, приближая конечности к телу, в результате чего частота вращения увеличивается до 308 об/мин. Не вытягивая руки и ноги, а увеличивая момент инерции, замедляясь.
{2}\) , это энергия химического объекта, связанного с вращением, где \(\omega\) — частота вращения (насколько быстро молекула вращается), а I — момент инерции (в некотором смысле ее сопротивление вращению, чем дальше друг от друга водород, тем больше I, чем ближе друг к другу, тем меньше I. Может быть несколько осей вращения Рисунок \(\PageIndex{2}\): Молекула воды вращается вокруг оси, делящей угол H-O-H пополам. (CC BY-SA 4.0 International; Darekk2 через Википедию) Видео 5.1.2 (0:17 мин. YouTube), показывающее, как фигуристка уменьшает момент инерции, приближая конечности к телу, в результате чего частота вращения увеличивается до 308 об/мин. Не вытягивая руки и ноги, а увеличивая момент инерции, замедляясь.Молекулярная потенциальная энергия
Кулоновская энергия — это энергия между заряженными частицами. Существуют как силы отталкивания (между одноименно заряженными частицами), так и силы притяжения (между противоположно заряженными частицами).
Атомная кулоновская энергия
Кулоновская энергия притяжения электрона к ядру атома. Они самые слабые для электронов внешней оболочки и самые сильные для электронов ядра.
Кулоновские энергии связи
Энергии ковалентных и ионных связей. В случае ионных соединений это взаимодействия притяжения и отталкивания различных катионов и анионов. Для ковалентных это +/- притяжения электронов к ядрам разных атомов, но есть и отталкивающие взаимодействия -/- электронов и +/+ ядер. Равновесное расстояние рассматривается как потенциальная энергия связи. Поскольку связи разрываются и образуются во время химической реакции, энергия потенциальной энергии может высвобождаться или поглощаться из окружающей среды, которая либо приобретает, либо теряет кинетическую энергию.
Ядерная энергия
Существуют «сильные» и «слабые» силы, удерживающие ядро вместе, и они не будут рассматриваться в этом классе.
Упражнение \(\PageIndex{1}\)
Определите тип энергии, описываемый каждым из следующих утверждений, как потенциальную или кинетическую
Единицы энергии
Определение энергии на основе работы
Это единица энергии в системе СИ, а один джоуль соответствует ньютон-метру (Дж = Н . м), где ньютон является единицей силы в системе СИ. {2}}\)
{2}}\)
Калория
Определение энергии на основе тепла
Исторически калория — это энергия, необходимая для нагревания одного грамма воды на один градус Цельсия (с 14,5 o C до 15,5 o C), но сегодня калорией считают быть амортизированной единицей, и, согласно специальной публикации NIST 1038, « Международная система единиц (СИ) — коэффициенты преобразования общего назначения », определение калорий основано на джоулях:
1 кал ≡ 4,184 Джоули
Обратите внимание, что указанное выше число является определенным и не должно рассматриваться как имеющее значащие цифры. Кроме того, калория на самом деле является очень маленькой единицей измерения, и следует отметить, что пищевая калория (написанная с большой буквы) на самом деле является килокалорией.
Упражнение \(\PageIndex{2}\)
NIH предоставляет таблицу расчетных потребностей в калориях (килокалориях) для гендерных и возрастных групп, которая показывает, что активному мужчине в возрасте 19-30 лет необходимо около 3000 калорий. калорий. Сколько это джоулей? Используйте соответствующий префикс СИ в своем ответе.
калорий. Сколько это джоулей? Используйте соответствующий префикс СИ в своем ответе.
Что такое работа?
Работа имеет много форм, из которых механическая (поступательная) работа может быть описана как энергия, используемая для перемещения объекта на расстояние d при противодействии силе, такой как сила тяжести.
\[w=Fd\]
где
Обратите внимание, что существуют и другие виды работы, такие как расширение газа и электрическая работа (работа, совершаемая для перемещения заряженной частицы в электрическом поле). В этом классе нас в основном будет интересовать работа PV, которую можно визуализировать как работу, выполняемую посредством поступательного движения молекул, движущихся в трехмерном пространстве.
Работа расширения: работа давления-объема (PV)
Чтобы полностью понять это, нам нужно иметь покрытые газы, но мы можем представить молекулы в газе как движущиеся поступательно, которые могли бы совершать работу против окружающей среды. Если бы мы могли представить поршень без трения в цилиндре, то были бы три возможности, когда давление внутри равно, больше или меньше давления снаружи. Если давление внутри больше, газ внутри будет расширяться, двигая поршень и совершая работу с окружающей средой. Если давление снаружи больше, поршень будет двигаться внутрь, сжимая газ внутри, поскольку в системе совершается работа.
Если бы мы могли представить поршень без трения в цилиндре, то были бы три возможности, когда давление внутри равно, больше или меньше давления снаружи. Если давление внутри больше, газ внутри будет расширяться, двигая поршень и совершая работу с окружающей средой. Если давление снаружи больше, поршень будет двигаться внутрь, сжимая газ внутри, поскольку в системе совершается работа.
\(P_{ext} = P_{int}\) Система находится в равновесии, работа не совершается
\(P_{ext} > P_{int}\) Система сжимается и в системе совершается работа
\(P_{ext} < P_{int}\) Система расширяется, и работа выполняется в среде

Давление определяется как Сила на единицу площади \(P = \dfrac{F}{A}\), поэтому F=PA, и если внешнее давление на рисунке 5.1.5 больше, чем внутреннее давление, будет выполнена работа. на систему, вызывая ее сокращение на объем AΔh, поэтому ΔV = AΔh
\[w = F d = P_{ext}AΔh \]
Изменение объема цилиндра (ΔV) при движении поршня расстояние d равно ΔV = AΔh, как показано на рисунке 5.1.5. Таким образом, совершенная работа равна 93=\mathrm{newton\cdot m}=\textrm{joule}\]
Рисунок 5.1.5 Работа, выполняемая при изменении объема. Изменение объема (ΔV) цилиндра с поршнем равно ΔV = AΔh при движении поршня. Работа, совершаемая окружающей средой над системой при движении поршня внутрь, определяется выражением w = P ext ΔV. Вопрос о том, определяется ли работа как имеющая положительный или отрицательный знак, является предметом соглашения. В разделе 5.4 мы узнаем, что положительная работа или теплота определяется, когда работа или тепло добавляется к системе, которой в данном случае является газ в цилиндре. Таким образом, сжимающийся газ коррелирует с положительной работой (система получает энергию), а расширяющийся газ коррелирует с отрицательной работой, когда система совершает работу с окружающей средой. В приведенном выше случае ΔV < 0, но это относится к положительному рабочему потоку с добавлением энергии в систему. Таким образом, исходя из этого соглашения,
Таким образом, сжимающийся газ коррелирует с положительной работой (система получает энергию), а расширяющийся газ коррелирует с отрицательной работой, когда система совершает работу с окружающей средой. В приведенном выше случае ΔV < 0, но это относится к положительному рабочему потоку с добавлением энергии в систему. Таким образом, исходя из этого соглашения,
\[ w = −PΔV \]
Упражнение \(\PageIndex{3}\)
Система, содержащая газообразный кислород, нагревается при постоянном давлении 40,0 атм, так что ее объем увеличивается со 177 л до 458 л. количество работы, выполненной системой в килоджоулях.


 Если средняя кинетическая энергия поступательного движения молекулы кислорода равна 6,21·10–21 Дж, то плотность газа равна … кг/м3.
Если средняя кинетическая энергия поступательного движения молекулы кислорода равна 6,21·10–21 Дж, то плотность газа равна … кг/м3.
