| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | O | |
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | S | ||
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | K | |
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Фтор — Протоны — Нейтроны — Электроны
Фтор является самым легким галогеном и существует в виде высокотоксичного бледно-желтого двухатомного газа при стандартных условиях. Как самый электроотрицательный элемент, он чрезвычайно реактивен: почти все другие элементы, включая некоторые благородные газы, образуют соединения с фтором.
Как самый электроотрицательный элемент, он чрезвычайно реактивен: почти все другие элементы, включая некоторые благородные газы, образуют соединения с фтором.
Из-за затрат на очистку чистого фтора в большинстве коммерческих применений используются соединения фтора, при этом около половины добытого флюорита используется в сталелитейном производстве.
Фтор получают электролизом раствора гидродифторида калия в безводной плавиковой кислоте.
Протоны и нейтроны во фторе
Фтор — это химический элемент с атомным номером 9 , что означает, что в его ядре 9 протонов. Общее количество протонов в ядре называется атомным номером атома и обозначается символом Z . Таким образом, общий электрический заряд ядра равен +Ze, где e (элементарный заряд) равен 1602 x 10 -19 кулонов .
Общее число нейтронов в ядре атома называется числом нейтронов атома и обозначается символом N . Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Для стабильных элементов обычно используется множество стабильных изотопов. Изотопы — это нуклиды с одинаковым атомным номером и, следовательно, одним и тем же элементом, но различающиеся числом нейтронов. Массовые числа типичных изотопов Фтор равны 19.
Основные изотопы фтора
В природе в изобилии встречается только один изотоп фтора, стабильный изотоп 19F. Изотопы 17F и 18F претерпевают β+-распад и захват электронов, более легкие изотопы распадаются с испусканием протонов, а более тяжелые, чем 19F, подвергаются β-распаду (наиболее тяжелые с испусканием запаздывающих нейтронов).
Фтор-19 состоит из 9 протонов, 10 нейтронов и 9 электронов. Его изобилие составляет 100%; других изотопов фтора в значительных количествах не существует.
Фтор-18 состоит из 9 протонов, 9 нейтронов и 9 электронов. Из нестабильных нуклидов фтора 18F имеет самый длинный период полураспада, 109,739 минут. Он имеет две моды распада, из которых основной — позитронно-эмиссионный. По этой причине 18F является коммерчески важным источником позитронов.
Фтор-20 состоит из 9протонов, 11 нейтронов и 9 электронов. Фтор-20 — один из самых нестабильных изотопов фтора. Он имеет период полураспада 11,07 секунды и подвергается бета-распаду.
Стабильные изотопы
Типичные нестабильные изотопы
Электроны и электронная конфигурация
Количество электронов в электрически нейтральном атоме равно количеству протонов в ядре. Следовательно, число электронов в нейтральном атоме фтора равно 9. На каждый электрон действуют электрические поля, создаваемые положительным зарядом ядра и другими (Z – 1) отрицательными электронами в атоме.
Поскольку количество электронов и их расположение ответственны за химическое поведение атомов, атомный номер идентифицирует различные химические элементы. Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Электронная конфигурация Фтор : [He] 2s2 2p5 .
Возможные степени окисления -1 .
Фтор образует множество химических соединений, в которых он всегда принимает степень окисления −1. С другими атомами фтор образует либо полярные ковалентные связи, либо ионные связи. Чаще всего ковалентные связи с участием атомов фтора представляют собой одинарные связи, хотя существуют по крайней мере два примера связи более высокого порядка. Химия фтора включает неорганические соединения, образованные водородом, металлами, неметаллами и даже благородными газами; а также разнообразный набор органических соединений.
Типичное химическое соединение фтора
Конверсия урана один из процессов ядерного топливного цикла, в котором уран химически очищают и переводят в химическую форму гексафторида урана (UF 6 ) , исходное сырье для большинства промышленных предприятий по обогащению урана. Гексафторид урана , известный также как «hex» , представляет собой химическое соединение, используемое в процессе обогащения урана , в результате которого производится топливо для ядерных реакторов. При атмосферном давлении гексафторид урана возгоняется при 56,5 °С . На этой стадии цикла продукт конверсии гексафторида урана все еще имеет естественную изотопную смесь, т.е. содержит только 0,71% делящегося изотопа 235 U.
О протонах
дело. Во Вселенной протонов много, и они составляют примерно половины всей видимой материи. Он имеет положительный электрический заряд (+1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ / c 2 ) — немного легче, чем у нейтрона, но почти в 1836 раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и его спин — ½ фермиона.
Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и его спин — ½ фермиона.
Протоны существуют в ядрах обычных атомов вместе с их нейтральными аналогами, нейтронами. Нейтроны и протоны, обычно называемые нуклонами , связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
О нейтронах
Нейтрон – это одна из субатомных частиц, из которых состоит материя. Во Вселенной много нейтронов, составляющих больше половины всей видимой материи. У него нет электрического заряда , а масса покоя равна 1,67493 × 10−27 кг — немного больше, чем у протона, но почти 1839раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10–15 м или 0,8 фм и является фермионом со спином ½.
Атомные ядра состоят из протонов и нейтронов, которые притягиваются друг к другу ядерной силой , а протоны отталкиваются друг от друга электрической силой благодаря своему положительному заряду. Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .
Нейтроны стабилизируют ядро , потому что они притягивают друг друга и протоны , что помогает компенсировать электрическое отталкивание между протонами. В результате, по мере увеличения числа протонов для формирования стабильного ядра требуется возрастающее отношение нейтронов к числу протонов . Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распаду, бета-распаду или захвату электронов. Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующим выбросом гамма-излучения . Чистые альфа- или бета-распады очень редки.
Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующим выбросом гамма-излучения . Чистые альфа- или бета-распады очень редки.
Об электронах и электронной конфигурации
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях. Знание электронная конфигурация различных атомов полезна для понимания структуры периодической таблицы элементов.
Каждое твердое тело, жидкость, газ и плазма состоят из нейтральных или ионизированных атомов. Химические химические свойства атома определяются количеством протонов, фактически числом и расположением электронов . Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Это принцип Паули, который требует, чтобы электроны в атоме занимали разные энергетические уровни вместо того, чтобы все они конденсировались в основном состоянии. Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел. Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Первые два столбца в левой части таблицы Менделеева занимают s подоболочек. Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d — это средние 10 столбцов периодической таблицы, а блок f — это раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d — это средние 10 столбцов периодической таблицы, а блок f — это раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Электронная конфигурация может быть представлена в виде основных электронов, эквивалентных благородному газу предыдущего периода, и валентных электронов (например, [Xe] 6s2 для бария).
Степени окисления
Степени окисления обычно представляются целыми числами, которые могут быть положительными, нулевыми или отрицательными. Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Текущее определение степени окисления в Золотой книге ИЮПАК:
«Степень окисления атома — это заряд этого атома после ионной аппроксимации его гетероядерных связей…»
, и термин «степень окисления» является почти синонимом. Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Сводка
| Элемент | Фтор |
| Количество протонов | 9 |
| Число нейтронов (типичные изотопы) | 19 |
| Количество электронов | 9 |
| Электронная конфигурация | [Он] 2s2 2p5 |
| Степени окисления | -1 |
Источник: www.luciteria.com
Свойства других элементов
Другие свойства фтора
Сколько протонов, нейтронов и электронов имеет фтор?
Фтор является классифицированным самым легким галогенным элементом, и его символ F. Фтор – это 9й элемент периодической таблицы, поэтому его атомный номер равен 9.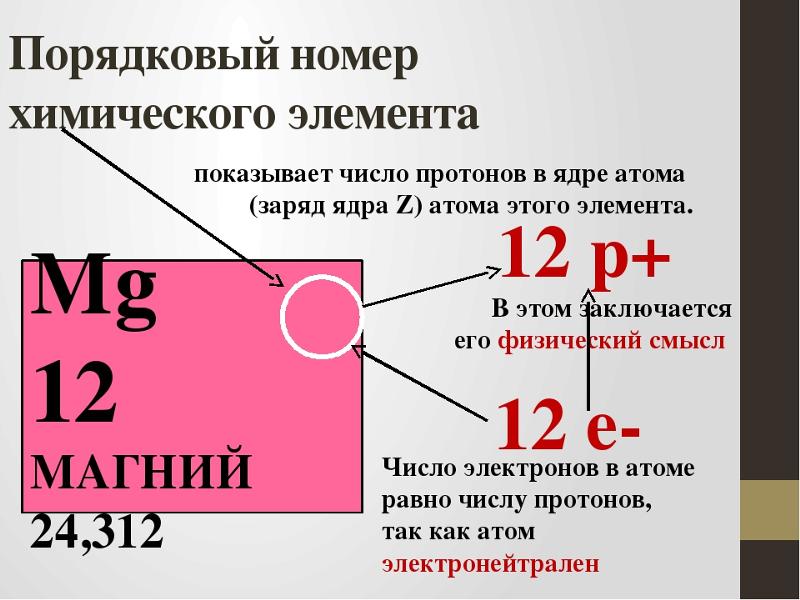 Атомный номер элемента равен количеству протонов и электронов в этом элементе.
Атомный номер элемента равен количеству протонов и электронов в этом элементе.
Следовательно, атом фтора имеет девять протонов и девять электронов. Количество нейтронов в атоме можно определить по разнице между массой атома и количеством протонов.
Разница между массовым числом атома фтора и числом протонов равна десяти. Следовательно, атом фтора имеет десять нейтронов. Количество нейтронов зависит от изотопа элемента. Атом фтора имеет один стабильный изотоп.
| Element Name | Fluorine |
| Symbol | F |
| Atomic number | 9 |
| Atomic weight (average) | 18.998 |
| Protons | 9 |
| Neutrons | 10 |
| Electrons | 9 |
| Group | 17 |
| Period | 2 |
| Block | p-block |
| Electrons per shell | 2, 7 |
| Electron configuration | [He] 2s 2 2p 5 |
| Oxidation states | -1 |
В этой статье подробно обсуждалось, как легко найти число протонов, нейтронов и электронов в атоме фтора.
Также обсуждаются положение электронов, протонов и нейтронов в атоме, число атомных масс и изотопы фтора. Надеюсь, после прочтения этой статьи вы узнаете подробности по этой теме.
Содержание
Где в атоме расположены электроны, протоны и нейтроны?
Атом – это мельчайшая частица элемента, которая не существует самостоятельно, но непосредственно участвует в химических реакциях как мельчайшая единица. Атомы настолько малы, что их невозможно увидеть даже под мощным микроскопом.
Диаметр атома водорода равен 0,1 нм (1,0 нм = 10 -9 м). Таким образом, если 1000 миллионов атомов водорода расположить рядом друг с другом, его длина составит 1 метр.
Атомная структура атомаОднако стало возможным обнаружить атомы, увеличив зрение очень мощного электронного микроскопа в два миллиона раз. В атоме существует множество постоянных и временных частиц.
Электроны, протоны и нейтроны находятся в атоме как постоянные частицы. Также нейтрино, антинейтрино, позитрон и масон находятся в атоме как временные частицы.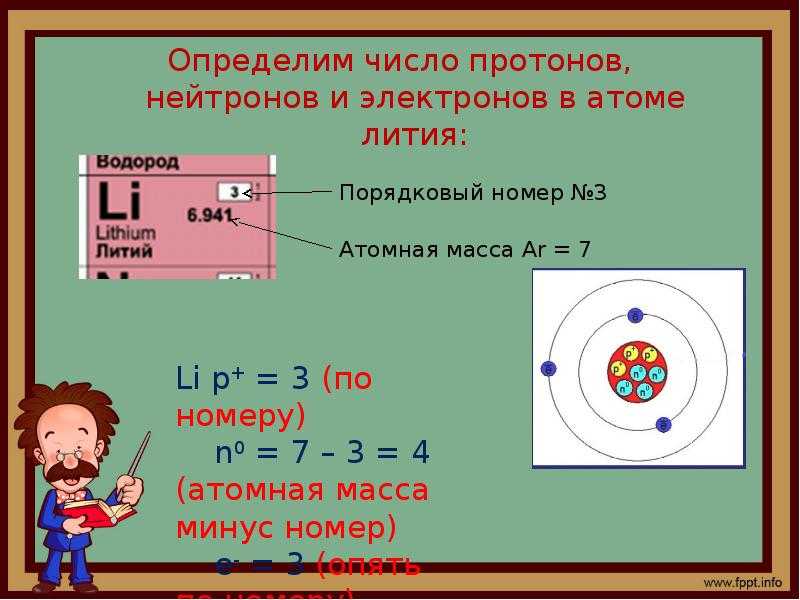
Атомы обычно можно разделить на две части. Один — ядро, а другой — орбита. Эксперименты разных ученых показали, что ядро атома содержит протоны и нейтроны.
Единственным исключением является водород, в ядре которого есть только протоны, но нет нейтронов. Электроны вращаются вокруг ядра по определенной орбите.
Как легко найти количество электронов, протонов и нейтронов в атоме фтора?
Ученый Генри Гвинн Джеффрис Мосл исследовал рентгеновский спектр различных элементов в период с 1913 по 1914 год. Результаты его экспериментов показывают, что каждый элемент имеет уникальное целое число, равное количеству положительных зарядов в ядре этого элемента.
Он назвал это число порядком атомов. Таким образом, количество положительных зарядов, присутствующих в ядре элемента, называется атомным номером этого элемента. Атомный номер элемента обозначается буквой «Z».
Этот номер равен порядковому номеру таблицы Менделеева. Мы знаем, что протоны находятся в ядре атома в виде положительного заряда.
То есть атомный номер это общее количество протонов. Атом в целом нейтрален по заряду. Следовательно, количество отрицательно заряженных электронов, обращающихся по своей орбите, равно количеству положительно заряженных протонов в ядре.
Атомный номер (Z) = количество зарядов в ядре (p)
Сколько протонов имеет атом фтора?
Протоны — постоянные частицы ядра атома. Он находится в центре или ядре атома. Когда атом водорода удаляет электрон со своей орбиты, оставшаяся положительно заряженная частица называется протоном. Следовательно, протон выражается как H + .
Относительная масса протонов равна 1, что примерно равно массе водорода (1,00757 а.е.м.). Однако фактическая масса протона составляет 1,6726 × 10 9 .0024 −27 кг. То есть масса протона примерно в 1837 раз больше массы электрона.
Протон — положительно заряженная частица. Его фактический заряд составляет +1,602 × 10 −19 кулонов. Диаметр протонной частицы составляет около 2,4 × 10 -13 см.
В периодической таблице 118 элементов, и 9-й из них — фтор. Элементы в периодической таблице расположены в соответствии с их атомным номером. Так как фтор 9й элемент периодической таблицы, атомный номер фтора равен 9.
Мы всегда должны помнить, что атомный номер и число протонов элемента равны. Следовательно, атом фтора содержит девять протонов.
Сколько электронов у атома фтора?
Электроны — постоянные частицы ядра атома. Он находится на определенной орбите атома и вращается вокруг ядра. Свойства элементов и их соединений зависят от электронной конфигурации.
В 1897 году ученый Дж. Дж. Томсон открыл существование электронов с помощью катодного исследования. Наименьшая из частиц постоянного ядра атома — это электрон. Его масса составляет примерно 1/1836 массы атома водорода.
Фактическая масса электрона составляет 9,1085 × 10 −28 г или 9,1093 × 10 −31 кг. Массой электрона часто пренебрегают, потому что эта масса слишком мала. Электроны всегда дают отрицательный заряд.
Электроны всегда дают отрицательный заряд.
Выражается e – . Заряд электронов составляет –1,609 × 10 –19 кулонов, а относительный заряд – –1. То есть заряд электрона равен заряду протона, но наоборот.
Мы также должны помнить, что количество протонов и электронов в элементе одинаково. Следовательно, атом фтора содержит на своей орбите девять электронов.
Сколько нейтронов у атома фтора?
Ученый Чедвик открыл нейтрон в 1932 году. Он находится в ядре в центре атома. Нейтрон является частицей с нейтральным зарядом и выражается через n.
Заряд нейтрона равен 0, и относительный заряд также равен 0. Масса нейтрона составляет 1,674 × 10 −27 кг. Количество электронов и протонов в атоме одинаково, но количество нейтронов разное.
Мы уже знаем, что ядро находится в центре атома. В ядре есть два типа частиц. Один из них представляет собой положительно заряженный протон, а другой — нейтрон с нейтральным зарядом.
Почти вся масса атома сосредоточена в ядре. Поэтому массу ядра называют атомной массой. Ядро состоит из протонов и нейтронов. Следовательно, атомная масса относится к общей массе протонов и нейтронов.
Атомная масса (A) = Масса ядра = Суммарная масса протонов и нейтронов (p + n)
Опять же, масса каждого протона и нейтрона составляет около 1 а.е.м. Поэтому общее число протонов и нейтронов называется атомным массовым числом. То есть число атомной массы (А) равно p + n
Таким образом, число нейтронов в элементе получается из разницы между числом атомных масс и числом атомов. То есть число нейтронов (n) = атомное массовое число (A) – атомное число (Z)
| Mass number (A) | Atomic number (Z) | Neutron number = A – Z |
| 19 (18.998) | 9 | 10 |
Мы знаем, что атомный номер фтора равен 9, а атомное массовое число около 19. Нейтрон = 19 – 9 = 10. Следовательно, атом фтора имеет десять нейтронов.
Нейтрон = 19 – 9 = 10. Следовательно, атом фтора имеет десять нейтронов.
Основываясь на атомном номере, массовом числе и числе нейтронов элемента, можно рассмотреть три вещи. Это изотоп, изобар и изотон. Количество нейтронов зависит от изотопа атома.
Количество протонов, электронов и нейтронов для фтораКак определить количество нейтронов по изотопам фтора?
Атомы, имеющие одинаковое количество протонов, но разные массовые числа, называются изотопами друг друга. Английский химик Фредерик Соди впервые выдвинул идею изотопов в 1912 году, а ученый Астон в 1919 году определил два атома неона с разными массами ( 20 Ne, 22 Ne).
Он назвал атомы с разными массами одного и того же элемента изотопами этого элемента. Количество протонов в атоме изотопа не меняется, но меняется количество нейтронов.
Количество протонов в атоме изотопа не меняется, но меняется количество нейтронов.
Атом фтора состоит из более чем девятнадцати изотопов. Такие как 13 F, 14 F, 15 F, 16 F, 17 F, 18 F, 1 F, 20 F, 21 F, 224 224 224 224 29 2924 9 F, 21 F, 224 224 224 224 224 29 29 2924 4 F, 21 F, 224 224 224 29 2924 20 F, 21 . F, 23 F, 24 F, 25 F, 26 F, 27 F, 28 F, 29 F, 30 F and 31 F.
| Изотоп | Mass number (A) | Atomic number (Z) | Neutron number = A – Z |
| 13 F | 13. 045120 045120 | 9 | 4 |
| 14 F | 14.034320 | 9 | 5 |
| 15 F | 15.017785 | 9 | 6 |
| 16 F | 16.011460 | 9 | 7 |
| 17 F | 17.00209524 | 9 | 8 |
| 18 F | 18.0009373 | 9 | 9 |
| 19 F | 18. 998403162 998403162 | 9 | 10 |
| 20 F | 19.99998125 | 9 | 11 |
| 21 F | 20.9999489 | 9 | 12 |
| 22 F | 22.002999 | 9 | 13 |
| 23 F | 23.003530 | 9 | 14 |
| 24 F | 24.008100 | 9 | 15 |
| 25 F | 25. 012170 012170 | 9 | 16 |
| 26 F | 26.020050 | 9 | 17 |
| 27 F | 27.026980 | 9 | 18 |
| 28 F | 28.035860 | 9 | 19 |
| 29 F | 29.043100 | 9 | 20 |
| 30 F | 30.052560 | 9 | 21 |
| 31 F | 31. 06020 06020 | 9 | 22 |
Среди изотопов 19 F стабилен и образуется естественным путем. Остальные изотопы фтора очень нестабильны, а их периоды полураспада очень короткие.
Из 19 радиоизотопов фтора самым долгоживущим является радиоизотоп 18 F, его период полураспада составляет 109,734 мин, а период полураспада всех остальных изотопов составляет менее минуты. Масса 19 F составляет около 19 (18,998403).
Сколько протонов, нейтронов и электронов имеет ион фтора (F
– )?Когда атом несет отрицательный или положительный заряд, принимая или отталкивая электроны, он называется ионом. Ионные свойства элементов зависят от обмена электронами.
В атомарном ионе изменяется только число электронов, но не изменяется число протонов и нейтронов. У фтора на последней орбите семь электронов.
Атомный номер, атомный вес и заряд фторид-иона Во время образования связи последняя оболочка атома фтора получает электрон и превращается в ион фтора (F – ). В этом случае атом фтора несет отрицательный заряд.
В этом случае атом фтора несет отрицательный заряд.
F + e – → F –
Здесь электронная конфигурация иона фтора (F – ) равна 1s 2 2s 2 2 24 900. Этот отрицательный ион фтора (F – ) имеет девять протонов, десять нейтронов и десять электронов.
Количество протонов и электронов для иона фтора (F – )Каковы свойства протонов, нейтронов и электронов?
| Name | Symbol | Relative Mass (amu) | Relative Charge | Actual Mass(kg) | Actual Charge(C) | Location |
| Протон | п | 1. 00757 00757 | +1 | 1.672×10 −27 | 1.602×10 −19 | Inside the nucleus |
| Neutron | n | 1.0089 | 0 | 1.674×10 − 27 | 0 | Inside the nucleus |
| Electron | e – | 5.488×10 −4 | –1 | 9.109×10 −31 | –1.6×10 –19 | Вне ядра |
Почему нам важно знать количество электронов и протонов?
Атомный номер — это число, которое несет в себе свойства элемента. Количество электронов и протонов в элементе определяется атомным номером. Также определяется точное положение элемента в периодической таблице.
Количество электронов и протонов в элементе определяется атомным номером. Также определяется точное положение элемента в периодической таблице.
Свойства элемента можно определить по электронной конфигурации. Кроме того, валентность, валентные электроны и ионные свойства элементов определяются электронной конфигурацией.
Чтобы определить свойства элемента, необходимо расположить электроны этого элемента. И чтобы расположить электроны, вы должны знать количество электронов в этом элементе.
Чтобы узнать количество электронов, вам нужно знать атомный номер этого элемента. Мы знаем, что в ядре элемента находится равное количество протонов с атомным номером, а электроны, равные протонам, находятся на орбите вне ядра.
Атомный номер (Z) = количество электронов
Атомный номер фтора равен 9. Итак, в атоме элемента фтора девять электронов. То есть по электронной конфигурации можно определить свойства фтора.
Электронная конфигурация фтора показывает, что на последней орбите семь электронов.
