Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Решено
Очень прошу Вашей помощи! 1) P + HNO3(конц) = HPO3 + 2) Mg + h3SO4(конц) = 3) Ni +HNO3(конц) = 4) KI + KMnO4 + HCLO4 = KIO3 + 5) K2S + KMnO4 + KOH = K2SO4 + 6) I2 + K2Cr2O7 + h3SO4 = HIO3 +
Решено
Написать уравнение реакции, с помощью которых можно осуществить следующие превращения: N2→ Li3N→ Nh4→ NO→ NO2 →HNO3
Осуществить превращение: этан←этен←ацетилен→бензол→нитробензол?
электронный баланс Nh4+O2=NO+h3O
Пользуйтесь нашим приложением
Гидроксид железа (II), характеристика, свойства и получение, химические реакции
Гидроксид железа (II), характеристика, свойства и получение, химические реакции.

Поделиться в:
Гидроксид железа (II) – неорганическое вещество, имеет химическую формулу Fe(OH)2.
Краткая характеристика гидроксида железа (II)
Физические свойства гидроксида железа (II)
Получение гидроксида железа (II)
Химические свойства гидроксида железа (II)
Химические реакции гидроксида железа (II)
Применение и использование гидроксида железа (II)
Краткая характеристика гидроксида железа (II):
Гидроксид железа (II) – неорганическое вещество белого цвета. Иногда имеет зеленоватый оттенок из-за примесей солей железа. Со временем на воздухе темнеет вследствие окисления, приобретая грязно-бурый цвет (цвет ржавчины).
Химическая формула гидроксида железа (II) Fe(OH)2.
Является одним из промежуточных соединений при ржавлении железа.
Не растворяется в воде и других растворителях. Растворимость в воде 5,2⋅10−5 г/100 мл.
Не горит. При нагревании разлагается на оксид железа (II,III) и водород.
Гидроксид железа (II) встречается в природе в виде минерала амакинита. Данный минерал содержит примеси магния и марганца (эмпирическая формула амакинита Fe0,7Mg0,2Mn0,1(OH)2). Цвет минерала амакинита жёлто-зелёный или светло-зелёный, твёрдость по Моосу 3,5-4, плотность 2,925—2,98 г/см³.
Физические свойства гидроксида железа (II):
| Наименование параметра: | Значение: |
| Химическая формула | Fe(OH)2 |
| Синонимы и названия иностранном языке | iron(II) hydroxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | белые или светло-зелёные тригональные кристаллы |
| Цвет | белый (иногда с зеленоватым оттенком), на воздухе со временем темнеет, приобретая грязно-бурый цвет. |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3400 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,4 |
| Температура разложения, °C | 150 |
| Гигроскопичность | отсутствует |
| Молярная масса, г/моль | 89,86 |
* Примечание:
— нет данных.
Получение гидроксида железа (II):
В лаборатории гидроксид железа (II) получается в результате следующих химических реакций:
- 1. в результате взаимодействия сульфата железа (II) с гидроксидом калия:
FeSO4 + 2KOH → Fe(OH)2 + K2SO4.
При этом гидроксид железа (II) выпадает в осадок.
- 2. в результате взаимодействия хлорида железа (II) и гидроксида калия:
FeCl2 + 2KOH → Fe(OH)2 + 2KCl.
При этом гидроксид железа (II) выпадает в осадок.
Гидроксид железа (II) получают при действии растворов щелочей на соли железа (II) без доступа воздуха.
- 3. в результате ржавления железа:
2Fe + 2Н2O + O2 → Fe(OH)2.
Данная реакция образование гидроксида железа (II) является одной из стадий ржавления железа. Реакция протекает медленно.
Химические свойства гидроксида железа (II). Химические реакции гидроксида железа (II):
Гидроксид железа (II) – слабое основание. Проявляет также и слабые амфотерные свойства, реагирует с концентрированными щелочами.
Химические свойства гидроксида железа (II) аналогичны свойствам гидроксидов других металлов. Поэтому для него характерны следующие химические реакции:
Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида железа (II) с ортофосфорной кислотой:
Fe(OH)2 + H3PO4 → Fe3(PO4)2 + 6H2O.
В результате реакции образуются фосфат железа (II) и вода. В качестве исходного вещества используется разбавленный раствор ортофосфорной кислоты.
2. реакция гидроксида железа (II) с азотной кислотой:
Fe(OH)2 + 2HNO3 → Fe(NO3)2 + 2H2O.
В результате реакции образуются нитрат железа (II) и вода. В качестве исходного вещества используется разбавленный раствор азотной кислоты.
Аналогично проходят реакции гидроксида железа (II) и с другими кислотами.
3. реакция гидроксида железа (II) с фтороводородом:
Fe(OH)2 + 2HF → FeF2 + 2H2O.
В результате реакции образуются фторид железа (II) и вода.
4. реакция гидроксида железа (II) с бромоводородом:
Fe(OH)2 + 2HBr → FeBr2 + 2H2O.
В результате реакции образуются бромид железа (II) и вода.
5. реакция гидроксида железа (II) с йодоводородом:
Fe(OH)2 + 2HI → FeI2 + 2H2O.
В результате реакции образуются йодид железа (II) и вода.
6. реакция гидроксида железа (II) с гидроксидом натрия:
Fe(OH)2 + 2NaOH → Na2[Fe(OH)4] (to).
В результате реакции образуется тетрагидроксоферрат (II) натрия. При этом в ходе реакции качестве исходного вещества используется гидроксид натрия в виде концентрированного раствора (концентрация более 50 %). Реакция протекает при кипении в атмосфере азота.
7. реакция гидроксида железа (II) с хлоридом аммония:
Fe(OH)2 + 2NH4Cl → FeCl2 + 2NH3 + 2H2O.
В результате реакции образуются хлорид железа (II), аммиак и вода. При этом в ходе реакции качестве исходного вещества используется концентрированный горячий раствор хлорида аммония.
8. реакция гидроксида железа (II) с бромидом аммония:
Fe(OH)2 + 2NH4Br → FeBr2 + 2NH3 + 2H2O.
В результате реакции образуются бромид железа (II), аммиак и вода. При этом в ходе реакции качестве исходного вещества используется концентрированный горячий раствор бромида аммония.
9. реакция гидроксида железа (II) с йодидом аммония:
Fe(OH)2 + 2NH4I → FeI2 + 2NH3 + 2H2O.
В результате реакции образуются йодид железа (II), аммиак и вода. При этом в ходе реакции качестве исходного вещества используется концентрированный горячий раствор йодида аммония.
10. реакция гидроксида железа (II) с кислородом:
4Fe(OH)2 + O2 → 4FeO(OH) + 2H2O (to).
В результате реакции образуются метагидроксид железа и вода. При этом в ходе реакции качестве исходного вещества используется гидроксид железа (II) в виде суспензии. Реакция протекает при кипении. Данная реакция также происходит (медленно) в процессе коррозии железа.
11. реакция гидроксида железа (II) с кислородом и водой:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3.
В результате реакции образуется гидроксида железа (III). Данная реакция также происходит (медленно) в процессе коррозии железа.
12. реакция гидроксида железа (II) с метагидроксидом железа:
2FeO(OH) + Fe(OH)2 → Fe3O4 + 2H2O (t = 600-1000 oС).
В результате реакции образуются оксид железа (II,III) и вода. Данная реакция также происходит (медленно) в процессе коррозии железа.
13. реакция термического разложения гидроксида железа (II):
Fe(OH)2 → FeO + H2O (t = 150-200 oC).
В результате реакции образуются оксид железа (II) и вода. Также образуются примеси: железо Fe, оксид железа (II,III) Fe3O4.
Применение и использование гидроксида железа (II):
Гидроксид железа (II) используется:
– при изготовлении активной массы железо-никелевых аккумуляторов.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
гидроксид железа (II) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида железа (II)
реакции с оксидом натрия
Коэффициент востребованности 11 426
3+}$ как типичный комплексный ион. Структура иона (октаэдрическая) представлена на диаграмме A ниже, а объяснение его кислотности дано на диаграмме B (из комплексных ионов металлов — кислотность ионов гексааква): Это объяснение дается представлением о том, что заряд иона 3+ полностью расположен на $\ce{Fe}$ в центре. Когда одна из неподеленных пар на $\ce{O}$ каждого $\ce{h3O}$ образует координационную связь с железом, можно визуализировать, что эти неподеленные пары сближаются к $\ce{Fe}$. Это влияет на электроны во всех связях $\ce{O-H}$ внутри комплекса (представьте, что все атомы $\ce{O}$ имеют частичный положительный заряд из-за этого движения электронов). Из-за этого электроны связей $\ce{O-H}$, в свою очередь, притягиваются к кислороду даже сильнее, чем обычно. Это делает каждое ядро $\ce{H}$ более открытым, чем обычно (по сравнению с молекулами $\ce{h3O}$ в растворе). Общий эффект заключается в том, что каждый из атомов $\ce{H}$ более положителен, чем в обычных молекулах воды. Таким образом, заряд 3+ больше не расположен полностью на $\ce{Fe}$, а распространяется по всему иону — большая его часть приходится на атомы водорода координированной воды. 93+}$ соответственно.
Когда одна из неподеленных пар на $\ce{O}$ каждого $\ce{h3O}$ образует координационную связь с железом, можно визуализировать, что эти неподеленные пары сближаются к $\ce{Fe}$. Это влияет на электроны во всех связях $\ce{O-H}$ внутри комплекса (представьте, что все атомы $\ce{O}$ имеют частичный положительный заряд из-за этого движения электронов). Из-за этого электроны связей $\ce{O-H}$, в свою очередь, притягиваются к кислороду даже сильнее, чем обычно. Это делает каждое ядро $\ce{H}$ более открытым, чем обычно (по сравнению с молекулами $\ce{h3O}$ в растворе). Общий эффект заключается в том, что каждый из атомов $\ce{H}$ более положителен, чем в обычных молекулах воды. Таким образом, заряд 3+ больше не расположен полностью на $\ce{Fe}$, а распространяется по всему иону — большая его часть приходится на атомы водорода координированной воды. 93+}$ соответственно.
Железо гидроксид (II), характеристика, свойства и получение, химические реакции
Железо гидроксид (II), характеристика, свойства и получение, химические реакции.

Гидроксид железа (II) представляет собой неорганическое вещество, имеющее химическую формулу Fe(OH)2.
Краткое описание гидроксида железа (II)
Физические свойства гидроксида железа (II)
Получение гидроксида железа (II)
Химические свойства гидроксида железа (II)
Химическая реакция гидроксида железа (II)
Применение и использование гидроксида железа (II)
Краткое описание Fe ( II):
Гидроксид железа (II) — неорганическое вещество белого цвета. Иногда имеет зеленоватый оттенок из-за примеси солей железа. Со временем воздух темнеет из-за окисления, приобретая грязно-коричневый цвет (цвет ржавчины).
Химическая формула Fe(II) Fe(OH)2.
Является одним из промежуточных соединений при ржавлении железа.
Не растворяется в воде и других растворителях. Растворимость в воде 5,2⋅10-5 г/100 мл.
Не горит. При нагревании разлагается на оксид железа (II,III) и водород.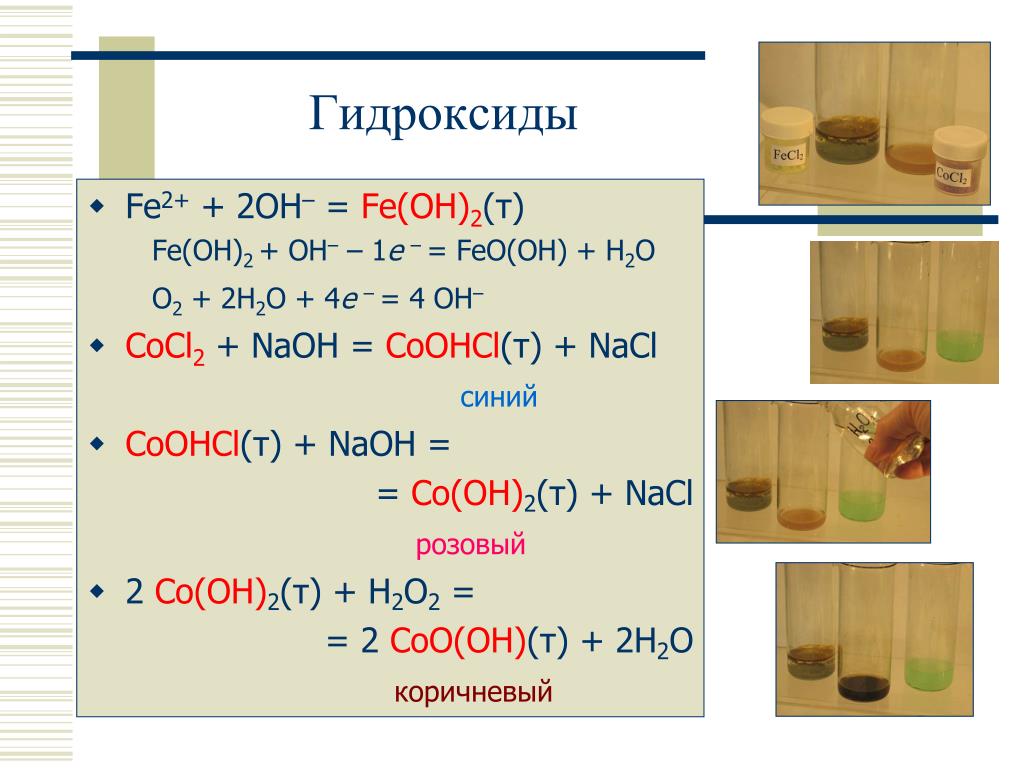
Гидроксид железа (II) встречается в природе в виде минерального макинита. Этот минерал содержит следы магния и марганца (эмпирическая формула Fe0 lacinita,7Mg0,2Mn0,1(OH)2). Цвет минерала макинита желто-зеленый или светло-зеленый, твердость по Моосу 3,5-4, плотность 2,9.25 — 2,98 г/см3.
Физические свойства гидроксида железа (II):
| Наименование параметра: | Значение: |
| Химическая формула | Fe(ОН)2 |
| Синонимы и названия иностранных языков | гидроксид железа(II) (англ.) |
| Тип вещества. | неорганический |
| Внешний вид | белые или светло-зеленые треугольные кристаллы |
| Цвет | белый (иногда с зеленоватым оттенком), а воздух со временем темнеет, приобретая грязно-бурый цвет. |
| Вкус | —* |
| Запах | — |
Агрегатное состояние (при 20 °С и атмосферном давлении 1 атм. ) ) | твердый |
| Плотность (состояние – твердое, при 20 °С), кг/м3 | 3400 |
| Плотность (состояние – твердое, при 20 °С) г/см3 | 3,4 |
| Температура разложения, °С | 150 |
| Гигроскопичность | отсутствует |
| Молярная масса, г/моль | 89,86 |
* Примечание:
— нет данных.
Получение гидроксида железа (II):
В лаборатории гидроксид железа (II) получают по следующим химическим реакциям:
1. взаимодействие сульфата железа (II) с гидроксидом калия:
FeSO4 + 2KOH → Fe(OH)2 + K2SO4.
Гидроксид железа (II) выпадает в осадок.
2. в результате взаимодействия хлорида железа (II) и гидроксида калия:
FeCl2 + 2KOH → Fe(OH)2 + 2KCl.
Гидроксид железа (II) выпадает в осадок.
Гидроксид железа (II) получают действием щелочей на соли железа (II) без доступа воздуха.
3. результат ржавления железа :
2Fe + 2Н2О + O2 → Fe(OH)2.
Данная реакция образования гидроксида железа (II) является одной из стадий коррозии железа. Реакция протекает медленно.
Химические свойства гидроксида железа (II). Химическая реакция гидроксида железа (II):
Гидроксид железа (II) – слабое основание. Также проявляет слабые амфотерные свойства, реагирует с концентрированными щелочами.
Химические свойства гидроксида железа (II) аналогичны свойствам гидроксидов других металлов. Так для него характерны следующие химические реакции:
1. реакция Fe(II) из фосфорной кислоты:
Fe(OH)2 + h4PO4 → Fe3(PO4)2 + 6h3O.
В результате реакции образуется фосфат железа (II) и вода. В качестве исходного материала используется разбавленный раствор ортофосфорной кислоты.
2. реакция Fe(II) с азотной кислотой:
Fe(OH)2 + 2HNO3 → Fe(NO3)2 + 2h3O.
В результате реакции образуется азотнокислое железо (II) и вода. В качестве исходного материала используется разбавленный раствор азотной кислоты.
Аналогично идут реакции Fe(II) и других кислот.
3. реакция Fe(II) с фтористым водородом:
Fe(OH)2 + 2HF → FeF2 + 2h3O.
В результате реакции образуется фторид железа (II) и вода.
4. реакция бромвалерата Fe(II):
Fe(OH)2 + 2HBr → FeBr2 + 2h3O.
В результате реакции образуются бромид, железо (II) и вода.
5. реакция Fe(II) йодовидона:
Fe(OH)2 + 2HI → FeI2 + 2h3O.
Реакция дает йодид железа (II) и воду.
6. реакция Fe(II) с гидроксидом натрия:
Fe(OH)2 + 2NaOH → Na2[Fe(OH)4] (к).
В результате реакции образуется тетрагидробиоптерин (II) натрия. В ходе реакции в качестве исходного сырья используют гидроксид натрия в виде концентрированного раствора (концентрация 50 %). Реакция протекает при кипячении с обратным холодильником в атмосфере азота.
Реакция протекает при кипячении с обратным холодильником в атмосфере азота.
7. реакция Fe(II) с хлоридом аммония:
Fe(OH)2 + 2Nh5Cl → FeCl2 + 2Nh4 + 2h3O.
В результате реакции образуются хлорид железа (II), аммиак и вода. В ходе реакции в качестве исходного вещества используют концентрированный горячий раствор хлорида аммония.
8. реакция гидроксида железа (II) бромида аммония:
Fe(OH)2 + 2Nh5Br → FeBr2 + 2Nh4 + 2h3O.
В результате реакции образуются бромид, железо (II), аммиак и вода. В ходе реакции в качестве исходного вещества используют концентрированный горячий раствор бромида аммония.
9. реакция гидроксида железа (II) йодистого аммония:
Fe(OH)2 + 2Nh5I → FeI2 + 2Nh4 + 2h3O.
В результате реакции образуются йодид железа (II), аммиак и вода. В ходе реакции в качестве исходного сырья используется концентрированный горячий раствор иодида аммония.
10. реакция Fe(II) с кислородом:
реакция Fe(II) с кислородом:
4Fe(OH)2 + O2 → 4FeO(OH) + 2h3O (к).
В результате реакции образовалась Метагалактика железа и воды. В ходе реакции в качестве исходного материала используют гидроксид железа (II) в виде суспензии. Реакция протекает при кипячении. Эта реакция также протекает (медленно) в процессе коррозии железа.
11. реакция Fe(II) с кислородом и водой:
4Fe(OH)2 + O2 + 2h3O → 4Fe(OH)3.
В результате реакции образуется гидроксид железа (III). Эта реакция также протекает (медленно) в процессе коррозии железа.
12. реакция Fe(II) метагалактики железо:
2FeO(OH) + Fe(OH)2 → Fe3O4 + 2h3O (t = 600-1000 oC).
В результате реакции образовались оксид железа (II,III) и вода. Эта реакция протекает (медленно) и в процессе коррозии железа.
13. реакция термического разложения гидроксида железа (II):
Fe(OH)2 → FeO + h3O (t = 150-200 oC).

 01.15
01.15