Условия протекания химических реакций — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Условия
протекания
химических
реакций
Из приведенного перечня определите
сильные и слабые электролиты:
h3SO4 , Cu (OH)2, h3CO3, K2SO4,
Mg(NO3)2, NiOH, NaOH, h3O
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ
h3SO4
K2SO4
Mg(NO3)2
NaOH
СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Cu (OH)2
h3CO3
NiOH
h3O
ДИССОЦИАЦИЯ ОСНОВАНИЙ,
КИСЛОТ,СОЛЕЙ
NaOH
+
Na
+
OH
h3SO4 2H+ + SO42Al2(SO4)3 2Al3+ + 3SO42-
Найдите среди предложенных
реакций реакции обмена:
Mg + HCl ?
Na2SO4 + Ba(NO3)2?
Zn(OH)2 ?
NaOH + HCl ?
SO3 + MgO ?
Реакции обмена:
K2CO3 + h3SO4
Na2SO4 + Ba(NO3)
NaOH + HCl
Определите ключевое понятие
сегодняшнего урока, используя
«лабиринт букв»
Ц И И С Р О А Н
К А И О О Г М Е
Р Е Б Н Н О Б К
ТЕМА УРОКА:
«РЕАКЦИИ
ИОННОГО
ОБМЕНА»
ТЕРМИНЫ
Ионы– это ?
положительно или отрицательно
заряженные частицы
Реакции ионного обмена– это ?
реакции между ионами.

Алгоритм составления
уравнений реакций ионного
обмена
Даны растворы хлорида железа(III) и
гидроксида калия. Написать
молекулярное и ионные уравнения
реакции между этими растворами.
1. Записать молекулярное уравнение реакции
FeCl3 + 3 KOH =
3 KCl + Fe(OH)3
расставить коэффициенты
2. Подчеркнуть сильные
электролитов (растворимые соли,
10!!! щелочей и 10!!! кислот)
FeCl3 + 3 KOH = 3 KCl + Fe(OH)3
FeCl3
KOH
KCl
Fe(OH)3
сильн
слаб
сильн сильн
FeCl3 + 3 KOH = 3KCl + Fe(OH)3
3. Написать полное ионное
уравнение реакции.
FeCl 3 + 3 KOH = 3 KCl + Fe(OH)3
Fe3+ + 3 Cl-+ 3 K+ + 3OH- = 3 K+ + 3 Cl- + Fe(OH)3
Необходимо учитывать индексы у ионов и
коэффициенты в уравнении реакции.
4. Для составления сокращённого ионного
уравнения надо найти одинаковые ионы справа
и слева от знака равенства и вычеркнуть их.
Fe3+ + 3 Cl- + 3 K+ + 3 OH- = 3 K+ + 3 Cl- + Fe(OH)3
5. Записать уравнение без вычеркнутых ионов.

Fe3+ + 3 OH- = Fe(OH)3
.
Реакции ионного обмена записывают
тремя уравнениями:
молекулярное
полное ионно-молекулярное
сокращенное ионно-молекулярное
ПРИЗНАКИ
ПРОТЕКАНГИЯ
РЕАКЦИИ
ИОННОГО
ОБМЕНА
Задание № 1
ВЫДЕЛЕНИЕ ГАЗА
• Молекулярное уравнение :
Na2CO3 + 2HCl = 2NaCl + h3O + CO2↑
2Na + + CO3 2– + 2H + + 2Cl –→ 2Na+ + CO2↑ +
h3O + 2Cl –
• Cокращенное ионное уравнение реакции:
CO3 2– + 2H + = CO2↑ + h3O
Вывод: реакция идет до конца.
Задание № 2.
ВЫПАДЕНИЕ ОСАДКА
• Молекулярное уравнение :
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
• Полное ионное уравнение реакции:
Cu 2+ + 2Cl – + 2Na + + 2OH –→ 2Na + + 2Cl – +
Cu(OH)2↓.
• Cокращённое ионное уравнение реакции:
Cu 2+ + 2OH –→ Cu(OH)2↓
Вывод: реакция идет до конца.
Задание № 3
ОБРАЗОВАНИЕ ВОДЫ
Молекулярное уравнение реакции щелочи с
кислотой:
NaOH + HCl → NaCl + h3O (слабый
электролит)
• Полное ионное уравнение реакции:
Na+ + OH– + H+ + Cl– →Na+ + Cl – + h3O
• Cокращённое ионное уравнение реакции:
H + + OH– → h3O
Вывод: реакция идет до конца.

Как называется реакция
взаимодействия сильной
кислоты с щелочью?
Реакция
нейтрализации
Задание № 4
ПРИЗНАКОВ НЕ НАБЛЮДАЕТСЯ
Молекулярное уравнение:
NaOH + KCl → NaCl + KOH
Полное ионное уравнение реакции :
Na + + OH– + K+ + Cl– → Na+ + Cl– + K+ + OH–
Вывод: РЕАКЦИЯ НЕ ИДЕТ, т.к. не
происходит связывания ионов.
.
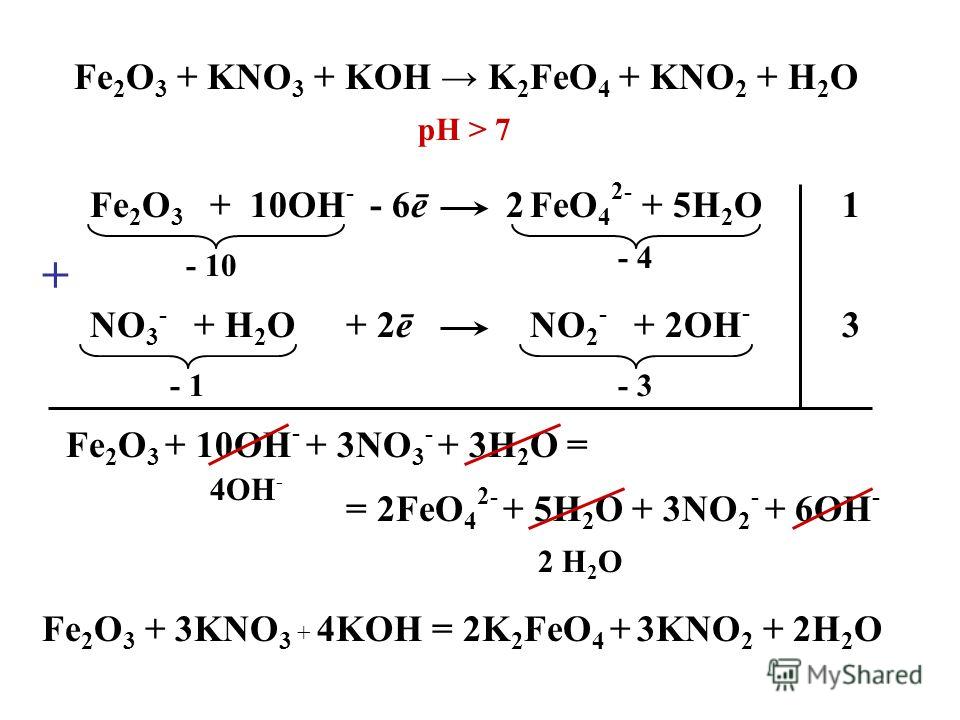
Условия протекания реакций
ионного обмена до конца
ОСАДОК
(МАЛОРАСТВОРИМОЕ
ВЕЩЕСТВО)
ГАЗ
СЛАБЫЙ ЭЛЕКТРОЛИТ
(ВОДА)
Тест «Проверь себя»:
1) Ионные реакции – это реакции между:
а) нейтральными атомами б) ионами
в) молекулами
г) протонами
2) Реакции нейтрализации – частный случай
реакции:
а) обмена
б) замещения
в) соединения г) разложения
3) Какое из приведенных веществ выпадает в
осадок:
а) MgS
б) KОН
в) HNO3
г) Na2SO4
.
4) Какое вещество надо добавить к
соляной кислоте, чтобы в результате
реакции выделился газ:
а) KOH
б) NaOH
в) Na2CO3
5) Какое вещество является
малодиссоциирующим:
а) h4PO4
б) KOH
в) Na2SO4
г) h3O
Ответы:
• 1.
 б
б• 2. а
• 3. а
• 4. в
• 5. г
РЕФЛЕКСИЯ
— Cегодня на уроке я
научилась(ся)……
— Мне было легко…
-Мне было сложно…
— Особенно интересным было…
Спасибо за работу!
English Русский Правила
Гидроксид железа (III) | CHEMEGE.RU
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например, хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
2Fe(OH)2 + H2O2 → 2Fe(OH)3
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например, хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов. Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
2FeBr3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + CO2↑ + 6NaBr
Но есть исключение! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
2FeCl3 + Na2SO3 + H2O = 2FeCl2 + Na2SO4 + 2HCl
Также допустима такая запись:
2FeCl3 + Na2SO3 + H2O = FeSO4 + 2NaCl + FeCl2 + 2HCl
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами.
Например, гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3HBr → FeBr3 + 3H2O
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
2Fe(OH)3 + 3SO3 → Fe2(SO4)3 + 3H2O
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например, гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
KOH + Fe(OH)3 → KFeO2 + 2H2O
4. Гидроксид железа (III) разлагается при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Понравилось это:
Нравится Загрузка. ..
..
KOH + FeCl3 = KCl + Fe(OH)3
| Поиск |
гидроксид калия + хлорид железа = хлорид калия + |
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| 124317000000-1.png» substance-weight=»56.10564 ± 0.00047″> КОН | + | 115233000000-download.png» substance-weight=»162.2040″> FeCl 3 | → | 130521000000-Untitled.png» substance-weight=»74.5513″> KCl | + | png» substance-weight=»106.8670″> Fe(OH) 3 | ||||
| potassium hydroxide | iron chloride | potassium Хлорид | ||||||||
| (Dung Dịch) | (Dung Dịch) | (RắN) | (KT) | (RắN) | (KT) | 0011 | ||||
| (không màu) | (vàng nâu) | (trắng) | (nâu đỏ) | |||||||
| 1 | 1 | 1 | 1 | Hệ Số | ||||||
| NGUYEN — Phân Tử KHốI (G/MOL) | ||||||||||
| Số MOL | ||||||||||
| KHốI LượNG (G) |
202 Рекламное объявление
Дополнительная информация об уравнении KOH + FeCl
3 → KCl + Fe(OH) 3В каких условиях КОН (гидроксид калия) реагирует с FeCl3 (хлоридом железа)?
Не найдено информации для этого химического уравнения
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием KCl (хлорид калия) и Fe(OH)3 () ?
FeCl3 реагирует с KOH
В полном предложении вы также можете сказать, что KOH (гидроксид калия) реагирует с FeCl3 (хлоридом железа) и производит KCl (хлорид калия) и Fe(OH)3 ()
Явление после реакции KOH (гидроксид калия) с FeCl3 (хлорид железа)
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Дополнительные вопросы, связанные с химическими реакциями KOH + FeCl
3 → KCl + Fe(OH) 3Вопросы, связанные с реагентом KOH (гидроксид калия)
Каковы химические и физические характеристики КОН (гидроксида калия)? В каких химических реакциях используется КОН (гидроксид калия) в качестве реагента?
Вопросы, связанные с реагентом FeCl3 (хлорид железа)
Каковы химические и физические характеристики FeCl3 (хлорид железа)? В каких химических реакциях используется FeCl3 (хлорид железа) в качестве реагента?
Вопросы, связанные с продуктом KCl (хлорид калия)
Каковы химические и физические характеристики KCl (хлорид железа)? Какие химические реакции происходят с KCl (хлоридом калия) в качестве продукта?
Вопросы, связанные с продуктом Fe(OH)3 ()
Каковы химические и физические характеристики Fe(OH)3 (хлорида железа)? Каковы химические реакции, в которых Fe(OH)3 () является продуктом?
Уравнения с КОН в качестве реагента
гидроксид калия
2KOH + Mg(NO 3 ) 2 → 2KNO 3 + Mg(OH) 2 KOH + FeCl 3 → KCl + Fe(OH) 3 2KOH + CH 3 NH 3 ХСО 3 → H 2 O + K 2 CO 3 + CH 3 NH 2 Просмотреть все уравнения с KOH в качестве реагента
Уравнения с FeCl3 в качестве реагента
хлорид железа
KOH + FeCl 3 → KCl + Fe(OH) 3 Mg + 2FeCl 3 → 2FeCl 2 + MgCl 2 Fe + 2FeCl 3 → 3FeCl 2 Просмотреть все уравнения с FeCl3 в качестве реагента
Рекламное объявление
Уравнения с FeCl3 в качестве продукта
хлорид железа
3CL 2 + 2FE → 2FECL 3
3FECL 2 + 4HNO 3 → 2H 2 O + NO + FE (№ 3 ) 3 + 2FECL (NO 3 ) 3 + 2FECL (NO 3 ) 3 + 2FECLECLEC 3 3 ) 3 3 3 ) 3 3 3 3 3 3 3 3 3 3 3 3 ) + 4HCl + KNO 3 → 2H 2 O + KCl + NO + FeCl 3 Просмотреть все уравнения с FeCl3 как произведениеУравнения с FeCl3 в качестве продукта
хлорид железа
3Cl 2 + 2Fe → 2FeCl 3 3FeCl 2 + 4HNO 3 → 2H 2 O + NO + Fe(NO 3 ) 3 + 2FeCl 3 3Cl 2 + 6Fe(NO 3 ) 2 → 4Fe(NO 3 ) 3 + 2FeCl 3 Просмотреть все уравнения с FeCl3 как произведение
koh+fecl3 → kcl+fe(oh)3Tất cả phương trình điều chế từ koh+fecl3 ra kcl+fe(oh)3
Тим Ким Пхонг Трин Хоа Хок |
| Тим Ким | Нхом Хок Мьен Пхи Онлайн Facebook | |||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: h3 O2 | ||||
Tổng hợp đầy đủ và chi tiết nhất can bằng phương trình điều chế từ koh+fecl3 ra kcl+fe(oh)3. Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học.
Đề Cương Ôn Thi & Bài Tập Trắc nghiệm
(Для версии 1.204.214 скачать бесплатно)
Những Điều Thú Vị Chỉ 5% Ngời Biet
Реклама
KOH + FeCl
3 → KCl + Fe(OH) 3Хонг ко
Xem trạng thái chất và chi tiết của phương trình KOH + FeCl3 => KCl + Fe(OH)3
Có 1 kết quả được tìm thấy
— Hiển thị kết quả từ 1 đến 1
Trang 1
Thông tin thêm về phương trình hóa học
Phản ứng cho KOH (кали гидроксит) tác dụng vói FeCl3 (Sắt triclorua) tạo thành KCl (кали clorua)
Phong trong tr chất KOH (kali hidroxit) (potassium hydroxide)
2NaOH + K 2 HPO 4 → 2KOH + Na 2 HPO 4 3C 2 H 4 + 4H 2 O + 2KMnO 4 → 2KOH + 2MnO 2 + 3C 2 H 4 (OH) 2 H 2 O + K 2 O → 2KOH
Phương trình đểo ra tể CHấT FECL3 (SắT TRICLORUA) (хлорид железа)
3CL 2 + 2FE → 2FECL 3 3FECL 2 + 4HNO 3 → 2H 2 O + FE + FE 3 → 2H 2 o + FE + FE + FE → 2H 2 .
