Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
Вычисли химическое количество соли, образовавшейся при взаимодействии соляной кислоты и 300 г раствора гидроксида натрия с массовой долей NaOH, равной 0,15
Выбрать особенности строения молекулы азота
Только концентрированная серная кислота реагирует со всеми веществами ряда: NaNO3,SO3,KBr MgCO3,Fe,BaCl2 Ca(OH)2,CaO,NaNO3 BaCl2,Ca(OH)2,Al2O3
Решено
Осуществить превращения: Cu-CuO-CuCl2-Cu(OH)2-CuO-Cu
Найди относительную молекулярную массу и определи формулу жира, в котором массовая доля углерода составляет 76,26 %, водорода — 12,23 %, а кислорода — 11,51 %.
Хлорид железа(III), FeCl3, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип
=892°C12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.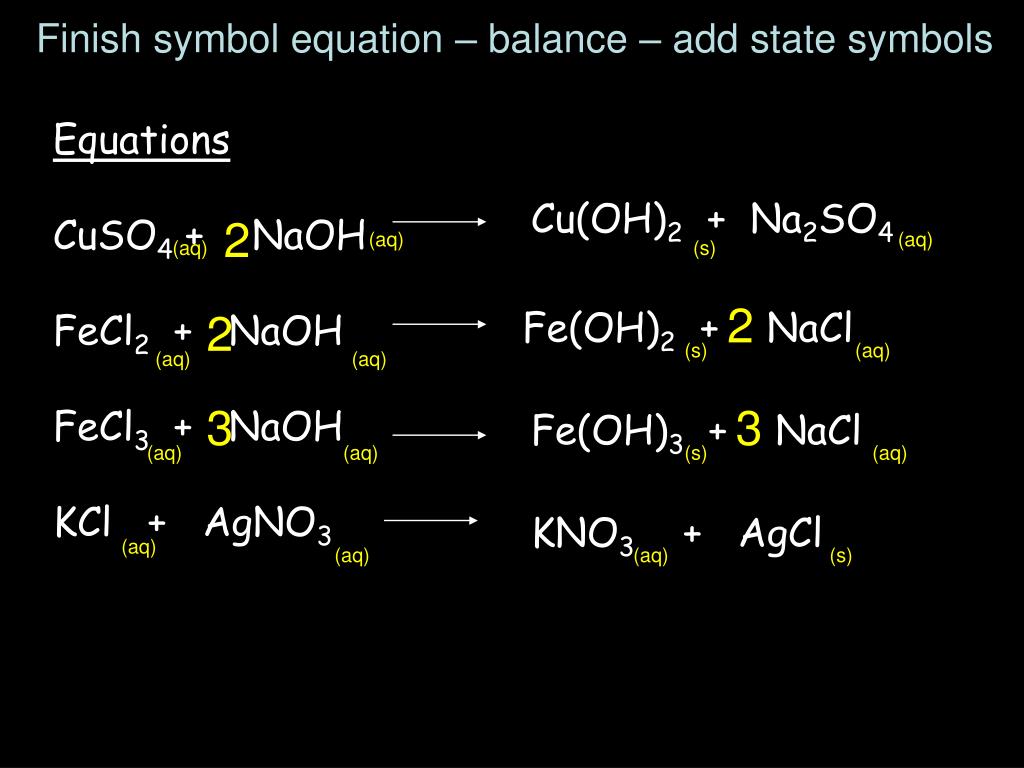
Чтобы получить подробное описание элемента, кликните по его названию.
окислительно-восстановительный потенциал. Почему раствор FeCl2 выглядит коричнево-желтым, как FeCl3?
спросил
Изменено 2 года, 7 месяцев назад
Просмотрено 10 тысяч раз
$\begingroup$
Если мы приготовим раствор $\ce{FeCl2}$, растворив твердый порошок $\ce{FeCl2}$ в воде, предположив, что бутылка с $\ce{FeCl2}$ оставлена открытой на достаточное время, возможно ли чтобы $\ce{FeCl2}$ окислился до $\ce{FeCl3}$? Я не могу найти подходящей реакции для этого, кроме той, которая включает $\ce{HCl}$, которого точно не было при приготовлении смеси.
- редокс
- экспериментальная химия
- водный раствор
- растворы
$\endgroup$
1
$\begingroup$
Желто-коричневый цвет, который вы видите в растворе $\ce{FeCl2}$, обусловлен образованием различных типов гидратированного оксида железа, а не хлорида железа(III). Они могут включать как безводный ($\ce{FeOOH}$), так и моногидрат ($\ce{FeOOH.h3O}$), часто называемый гидроксидом железа ($\ce{Fe(OH)3}$). Обычно они имеют цвет от желтого до коричневого. Реакция дана здесь:
Они могут включать как безводный ($\ce{FeOOH}$), так и моногидрат ($\ce{FeOOH.h3O}$), часто называемый гидроксидом железа ($\ce{Fe(OH)3}$). Обычно они имеют цвет от желтого до коричневого. Реакция дана здесь:
$$\ce{4FeCl2 + 6h3O + O2 → 4FeO(OH) + 8HCl}$$
Реакция между хлоридом железа (II), водой и кислородом(влагой) с образованием метагидроксид железа (оксид-гидроксид железа (III)) и хлороводород. Реакция протекает при рефлюкс.
Более того, при дальнейшем нагревании хлорида железа в кислороде при 450-480℃ образуется оксид железа.
Ссылки (все ссылки в формате pdf)
- http://www.jieas.com/fvolumes/vol081-5/3-5-11.pdf
- http://www.gfredlee.com/SurfaceWQ/StummOxygenFerrous.pdf 9\circ &= \pu{+0,40 В} \tag{R2}
\end{выравнивание}
$$
Таким образом, окисление железа(II) до ионов железа(III) возможно кислородом воздуха, так как общий потенциал клетки для реакции составляет $\pu{+1,171 V}$, и она происходит с разумно наблюдаемой скоростью .

$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
Баланс KMnO4 + HCl + FeCl2 = FeCl3 + MnCl2 + KCl + h3O
15 августа 2020 г.
 Трубка для обучения
Химическая реакция
0
Трубка для обучения
Химическая реакция
0KMnO4, HCl и FeCl2 являются реагентами вышеуказанной реакции. Но мы должны знать, что HCl в этой реакции создает кислую среду для реакции. Если мы рассмотрим степень окисления каждого из реагентов вышеупомянутой реакции, мы можем заметить, что между ионами реагентов происходит обмен электронами. Давайте сначала разберемся.
Обмен электрона между KMNO4, HCL и FECL2
Реакция-
KMNO 4 + HCL + FECL 2 = KCL + MNCL 2 + H 2 o + FECL 2 + H 2 o + FECL 2 + H 2 .
Если ориентироваться на степень окисления Mn (марганец) и Fe (железо),
KMn (7+) O 4 + HCl + Fe (2+) Cl 2 2 KCl + Mn (2+) Cl 2 + H 2 O + Fe (3+) Cl 3
Здесь Mn отдает 5 электронов, а Fe принимает только один электрон.
 Что это значит? Вы можете ответить на него? Да, ты прав. Реакция представляет собой реакцию электронного обмена, е.и. это окислительно-восстановительная реакция (окислительно-восстановительная реакция). Этот тип реакции очень легко уравновешивается ионно-электронным методом. Теперь мы узнаем, как использовать ионно-электронный метод для балансировки реакции.
Что это значит? Вы можете ответить на него? Да, ты прав. Реакция представляет собой реакцию электронного обмена, е.и. это окислительно-восстановительная реакция (окислительно-восстановительная реакция). Этот тип реакции очень легко уравновешивается ионно-электронным методом. Теперь мы узнаем, как использовать ионно-электронный метод для балансировки реакции.Реагенты реакции
Названия химических реагентов для окислительно-восстановительной реакции, о которой идет речь в этом посте, еще ниже.0005
- KMnO 4 = Перманганат калия , который является окислителем (как ион MnO 4 -1 6 )
- FeCl 2 = Хлорид железа(II) Восстановитель (в виде иона Fe 2+ )
- HCl = Соляная кислота (создает кислую среду)
Перманганат калия реагирует в
соляной кислоте с железом(II) ХлоридРеакция скелета калий перманганат и Железо (II) хлорид в гидрохлорной кислоте ( кмно4 + HCL + FECL2 ) IS
KMNO4 + HCL + FECL2
) IS 9 0005KMNO4 + HCL + FECL2
) IS 9 0005KMNO4 + HCL + FECL2
) IS 9 0005KMNO4 + HCL + FECL2
). = KCl + MnCl 2 + H 2 O + FeCl 3
= KCl + MnCl 2 + H 2 O + FeCl 3 Половина реакции окисления
Здесь Fe (2+) отдает один электрон, поэтому степень окисления железа становится +3. Отдача электрона химическим веществом называется реакцией окисления. Таким образом, полуреакция окисления для приведенной выше реакции должна быть следующей:0005
⇒ FE 2+ — E — = Fe 3+ ……… (1)
Результат Половина реакции
MN (7+) Пятитеки из -за восстановления с красотыми агентами. и в реакции превращается в Mn (2+) . Так как окисление происходит одновременно с реакцией восстановления в любой окислительно-восстановительной реакции. Поэтому тот же самый электрон, который отдает железо, Mn принимает. Следовательно, полуреакция восстановления:
⇒ MnO 4 -1 + 5e – + 8H + = 4H 2 O + Mn 2- … ….
 …. …. (3)
…. …. (3) Теперь окислитель высвобождает 5 электронов, с другой стороны, восстановитель принимает только один электрон за раз. Таким образом, восстановитель FeCl 2 Хлорид железа (II) требуется в пять раз больше, чем окислитель KMnO 4 (перманганат калия) . Это означает уравнение (1)x5.
После этого мы добавляем обе полуреакции ( Уравнение полуреакции окисления 1 и Уравнение полуреакции восстановления 2 ), чтобы получить полную реакцию окисления-восстановления (редокс) реакцию.
MNO 4 -1 + 5E — + 8H + = MN 2- + 4H 2 O
5FE 2 ZAT 3+
MnO 4 -1 + 8H + + 5FE 2+ = MN 2- + 5FE 3+ + 4H 2 O
DO, вы помните, что мы исключили K + 99
.

- KMnO 4 = Перманганат калия , который является окислителем (как ион MnO 4 -1 6 )

 05.20
05.20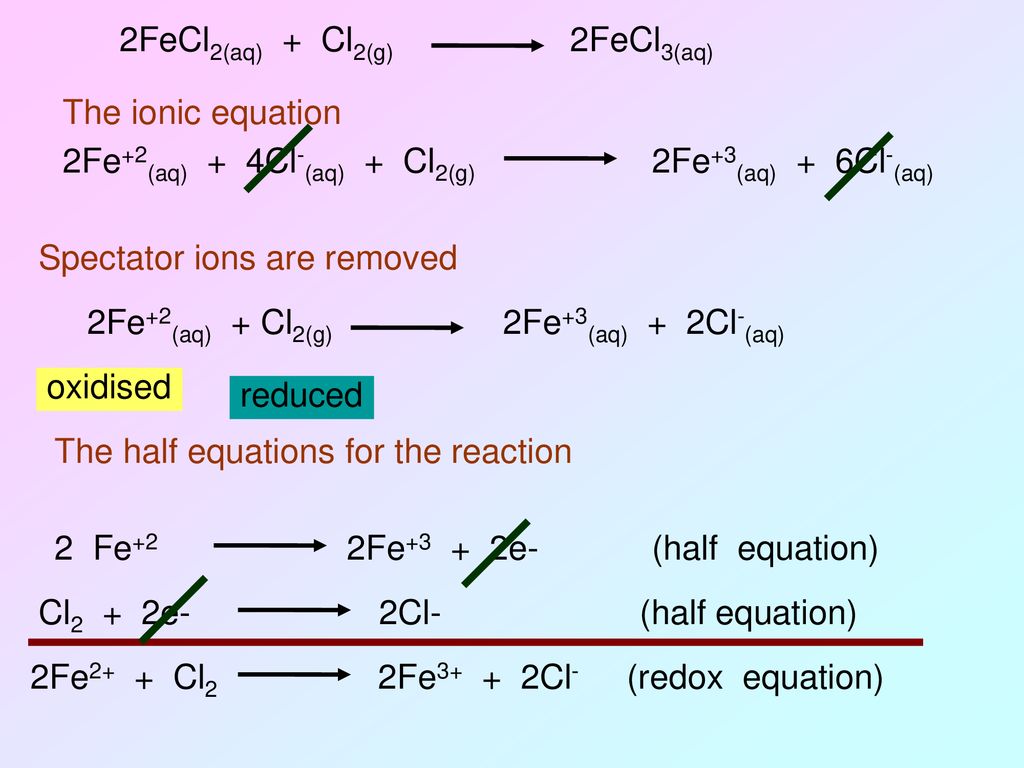
 Трубка для обучения
Химическая реакция
0
Трубка для обучения
Химическая реакция
0 Что это значит? Вы можете ответить на него? Да, ты прав. Реакция представляет собой реакцию электронного обмена, е.и. это окислительно-восстановительная реакция (окислительно-восстановительная реакция). Этот тип реакции очень легко уравновешивается ионно-электронным методом. Теперь мы узнаем, как использовать ионно-электронный метод для балансировки реакции.
Что это значит? Вы можете ответить на него? Да, ты прав. Реакция представляет собой реакцию электронного обмена, е.и. это окислительно-восстановительная реакция (окислительно-восстановительная реакция). Этот тип реакции очень легко уравновешивается ионно-электронным методом. Теперь мы узнаем, как использовать ионно-электронный метод для балансировки реакции. = KCl + MnCl 2 + H 2 O + FeCl 3
= KCl + MnCl 2 + H 2 O + FeCl 3  …. …. (3)
…. …. (3) 