Первый закон термодинамики — материалы для подготовки к ЕГЭ по Физике
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
Начнём с обсуждения работы газа.
Газ, находящийся в сосуде под поршнем, действует на поршень с силой , где — давление газа, — площадь поршня. Если при этом поршень перемещается, то газ совершает работу.
При расширении газа эта работа будет положительной (сила давления газа и перемещение поршня направлены в одну сторону). При сжатии работа газа отрицательна (сила давления газа и перемещение поршня направлены в противоположные стороны).
Работа газа в изобарном процессе
Предположим, что газ расширяется при постоянном давлении . Тогда сила , с которой газ действует на поршень, также постоянна. Пусть поршень переместился на расстояние (рис. 1).
1).
Рис. 1.
Работа газа равна:
Но — изменение объёма газа. Поэтому для работы газа при изобарном расширении мы получаем формулу:
(1)
Если и — начальный и конечный объём газа, то для работы газа имеем: . Изобразив данный процесс на -диаграмме, мы видим, что работа газа равна площади прямоугольника под графиком нашего процесса (рис. 2).
Рис. 2. Работа газа как площадь
Пусть теперь газ изобарно сжимается от объёма до объёма . С помощью аналогичных рассуждений приходим к формуле:
Но , и снова получается формула (1).
Работа газа опять-таки будет равна площади под графиком процесса на -диаграмме, но теперь со знаком минус.
Итак, формула выражает работу газа при постоянном давлении — как в процессе расширения газа, так и в процессе сжатия.
Работа газа в произвольном процессе
Геометрическая интерпретация работы газа (как площади под графиком процесса на -диаграмме) сохраняется и в общем случае неизобарного процесса.
Действительно, рассмотрим малое изменение объёма газа — настолько малое, что давление будет оставаться приблизительно постоянным. Газ совершит малую работу . Тогда работа газа во всём процессе найдётся суммированием этих малых работ:
Но данный интеграл как раз и является площадью криволинейной трапеции (рис. 3):
Рис. 3. Работа газа как площадь
Работа, совершаемая над газом
Наряду с работой , которую совершает газ по передвижению поршня, рассматривают также работу , которую поршень совершает над газом.
Если газ действует на поршень с силой , то по третьему закону Ньютона поршень действует на газ с силой , равной силе по модулю и противоположной по направлению: (рис. 4).
Рис. 4. Внешняя сила , действующая на газ
Следовательно, работа поршня равна по модулю и противоположна по знаку работе газа:
Так, в процессе расширения газ совершает положительную работу ; при этом работа, совершаемая над газом, отрицательна .
Будьте внимательны: если в задаче просят найти работу, совершённую над газом, то имеется в виду работа .
Как мы знаем, существует лишь два способа изменения внутренней энергии тела: теплопередача и совершение работы.
Опыт показывает, что эти способы независимы — в том смысле, что их результаты складываются. Если телу в процессе теплообмена передано количество теплоты , и если в то же время над телом совершена работа , то изменение внутренней энергии тела будет равно:
(2)
Нас больше всего интересует случай, когда тело является газом. Тогда (где , как всегда, есть работа самого газа). Формула (2) принимает вид: , или
(3)Соотношение (3) называется первым законом термодинамики. Смысл его прост: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа и на совершение газом работы.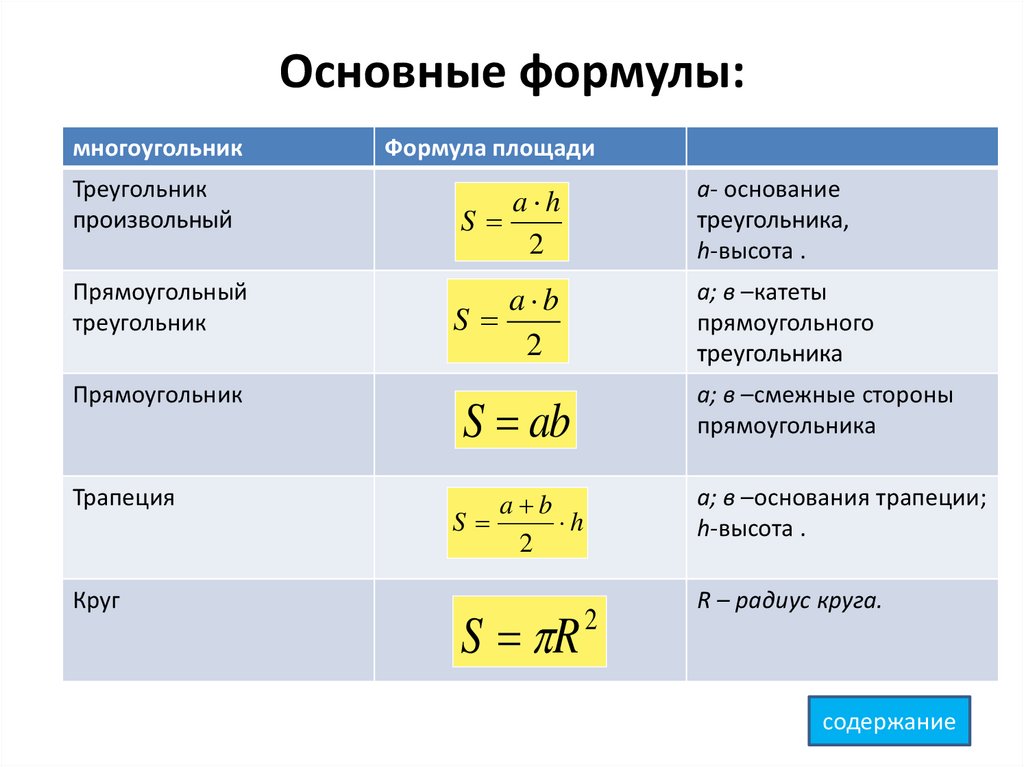
Напомним, что величина может быть и отрицательной: в таком случае тепло отводится от газа. Но первый закон термодинамики остаётся справедливым в любом случае. Он является одним из фундаментальных физических законов и находит подтверждение в многочисленных явлениях и экспериментах.
Применение первого закона термодинамики к изопроцессам
Напомним, что в изопроцессе остаётся неизменным значение некоторой величины, характеризующей состояние газа — температуры, объёма или давления. Для каждого вида изопроцессов запись первого закона термодинамики упрощается.
1. Изотермический процесс, .
Внутренняя энергия идеального газа зависит только от его температуры. Если температура газа не меняется, то не меняется и внутренняя энергия: . Тогда формула (3) даёт:
Всё подведённое к газу тепло идёт на совершение газом работы.
2. Изохорный процесс, .
Если объём газа остаётся постоянным, то поршень не перемещается, и потому работа газа равна нулю: . Тогда первый закон термодинамики даёт:
Тогда первый закон термодинамики даёт:
Всё тепло, переданное газу, идёт на изменение его внутренней энергии.
3. Изобарный процесс, .
Подведённое к газу тепло идёт как на изменение внутренней энергии, так и на совершение работы (для которой справедлива формула (1)). Имеем:
Адиабатный процесс
Процесс называется адиабатным, если он идёт без теплообмена с окружающими телами.
Адиабатный процесс совершается газом, находящимся в теплоизолированном сосуде. Такой сосуд препятствует всем видам теплопередачи: теплопроводности, конвекции, излучению. Пример теплоизолированного сосуда — термос.
Приблизительно адиабатным будет всякий процесс, протекающий достаточно быстро: в течение процесса теплообмен просто не успевает произойти.
При адиабатном процессе . Из первого закона термодинамики получаем: , или .
В процессе адиабатного расширения газ совершает положительную работу, поэтому (работа совершается за счёт убыли внутренней энергии). Следовательно, газ охлаждается. Если заставить газ совершить достаточно большую работу, охладить его можно весьма сильно. Именно на этом основаны методы сжижения газов.
Следовательно, газ охлаждается. Если заставить газ совершить достаточно большую работу, охладить его можно весьма сильно. Именно на этом основаны методы сжижения газов.
Наоборот, в процессе адиабатного сжатия будет , поэтому : газ нагревается. Адиабатное нагревание воздуха используется в дизельных двигателях для воспламенения топлива.
Кривая, изображающая ход адиабатного процесса, называется
Рис. 5. Сравнительный ход изотермы и адиабаты
В обоих процессах давление убывает с увеличением объёма, но в адиабатном процессе убывание идёт быстрее. Почему?
При изотермическом расширении давление падает потому, что уменьшается концентрация частиц газа, в результате чего удары частиц по стенкам сосуда становятся реже. Однако интенсивность этих ударов остаётся прежней: ведь температура газа не меняется — значит, не меняется и средняя кинетическая энергия его частиц.
А при адиабатном расширении, наряду с уменьшением концентрации частиц, падает также и температура газа. Удары частиц становятся не только более редкими, но и более слабыми. Вот почему адиабата убывает быстрее изотермы.
Молекулярная физика: основные формулы определения количества вещества, термодинамики и давления газа
Молекулярная физика изучает свойства тел, руководствуясь поведением отдельных молекул. Все видимые процессы протекают на уровне взаимодействия мельчайших частиц, то, что мы видим невооруженным глазом — лишь следствие этих тонких глубинных связей….
Содержание
Основные понятия
Молекулярная физика иногда рассматривается как теоретическое дополнение термодинамики. Возникшая намного раньше, термодинамика занималась изучением перехода тепла в работу, преследуя чисто практические цели. Она не производила теоретического обоснования, описывая лишь результаты опытов. Основные понятия молекулярной физики возникли позже, в XIX веке.
Она изучает взаимодействие тел на молекулярном уровне, руководствуясь статистическим методом, который определяет закономерности в хаотических движениях минимальных частиц – молекул. Молекулярная физика и термодинамика дополняют друг друга, рассматривая процессы с разных точек зрения. При этом термодинамика не касается атомарных процессов, имея дело только с макроскопическими телами, а молекулярная физика, напротив, рассматривает любой процесс именно с точки зрения взаимодействия отдельных структурных единиц.
Молекулярная физика и термодинамика дополняют друг друга, рассматривая процессы с разных точек зрения. При этом термодинамика не касается атомарных процессов, имея дело только с макроскопическими телами, а молекулярная физика, напротив, рассматривает любой процесс именно с точки зрения взаимодействия отдельных структурных единиц.
Все понятия и процессы имеют собственные обозначения и описываются специальными формулами, которые наиболее наглядно представляют взаимодействия и зависимости тех или иных параметров друг от друга. Процессы и явления пересекаются в своих проявлениях, разные формулы могут содержать одни и те же величины и быть выражены разными способами.
Количество вещества
Количество вещества определяет взаимосвязь между весом (массой) и количеством молекул, которые содержит эта масса. Дело в том, что разные вещества при одинаковой массе имеют разное число минимальных частиц. Процессы, проходящие на молекулярном уровне, могут быть поняты только при рассмотрении именно числа атомных единиц, участвующих во взаимодействиях. Единица измерения количества вещества, принятая в системе СИ, — моль.
Единица измерения количества вещества, принятая в системе СИ, — моль.
Внимание! Один моль всегда содержит одинаковое количество минимальных частиц. Это число называется числом (или постоянной) Авогадро и равняется 6,02×1023.
Эта константа используется в случаях, когда для расчетов требуется учитывать микроскопическое строение данного вещества. Иметь дело с количеством молекул сложно, так как придется оперировать огромными числами, поэтому используется моль – число, определяющее количество частиц в единице массы.
Формула, определяющая количество вещества:
Расчет количества вещества производится в разных случаях, используется во многих формулах и является важным значением в молекулярной физике.
Давление газа
Давление газа — важная величина, имеющая не только теоретическое, но и практическое значение. Рассмотрим формулу давления газа, используемую в молекулярной физике, с пояснениями, необходимыми для лучшего понимания.
Для составления формулы придется сделать некоторые упрощения. Молекулы представляют собой сложные системы, имеющие многоступенчатое строение. Для простоты рассмотрим газовые частицы в определенном сосуде как упругие однородные шарики, не взаимодействующие друг с другом (идеальный газ).
Скорость движения минимальных частиц также будем считать одинаковой. Введя такие упрощения, не сильно меняющие истинное положение, можно вывести такое определение: давление газа — это сила, которую оказывают удары молекул газа на стенки сосудов.
При этом, учитывая трехмерность пространства и наличие двух направлений каждого измерения, можно ограничить количество структурных единиц, воздействующих на стенки, как 1/6 часть.
Таким образом, сведя воедино все эти условия и допущения, можем вывести формулу давления газа в идеальных условиях.
Формула выглядит так:
где P — давление газа,
n — концентрация молекул,
K — постоянная Больцмана (1,38×10-23),
Ek — кинетическая энергия молекул газа.
Существует еще один вариант формулы:
P = nkT,
где n — концентрация молекул,
T — абсолютная температура.
Формула объема газа
Объем газа — это пространство, которое занимает данное количество газа в определенных условиях. В отличие от твердых тел, имеющих постоянный объем, практически не зависящий от окружающих условий, газ может менять объем в зависимости от давления или температуры.
Формула объема газа – это уравнение Менделеева-Клапейрона, которое выглядит таким образом:
PV = nRT
где P — давление газа,
V — объем газа,
n — число молей газа,
R — универсальная газовая постоянная,
T — температура газа.
Путем простейших перестановок получаем формулу объема газа:
Важно! Согласно закону Авогадро равные объемы любых газов, помещенные в совершенно одинаковые условия — давление, температура — будут всегда содержать равное количество минимальных частиц.
Кристаллизация
Кристаллизация — это фазовый переход вещества из жидкого в твердое состояние, т. е. процесс, обратный плавлению. Процесс кристаллизации происходит с выделением теплоты, которую требуется отводить от вещества. Температура совпадает с точкой плавления, весь процесс описывается формулой:
е. процесс, обратный плавлению. Процесс кристаллизации происходит с выделением теплоты, которую требуется отводить от вещества. Температура совпадает с точкой плавления, весь процесс описывается формулой:
Q = λm,
где Q — количество теплоты,
λ — теплота плавления,
M — масса.
Эта формула описывает как кристаллизацию, так и плавление, поскольку они, по сути, являются двумя сторонами одного процесса. Для того чтобы вещество кристаллизовалось, необходимо охладить его до температуры плавления, а затем отвести количество тепла, равное произведению массы на удельную теплоту плавления (λ). Во время кристаллизации температура не меняется.
Существует еще один вариант понимания этого термина — кристаллизация из перенасыщенных растворов. В этом случае причиной перехода становится не только достижение определенной температуры, но и степень насыщения раствора определенным веществом. На определенном этапе количество частиц растворенного вещества становится слишком большим, что вызывает образование мелких монокристалликов. Они присоединяют молекулы из раствора, производя послойный рост. В зависимости от условий роста кристаллы имеют различную форму.
Они присоединяют молекулы из раствора, производя послойный рост. В зависимости от условий роста кристаллы имеют различную форму.
Число молекул
Определить количество частиц, содержащееся в данной массе вещества, проще всего при помощи следующей формулы:
Отсюда выходит, что число молекул равняется:
То есть необходимо прежде всего определить количество вещества, приходящееся на определенную массу. Затем оно умножается на число Авогадро, в результате чего получаем количество структурных единиц. Для соединений подсчет ведется суммированием атомного веса компонентов. Рассмотрим простой пример:
Определим количество молекул воды в 3 граммах. Формула воды (h3O) содержит два атома водорода и один кислорода. Общий атомный вес минимальной частицы воды составит: 1+1+16 = 18 г/моль.
Количество вещества в 3 граммах воды:
3:18= 1/6.
Число молекул:
1/6 × 6 × 1023 = 1023.
Формула массы молекулы
Один моль всегда содержит одинаковое количество минимальных частиц. Следовательно, зная массу моля, можно разделить ее на количество молекул (число Авогадро), получив в результате массу системной единицы.
Следовательно, зная массу моля, можно разделить ее на количество молекул (число Авогадро), получив в результате массу системной единицы.
Следует учесть, что эта формула относится лишь к неорганическим молекулам. Размеры органических молекул намного больше, их величина или вес имеют совсем другие значения.
Молярная масса газа
Молярная масса — это масса в килограммах одного моля вещества. Поскольку в одном моле содержится одинаковое количество структурных единиц, формула молярной массы имеет такой вид:
M = κ × Mr
где k — коэффициент пропорциональности,
Mr — атомная масса вещества.
Молярная масса газа может быть рассчитана по уравнению Менделеева-Клапейрона:
pV = mRT / M,
из которой можно вывести:
M = mRT / pV
Таким образом, молярная масса газа прямо пропорциональна произведению массы газа на температуру и универсальную газовую постоянную и обратно пропорциональна произведению давления газа и его объема.
Внимание! Следует учесть, что молярная масса газа как элемента может отличаться от газа как вещества, например, молярная масса элемента кислорода (О) равна 16 г/моль, а масса кислорода как вещества (О2) равна 32 г/моль.
Основные положения МКТ.
Физика за 5 минут молекулярная физика
Вывод
Формулы, которые содержат молекулярная физика и термодинамика, позволяют вычислить количественные значения всех процессов, происходящих с твердыми веществами и газами. Такие расчеты необходимы как в теоретических изысканиях, так и на практике, поскольку они способствуют решению практических задач.
Формула мощности – определение, преимущества, примеры, взаимосвязь
Формулы физики
Большинству вещей вокруг нас требуется некоторая сила, чтобы эффективно функционировать. Здесь слово мощность относится ко всему, что обеспечивает необходимую силу или энергию для правильной работы чего-либо. Например, многие устройства, такие как мобильные телефоны, компьютеры, вентиляторы и т. д., работают от электричества; если мы не зарядим аккумулятор телефона, он выключится. Точно так же, если в доме нет электричества, вентилятор не может работать. Энергией для таких устройств является, следовательно, электричество. Эта власть также может быть в других формах, таких как физические или человеческие ресурсы.
| Содержание |
|
Способность выполнять определенную работу известна как Энергия. Энергия, затрачиваемая на выполнение работы в единицу времени, называется мощностью. Он представлен как P.
Энергия, затрачиваемая на выполнение работы в единицу времени, называется мощностью. Он представлен как P.
Формула мощности
P = F × с/т
Как известно,
Мощность = работа, выполненная за время
P = вес/т
Работа = Сила ( F ) × Смещение (с)
P = F × с/т
Здесь,
П = Мощность.
F = сила, приложенная к телу.
W = работа, совершенная телом.
t = общее время.
s = полное перемещение тела.
Преимущества формулы Power
Формула мощности дает много преимуществ, таких как
- Формула мощности помогает нам определить работу, выполненную конкретным объектом или человеком в определенное время.
- Это помогает определить, какой объект более эффективен, а какой менее эффективен. Например, если x и y выполняют одну и ту же задачу, и x завершает ее за 3 часа, а y выполняет ту же задачу за 6 часов.
 Это означает, что «x» более эффективен, чем «y». Это просто потому, что x имеет больше мощности, чем y.
Это означает, что «x» более эффективен, чем «y». Это просто потому, что x имеет больше мощности, чем y. - Из примера также можно понять, как мощность может помочь определить, какой объем работы будет выполнен и в какое время. А зная эффективность чьей-то или чего-то работы, мы также можем делать правильные выводы и принимать решения об этом.
Формула мощности для различных отношений
П = ВИ
Формула была выведена великим ученым по имени Ом, и эта формула названа в его честь и также известна как закон Ома.
Где,
Р = Мощность,
Я = ток.
Формула электроэнергии
P = R × I 2 или V 2 / Р
Приведенные выше формулы являются вариантом закона Ома.
Где,
R = сопротивление
V= разность потенциалов
Я = ток.
Уравнение мощности
Р = Э/т
Эта формула также известна как уравнение механической мощности.
Где,
E = энергия в джоулях
т = время
P = вес/т
Эта формула получена из теоремы работы-энергии
Где,
W = работа в джоулях
т = время
P = F × с/т
В этой формуле F = сила, приложенная к объекту, s = перемещение объекта и t = общее затраченное время.
Решенные примеры
Q1. Электрическая машина использует энергию 200 Дж, чтобы совершить работу за 10 с. Сколько энергии он использует?
Анс. Проделанная работа = W = 300 Дж,
Затраченное время t = 10 с.
Мощность, используемая им, определяется как
Р = В/Т
Р = 200/10
P = 20 Вт
Q2. Баран имеет массу 60 кг и поднимается на высоту до 12 м за 40 секунд. Рассчитайте его мощность.
Анс. Дано, т (масса) = 60 кг,
h (Высота) = 12 м,
t (затраченное время) = 40 секунд.
Мощность дается:
Р = Вт/Т
P= мг/т
Р = 60 х 9,8 х 12/40
P = 588 Вт
Часто задаваемые вопросы (FAQ)
Q1. Какова формула Силы?
Анс. P = Вт/т
Где W = выполненная работа
т = время
Q2. Что такое единица СИ для Мощность?
Ответ. Вт (Вт).
Q3. Может ли Сила быть отрицательной?
Анс. Мощность представляет собой скорость потока электрической энергии, вытекающей или поступающей в электрическое устройство или контрольный объем. Это величина со знаком; отрицательная Сила представляет собой Силу, текущую в направлении, противоположном положительной Силе.
Q4. Как сила связана с Властью?
Анс. В линейных случаях, когда постоянная сила перемещает объект с постоянной скоростью, Мощность равна P = Fv. В обычном случае направление скорости не совпадает с силой, тогда необходимо использовать скорость и скалярное произведение силы.
Q5. Является ли мощность векторной величиной?
Анс. Мощность является скалярной величиной.
Как вычислить силу на основе давления
: Стивен Холцнер и
Обновлен: 10-07-2021
Из книги: Физики I для ДУМИ Купить книгу на Amazon
Давление и сила связаны между собой, поэтому вы можете вычислить одно, если знаете другое, используя уравнение физики 9.0270 P = F/A . Поскольку давление представляет собой силу, деленную на площадь, его единицами измерения метр-килограмм-секунда (MKS) являются ньютоны на квадратный метр, или Н/м 2 . В системе фут-фунт-секунда (FPS) единицами измерения являются фунты на квадратный дюйм или фунты на квадратный дюйм. Единица ньютонов на квадратный метр настолько распространена в физике, что имеет специальное название: паскаль, , что равно 1 ньютону на квадратный метр. Паскаль обозначается аббревиатурой Па.
Паскаль обозначается аббревиатурой Па.
Атмосферное давление на уровне моря — это стандартное давление, которое люди называют 1 атмосфер (сокращенно атм):
Если перевести атмосферу в фунты на квадратный дюйм, получится около 14,7 фунтов на квадратный дюйм. Это означает, что 14,7 фунтов силы давят на каждый квадратный дюйм вашего тела на уровне моря.
Ваше тело отталкивается с давлением 14,7 фунтов на квадратный дюйм, поэтому вы вообще не чувствуете никакого давления на себя. Но если бы вас внезапно перенесло в открытый космос, внутреннее давление воздуха, давящего на вас, исчезло бы, и все, что осталось бы, — это 14,7 фунтов на квадратный дюйм, которые ваше тело оказывает наружу. Вы не взорветесь, но ваши легкие могут взорваться, если вы попытаетесь задержать дыхание. Изменение давления также может привести к тому, что азот в вашей крови начнет образовывать пузырьки и вызывать изгибы тела!
Изменение давления также может привести к тому, что азот в вашей крови начнет образовывать пузырьки и вызывать изгибы тела!
Вот пример задачи давления с использованием давления воды. Скажем, вы находитесь в бассейне своего соседа и ждете у дна, пока ваши соседи не перестанут пытаться прогнать вас и не вернутся в дом. Вы находитесь в самом глубоком конце бассейна и с помощью удобного манометра, который всегда носите с собой, измеряете давление на тыльную сторону ладони как
С какой силой вода действует на тыльную сторону ладони? Тыльная сторона ладони имеет площадь примерно
Вы полагаете, что если P = F/A, , тогда верно следующее:
F = PA
Подставив числа и решив, вы получите ответ:
Упс. Тысяча ньютонов! Вы достаете свой подводный калькулятор и обнаруживаете, что это около 230 фунтов. Силы быстро складываются, когда вы находитесь под водой, потому что вода — тяжелая жидкость. Сила, которую вы чувствуете, — это вес воды над вами.

 Это означает, что «x» более эффективен, чем «y». Это просто потому, что x имеет больше мощности, чем y.
Это означает, что «x» более эффективен, чем «y». Это просто потому, что x имеет больше мощности, чем y.