ICSC 1129 — ГИДРОФОСФАТ НАТРИЯ
ICSC 1129 — ГИДРОФОСФАТ НАТРИЯ« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RU
| ГИДРОФОСФАТ НАТРИЯ | ICSC: 1129 (Апрель 2006) |
| CAS #: 7558-79-4 |
| EINECS #: 231-448-7 |
| ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | ||
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. При пожаре выделяет раздражающие или токсичные пары (или газы). При пожаре выделяет раздражающие или токсичные пары (или газы). |
В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. |
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
|---|---|---|---|
| Вдыхание | Кашель. Боли в горле. | Применять вентиляцию. | Свежий воздух, покой. |
| Кожа | Покраснение. Боль. | Защитные перчатки. | Промыть кожу большим количеством воды или принять душ. |
| Глаза | Покраснение. Боль. | Использовать защитные очки. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью.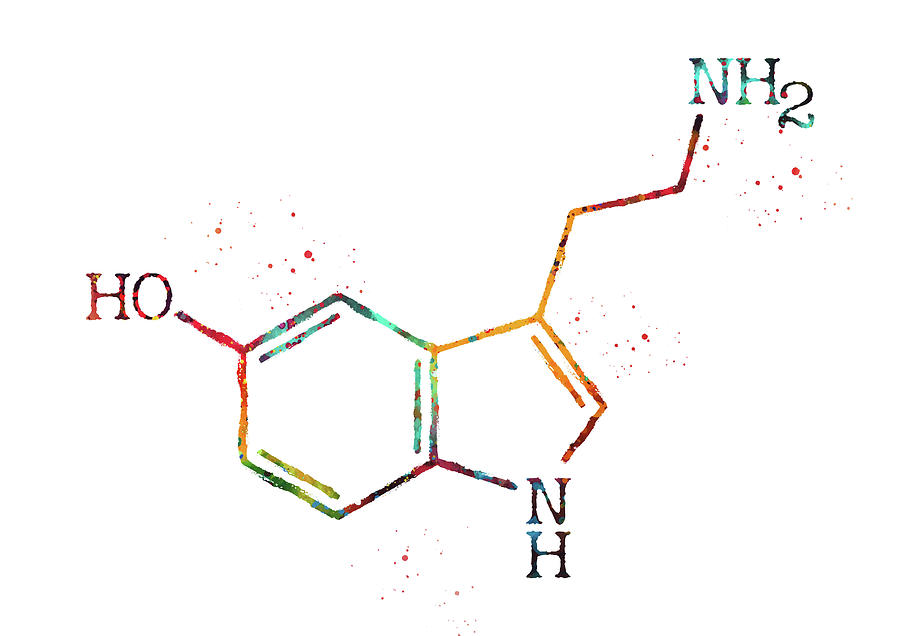 |
| Проглатывание | Боль в животе. Диарея. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Дать выпить один или два стакана воды. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. |
Согласно критериям СГС ООН Вызывает легкое раздражение кожиВызывает раздражение глаз Транспортировка |
| ХРАНЕНИЕ | |
Отдельно от сильных кислот. |
|
| УПАКОВКА | |
| ГИДРОФОСФАТ НАТРИЯ | ICSC: 1129 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: HO4PNa2 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
ТОП-10 самых сильных кислот в мире их опасные свойства и формулы
Кислоты — это ионные соединения, которые при реакции с раствором образуют ионы водорода (H+). Более короткий способ описания кислоты — это образование, которое легко отдает протон. Ионизированный атом водорода, атом без электронов, — это просто протон. На другой стороне спектра оснований находятся единицы, которые легко принимают этот протон.
Следовательно, чем выше концентрация ионов H+ в растворе, тем больше кислотность кислоты.
Свойства кислот
Все кислоты обладают определенными химическими свойствами, которые можно назвать общими для этого класса химических соединений.
- Их способность вступать в реакцию с металлами, выделяя водород.
- Способность вступать в реакцию с основаниями, выделяя при этом соли.
- Способность изменять цвет индикаторов, например, вызывать покраснение лакмусовой бумаги.

При всех вышеперечисленных свойствах, еще одной «способностью» любой известной кислоты является ее способность отдавать атом водорода, заменяя его атомом другого химического вещества или молекулой какого-либо соединения. Именно эта способность характеризует «силу» кислоты и степень ее взаимодействия с другими химическими элементами.
Химические свойства кислот
- Взаимодействие с металлами (в ряду активности перед водородом) протекает с выделением газообразного водорода и образованием солей:
h3SO4 + 2Na → Na2SO4 + h3↑.
Металлы послеводородного ряда активности не реагируют с кислотой (за исключением концентрированной серной кислоты).
Азотная и концентрированная серная кислоты проявляют окислительные свойства, и продукты реакции будут зависеть от концентрации, температуры и типа восстановителя.
- Они реагируют с основными и амфотерными оксидами металлов с образованием солей и воды:
h3SO4 + MgO → MgSO4 + h3O
- Со щелочами — с образованием солей и воды (так называемая реакция нейтрализации):
h3SO4 + 2NaOH → Na2SO4 + h3O
- Кислоты могут реагировать с солями, если в результате реакции образуется нерастворимая соль или выделяется газ:
h3SO4 + K2CO3 → K2SO4 + h3O + CO2↑.
- Сильные кислоты могут вытеснять из соли более слабые кислоты:
3h3SO4 + 2K3PO4 → 3K2SO4 + h4PO4
Известные сильные кислоты
Наиболее знакомые из курса неорганической химии кислоты: йодистоводородная (HI), бромистоводородная (HBr), соляная (HCl), серная (h3SO4) и азотная (HNO3).
Все они имеют высокий показатель кислотности и могут реагировать с большинством металлов и оснований. Самая сильная кислота в этом ряду — смесь азотной и соляной кислот, называемая «aqua regia».
Формула самой сильной кислоты в этом ряду — HNO3+3 HCl. Даже драгоценные металлы, такие как золото и платина, могут быть растворены этим соединением.
Удивительно, но фтористоводородная кислота, которая является соединением водорода с самым сильным галогеном — фтором, не вошла в число претендентов на звание «Самая сильная кислота в химии». Единственной особенностью этого вещества является его способность растворять стекло. Поэтому такая кислота хранится в полиэтиленовом контейнере.
Фторированная карборановая кислота
Химическая формула: H (CHB 11 F 11)
H o value: -18
значение pK a: -20
Карборановые кислоты являются одной из самых сильных групп суперкислот, известных человеку, и считается, что немногие из них имеют значение функции кислотности Хамметта -18, что более чем в миллион раз превышает уровень кислотности чистой (100%) серной кислоты.
Одним из таких представителей этой группы является фторированная карборановая кислота. Хотя первоначально о существовании этого химического вещества было сообщено в 2007 году, ученые смогли полностью исследовать его природу только в 2013 году. До его открытия корона самой мощной кислоты Бранстеда перешла в высокохлорированную версию этого семейства суперкислот.
Фторкарборан — единственная известная кислота, которая может протонировать (переносить ион водорода) углекислый газ с образованием катионов с водородными связями. В отличие от этого, CO 2 не подвергается заметному протонированию при обработке другими суперкислотами, такими как магниевая кислота и HF-SbF5.
Плавиковая кислота
Фтористый водород описывается как еще одно сильное соединение. Он встречается в виде растворов различной концентрации. Продукт бесцветен и выделяет тепло при реакции с водой. Токсин разрушает стекло, металл и не связывается с парафином.
Транспортируется в полиэтилене. Плавиковая кислота опасна для человека, вызывая наркоз, нарушения кровообращения, дыхания. Соединение способно к испарению. Пары также ядовиты и могут раздражать слизистые оболочки и кожу. Он быстро впитывается через эпидермис и вызывает мутации.
Серная кислота
Химическая формула: h3SO4
значение pKa: -3
Значение Ho: 12
Серная кислота или купорос не нуждаются в формальном представлении. Он не имеет запаха, бесцветен и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим соединением, необходимым во многих отраслях промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Он также используется в аккумуляторных кислотах и чистящих средствах.
Он также играет важную роль в изучении кислот в целом. Серная кислота служит базовой точкой отсчета для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов производства серной кислоты, обычно используется контактный и мокрый процесс получения серной кислоты.
H 2 SO 4 может вызвать значительные повреждения кожи человека при прямом контакте. Он также очень коррозионно активен по отношению ко многим металлам. Этот химикат гораздо более агрессивен и опасен, когда присутствует в высоких концентрациях, благодаря своим превосходным окисляющим и обезвоживающим свойствам.
Соляная кислота
Химическая формула: HCl
значение pK A: -5,9
Как и серная кислота, соляная кислота также является важным химическим веществом, широко используемым в лабораториях и различных отраслях промышленности. Соляная кислота была открыта где-то около 800 года нашей эры иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задается вопросом, почему соляная кислота сильнее серной, несмотря на то, что последняя является эталоном суперкислот, объясняют это тем, что серная кислота является дипротонной кислотой, которая обычно не диссоциирует полностью.
Другими словами, HCl сильнее серной кислоты, потому что ее ионы водорода (HCl) легко диссоциируют на хлориды по сравнению с ионами сульфата из серной кислоты. В любом случае, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой. Он также является важным ингредиентом в производстве органических соединений (винилхлорид используется для производства ПВХ) и многих неорганических соединений.
Хлорная кислота
Химическая формула: HClO 4
значение pK A: -10, -15,2
Хлорная кислота — одна из самых сильных кислот Бранстеда-Лоури, которая обладает сильными окислительными свойствами и является высококоррозионной. Традиционно его получают путем обработки перхлората натрия соляной кислотой (HCl), в результате чего также образуется хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, соляная кислота не подвергается гидролизу. Это также одна из самых регулируемых кислот в мире. Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек были ранены и 17 погибли в результате химического взрыва, содержавшего почти 75% соляной кислоты (по объему) и 25% уксусного ангидрида. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек были ранены и 17 погибли в результате химического взрыва, содержавшего почти 75% соляной кислоты (по объему) и 25% уксусного ангидрида. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на свой взрывоопасный характер, перхлорная кислота широко используется и даже предпочтительна в некоторых видах синтеза. Он также является важным компонентом перхлората аммония, который используется в современном ракетном топливе.
Азотная кислота
Азотная кислота — это бесцветная минеральная кислота, обладающая высокой коррозионной активностью. Азотная кислота широко используется для нитрования — присоединения нитратной группы к молекуле, обычно органического соединения. Как и HCl, его значение pH близко к -1, и он почти полностью диссоциирует в водном растворе, что делает его значение Ka также высоким — 2,4 × 10.
Являясь чрезвычайно хорошим окислителем, он взрывообразно реагирует с неметаллами и органическими веществами. Нитрование органических соединений азотной кислотой — хорошо известный метод получения взрывчатых веществ, таких как тринитротолуол (ТНТ). Он также используется для очистки кремниевых пластин или для удаления загрязнений из нержавеющей стали.
Нитрование органических соединений азотной кислотой — хорошо известный метод получения взрывчатых веществ, таких как тринитротолуол (ТНТ). Он также используется для очистки кремниевых пластин или для удаления загрязнений из нержавеющей стали.
В целях безопасности настоятельно рекомендуется хранить азотную кислоту вдали от щелочей и органических веществ из-за ее коррозионной активности. Контакт с кожей может вызвать тяжелые химические ожоги и немедленное разложение тела и тканей. Чтобы нейтрализовать эту кислоту, на место ожога можно нанести большое количество воды.
Фторсульфоновая кислота
Химическая формула: HSO 3 F
Значение H O: -15,1
значение pK A: -10
Фторсульфоновая кислота или фторсульфоновая кислота (официальное название) является второй по силе моносульфоновой кислотой, доступной на сегодняшний день. Он имеет желтый цвет и, очевидно, очень коррозийный/токсичный. HSO 3 F обычно получают путем соединения фтористого водорода с триоксидом серы, а при соединении с пентафторидом сурьмы образуется «волшебная кислота», гораздо более сильная кислота и протонирующий агент.
Кислота может использоваться для алкилирования углеводородов (с получением алкенов) и изомеризации алканов, а также для травления стекла (художественного стекла). Это широко используемый в лабораториях фторирующий агент.
Сильные органические кислоты в мире
Существуют опасные кислоты не только химического, но и органического происхождения. Они также оказывают негативное влияние на здоровье.
Муравьиная кислота
Моноосновная кислота, бесцветная, растворимая в ацетоне и смешивающаяся с водой. Вреден в высоких концентрациях, при контакте с кожей разъедает ткани и вызывает сильные ожоги. В газообразном состоянии он действует на слизистые оболочки глаз и дыхательных путей. Проглатывание вызывает тяжелое отравление с неблагоприятными последствиями.
Уксусная
Вредное соединение, используемое в домашнем хозяйстве. Хорошо контактирует с водой, что снижает концентрацию. Проглатывание вызывает сильные ожоги внутренних органов, пары оказывают негативное воздействие на слизистые оболочки, раздражая их. В высоких концентрациях вызывает сильные ожоги вплоть до некроза тканей. Требуется немедленная госпитализация после передозировки уксусной кислоты.
В высоких концентрациях вызывает сильные ожоги вплоть до некроза тканей. Требуется немедленная госпитализация после передозировки уксусной кислоты.
Синильная
Опасное и ядовитое вещество. Содержится в семенах некоторых ягод. Вредный: образуется при вдыхании небольших количеств и может вызвать проблемы с дыханием, головные боли и другие неприятные симптомы.
Проглатывание больших количеств вызывает быструю смерть из-за паралича дыхательного центра. При отравлении солью синильной кислоты требуется быстрое введение антидота и транспортировка в медицинское учреждение.
Самая сильная кислота в мире
Карборановая кислота является самым мощным соединением в мире на сегодняшний день. Формула самой сильной кислоты выглядит следующим образом: H(CHB11Cl11).
Этот монстр был создан в 2005 году в Калифорнийском университете в тесном сотрудничестве с Институтом катализа Новосибирского СО РАН.
Сама идея синтеза возникла в умах ученых вместе с мечтой о новых, ранее невиданных молекулах и атомах. Новая кислота в миллион раз сильнее серной кислоты, но она совсем не агрессивна, а самую сильную кислоту можно легко хранить в стеклянной бутылке. Однако верно, что стекло со временем растворяется, и скорость этой реакции значительно увеличивается при повышении температуры.
Новая кислота в миллион раз сильнее серной кислоты, но она совсем не агрессивна, а самую сильную кислоту можно легко хранить в стеклянной бутылке. Однако верно, что стекло со временем растворяется, и скорость этой реакции значительно увеличивается при повышении температуры.
Эта удивительная мягкость объясняется высокой стабильностью нового соединения. Как и все кислоты, карборановая кислота легко вступает в реакцию, отдавая свой один протон. В то же время основание кислоты настолько стабильно, что химическая реакция не идет дальше.
Новая кислота является отличным донором протонов H+. Именно это определяет прочность данного вещества. Раствор карборановой кислоты содержит больше ионов водорода, чем любая другая кислота в мире. В химической реакции SbF5, пентафторид сурьмы, связывает ион фтора. При этом высвобождается все больше и больше атомов водорода. Именно поэтому карборановая кислота является самой сильной в мире — взвесь протонов в ее растворе в 2×1019 раз больше, чем в серной кислоте.
Однако кислотное основание этого соединения удивительно стабильно. Его молекула состоит из одиннадцати атомов брома и такого же количества атомов хлора. В пространстве эти частицы образуют сложную, геометрически правильную форму, называемую икосаэдром. Такое расположение атомов является наиболее стабильным и объясняет устойчивость карборановой кислоты.
Уникальное свойство самой сильной кислоты
При упоминании самой сильной кислоты в мире человеческое воображение рисует образ вещества, которое растворяет все на своем пути.
В действительности, деструктивные свойства вовсе не являются главной характеристикой прочности химического соединения. Например, многие считали, что плавиковая кислота — самая сильная кислота, потому что она растворяет стекло. Однако это далеко не так.
Фтористоводородная кислота разъедает стеклянные емкости, но ее можно хранить в полиэтиленовых контейнерах.
Карборная кислота, признанная самой сильной в мире, легко хранится в стеклянной таре. Дело в том, что это химическое соединение обладает высокой химической стабильностью.
Дело в том, что это химическое соединение обладает высокой химической стабильностью.
Как и другие подобные соединения, карборановая кислота вступает в реакцию с реагентами и отдает заряженные атомы водорода.
После этой реакции соединение имеет незначительный отрицательный заряд и не оказывает вредного воздействия на окружающие материалы.
Объективное измерение кислотности
Фактически, именно так объективно измеряется кислотность по шкале pH. Шкала варьируется от 1 до 14, где 1 соответствует очень сильной кислоте, 7 — нейтральному раствору, а 14 — очень сильному основанию.
Шкала pH — это логарифмическая шкала. Он берет отрицательный логарифм (обозначается как p) концентрации ионов H+ (H в pH). Если концентрация ионов водорода каким-либо образом уменьшается, pH увеличивается, так как увеличивается щелочность.
Однако дело не только в концентрации, но и в активности этих ионов. Активность этих ионов зависит от многих факторов, и концентрация — лишь один из них. Сказав это, для простоты давайте продолжим рассмотрение концепции концентрации.
Сказав это, для простоты давайте продолжим рассмотрение концепции концентрации.
Удельную кислотность можно получить, растворив кислоту в растворе воды. Катионы H + не могут свободно перемещаться; они реагируют с молекулами воды (h3O), образуя ионы гидроксона (h4O +) и гидроксид-ионы (OH-).
Поэтому более высокая концентрация ионов h4O+ в воде свидетельствует о наличии сильной кислоты. Остальные ионы, лишенные протона, или ионы H+, являются основанием. Поэтому, в некотором смысле, кислоты и основания естественно существуют парами. Общее представление о реакции между водой и кислотой можно проиллюстрировать следующим выражением.
Другой метод определения относительной кислотности растворов заключается в определении равновесной константы диссоциации кислоты, обозначаемой символом «Ka».
Ссылаясь на уравнение выше, мы можем найти значение Ka, используя:
[h4O +] и [A-] — концентрации гидроксон-иона и диссоциированного основания в молях на литр. Тогда как [HA] — это концентрация молекул, которые молчали и не вносили ионы H+.
Для сильной кислоты продукт в числителе имеет большее значение, чем сумма, приведенная в знаменателе, потому что сильная кислота катализирует расщепление быстро и производит больше ионов, оставляя меньше молекул HA. Поэтому значение Ka для сильной кислоты будет больше 1.
И наоборот, для слабой кислоты продукт в числителе имеет меньшее значение, чем в знаменателе, потому что она очень неспособна производить ионы H+. Поэтому значение Ka для слабой кислоты будет меньше 1.
Таким образом, значение Ka определяет абсолютную силу кислоты.
Реакции кислот и оснований
Слабое основание и слабая кислота
Общий вид реакции:
Слабое основание(р-р) + h3O ↔ Слабая кислота(р-р) + OH-(р-р)
Сильная кислота и слабое основание
Кислота диссоциирует полностью, основание диссоциирует неполностью:
Сильное основание и слабая кислота
Основание диссоциирует полностью, кислота диссоциирует частично, полученный раствор обладает свойствами слабого основания:
Сильная кислота и сильное основание
Эта реакция называется нейтрализацией: если реактивов достаточно для полной диссоциации кислоты и основания, то полученный раствор будет нейтральным.
Сколько кислоты может убить человека?
Какое количество ядовитой кислоты необходимо для того, чтобы вызвать отравление или смерть? Сильные кислоты реагируют мгновенно, поэтому в некоторых случаях может быть достаточно небольшой капли или одного вдоха.
Количество кислоты, которое может вызвать отравление, зависит от возраста человека, его физического состояния, иммунной системы и способности организма сопротивляться вредным веществам. У детей отравление развивается быстрее, чем у взрослых, из-за ускоренного метаболизма. Точную дозировку может определить медицинский работник.
Симптомы отравления кислотой
Как проявляется отравление кислотой? В зависимости от типа соединения могут возникать различные симптомы. Однако для всех отравлений характерны одни и те же симптомы.
- Болезненность при глотании, боль в горле, пищеводе, желудке. Тяжелое отравление может вызвать болевой шок.
- Тошнота, рвота. Отходы жизнедеятельности могут быть черного цвета из-за кровотечения в желудке.

- Учащенное сердцебиение.
- Сильная диарея, стул черного цвета из-за кровотечения в кишечнике.
- Низкое кровяное давление.
- Бледная кожа и слизистые оболочки, возможно посинение.
- Сильная головная боль.
- Снижение выделения мочи.
- Нарушение дыхания, дыхание учащенное и прерывистое.
- Потеря сознания, погружение в кому.
При появлении любого из этих симптомов немедленно вызывайте службу спасения. Жизнь и дееспособность пострадавшего зависит от быстрой реакции окружающих.
Лечение при отравлении ядом
Первая помощь может быть оказана до прибытия врачей. При отравлении необходима профессиональная помощь, но некоторые действия могут облегчить состояние больного.
- Если произошло отравление газом, больного человека выводят или перемещают на свежий воздух;
- Человека кладут на горизонтальную поверхность и оставляют отдыхать;
- Не следует промывать желудок, так как это может вызвать повторное жжение в пищеводе;
- На область живота будет положен лед, это поможет остановить внутреннее кровотечение;
- Во избежание негативных последствий не следует давать таблетки или что-либо запивать.

Последствия и профилактика
Отравление кислотой часто приводит к летальному исходу. При своевременно начатом лечении возможен благоприятный прогноз, но во многих случаях человек остается инвалидом. Все кислоты оказывают негативное воздействие на желудочно-кишечный тракт, на мозг и нервную систему.
Избежать отравления можно, соблюдая осторожность при работе с кислотами. Не оставляйте токсичные вещества в пределах досягаемости детей или животных. Носите защитную одежду, закрывайте глаза очками и надевайте перчатки при работе с токсичными соединениями.
Самая страшная и опасная кислота недоступна простому человеку. Однако при использовании таких веществ в лабораториях следует соблюдать осторожность. При появлении симптомов отравления срочно обратитесь в медицинское учреждение.
Реакция химических элементов всегда приводит к образованию новых веществ. Учёные обратили внимание, что некоторые из таких соединений обладают кислым вкусом, а потому они были названы кислотами.
- Общие свойства
- Концентрация вещества
- Основная классификация
- Сильные и слабые реагенты
- Химические реакции
- Водородный показатель
- Самые опасные кислотные соединения
- Кривые титрования
На сильные и слабые эти субстанции подразделяются в зависимости от возможности отдавать ионы водорода во время взаимодействия с металлами.
Общие свойства
Все кислоты содержат атомы водорода, которые способны вступать в реакцию. Таким образом, кислота представляет собой сложное вещество, молекулы которого состоят из разного количества атомов водорода и кислотного остатка. Эти соединения обладают кислым и зачастую слегка металлическим вкусом. При контакте с ними индикаторы приобретают другой оттенок вплоть до кардинальной смены цвета.
Химические свойства, являющиеся общими для всех кислот:
- Все вещества, содержащие кислород, в процессе разложения образуют воду и кислотный оксид.

- Бескислородные соединения распадаются на простые элементы.
- Окислители вступают в реакцию со всеми расположенными слева от H металлами из ряда активности.
- Кислоты взаимодействуют с солями, образованными более слабым соединением.
Физические свойства веществ могут кардинально отличаться. Например, одни из них имеют запах, у других он отсутствует совершенно.
Кислоты могут быть жидкими, газообразными и твёрдыми. К твёрдым соединениям относятся, например, C2h304 и h4BO3.
Концентрация вещества
Зачастую химикам приходится решать задачи на определение количества чистой кислоты, находящейся в растворе, в процентах. В таких случаях искомым значением является концентрация.
Это величина, позволяющая определять количественный состав жидкого химического вещества. К примеру, для того, чтобы узнать, сколько чистой серной кислоты находится в разбавленном растворе, необходимо небольшое количество смеси налить в мерный стакан, взвесить и определить искомое значение по таблице плотности. Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.
Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.
Основная классификация
Чаще всего кислые вещества разделяют на кислородосодержащие и бескислородные. Состав последних соединений отличается тем, что в них нет кислорода, но есть водород. В связи с этим их названия всегда дополнены словом «водородная». Например, хлороводородная, сероводородная.
Кроме того, кислоты имеют классификацию по количеству атомов водорода.
Так, они подразделяются на следующие типы:
- одноосновные;
- двухосновные;
- трехосновные.
Но также существуют органические кислоты, то есть органические вещества, которые проявляют свойства, присущие кислотным соединениям. Из них наиболее известны уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная.
Все кислые вещества и основания подразделяются на сильные и слабые. Но необходимо понять, что эти понятия никак не связаны с концентрацией соединений. Сила кислоты определяется её способностью вступать в химическую реакцию, отдавая водородные ионы.
Сила кислоты определяется её способностью вступать в химическую реакцию, отдавая водородные ионы.
Так, вещество считается сильным, если этот процесс проходит легко.
Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.
Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | Ch4COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | h3SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | h3S сероводородная | Ba(OH)2 гидроокись бария | Nh5OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| h3SO4 серная | h3SiO3 кремниевая |
А также следует отметить, что кислородсодержащая угольная (h3CO3) и ортофосфорная (h4PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Химические реакции
При соединении сильной кислоты с таким же основанием получится нейтральный раствор. Произошедшая в этом случае химическая реакция называется нейтрализацией. Если же заменить основание на слабое, то полностью диссоциирует только кислое вещество.
Второй компонент не распадается на ионы полностью.
Слабое основание лишь незначительно вступает в реакцию со слабой кислотой.
Когда кислотное соединение реагирует с сильным основанием, то первый реагент проходит частичную диссоциацию, второй же полностью диссоциирует.
Полученный в результате раствор обладает слабыми свойствами основания.
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
- Инструментальный способ. В этом случае применяется pH-метр. Этот прибор трансформирует концентрацию протонов в какой-либо жидкости в электрический сигнал.
- Индикаторы. Это вещества, изменяющие оттенок цвет в зависимости от показателя pH. Использование различных индикаторов позволяет получить довольно точные данные об уровне кислотности.

- Соль. Соль представляет собой соединение ионов, которое полностью диссоциирует в слабом водном растворе. Для определения кислотно-щелочных свойств соляного раствора, прежде всего, нужно установить и изучить свойства ионов, находящиеся в растворе.
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.
При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
- Интервал уровня кислотности, в котором вещество станет эффективным.
- Ёмкость раствора, то есть какой объём сильного кислотного соединения или основания можно добавить в смесь, не изменив её pH.
- При соединении веществ не должно быть реакций, способных повлиять на состав раствора.

Самые опасные кислотные соединения
На сегодняшний день самой сильной кислотой в мире считается пентафторид сурьмы фтористоводородной кислоты. Её химическая формула — HFSbF5. Не существует точных данных об активности этого соединения, но установлено, что его 55-процентный раствор почти в миллион раз сильнее концентрированной серной кислоты.
Следующим по силе является карборановое кислотное соединение. Это вещество разрешается хранить только в специальной ёмкости. Она также во много раз опаснее серной и растворяет даже стекло.
Ещё одной суперкислотой является плавиковая. Она не имеет цвета и, подобно предыдущему веществу, способна разъедать стекло. Для перевозки этого едкого соединения применяют полиэтилен. Вещество прекрасно вступает в реакцию с большинством металлов, но не взаимодействует с парафином. Соединение токсично, даже его пары опасны для здоровья. Кислота обладает эффектом наркотика.
Кислота обладает эффектом наркотика.
Самое известное сильное вещество — серная кислота. Из-за больших производственных объёмов некоторые химики считают именно её самой опасной в мире. По мере того как увеличивается концентрация реагента, растёт и его опасность для здоровья человека, хотя даже растворы серного кислотного соединения могут нанести серьёзный вред. Это вещество окисляет металлы и является крайне едким, даже пары реагента очень опасны. При контакте происходит поражение кожи и слизистых оболочек, органов дыхания, а также внутренних органов человека.
Часто используемая в быту муравьиная кислота тоже относится к ядовитым химикатам. Эта ситуация объясняется тем, что опасность возникает только при высокой концентрации вещества. В обычных условиях оно бесцветно, легко образует водные растворы, а также успешно растворяется в ацетоне.
При концентрации меньше 10% реагент вызывает только раздражение. Если же этот показатель повышен, то соединение может разъесть ткани и множество других веществ.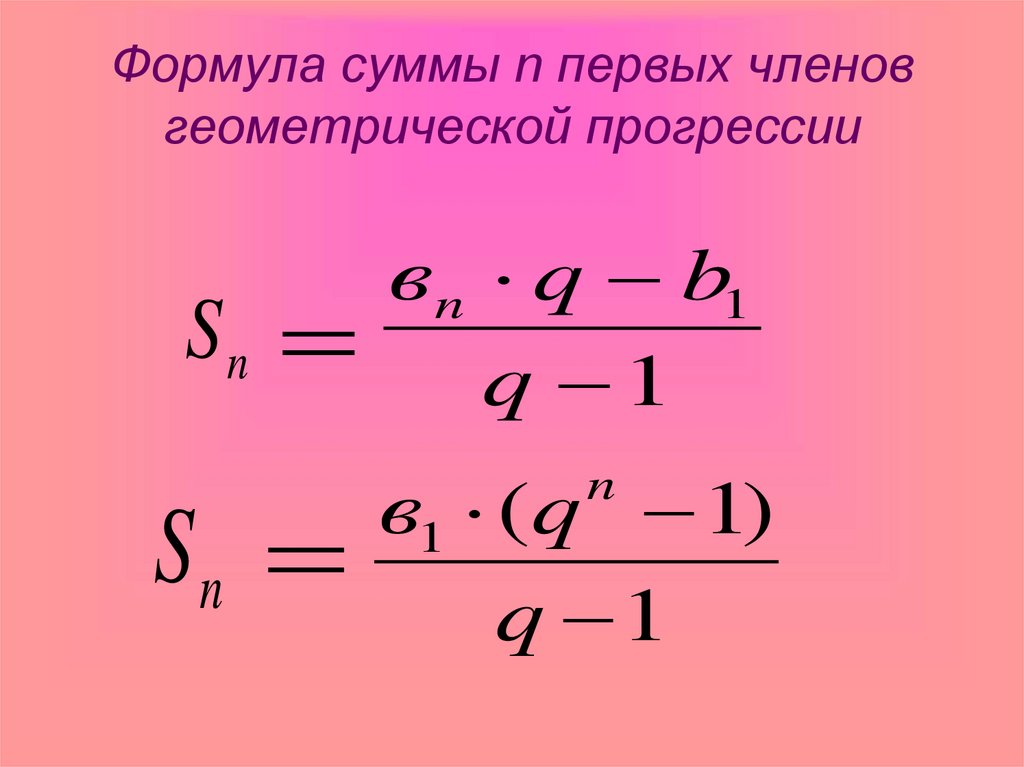 Его пары повреждают глаза, слизистые оболочки и дыхательные пути. При попадании внутрь организма наступает серьёзное отравление. Но в минимальных концентрациях реагент успешно перерабатывается и выводится из организма. В небольших дозах оно присутствует во фруктах, выделениях насекомых, крапиве.
Его пары повреждают глаза, слизистые оболочки и дыхательные пути. При попадании внутрь организма наступает серьёзное отравление. Но в минимальных концентрациях реагент успешно перерабатывается и выводится из организма. В небольших дозах оно присутствует во фруктах, выделениях насекомых, крапиве.
Мощным ядом является азотная кислота. В разных пропорциях она прекрасно смешивается с водой. Реагент крайне опасен для человека. Его пары наносят серьёзный вред органам дыхания и слизистым оболочкам. Кожный покров при попадании кислоты становится жёлтым, на нём остаются язвы. Пострадавшие места требуют длительного восстановительного процесса.
При воздействии высокой температуры или света азотная кислота распадается, превращаясь в довольно токсичный газ. У вещества не возникает химической реакции со стеклом, а потому этот материал применяют для хранения реагента. Создателем ядовитого соединения является алхимик Джабир.
Кривые титрования
Кривые титрования представляют собой график зависимости параметра вещества, который связан с концентрацией реагента, подвергающегося титрованию, титранта или продукта химической реакции, от степени протекания процесса. Если проходит кислотно-основная реакция, то показателем концентрации каждого её участка является уровень рН.
Если проходит кислотно-основная реакция, то показателем концентрации каждого её участка является уровень рН.
Существуют теоретические и экспериментальные кривые. Теоретические используются для того, чтобы обосновать выбор индикатора. Их расчёт осуществляется по уравнению реакции и данным об исходной концентрации соединений, вступающих в реакцию. Экспериментальные кривые позволяют определить точки эквивалентности. Их получают путём измерения одного из свойств системы в процессе титрования.
Протекание и результат химических реакций, в которые вступает любая кислота, напрямую зависят от того, является это вещество сильным или слабым. В специальных химических таблицах приведены наименования самых распространённых соединений, что позволяет безошибочно определить силу реагента.
Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Это химическое соединение, которое принимает электроны и / или отдает (диссоциирует) ионы водорода, также известные как протоны.
Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, т.е. чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться.
Константа диссоциации кислоты (Ka): иногда известная как константа ионизации кислоты или просто кислотная константа — это количественно выраженная сила кислоты в водном растворе. С одной стороны, когда pH или «мощность водорода» определяют уровень основности или, в этом случае, кислотность любого раствора, константа диссоциации кислоты говорит нам о концентрации ионов водорода [H +] или ионов гидрония [h4O +] в растворе.
Это подводит нас к другому связанному и важному показателю кислотности pKa. Это в основном отрицательный целочисленный логарифм Ka.
Чем сильнее кислота, тем ниже значения pKa.
Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата.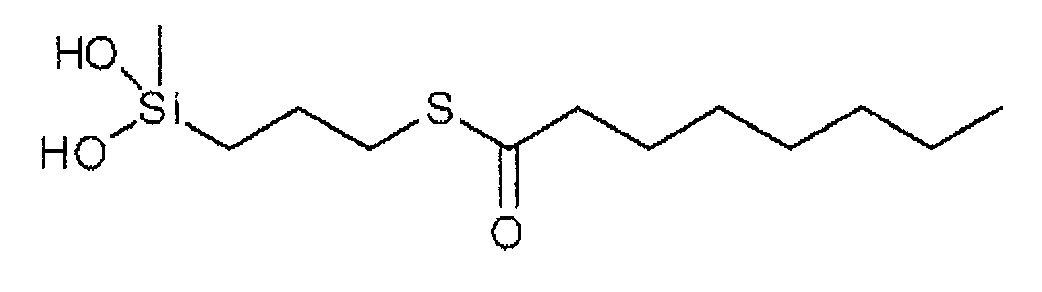 (Кислород в красном, водород в белом и углерод в черном)
(Кислород в красном, водород в белом и углерод в черном)
Функция кислотности Гаммета: (H o) Всем нам известна шкала pH, которая обычно используется для измерения уровней кислотности или основности химических веществ, но когда речь идет о суперкислотах, она просто становится бесполезной, поскольку их уровни кислотности в миллион раз больше, чем серная и соляная кислоты.
Таким образом, чтобы измерить суперкислоты на основе их уровней кислотности, исследователи придумали функцию кислотности Гаммета. Первоначально он был предложен американским физическим химиком Луи Плаком Гаммет.
Суперкислота. Суперкислота — это просто кислота с уровнем кислотности более 100% -ной серной кислоты с функцией кислотности Гаммета ниже -12. В более технических терминах его можно определить как среду, в которой химический потенциал протона выше, чем в чистой серной кислоте.
8. Серная кислота
Серная кислота (98%) на листе бумаги
Химическая формула: h3SO4
pKa значение: -3
Ho значение: 12
Серная кислота или купорос не нуждаются в формальном введении. Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Она также используется в кислотах аккумулятора и чистящих средствах.
Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Она также используется в кислотах аккумулятора и чистящих средствах.
Она также играет важную роль в изучении кислот в целом. Серная кислота служит базовым эталоном для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
H 2 SO 4 может нанести значительный ущерб коже человека при прямом контакте. Это также очень разъедает многие металлы. Химическое вещество гораздо более агрессивно и опасно, когда присутствует в высокой концентрации, благодаря своим превосходным окислительным и дегидратирующим свойствам.
7. Соляная кислота
Химическая формула: HCl
pK A значение: -5,9
Подобно серной кислоте, соляная кислота также является важным химическим веществом, которое широко используется в лабораториях и различных отраслях промышленности. Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задаются вопросом, почему соляная кислота сильнее серной кислоты, несмотря на то, что последняя является контрольной точкой для суперкислот, причина этого заключается в том, что серная кислота является дипротоновой кислотой, которая обычно не полностью диссоциирует.
Другими словами, HCl сильнее серной кислоты, поскольку ее ионы водорода (HCl) легко отделяются от хлорида по сравнению с сульфат-ионом из серной кислоты. Так или иначе, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой. Кроме того, это жизненно важный компонент в производстве органических (винилхлорид используется для ПВХ) и многих неорганических соединений.
6. Трифторметансульфоновая кислота
Химическая формула: CF 3 SO 3 H
pK A значение: -14,7
Трифторметансульфоновая кислота, наиболее известная как трифликовая кислота, была впервые синтезирована / обнаружена Робертом Хазелдином, британским химиком, еще в 1954 году. Она известна своей замечательной химической и термической стабильностью. В то время как другие сильные кислоты, такие как азотная и хлорная кислоты, подвержены окислению, трифликовая кислота — нет.
Она известна своей замечательной химической и термической стабильностью. В то время как другие сильные кислоты, такие как азотная и хлорная кислоты, подвержены окислению, трифликовая кислота — нет.
Трифликовая кислота используется во многих протонированиях и титрованиях (количественный анализ химического состава). Важная причина, по которой трифликовая кислота является предпочтительной в определенных случаях, заключается в том, что она не сульфонирует другие вещества, что характерно для хлорсульфоновой кислоты и серной кислоты.
Излишне говорить, что это чрезвычайно опасно. Любой контакт кожи с кислотой может вызвать серьезные ожоги и может привести к незначительному повреждению тканей. Это может также вызвать отек легких и судороги и другие критические условия при вдыхании.
5. Фторсульфоновая кислота
Химическая формула: HSO 3 F
H O значение: -15.1
pK A значение: -10
Фторосерная кислота или серно-фтористоводородная кислота (официальное название) является второй сильнейшей однокомпонентной кислотой, доступной сегодня. Это желтый на вид и, конечно, очень едкий / токсичный. HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Это желтый на вид и, конечно, очень едкий / токсичный. HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Кислота может быть использована для алкилирования углеводородов (с алкенами) и изомеризации алканов, а также для травления стекла (художественное стекло). Это обычный фторирующий агент в лабораториях.
4. Хлорная кислота
Химическая формула: HClO 4
pK A значение: -10, -15.2
Хлорная кислота является одной из самых сильных кислот Бренстеда-Лоури, которые обладают сильными окислительными свойствами и обладают высокой коррозионной активностью. Традиционно ее получают обработкой перхлората натрия соляной кислотой (HCl), которая также создает хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, хлорная кислота не подвержена гидролизу. Это также одна из самых регулируемых кислот в мире. Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на взрывную природу, хлорная кислота широко используется и даже предпочтительна в некоторых типах синтеза. Это также важный компонент перхлората аммония, который используется в современном ракетном топливе.
3. Фторированная карборановая кислота
Общая структура карбоновой кислоты
Химическая формула: H (CHB 11 F 11)
H o значение: -18
pK a значение: -20
Карборановые кислоты являются одной из самых сильных групп суперкислот, известных человеку, немногие из которых, как считается, имеют значение функции кислотности Гамметта, равное -18, что более чем в миллион раз выше уровня кислотности, чем чистая (100%) серная кислота.
Одним из таких членов этой группы является фторированная карборановая кислота. Хотя о существовании такого химического вещества первоначально сообщалось в 2007 году, исследователи смогли в полной мере изучить его природу только в 2013 году. До его открытия корона сильнейшей кислоты Бренстеда перешла к сильно хлорированной версии этого семейства суперкислот.
Фторированный карборан является единственной известной кислотой, которая может протонировать (переносить ион водорода) диоксид углерода с образованием катионов, соединенных водородом. В отличие от этого, CO 2 не подвергается какой-либо заметной протонации при обработке другими суперкислотами, такими как магическая кислота и HF-SbF5.
2. Волшебная кислота
Химическая формула: FSO 3 H · SbF 5
H o значение: -23
FSO 3 H · SbF 5, наиболее известный как магическая кислота, получают смешением фторсерной кислоты и пентафторида сурьмы в молярном соотношении 1: 1. Эта сверхкислотная система была впервые разработана в 1966 году исследователями из лаборатории Джорджа Олаха, Университета Case Western Reserve в Огайо.
Его довольно причудливое название было установлено после официального события в 1966 году, когда сотрудник лаборатории Олаха продемонстрировал протонирование углеводородов, в котором парафиновая свеча «волшебным образом» растворилась и превратилась в раствор трет-бутильного катиона после того, как она была помещена в то, что сейчас известно как волшебная кислота.
Хотя Волшебная кислота обычно используется для стабилизации ионов углерода в растворах, она имеет несколько других важных промышленных применений. Например, он может ускорить изомеризацию насыщенных углеводородов и даже протоната метана, ксенона и галогенов, которые все являются слабыми основаниями.
1. Фтороантимоновая кислота
Химическая формула: H 2 FSbF 6
H o значение: -15 (в чистом виде), -28 (с> 50 мол.%)
Фторантимоновая кислота является, пожалуй, самой сильной из всех известных суперкислот, основанных на значениях функции кислотности Гаммета. Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Этот суперкислота имеет несколько важных применений в химическом машиностроении и нефтехимической промышленности. Например, его можно использовать для отделения метана и Н 2 от неопентана и изобутана (оба алкана) соответственно.
Неудивительно, что H 2 FSbF 6 чрезвычайно агрессивен и может подвергаться сильному гидролизу при контакте с водой. Как и большинство суперкислот, фторантимоновая кислота может питаться прямо через стекло, поэтому она должна храниться в контейнерах из политетрафторэтилена.
Теперь, большинство из вас, возможно, наткнулись на карбоновые кислоты (либо хлорированная карбоновая кислота, либо фторированная карборановая кислота), когда искали «самые сильные кислоты в мире». Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).
СКТН Синтетический каучук
Силиконовые каучуки СКТН химически инертны, ткане- и гемосовместимы, газопроницаемы, селективны по газопроницаемости, легко стерилизуются.
Материалы, изготавливаемые на основе каучуков СКТН, устойчивы к температурам от -60°C до +300°C, обладают высокой гидрофобностью, химической инертностью, диэлектрическими свойствами, вибростойкостью, стойкостью к действию грибков и микроорганизмов, сопротивлением действию озона, окислителей и ультрафиолетовых лучей.
Международное обозначение
Название: OH POLYMER
Синонимы: Silanol Terminated Polydimethylsiloxane, Hydroxy-terminated polydimethylsiloxane
CAS: 70131-67-8
Формула: HO [-Si (CH 3 ) 2 O-] n H
Отличие от органических каучуков:
- Cиликоновые каучуки СКТН более экономичны в использовании
- Надежны и долговечны даже в экстремальных условиях
- Способны длительно сохранять эластичность в широком интервале температур
- Просты в переработке.

Каучуки отверждаются при комнатной температуре в присутствии катализаторов холодной вулканизации.
Каучук синтетический термостойкий низкомолекулярный диметилсилоксановый.
Особенности
- Материалы, изготавливаемые на основе силиконовых каучуков СКТН, обладают значительной эластичностью, упругостью и прочностью, высокой гидрофобностью, химической инертностью, диэлектрическими свойствами, вибростойкостью, стойкостью к действию грибков и микроорганизмов, сопротивлением действию озона, окислителей и ультрафиолетовых лучей.
- Силиконовые каучуки СКТН физиологически инертны, ткане- и гемосовместимы, газопроницаемы (наибольшая проницаемость из всех известных полимеров), селективны по газопроницаемости, легко стерилизуются.
- По сравнению с другими биоинертными материалами, используемыми для имплантации, силоксановые каучуки в значительной степени имитируют мягкие ткани человека (плотность, мягкость, вязкость, эластичность).
- В отличие от органических, силиконовые каучуки СКТН более экономичны, надежны и долговечны даже в экстремальных условиях.
 Длительно сохраняют эластичность в широком интервале температур. Просты в переработке.
Длительно сохраняют эластичность в широком интервале температур. Просты в переработке. - Отверждаются кремнийорганические каучуки при комнатной температуре в присутствии катализаторов холодной вулканизации.
- Каучуки кремнийорганические СКТН нетоксичны. Не содержат растворителей.
Состав
Силоксановые каучуки СКТН представляет собой низкомолекулярную диметилсилоксановую жидкость, стабилизованную активной окисью кремния и отверждаемый катализаторами холодного отверждения.
Применение
- Изготовление монолитных заливочных и обволакивающих компаундов, герметиков, пеногерметиков, пропиточных композиций, резиноподобных покрытий, обладающих высокими диэлектрическими свойствами и работающих при температуре от -60 до +250°С. Изготовления газоселективных мембран.
- Для изготовления различных композиций резин, которые обладают высокой гидрофобностью, стойкостью в тропическом климате.
- Для изготовления термо-, влаго-, электро- и виброизолирующей герметизации различных устройств; изготовления заливок и прокладок для механизмов и приборов.

- Для герметизации простых и многослойных элементов зданий, заделки швов, герметизации фасадов, трубопроводов.
Упаковка и транспортировка
Силиконовый каучук СКТН поставляется в металлических бочках по 200 кг, либо в пластиковых канистрах 20кг.
Транспортировка силоксанового каучука возможна любым видом транспорта в соответствии с правилами перевозки грузов.
Гарантийный срок хранения
Гарантийный срок хранения — 36 месяцев со дня изготовления. Хранить в складском помещении при температуре не выше +30°С в дали от действия прямых солнечных лучей.
Свойства
Марки СКТН А, Б, В, Г – ГОСТ 13835-73, с изм. 1 — 4
| Марки СКТН | А | Б | В | Г | Д | Е | Е1 |
|---|---|---|---|---|---|---|---|
| Условная вязкость | |||||||
| Потеря массы, % масс, не более | |||||||
| Термостабильность, %, не более |  0 0 | ||||||
Copyright © 2013 — 2022 ХимТЭК. Все права защищены.
Спирты — химические свойства, формулы и получение
Химические свойства одноатомных спиртов
Общая формула одноатомных предельных спиртов: CnH2n+1OH. В спиртах, одноатомных и многоатомных, помимо связи между углеродом и водородом (С—ОН), есть еще одна связь между кислородом и водородом (О—Н). Поэтому химические реакции проходят с разрывом одной из цепей:
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Кислотно-основные свойства
Согласно теории Бренстеда-Лоури спирты — достаточно слабые кислоты. Кислотность спиртов уменьшается по мере усложнения углеродного скелета.
Спирты — более слабые кислоты, чем вода, поэтому невозможна реакция с водными растворами щелочей. Взаимодействие с твердыми щелочами возможно, реакция обратима. Равновесие сильно смещено влево.
Основность кислот увеличивается по мере увеличения углеродного скелета.
Замещение гидроксогруппы
Гидроксогруппа является плохо уходящей. Энергия разрыва связи С—О довольно высока, поэтому непосредственное замещение группы ОН на другую группу невозможно.
Для того, чтобы замещение было возможно, группу ОН превращают в хорошо уходящую, т. е. понижают энергию разрыва связи. Для этого:
проводят реакцию в кислой среде;
переводят гидроксигруппу в сульфогруппу применяя H2SO4;
применяют кислоты Льюиса.
R—OH + PCl5 → R—Cl + POCl3 + HCl
R—OH + SOCl2 → R—Cl + SO2 + HCl
R—OH + HCl → R—Cl + H2O
R—OH + PBr → R—Br + H3PO3
R—OH + KBr + H2SO4 → R—Br + KHSO4 + H2O
Реакция с использованием реактива Лукаса
Реактив Лукаса — это смесь ZnCl2 и HCl.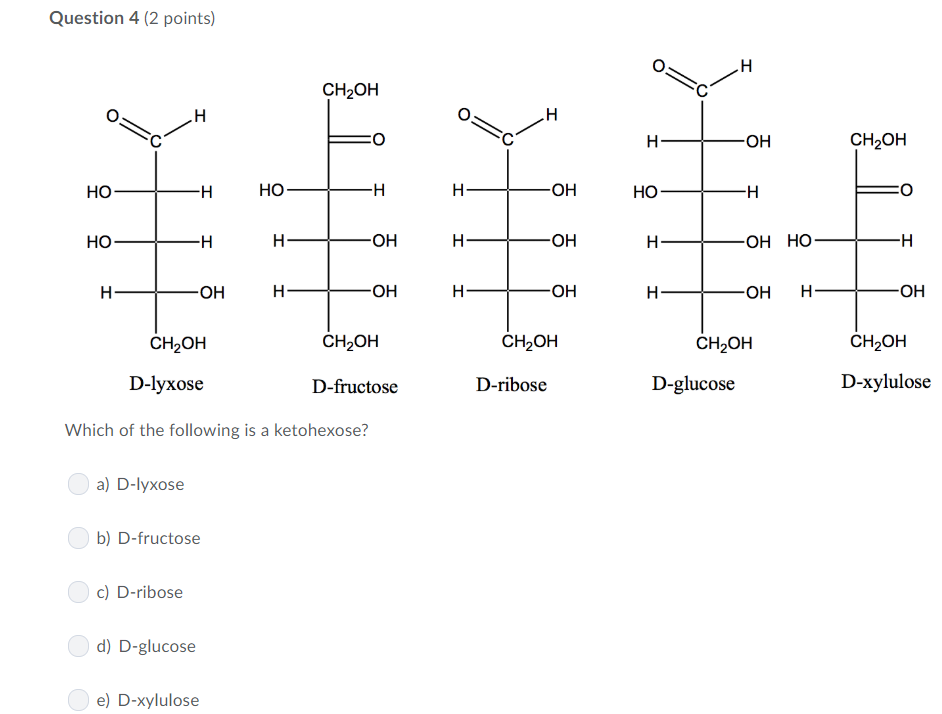 Скорость реакции убывает при упрощении углеродного скелета. Внешним признаком реакции служит расслоение реакционной смеси в случае образования хлоруглеводорода R—Cl, представляющего собой маслообразное нерастворимое вещество.
Скорость реакции убывает при упрощении углеродного скелета. Внешним признаком реакции служит расслоение реакционной смеси в случае образования хлоруглеводорода R—Cl, представляющего собой маслообразное нерастворимое вещество.
Быстрее всего реагируют третичные спирты, слой нерастворимого алкилгалогенида появляется фактически сразу же после смешения реагентов — меньше чем за минуту.
Вторичные спирты вначале растворяются в реактиве, но затем раствор мутнеет, в течение 5 минут появляются капли алкилгалогенида.
Растворы первичных спиртов остаются прозрачными, они образуют хлориды только при нагревании.
Дегидратация спиртов
При температуре &rt; 140°C и в присутствии серной кислоты происходит внутримолекулярная дегидратация. В результате реакции получается алкен.
При температуре < 140°C и в присутствии серной кислоты происходит межмолекулярная дегидратация. В результате образуется простой эфир.
Реакция этерификации — получение сложных эфиров
Предельные одноатомные спирты вступают в химические реакции с карбоновыми кислотами, продукты таких реакций — сложные эфиры.
Взаимодействие с аммиаком
Эта реакция происходит при нагревании и в присутствии катализатора. Гидроксогруппа замещается на аминогруппу. Продукт реакции — амин.
Окисление
Горение спиртов:
C2H5OH + 3O2 → 2CO2 + 3H2O.Жидкофазное окисление с применением хромовой смеси K2Cr2O7 + H2SO4:
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3COOH + K2SO4 + Cr2(SO4)3 + H2O.Окисление оксидом меди (II) при нагревании:
CH3—CH2—OH + CuO → CH3—CHO + Cu + H2O.
Первичные спирты при окислении образуют альдегиды, вторичные переходят в кетоны, третичные окисляются с разрушением углеродного скелета.
Химические свойства многоатомных спиртов
В целом многоатомные спирты сходны с одноатомными, но имеют особенности: проявляют более сильные кислотные свойства и вступают в специфические реакции.
Кислотные свойства
Многоатомные спирты взаимодействуют с щелочными металлами:
Взаимодействие со свежеосажденным гидроксидом меди (II)
Это качественная реакция на многоатомные спирты:
Окисление йодной кислотой и ее солями
Образование эфиров с азотной кислотой
Вопросы для самопроверки
Что такое спирты?
Что образуется при межмолекулярной дегидратации спиртов?
Какую качественную реакцию имеют многоатомные спирты?
Какой характерной реакцией можно получить этанол?
Напишите все виды изомерии для пентанола-1.
Как классифицируют спирты?
Ho2 что это за вещество
Компьютеры admin 0 комментариев
Содержание
- 1 Содержание
- 2 Образование [ править | править код ]
- 3 Химические свойства [ править | править код ]
- 4 Воздействие на окружающую среду [ править | править код ]
- 5 Содержание
- 6 Contents
- 7 Structure and reactions [ edit ]
- 7.1 Reactive oxygen species in biology [ edit ]
- 7.2 Importance for atmospheric chemistry [ edit ]
| Гидропероксильный радикал | |
|---|---|
( <<<картинка>>> ) | |
| Общие | |
| Систематическое наименование | Гидропероксил |
| Традиционные названия | гидродиоксид гидродиоксил |
| Хим. формула | HO2 |
| Физические свойства | |
| Молярная масса | 33,01 г/моль |
| Химические свойства | |
| Константа диссоциации кислоты p K a <displaystyle pK_> | 4. 88 [1] 88 [1] |
| Классификация | |
| Рег. номер CAS | 3170-83-0 |
| PubChem | 520535 |
| SMILES | |
| ChEBI | 25935 |
| ChemSpider | 454055 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидропероксильный радикал или пероксильный радикал — это протонированная форма супероксида с формулой HO2•.
Содержание
Образование [ править | править код ]
Гидропероксильный радикал образуется в результате переноса атома водорода на молекулу кислорода, путём взаимодействия атома кислорода с гидроксильным радикалом (HO•) или протона с супероксид анионом [2] .
Химические свойства [ править | править код ]
В водном растворе супероксид анинон O2 − и гидропероксильный радикал находятся в равновесии:
O2 − + H2O HO2 + OH −
Константа равновесия этого процесса pKa = 4. 88 [3] , из чего можно сделать вывод, что 0,3 % супероксида в цитозоле находится в протонированной форме.
88 [3] , из чего можно сделать вывод, что 0,3 % супероксида в цитозоле находится в протонированной форме.
В отличие от O2 − , который является сильным восстановителем, HO2• в ходе многих биологически важных реакций может вести себя как окислитель, отбирая атомы водорода от токоферола и полиненасышенных жирных кислот липидной мембраны. По этой причине он является одним из основных инициаторов перекисного окисления липидов.
Поскольку диэлектрическая постоянная сильно влияет на pKa, а диэлектрическая проницаемость воздуха весьма мала, образующийся (фотохимически) в атмосфере супероксид практически полностью существует в форме HO2•. Поскольку HO2• весьма реакционноспособен, он действует как атмосферное «моющее средство», разлагая некоторые органические загрязнители. По этой причине химия HO2 имеет геохимическое значение.
Воздействие на окружающую среду [ править | править код ]
Гидропероксильный радикал разрушает озоновый слой стратосферы; он образуется в результате окисления углеводородов в тропосфере [2] .
Гидропероксильный радикал или пероксильный радикал — это протонированная форма супероксида с формулой HO2•.
| Гидропероксильный радикал | |
|---|---|
( <<<картинка>>> ) | |
| Общие | |
| Систематическое наименование | Гидропероксил |
| Традиционные названия | гидродиоксид гидродиоксил |
| Хим. формула | HO2 |
| Физические свойства | |
| Молярная масса | 33,01 г/моль |
| Химические свойства | |
| Константа диссоциации кислоты p K a <displaystyle pK_> | 4.88 [1] |
| Классификация | |
| Рег. номер CAS | 3170-83-0 |
| PubChem | 520535 |
| SMILES | |
Содержание
Гидропероксильный радикал образуется в результате переноса атома водорода на молекулу кислорода, путём взаимодействия атома кислорода с гидроксильным радикалом (HO•) или протона с супероксид анионом [2] .
В водном растворе супероксид анинон O2 − и гидропероксильный радикал находятся в равновесии:
Константа равновесия этого процесса pKa = 4.88 [3] , из чего можно сделать вывод, что 0,3 % супероксида в цитозоле находится в протонированной форме.
В отличие от O2 − , который является сильным восстановителем, HO2• в ходе многих биологически важных реакций может вести себя как окислитель, отбирая атомы водорода от токоферола и полиненасышенных жирных кислот липидной мембраны. По этой причине он является одним из основных инициаторов перекисного окисления липидов.
Поскольку диэлектрическая постоянная сильно влияет на pKa, а диэлектрическая проницаемость воздуха весьма мала, образующийся (фотохимически) в атмосфере супероксид практически полностью существует в форме HO2•. Поскольку HO2• весьма реакционноспособен, он действует как атмосферное «моющее средство», разлагая некоторые органические загрязнители. По этой причине химия HO2 имеет геохимическое значение.
Поскольку HO2• весьма реакционноспособен, он действует как атмосферное «моющее средство», разлагая некоторые органические загрязнители. По этой причине химия HO2 имеет геохимическое значение.
Гидропероксильный радикал разрушает озоновый слой стратосферы; он образуется в результате окисления углеводородов в тропосфере [2] .
| Names | |
|---|---|
| Preferred IUPAC name | |
| Other names | |
| Identifiers | |
| |
| Properties | |
| H O 2 | |
| Molar mass | 33.006 g·mol −1 |
| Acidity (pKa) | 4.88 [1] |
| Basicity (pKb) | 9.12 (basicity of superoxide ion) |
| Conjugate base | Superoxide anion |
The hydroperoxyl radical, also known as the perhydroxyl radical, is the protonated form of superox >[2] ContentsStructure and reactions [ edit ]The molecule has a bent structure. The superox >O − The pKa of HO2 is 4.88. Therefore, about 0.3% of any superox >[4] Reactive oxygen species in biology [ edit ]Importance for atmospheric chemistry [ edit ]Gaseous hydroperoxyl is involved in reaction cycles that destroy stratospheric ozone. It is also present in the troposphere, where it is essentially a byproduct of the ox >[5] Because dielectric constant has a strong effect on pKa, and the dielectric constant of air is quite low, superoxide produced (photochemically) in the atmosphere is almost exclusively present as HO2. As HO2 is quite reactive, it acts as a «cleanser» of the atmosphere by degrading certain organic pollutants. As such, the chemistry of HO2 is of considerable geochemical importance. | |
Spatial Variations in Fish Abundance in the Mekong Delta
База результатов деятельности
научных работников ФИЦ ИнБЮМ
Научно-информационный отдел ФИЦ ИнБЮМ
+7 8692 54-55-50
sci-info@marine-research. org
org
Балл 0
Дата внесения публикации в базу 01-05-2021 07:12 не попадает в период стимулирования 01-12-2021 – 31-11-2022
КБПР (данная функция работает в тестовом режиме) 0.416
Количество соавторов публикации — 8
Публикации в изданиях, индексируемых в Web of Science Core Collection: Q4, K=2.5
формула: K/(Nсоавторов*Nаффил) = 2.5/(8*3) = 0.104
формула: K/(Nсоавторов*Nаффил) = 2.5/(8*3) = 0.104
 Р.: количество аффилиаций — 3, вклад в КБПР публикации:
Р.: количество аффилиаций — 3, вклад в КБПР публикации:
формула: K/(Nсоавторов*Nаффил) = 2.5/(8*3) = 0.104
формула: K/(Nсоавторов*Nаффил) = 2.5/(8*3) = 0.104
Статья в периодическом издании
Spatial Variations in Fish Abundance in the Mekong Delta
WoS 0.557/Q4 SCOPUS 0.299/Q3
| Перевод Оригинальная статья: Пространственные вариации обилия рыб в дельте Меконга // Экология. 2021. № 2. С. 134-142 | |
| DOI | https://doi.org/10.1134/S1067413620050082 |
|---|---|
| Язык | Английский |
| Журнал | Russian Journal of Ecology ISSN: 1067-4136; Онлайн ISSN: 1608-3334 |
| Год | 2021 |
| Выходные данные | Том: 52, Номер: 2, Страницы: 146-154 |
| Авторы |
|
| Даты | Поступила в редакцию: 20. 09.2019 09.2019После доработки 21.02.2020 Принята к публикации: 04.03.2020 Опубликована: 06.04.2021 |
| Абстракт | For the first time, the density of fish population has been quantitatively assessed in the Mekong River delta in the territory of the Socialist Republic of Vietnam. The studies were carried out in the main courses of two main branches, Hau and Tien rivers, into which the Mekong River splits in its lower course, and in the mouth branches of the delta. When comparing the fish abundance at 28 stations of the delta, statistically significant differences in the average specific abundance were found between the main river course and a mixohaline zone of the estuarine ecotone where values of the fish abundance were much lower. The analysis of the relationship between the fish abundance dynamics and different natural and anthropogenic environmental factors has demonstrated a weak significant correlation with salinity, distance from the mouth, the type of fish community and the amount of anthropogenic debris on the bottom. Large fluctuations in the fish abundance parameters associated with aggregated distribution of such species as Polynemusmelanochir, Ariusmaculatus and some representatives of the families Akysidae, Cynoglossidae, and Ariidae are observed in the delta. The results may be used as a baseline for subsequent monitoring of the abundance dynamics of bottom-dwelling fish communities in the Mekong Delta. Large fluctuations in the fish abundance parameters associated with aggregated distribution of such species as Polynemusmelanochir, Ariusmaculatus and some representatives of the families Akysidae, Cynoglossidae, and Ariidae are observed in the delta. The results may be used as a baseline for subsequent monitoring of the abundance dynamics of bottom-dwelling fish communities in the Mekong Delta.Ключевые слова: fish, Mekong River, abundance, distribution, fluctuations, estuary |
| URL | https://link.springer.com/article/10.1134/S1067413620050082 |
Запись создана: 01-05-2021 07:12
Последнее изменение: 19-07-2021 11:07
Текущий статус издания
Russian Journal of Ecology
ISSN: 1067-4136
E-ISSN: 1608-3334
Входит в список ВАК
WoS: Q4
SCOPUS: Q3
Страница журнала в E-library
Библиографическая ссылка:
Karpova E.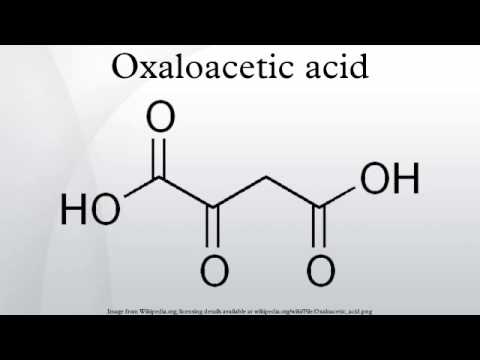 P., Болтачев А. Р., Аблязов Э. Р., Куцын Д. Н., Cu Nguyen Dinh, Truong Ba Hai, Nguyen Van Thinhc, Trinh Thi Lan Tri. Spatial Variations in Fish Abundance in the Mekong Delta // Russian Journal of Ecology. 2021. Vol. 52, no. 2. P. 146-154. https://doi.org/10.1134/S1067413620050082
P., Болтачев А. Р., Аблязов Э. Р., Куцын Д. Н., Cu Nguyen Dinh, Truong Ba Hai, Nguyen Van Thinhc, Trinh Thi Lan Tri. Spatial Variations in Fish Abundance in the Mekong Delta // Russian Journal of Ecology. 2021. Vol. 52, no. 2. P. 146-154. https://doi.org/10.1134/S1067413620050082
[Перевод][WoS 0.557/Q4][SCOPUS 0.299/Q3]
Экспертное заключение: № 444, 2019
Индексация на момент включения в базу:
Web of Science
- Статус
- Да
- Импакт-фактор/Квартиль(год)
- 0.557/Q4 (2019)
- Идентификатор
- —
SCOPUS
- Статус
- Да
- Импакт-фактор/Квартиль(год)
- 0.299/Q3 (2019)
- Идентификатор
- —
РИНЦ
- Статус
- Нет
- ID
- 46284499
- EDN
- –
В публикации указано госзадание:
№ 121030100028-0 «Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна и других районов Мирового океана» (предыдущий номер АААА-А18-118020890074-2)
Буксировочная труба HO Sports Formula 2
youtube.com/embed/tOBGqwQYTIw?controls=1&enablejsapi=1&modestbranding=1&origin=https%3A%2F%2Fcog.ph&playsinline=1&rel=0″ title=»HO Sports Formula 2 towable tube»>Наведите курсор на изображение, чтобы увеличить Нажмите на изображение, чтобы увеличить
Сохранить 0
CoG.ph
Поделитесь этим продуктом
ДОСТУПЕН ДЛЯ ПРЕДЗАКАЗА
ДОСТАВКА 7-10 РАБОЧИХ ДНЕЙ
Formula 2 — это полностью закрытый тюбик, который отлично подходит для детей всех возрастов! Сядьте бок о бок на безопасные сиденья в стиле кокпита Формулы 2 и наслаждайтесь поездкой. Квадратная задняя часть Formula 2 делает ее устойчивой в кнуте, а наш новый цельный пол позволяет легко надувать и сдувать. Сделанный из лучших материалов и имеющий лучшую в отрасли гарантию на 1 год, Formula 2 обязательно станет эпицентром морских приключений вашей семьи.
2 RIDERS — SEATED TOWABLE
BOSTON VALVES
For quick and easy inflation and deflation
HEAVY-DUTY PVC BLADDER
NYLON COVERED SOFT FOAM HANDLES
1 YEAR LIMITED WARRANTY
Guaranteed Lasting Quality с нашей ограниченной гарантией сроком на 1 год
Ваша платежная информация надежно обрабатывается. Мы не храним данные кредитной карты и не имеем доступа к информации о вашей кредитной карте.
Страна
Филиппины
Почтовый индекс
Возврат
Наш полис действует 7 дней. Если с момента покупки прошло 7 дней, к сожалению, мы не можем предложить вам возврат или обмен.
Чтобы иметь право на возврат, ваш товар должен быть неиспользованным и находиться в том же состоянии, в котором вы его получили. Он также должен быть в оригинальной упаковке.
Он также должен быть в оригинальной упаковке.
Некоторые виды товаров не подлежат возврату. Скоропортящиеся товары, такие как продукты питания, цветы, газеты или журналы, возврату не подлежат. Мы также не принимаем товары интимного или санитарного назначения, опасные материалы, легковоспламеняющиеся жидкости или газы.
Дополнительные товары, не подлежащие возврату:
— Подарочные карты
— Загружаемые программные продукты
— Некоторые товары для здоровья и личной гигиены
Для оформления возврата нам потребуется квитанция или подтверждение покупки.
Пожалуйста, не отправляйте покупку обратно производителю.
Существуют определенные ситуации, когда предоставляется только частичное возмещение (если применимо)
— Книга с явными признаками использования
— CD, DVD, кассета VHS, программное обеспечение, видеоигра, кассета или виниловая пластинка, которые были вскрыты
— Любой товар, не находящийся в своем первоначальном состоянии, поврежден или отсутствует по причинам, не связанным с нашей ошибкой
— Любой товар, возвращенный более чем через 30 дней после доставки проверено, мы отправим вам электронное письмо, чтобы уведомить вас о том, что мы получили ваш возвращенный товар. Мы также уведомим вас об одобрении или отклонении вашего возмещения.
Мы также уведомим вас об одобрении или отклонении вашего возмещения.
Если вы одобрены, ваш возврат будет обработан, и кредит будет автоматически применен к вашей кредитной карте или исходному способу оплаты в течение определенного количества дней.
Задержка или отсутствие возврата средств (если применимо)
Если вы еще не получили возмещение, сначала проверьте свой банковский счет еще раз.
Затем свяжитесь с компанией, выпустившей вашу кредитную карту, может пройти некоторое время, прежде чем ваш возврат будет официально отправлен.
Далее обратитесь в свой банк. Часто перед отправкой возмещения требуется некоторое время на обработку.
Если вы сделали все это, но до сих пор не получили возмещение, свяжитесь с нами по адресу [email protected].
Товары для продажи (если применимо)
Возврат возможен только за товары по обычной цене, к сожалению, за товары со скидкой возврат невозможен.
Обмен (если применимо)
Мы заменяем товары только в том случае, если они неисправны или повреждены. Если вам нужно обменять его на такой же товар, отправьте нам электронное письмо по адресу [email protected] и отправьте свой товар в Lubao Pampanga, 2005, Филиппины.
Если вам нужно обменять его на такой же товар, отправьте нам электронное письмо по адресу [email protected] и отправьте свой товар в Lubao Pampanga, 2005, Филиппины.
Подарки
Если товар был помечен как подарок при покупке и доставке непосредственно вам, вы получите подарочный кредит на сумму вашего возврата. После получения возвращенного товара вам будет отправлен подарочный сертификат.
Если товар не был помечен как подарок при покупке, или даритель отправил заказ себе, чтобы передать вам позже, мы отправим возврат дарителю, и он узнает о вашем возврате.
Доставка
Чтобы вернуть товар, отправьте его по почте Lubao Pampanga, 2005, Филиппины
Вы будете нести ответственность за оплату транспортных расходов при возврате товара. Стоимость доставки не возвращается. Если вы получите возмещение, стоимость обратной доставки будет вычтена из вашего возмещения.
В зависимости от того, где вы живете, время, которое может потребоваться для доставки товара по обмену, может различаться.
Если вы отправляете товар стоимостью более 75 долларов США, вам следует рассмотреть возможность использования службы доставки с возможностью отслеживания или приобретения страховки доставки. Мы не гарантируем, что получим ваш возвращенный товар.
2023 HO Sports Formula 2 Person Tube
Написать отзыв
Название по умолчаниюКол-во
- Обычная цена
- $359,99
$0.00
ОТСУТСТВУЕТ НА СКЛАДЕ
В настоящее время у нас нет информации о том, когда этот продукт снова будет в наличии, подпишитесь, чтобы получить уведомление, когда он будет доступен
В НАЛИЧИИ — Отправка
Разместите заказ до 16:00 по восточному поясному времени/13:00 по тихоокеанскому стандартному времени для доставки в тот же день всех товаров, имеющихся на складе.
Артикул: S153981
Подробнее Спецификации Отзывы Часто задаваемые вопросы
Бери друга, садись на кресла в стиле лаунж и готовься к действию.
Formula 2 — это полностью закрытая трубка, которая отлично подходит для детей всех возрастов! Сядьте бок о бок на безопасные сиденья в стиле кокпита Формулы 2 и наслаждайтесь поездкой. Квадратная задняя часть Formula 2 делает ее устойчивой в кнуте, а наш новый цельный пол позволяет легко надувать и сдувать. Сделанный из лучших материалов и имеющий лучшую в отрасли гарантию на 1 год, Formula 2 обязательно станет эпицентром морских приключений вашей семьи.
- Гарантия
- 1 год
- Номер детали производителя
- 22662740
- Товар#
- S153981
- Предупреждение
ПРЕДУПРЕЖДЕНИЕ
Этот продукт может подвергать вас воздействию химических веществ, включая DINP (диизононилфталат) и DIDP (диизодецилфталат), которые, как известно в штате Калифорния, вызывают рак.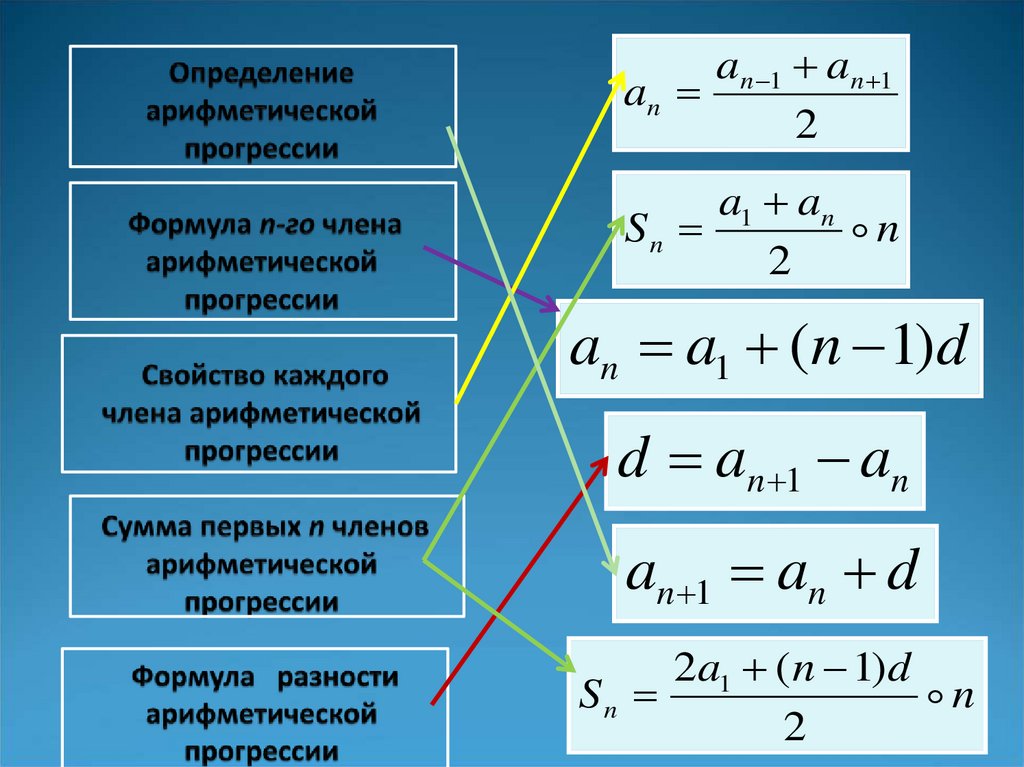 Для получения дополнительной информации посетите сайт https://www.p65warnings.ca.gov.
Для получения дополнительной информации посетите сайт https://www.p65warnings.ca.gov.
Обещание лучшей цены
Мы хотим, чтобы вы получали самые выгодные предложения на товары для лодок. Мы соответствуем рекламируемой цене любого авторизованного дилера для одного и того же товара на складе. Что это значит для вас? Если вы найдете такой же товар в наличии у другого авторизованного продавца, мы с радостью сравним его цену с доставкой. Не забывайте, что в дополнение к нашей бесплатной быстрой доставке (для любого заказа на сумму более 99 долларов США, отправленного в континентальную часть США) мы также предлагаем нашу эксклюзивную пожизненную техническую поддержку.
- WakeMAKERS Обещание лучшей цены распространяется только на продукты, продаваемые авторизованными фабрикой интернет-дилерами.
- WakeMAKERS Обещание лучшей цены не действует с купонами или индивидуальными скидками.
- WakeMAKERS Обещание лучшей цены основано на цене товара с доставкой и включает стоимость доставки и налоги.

- WakeMAKERS Обещание лучшей цены доступно только для точного продукта, имеющегося в наличии, с отображаемой интернет-ценой (цена не подразумевается после рекламных акций и купонов)
- WakeMAKERS Обещание лучшей цены не может применяться задним числом, поэтому, пожалуйста, свяжитесь с нами ДО размещения заказа.
Если у вас есть какие-либо вопросы о нашей политике соответствия цен или если вы хотите, чтобы мы согласовали цену для вас, просто свяжитесь с нами.
Примечание Мы имеем право отказать в сопоставлении цен в любое время по любой причине. Чтобы претендовать на соответствие цены, товар должен быть идентичной марки, модели, года выпуска и номера детали, а также должен находиться на складе. Сопоставление цен не включает товары со скидкой и ранее приобретенные товары.
365 дней возврата
365-дневный возврат
Ваше удовлетворение является нашим самым большим приоритетом, поэтому мы с радостью принимаем возврат любого нового продукта в течение 365 дней с даты отправки вашего заказа. Возврат средств будет произведен на исходный способ оплаты в течение 30 дней с даты первоначальной отправки. Возвраты по заказам старше 30 дней до 365 дней будут обрабатываться как кредит магазина, который можно применить к будущему заказу.
Возврат средств будет произведен на исходный способ оплаты в течение 30 дней с даты первоначальной отправки. Возвраты по заказам старше 30 дней до 365 дней будут обрабатываться как кредит магазина, который можно применить к будущему заказу.
Для получения полной информации о нашей Политике возврата 365, включая любые ограничения и исключения, посетите раздел «Возврат и обмен» на странице обслуживания клиентов.
Консультации экспертов
Наши эксперты по продуктам обладают более чем 40-летним практическим опытом и знаниями в области судостроения. Они действительно разбираются в снаряжении, потому что проводят свободное время на воде с друзьями и семьей, тестируя продукты.
Время работы эксперта по продукту 9утра до 5 вечера (PST) с понедельника по пятницу
Электронная почта эксперта по продукту
Мы отвечаем на большинство писем в течение 24-48 часов.
Ищете специальные руководства по установке или обучающие видеоролики? Посетите наш раздел ресурсов для получения подробной информации.
Инструменты для онлайн-покупок WakeMAKERS Наши инструменты Finder разработаны, чтобы помочь вам выбрать идеальный продукт. Мы упростили сложный процесс поиска подходящего балласта или опоры для вашего стиля катания на лодке и упростили его, проведя исследование за вас.
- Поиск заводского балласта
- Поиск реквизита
- Поиск вейксерфинга
Наша цель проста; предоставить лучший продукт, по лучшей цене, с лучшей поддержкой клиентов.
Бесплатная доставка при заказе на сумму более 9 долларов США9
Последнее, что вы хотите сделать, это платить за доставку вашего заказа при совершении покупок в Интернете, поэтому мы включаем бесплатную доставку для всех заказов на сумму более 99 долларов США *.
*Предложение о бесплатной доставке распространяется на заказы на сумму более 99 долларов США, отправленные в пределах континентальной части США, и не может сочетаться с другими скидками или рекламными акциями (включая коды купонов).
19 HO Formula 3 (3 человека)
19 HO Formula 3 (3 человека)Вам необходимо включить Javascript.
- 309-928-9498
- [email protected]
- Новый
- Рекомендуемый
- Распродажа!
Дом > 19 HO Formula 3 (3 человека)
Цена: 399,99 $
Марка: HO
Количество:
Добавить
Буксируемый тюбик HO Sports Formula 3 2019 — это сидячий тюбик для 3 гонщиков. Низкий центр тяжести и квадратная спинка обеспечивают устойчивость в поворотах, а ручки из мягкого пеноматериала и надувное дно обеспечивают комфортную езду по неспокойной воде. Трубка HO Formula 3, способная буксировать 1, 2 или 3 гонщика, обязательно будет в центре внимания. Сделанный из лучших материалов и имеющий лучшую в отрасли гарантию на 1 год, Formula 3 вас не подведет.
Сделанный из лучших материалов и имеющий лучшую в отрасли гарантию на 1 год, Formula 3 вас не подведет.
— Размеры 94 x 90 дюймов (надутые)
— Надежные сиденья в стиле кокпита — особенно популярны среди детей
— Номер для 3 взрослых — 510 фунтов. рекомендуемая емкость
— Одинаково хорошо работает с 1, 2 или 3 райдерами
— Буксирный крюк HO Quick Connect для удобного крепления веревки
— 2-ходовой клапан Boston для быстрого и легкого надувания и спуска воздуха
Информация
- О нас
- Доставка и возврат
- Privacy Policy
- Terms & Conditions
Customer Service
- Track Orders
- Contact Us
My Account
- My Account
- Order History
- Address Book
Call us:
- 309-928-9498
© Оверсток Лыжи. Все права защищены. Дизайн KREATIVE
Наш веб-сайт использует файлы cookie, чтобы сделать ваш просмотр более удобным. Используя наш сайт, вы соглашаетесь на использование нами файлов cookie. Учить больше
Я согласен
Используя наш сайт, вы соглашаетесь на использование нами файлов cookie. Учить больше
Я согласен
× Что такое файлы cookie
Как это принято почти на всех профессиональных веб-сайтах, этот сайт использует файлы cookie, представляющие собой крошечные файлы, которые загружаются на ваш компьютер для улучшения вашего опыта. На этой странице описывается, какую информацию они собирают, как мы ее используем и почему нам иногда нужно хранить эти файлы cookie. Мы также расскажем, как вы можете предотвратить сохранение этих файлов cookie, однако это может привести к понижению или «нарушению» определенных элементов функциональности сайтов.
Для получения более общей информации о файлах cookie см. статью Википедии о файлах cookie HTTP. Как мы используем файлы cookie
Мы используем файлы cookie по целому ряду причин, описанных ниже. К сожалению, в большинстве случаев не существует стандартных вариантов отключения файлов cookie без полного отключения функций и функций, которые они добавляют на этот сайт. Рекомендуется оставить все файлы cookie, если вы не уверены, нужны они вам или нет, в случае, если они используются для предоставления услуги, которую вы используете. Отключение файлов cookie
Вы можете запретить установку файлов cookie, изменив настройки своего браузера (как это сделать, см. Справку браузера). Имейте в виду, что отключение файлов cookie повлияет на функциональность этого и многих других веб-сайтов, которые вы посещаете. Отключение файлов cookie обычно приводит к отключению определенных функций и функций этого сайта. Поэтому рекомендуется не отключать файлы cookie. Файлы cookie, которые мы устанавливаем
Рекомендуется оставить все файлы cookie, если вы не уверены, нужны они вам или нет, в случае, если они используются для предоставления услуги, которую вы используете. Отключение файлов cookie
Вы можете запретить установку файлов cookie, изменив настройки своего браузера (как это сделать, см. Справку браузера). Имейте в виду, что отключение файлов cookie повлияет на функциональность этого и многих других веб-сайтов, которые вы посещаете. Отключение файлов cookie обычно приводит к отключению определенных функций и функций этого сайта. Поэтому рекомендуется не отключать файлы cookie. Файлы cookie, которые мы устанавливаем
Файлы cookie, связанные с учетной записью
Если вы создадите у нас учетную запись, мы будем использовать файлы cookie для управления процессом регистрации и общего администрирования. Эти файлы cookie обычно удаляются, когда вы выходите из системы, однако в некоторых случаях они могут сохраняться впоследствии, чтобы запомнить ваши настройки сайта при выходе из системы. Файлы cookie, связанные с входом в систему
Мы используем файлы cookie, когда вы входите в систему, чтобы мы могли запомнить этот факт. Это избавляет вас от необходимости входить в систему каждый раз, когда вы посещаете новую страницу. Эти файлы cookie обычно удаляются или очищаются, когда вы выходите из системы, чтобы обеспечить доступ к ограниченным функциям и областям только при входе в систему. Файлы cookie, связанные с формами
Когда вы отправляете данные через форму, такую как те, которые можно найти на страницах контактов или формах комментариев, файлы cookie могут быть настроены для запоминания ваших данных пользователя для будущей переписки. Файлы cookie предпочтений сайта
Чтобы обеспечить вам максимальное удобство на этом сайте, мы предоставляем функциональные возможности для установки ваших предпочтений в отношении того, как этот сайт работает, когда вы его используете. Чтобы запомнить ваши предпочтения, нам необходимо установить файлы cookie, чтобы эта информация могла вызываться всякий раз, когда вы взаимодействуете со страницей, на которую влияют ваши предпочтения.
Файлы cookie, связанные с входом в систему
Мы используем файлы cookie, когда вы входите в систему, чтобы мы могли запомнить этот факт. Это избавляет вас от необходимости входить в систему каждый раз, когда вы посещаете новую страницу. Эти файлы cookie обычно удаляются или очищаются, когда вы выходите из системы, чтобы обеспечить доступ к ограниченным функциям и областям только при входе в систему. Файлы cookie, связанные с формами
Когда вы отправляете данные через форму, такую как те, которые можно найти на страницах контактов или формах комментариев, файлы cookie могут быть настроены для запоминания ваших данных пользователя для будущей переписки. Файлы cookie предпочтений сайта
Чтобы обеспечить вам максимальное удобство на этом сайте, мы предоставляем функциональные возможности для установки ваших предпочтений в отношении того, как этот сайт работает, когда вы его используете. Чтобы запомнить ваши предпочтения, нам необходимо установить файлы cookie, чтобы эта информация могла вызываться всякий раз, когда вы взаимодействуете со страницей, на которую влияют ваши предпочтения.
Файлы cookie третьих лиц В некоторых особых случаях мы также используем файлы cookie, предоставленные доверенными третьими лицами. В следующем разделе подробно описано, с какими сторонними файлами cookie вы можете столкнуться на этом сайте.
Этот сайт использует Google Analytics, который является одним из самых распространенных и надежных аналитических решений в Интернете, помогая нам понять, как вы используете сайт, и способы, которыми мы можем улучшить ваш опыт. Эти файлы cookie могут отслеживать такие вещи, как время, которое вы проводите на сайте, и страницы, которые вы посещаете, чтобы мы могли продолжать создавать привлекательный контент.
Для получения дополнительной информации о файлах cookie Google Analytics посетите официальную страницу Google Analytics. Мы также используем кнопки социальных сетей и/или плагины на этом сайте, которые позволяют вам подключаться к социальной сети различными способами. Чтобы они работали, социальные сети могут устанавливать файлы cookie через наш сайт, которые могут использоваться для улучшения вашего профиля на их сайте или для достижения других целей, изложенных в их соответствующих политиках конфиденциальности.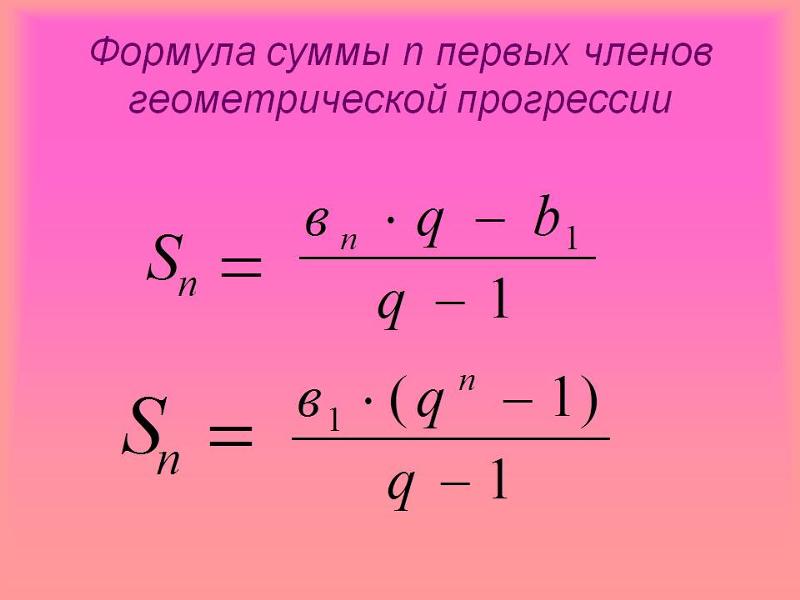
Трубка HO Sports Formula 2
БЕСПЛАТНАЯ доставка при заказе на сумму более 50 долларов США*!
*Могут применяться некоторые исключения.
Какие товары доставляются бесплатно?
Если общая сумма вашего заказа составляет 50 долларов США или более, вы имеете право на бесплатную доставку наземным транспортом UPS. Предложения о бесплатной доставке применяются к общей сумме вашего заказа после применения любых рекламных акций или кредитов. Крупные или тяжелые предметы, такие как велосипеды, байдарки, байдарки, грузовые ящики и т. д., могут не подпадать под действие нашего предложения по бесплатной доставке или могут быть доступны только для получения в магазине. Для продуктов с этими ограничениями доступные варианты доставки будут отображаться на странице продукта или при оформлении заказа.
ДОСТАВКАДоставка осуществляется только в США (нижние 48 штатов, Аляска, Гавайи и Пуэрто-Рико).
Мы знаем, что вы рады получить свое снаряжение, и мы очень рады доставить его вам! Заказы, размещенные на BlueZoneSports. com, обычно доставляются из наших магазинов в течение 1-2 рабочих дней.
com, обычно доставляются из наших магазинов в течение 1-2 рабочих дней.
Чтобы обеспечить наилучший ассортимент на BlueZoneSports.com, мы выполняем все заказы из нашей сети магазинов. Хотя это может сократить время доставки, это может привести к тому, что части вашего заказа будут отправлены в нескольких упаковках и/или иметь несколько оценок доставки.
МЕЖДУНАРОДНАЯ ДОСТАВКАМы понимаем, что многие искатели приключений за пределами США хотят испытать BlueZone. К сожалению, в настоящее время мы не можем отправлять посылки за границу.
BIKE FLIGHTS Все заказы на велосипеды, размещенные на BlueZoneSports.com, будут отправлены через Bike Flights. Bike Flights — это служба перевозки пассажиров 3 rd , которую мы используем для обеспечения безопасной доставки вашего велосипеда. Эта услуга позволит нам добавить страховку к вашему пакету и может потребовать подписи при доставке в зависимости от суммы вашего заказа. Пожалуйста, подождите 3-4 рабочих дня, чтобы ваш заказ на велосипед был обработан. Все велосипеды поставляются из наших торговых точек и сначала собираются и проверяются нашей командой опытных специалистов по велосипедам, а затем переупаковываются и отправляются вам. Вы получите отдельное электронное письмо с информацией об отслеживании.
Пожалуйста, подождите 3-4 рабочих дня, чтобы ваш заказ на велосипед был обработан. Все велосипеды поставляются из наших торговых точек и сначала собираются и проверяются нашей командой опытных специалистов по велосипедам, а затем переупаковываются и отправляются вам. Вы получите отдельное электронное письмо с информацией об отслеживании.
Обратите внимание, что велосипеды некоторых марок мы не можем доставить, однако у нас есть возможность забрать их в магазине.
Окончательная сборка всех приобретенных велосипедов ДОЛЖНА выполняться квалифицированным специалистом по велосипедам. Отказ от сборки велосипеда квалифицированным специалистом И с сохранением копии квитанции об оплате труда может привести к аннулированию гарантии производителя и может привести к повреждению и/или травмам в случае неправильной сборки. Обратите внимание, что в соответствии с отраслевым стандартом некоторые велосипеды могут иметь незначительные косметические дефекты из-за характера доставки. Пожалуйста, сообщите о любой поврежденной детали, которая влияет на безопасность или ходовые качества вашего велосипеда, сразу после получения.
Пожалуйста, сообщите о любой поврежденной детали, которая влияет на безопасность или ходовые качества вашего велосипеда, сразу после получения.
Информацию о доставке, такую как изменение адреса, можно изменить до момента отправки. После того, как ваша посылка покинет наш магазин, вам нужно будет работать с перевозчиком, чтобы скорректировать информацию.
После того, как вы разместили свой заказ, мы не можем изменить способ доставки. Пожалуйста, внимательно проверьте свой заказ перед отправкой, чтобы убедиться, что вы выбрали правильный способ доставки.
Если у вас есть код доступа или специальные инструкции по доставке, мы рекомендуем использовать варианты бесплатной доставки от UPS. Эти сервисы предупредят вас о входящих посылках, позволят добавить инструкции по доставке, изменить график доставки и многое другое. Регистрация этих сервисов бесплатна, однако за некоторые функции может взиматься плата. Для получения дополнительной информации об этих услугах, пожалуйста, перейдите по ссылке ниже.
UPS My Choice
РАСЧЕТ ДОСТАВКИДоставка наземным транспортом UPS и UPS 2 nd Сроки доставки воздушным транспортом являются приблизительными. Сроки доставки не зависят от нас, как только ваше снаряжение покинет наши магазины, и мы не можем гарантировать временные рамки этих способов доставки. Просмотр расчетных дней наземного транзита UPS в зависимости от того, когда ваша посылка покидает наши магазины. Обратите внимание, что UPS не гарантирует сроки доставки, и они являются приблизительными.
- 1-3 рабочих дня: CA, NV, OR, WA, ID, UT, AZ, NM, CO, WY, OK, AK, HI
- 4-5 рабочих дней: MT, ND, SD, NE, KS, TX, MN, IA, MO, AR, LA, WI, IL, IN, MI, OH, KY, TN, MS, AL, GA , FL, SC, NC, VA, WV, PA, DE, MD, NJ, NY, CT, RI, MA, NH, VT, ME
- 6 рабочих дней: PR
Нужно отменить заказ? Мы понимаем, всякое бывает. Если вам нужно отменить свой заказ, пожалуйста, свяжитесь с нами по телефону:
Если вам нужно отменить свой заказ, пожалуйста, свяжитесь с нами по телефону:
- через чат
- [email protected]
- (844) 786-6486
Обратите внимание, что если вы отменяете заказ, который уже покинул наш магазин, из вашего возмещения может быть вычтена комиссия за перенаправление пакета в размере 20 долларов США.
ПОДПИСИЧтобы гарантировать, что ваша посылка будет доставлена вам в целости и сохранности, мы в BlueZone Sports оставляем за собой право потребовать подпись во время доставки любого заказа. Все заказы на сумму более 250 долларов США потребуют вашей подписи по прибытии. Пожалуйста, не забудьте проверить статус отслеживания, чтобы знать, когда ожидается прибытие вашего заказа.
ПОСЫЛОЧНЫЕ УСЛУГИ Некоторые люди за пределами США могут использовать экспедиторские услуги для доставки своего снаряжения за границу. Имейте в виду, что BlueZone Sports и партнеры и поставщики BlueZone Sports не несут ответственности за ущерб или расходы, которые могут возникнуть после доставки посылки по адресу доставки, указанному при покупке. Если вы планируете использовать услугу пересылки посылок, пожалуйста, свяжитесь с нами перед размещением заказа.
Если вы планируете использовать услугу пересылки посылок, пожалуйста, свяжитесь с нами перед размещением заказа.
Мы хотим, чтобы вы вовремя получили свое снаряжение для следующего приключения, но бывают времена года, когда нам нужно дать нашим трудолюбивым работникам UPS дополнительный день или два. Пожалуйста, дайте вашей посылке несколько дополнительных дней, если вы разместили свой заказ примерно в одну из этих дат.
- День памяти | 31 мая st , 2022
- День Независимости | 4 июля -й -й, 2022-й -й
- День труда | 5 сентября -й -й, 2022-й -й
- День благодарения | 24 ноября -й -й, 2022
- Сочельник | 24 декабря -й -й , 2022 -й
- Рождество | 25 декабря -й -й , 2022 -й
- Канун Нового года | 31 декабря st , 2022
- Новый год | 1 января st , 2023
Обратите внимание, что наши магазины закрыты на День Благодарения и Рождество.
Вы будете получать уведомления об обновлении статуса по электронной почте по мере того, как ваш заказ проходит процесс доставки.
Статус вашего заказа также можно узнать, выполнив следующие действия.
- Войдите в свою учетную запись BlueZoneSports.com, нажав кнопку «Моя учетная запись» в правом верхнем углу
- После входа в систему нажмите «Просмотреть историю/статус заказов».
- Найдите свой заказ в списке «История заказов» и нажмите «Просмотреть подробности»
- Статус вашего заказа будет отображаться справа
После того, как ваш заказ будет обработан и отправлен, вам будет отправлено электронное письмо с подтверждением доставки, содержащее ваш номер для отслеживания.
Информацию об отслеживании также можно найти, выполнив следующие действия.
- Войдите в свою учетную запись BlueZoneSports.
 com, нажав кнопку «Моя учетная запись» в правом верхнем углу
com, нажав кнопку «Моя учетная запись» в правом верхнем углу - После входа в систему нажмите «Просмотреть историю/статус заказов».
- Найдите свой заказ в списке «История заказов» и нажмите «Просмотреть подробности»
- Ваш номер для отслеживания будет расположен справа
Хотите вернуть товар? Иногда что-то просто не получается. Ознакомьтесь с нашей политикой возврата и обмена здесь.
Все возвраты отправляйте по адресу:
BlueZoneSports.com
Attn: Returns
2480 Precision Drive Suite H
Minden, NV 89423
HO Formula 2 Inflatable
Наведите курсор на изображение, чтобы увеличить
HO Skis
Сэкономьте 5%
Поделитесь этим продуктом
Для больших детей, чтобы расслабиться, или для маленьких, чтобы повеселиться, HO Formula 2 — это идеальная надувная лодка в стиле кокпита, которую можно поставить за лодкой. Формула, обеспечивающая комфорт и большую площадь сидений, подойдет практически любому.
Формула, обеспечивающая комфорт и большую площадь сидений, подойдет практически любому.
Материалы
- Внутренний баллон из ПВХ калибра 28
- Наружная крышка из сверхпрочного нейлона
Размеры
- 75 x 73 дюйма (190 x 185 см)
Вместимость
- 2 велосипедиста
Особенности
- P.U. Покрытие ткани
- Мягкие тканые рукоятки, с мягкой защитой суставов
- Усиленная буксирная система быстрого соединения
- Большие утопленные сиденья
- Бостонский клапан для тяжелых условий эксплуатации
Гарантия
- 1 год ограниченной гарантии производителя
ФОРМА ВОЗВРАТА
Мы уверены в нашей продукции и в нашем торговом персонале, чтобы убедиться, что вы получите самые лучшие продукты. Если у вас есть какие-либо вопросы о продуктах, позвоните нам или отправьте электронное письмо, и мы будем рады ответить на ваши вопросы, чтобы вы могли принять более обоснованное решение.
Даже с самой лучшей помощью вы можете иногда получить неправильный размер, так как мы являемся местным, независимым магазином и не предлагаем возврат средств «передумали» (включая неправильный размер), однако мы рады предложить вам кредит магазина , который длится до 3 лет при соблюдении следующих условий
- Возврат в течение 30 дней с даты покупки (или даты доставки для онлайн-заказов).
- Подтверждение покупки прилагается
- Предметы должны быть отправлены обратно в том состоянии, в котором вы их получили, и с оригинальная коробка и/или упаковка в пригодном для продажи состоянии, включая бирки производителя , если применимо. Клиенты несут ответственность за то, чтобы все возвращенные товары были доставлены в Skiforce Australia в их первоначальном состоянии.
Если вы считаете, что ваше снаряжение подлежит гарантийной оценке производителем из-за дефекта материалов или изготовления, свяжитесь с нами, и мы поможем вам выполнить соответствующие действия.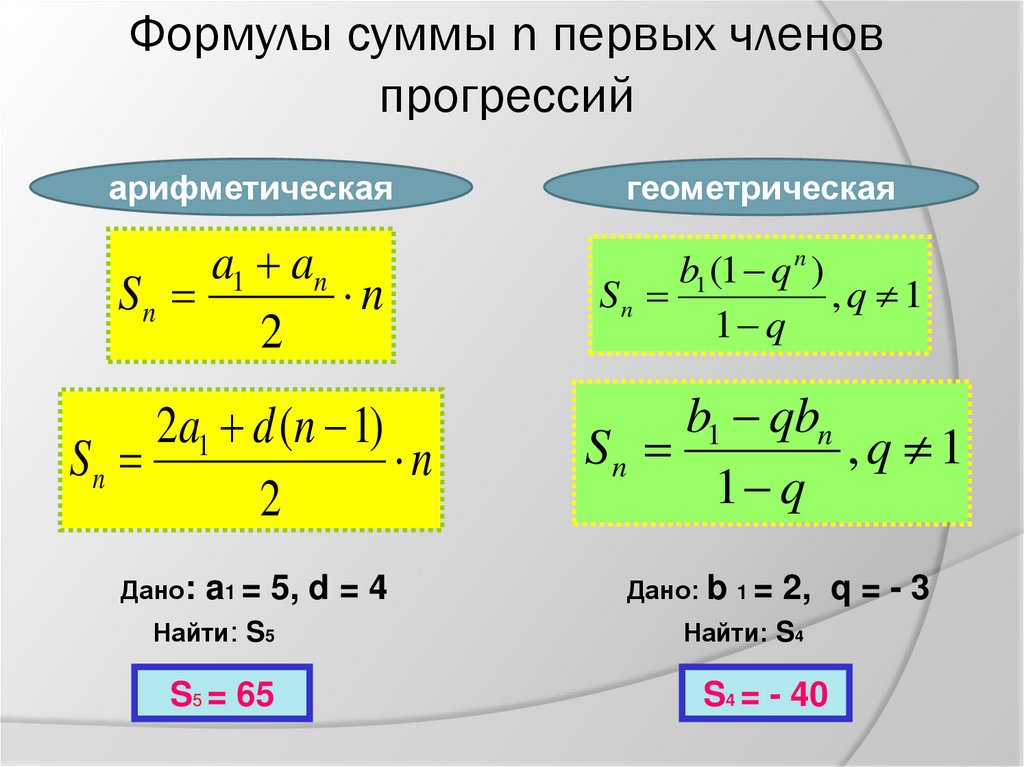 Пожалуйста, приложите фотографии проблемы, чтобы мы могли ускорить процесс. Узнайте больше на нашей странице гарантии.
Пожалуйста, приложите фотографии проблемы, чтобы мы могли ускорить процесс. Узнайте больше на нашей странице гарантии.
ВОЗВРАТ И ОБМЕН
Иногда нужно обменять товар на что-то другое — такое бывает.
Сделать возврат легко. Пожалуйста, следуйте инструкциям ниже, чтобы сделать процесс быстрым и легким для всех.
- Заполните и распечатайте следующую форму: ФОРМА ВОЗВРАТА . Если вы не можете распечатать форму возврата, достаточно рукописной заметки со всей необходимой информацией.
- Потратьте время на тщательную упаковку возвращаемых товаров. Покупатель обязан оплатить расходы, связанные с ремонтом возвращенных товаров, поврежденных при транспортировке из-за неправильной упаковки.
- При возврате продукта в его коробке, пожалуйста, оберните коробку, чтобы защитить ее, прежде чем приклеивать ленту, и не прикрепляйте транспортировочные этикетки непосредственно к коробке.
 В противном случае может взиматься комиссия или уменьшаться сумма вашего кредита в магазине.
В противном случае может взиматься комиссия или уменьшаться сумма вашего кредита в магазине. - Отправьте посылку по адресу, указанному в бланке возврата (приложите заполненный бланк возврата к внешней стороне посылки)
- Как только мы получим товар по почте , мы свяжемся с вами, чтобы подтвердить изменение продукта/размера или организовать кредит в магазине.
Skiforce не оплачивает доставку на биржах, и вам будет предложено оплатить доставку в обоих направлениях. Когда это возможно, мы постараемся предоставить вам наилучшие возможные цены, и мы можем принять меры, чтобы объединить ваш обмен в другой заказ, если вы планируете приобрести больше продуктов. Если вы потратите дополнительно 50 долларов, мы отправим ваш обмен бесплатно.
У вас есть до 30 дней с даты покупки, чтобы обработать обмен, но стоимость обмена основана на текущей цене предмета, а не на первоначальной цене.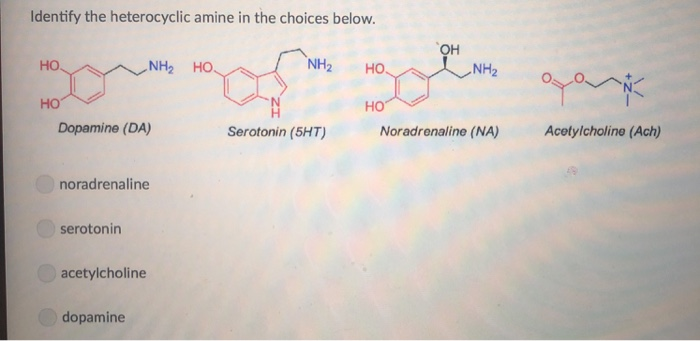
Пожалуйста, присылайте ваши обмены по адресу:
Skiforce Australia
Attn: Exchanges and Returns
392 Plenty Rd
Preston VIC 3072
Мы позвоним или напишем вам, как только получим ваши товары обратно.
Как правило, мы можем произвести обмен в течение 24 часов в обычный рабочий день после того, как мы поговорили с клиентом.
Если у вас есть смягчающие обстоятельства, мы можем оформить возврат с уплатой 20 % платы за пополнение запасов и обработку , а также первоначальной стоимости доставки если доставка была предоставлена нами бесплатно. Как и в случае обмена, мы также просим вас оплатить доставку для возврата, и он должен быть обработан в течение 30 дней с момента первоначальной покупки.
Плата за возврат не будет обработана, если мы допустили ошибку в заказе или если вы хотите обработать успешную гарантию.
ГАРАНТИЙНАЯ ПОЛИТИКА Посмотрим правде в глаза, мы все ездим тяжело, и игрушки, на которых мы играем, обязательно выдержат некоторое обращение. Практически все производители это понимают и предоставляют гарантию на дефекты и качество изготовления. На каждый новый продукт, продаваемый Skiforce, распространяется отдельная гарантия производителя. Пожалуйста, посетите веб-сайт производителя для получения информации об их конкретной гарантийной политике. Все решения по гарантии принимает производитель. Все расходы по обратной доставке несет покупатель. Как австралийский продавец вейк и водных лыж, мы можем гарантировать только продукты, приобретенные в нашем магазине и на веб-сайте. Пожалуйста, имейте при себе доказательство покупки в Skiforce, когда имеете дело с любыми гарантиями.
Практически все производители это понимают и предоставляют гарантию на дефекты и качество изготовления. На каждый новый продукт, продаваемый Skiforce, распространяется отдельная гарантия производителя. Пожалуйста, посетите веб-сайт производителя для получения информации об их конкретной гарантийной политике. Все решения по гарантии принимает производитель. Все расходы по обратной доставке несет покупатель. Как австралийский продавец вейк и водных лыж, мы можем гарантировать только продукты, приобретенные в нашем магазине и на веб-сайте. Пожалуйста, имейте при себе доказательство покупки в Skiforce, когда имеете дело с любыми гарантиями.
ЭТАПЫ ОФОРМЛЕНИЯ ГАРАНТИЙНЫХ ОБЯЗАТЕЛЬСТВ
Шаг 1. Определить, должны ли повреждения покрываться гарантией. Вот несколько вещей, на которые НЕ распространяется гарантия:
- Нормальный износ в результате стандартного использования, который происходит с течением времени. (сколотый верхний лист, выцветший на солнце верхний лист и т.
 д.)
д.) - Повреждение в результате контакта с предметами. (Рельсы, кикеры, бревна, пни, козлята, лыжники и т.д.)
- Повреждение изделия в результате неправильного ухода или излишней шероховатости. (бросать его на банку, продукт слетает с подставок для досок и т. д.)
- Детали, оборудование, принадлежности, которые были утеряны или пропали без вести ПОСЛЕ получения вашего груза.
Шаг 2. Напишите нам по электронной почте о своей гарантии и приложите CLEAR и подробные изображения, поясняющие проблему. Размытые фотографии не принимаются.
Если у вас есть какие-либо вопросы, не стесняйтесь звонить нам. Мы хотим, чтобы вы отказались от своего продукта так же часто, как вы хотите его использовать, и постараемся получить ответ в течение 48 часов с момента получения продукта.
Шаг 3. Мы свяжемся с вами и предоставим дальнейшие инструкции.
Следующий шаг зависит от производителя, и мы предоставим вам все подробности для следующего шага. Если ваша претензия по гарантии будет принята, вам придется отправить свой продукт обратно к нам, чтобы мы могли подтвердить гарантию у производителя. Ответственность за обратную доставку по гарантийным претензиям несет покупатель. Производитель или Skiforce покроет стоимость доставки всех элементов, замененных или отремонтированных по гарантии.
Если ваша претензия по гарантии будет принята, вам придется отправить свой продукт обратно к нам, чтобы мы могли подтвердить гарантию у производителя. Ответственность за обратную доставку по гарантийным претензиям несет покупатель. Производитель или Skiforce покроет стоимость доставки всех элементов, замененных или отремонтированных по гарантии.
Сообщите нам, если вы спешите и хотели бы доплатить за экспресс-доставку по гарантийному возврату.
Бесплатная доставка свыше 50 долларов США*
Если ваш заказ превышает 50 долларов США и отправляется на адрес в Австралии, мы отправим его бесплатно! Нажмите здесь для получения более подробной информации.
Возврат в течение 30 дней
Чтобы ознакомиться с нашей политикой возврата, нажмите здесь
Свяжитесь с нами!
Свяжитесь с нами по телефону, электронной почте или в социальных сетях. Нажмите здесь для получения более подробной информации.
Купи сейчас, заплати потом
Купите сейчас, а платите позже с помощью Zip Pay и AfterPay.
2023 HO Буксируемый туннель Formula 2 | Waterskis.com
Сопутствующие товары
В корзину
Быстрый просмотр
2023 HO 4G буксируемая труба
HO Sports
MSRP: $685.00
Сейчас: 599,99 $
2023 HO 4G Буксируемая труба HO Sports с гордостью представляет новый модульный буксируемый 4G. Возьмите 3 своих друзей и сядьте на эргономичные сиденья в стиле гостиной ИЛИ переверните трубу и встаньте на колени на…
В корзину
Быстрый просмотр
2023 HO Mavericks 2 Буксируемая труба
HO Sports
MSRP: $270.00
Сейчас: 234,99 $
Трубка HO Mavericks 2
Трубка HO Mavericks 2 представляет собой трубу премиум-класса в стиле палубы, которая обеспечивает больше места для ног благодаря профилю в форме буквы «D». Благодаря технологии softshell вы можете слушать музыку весь день…
Благодаря технологии softshell вы можете слушать музыку весь день…
В корзину
Быстрый просмотр
2023 HO Mavericks 3 Буксируемая труба
HO Sports
MSRP: $405.00
Сейчас: 349,99 $
Трубка HO Mavericks 3 В Mavericks 3 используется технология HO Sports Softshell, благодаря которой вы можете ходить на тюбинг весь день! Больше никакой сыпи на трубке от скольжения и подпрыгивания на этой трубке для 3 человек…
В корзину
Быстрый просмотр
2023 HO Sunset 2 Буксируемая труба
HO Sports
MSRP: $230.00
Сейчас: 199,99 $
HO Sunset 2 Towable Tube
Трубка Sunset 2 — это классическая палубная труба, которая идеально подходит для вас и вашего друга! В нем используется технология HO Sports Softshell, позволяющая слушать музыку весь день!. ..
..
Клиенты также просмотрели
В корзину
Быстрый просмотр
HO 12-вольтовый трубчатый инфлятор/дефлятор
HO Sports
MSRP: $45.00
Сейчас: 34,99 $
HO 12-вольтовый трубчатый нагнетатель/дефлятор Возможность надувать и сдувать камеры в вашей лодке — это огромное преимущество и удобство, и один из наших превосходных надувных/дефляторов HO определенно улучшит ваше…
В корзину
Быстрый просмотр
Radar 2.5 PSI Высокообъемный насос для надувания трубок
Радарные лыжи
Сейчас: 79,99 $
Radar 2,5 PSI Высокообъемный насос для накачивания трубок
Если вы устали ждать, пока ваша трубка накачается, вам нужен насос Radar 2. 5 PSI High Volume Tube Inflator. Это трубка на 12 вольт, так что вы можете…
5 PSI High Volume Tube Inflator. Это трубка на 12 вольт, так что вы можете…
Добавить в корзину
Быстрый просмотр
HO 2K Tube Rope
HO Sports
MSRP: $25.00
Сейчас: 24,99 $
HO 1-2 Трос пассажирской трубы Отличная трубчатая веревка для 1-2 человек! Трубчатый канат Accurate 2k не только хорошо выглядит, но и изготовлен из высококачественного материала для изготовления прочного и долговечного трубчатого каната. — 2,375…
Добавить в корзину
Быстрый просмотр
2022 Radar Edge 2 Towable Tube — 2 человека
Радарные лыжи
Сейчас: $199,99
2022 Radar Edge 2 Буксируемая труба-2 человека
Edge 2 — это отличное времяпрепровождение.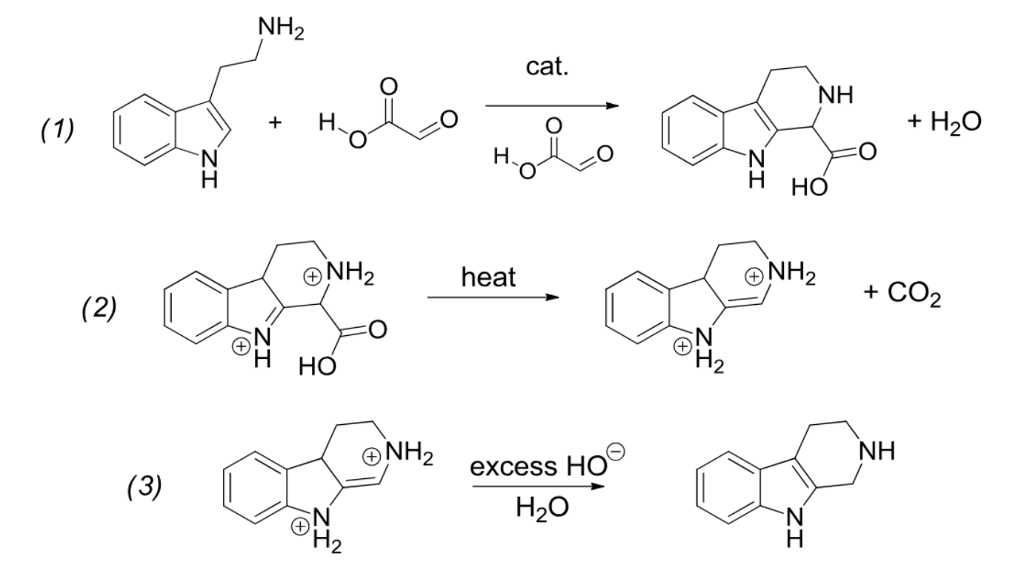 Свернутые углы позволяют вам нестись высоко на лодке, даже не ловя воду.
Свернутые углы позволяют вам нестись высоко на лодке, даже не ловя воду.
В корзину
Быстрый просмотр
Буксируемая труба O’Brien LeTube 2022 года
OBrien
MSRP: $120.00
Сейчас: 99,99 $
2022 O’Brien LeTube Towable Tube LeTube — это абсолютная классика, которая уже более 25 лет является бестселлером! Когда люди думают о трубках любого рода, это то, что они себе представляют. Этот сингл…
В корзину
Быстрый просмотр
2023 HO Sunset 2 Буксируемая труба
HO Sports
MSRP: $230.00
Сейчас: 199,99 $
HO Sunset 2 Towable Tube
Трубка Sunset 2 — это классическая палубная труба, которая идеально подходит для вас и вашего друга! Он оснащен технологией HO Sports Softshell, которая позволяет вам работать с трубкой весь день!.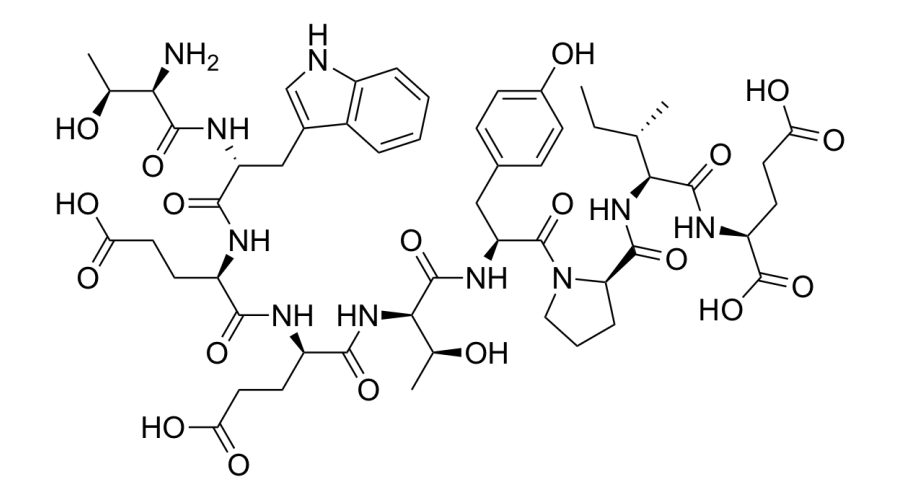 ..
..
Добавить в корзину
Быстрый просмотр
2023 HO Mavericks 2 Буксируемая труба
HO Sports
MSRP: $270.00
Сейчас: 234,99 $
Трубка HO Mavericks 2 Трубка HO Mavericks 2 представляет собой трубу премиум-класса в стиле палубы, которая обеспечивает больше места для ног благодаря профилю в форме буквы «D». Благодаря технологии softshell вы можете слушать музыку весь день…
Добавить в корзину
Быстрый просмотр
Буксируемая труба O’Brien Super Screamer 2022 года
OBrien
MSRP: $220.00
Сейчас: 179,99 $
2022 O’Brien Super Screamer Towable Tube
Вы услышите серьезные крики, но, что более важно, много смеха! Super Screamer может перевозить до двух гонщиков, так что вам понравится.

 5-1.2 g/cm³
5-1.2 g/cm³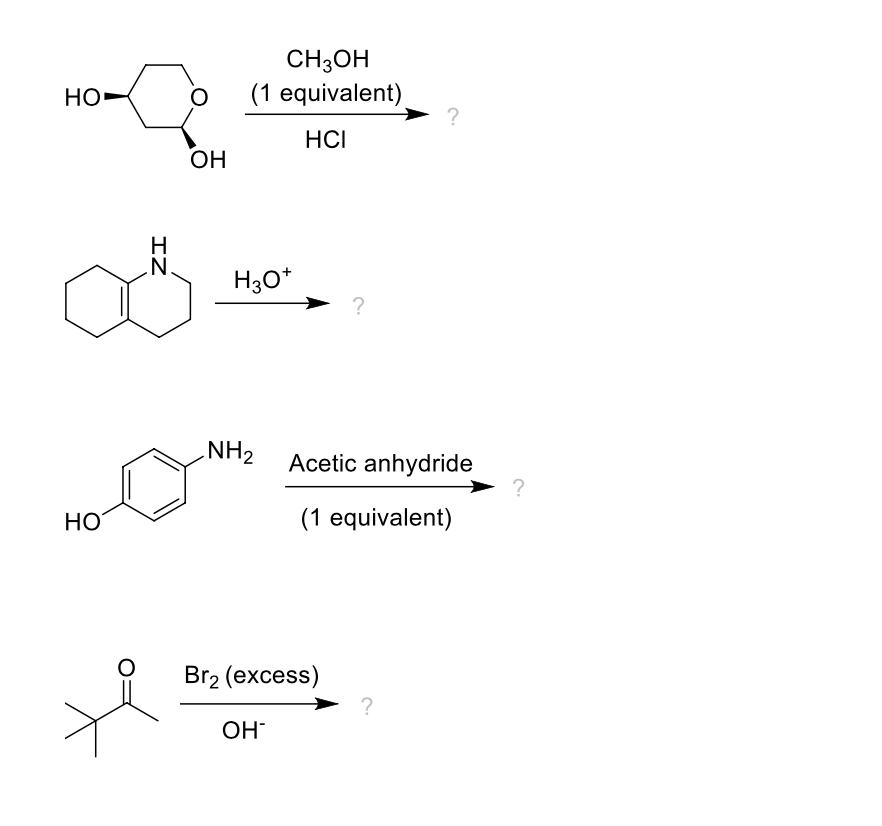


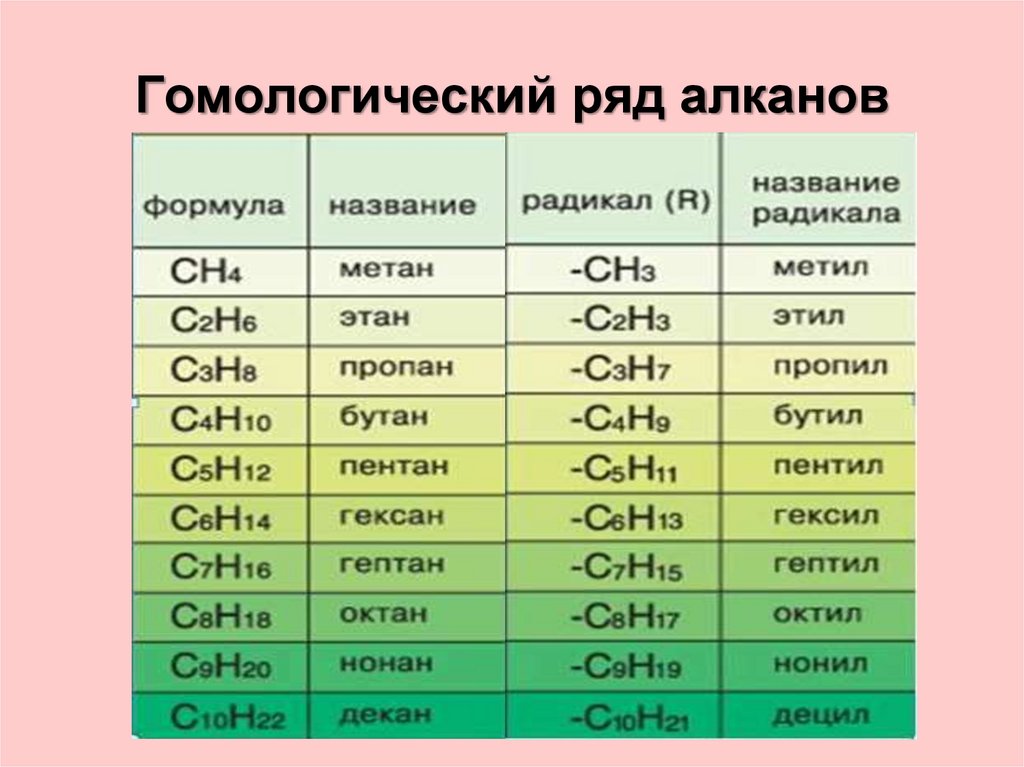


 Длительно сохраняют эластичность в широком интервале температур. Просты в переработке.
Длительно сохраняют эластичность в широком интервале температур. Просты в переработке.
 [3]
[3]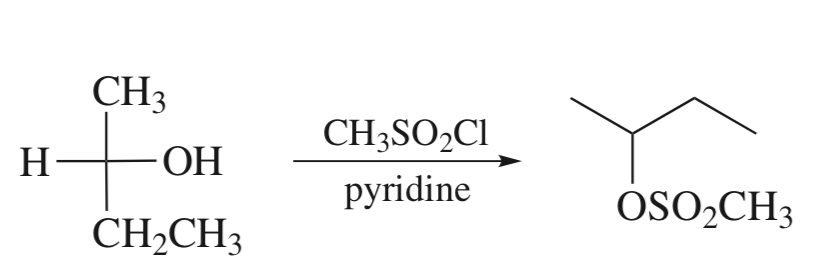 П.
(Karpova E. P.)
П.
(Karpova E. P.) аффилиация: Joint Russian-Vietnamese Tropical Research and Technological Center, Ho Chi Minh, Vietnam (vnm)
аффилиация: Joint Russian-Vietnamese Tropical Research and Technological Center, Ho Chi Minh, Vietnam (vnm) 
 com, нажав кнопку «Моя учетная запись» в правом верхнем углу
com, нажав кнопку «Моя учетная запись» в правом верхнем углу В противном случае может взиматься комиссия или уменьшаться сумма вашего кредита в магазине.
В противном случае может взиматься комиссия или уменьшаться сумма вашего кредита в магазине. д.)
д.)