Концентрация растворов | это… Что такое Концентрация растворов?
Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это отношение неоднородных величин.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора), правильно называть долями. Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
Существует много способов выражения концентрации растворов.
Содержание
|
Массовая доля
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
Массовая доля измеряется в долях единицы или в процентах.
- ,
где:
- m1 — масса растворённого вещества, г ;
- m — общая масса раствора, г .
Массовое процентное содержание компонента, m%
m%=(mi/Σmi)*100
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят 2 измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
| ω, % | 5 | 10 | 15 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 95 |
| ρ H2SO4, г/мл | 1,032 | 1,066 | 1,102 | 1,139 | 1,219 | 1,303 | 1,395 | 1,498 | 1,611 | 1,727 | 1,814 | 1,834 |
Основная статья: Объёмная доля
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
- ,
где:
- V1 — объём растворённого вещества, л;
- V — общий объём раствора, л.

Как и было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
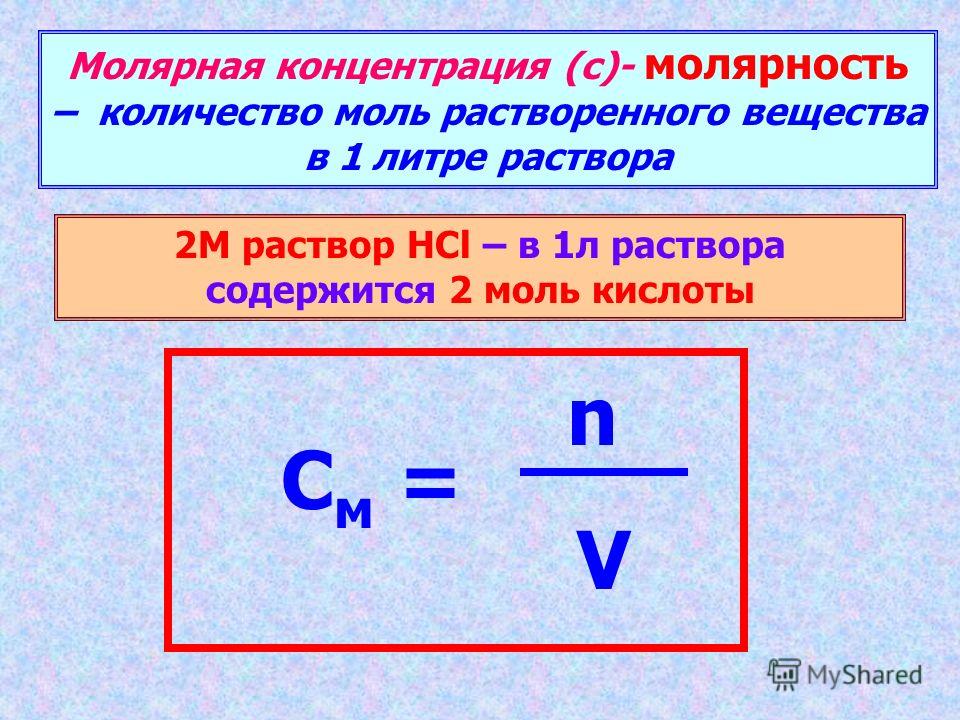
Молярность (молярная объёмная концентрация)
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным. Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» и т. д.
д.
- ,
где:
- ν — количество растворённого вещества, моль;
- V — общий объём раствора, л.
Нормальная концентрация (мольная концентрация эквивалента, или просто «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
- ,
где:
- ν — количество растворённого вещества, моль;
- V — общий объём раствора, л;
- z — число эквивалентности (фактор эквивалентности ).
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K 2SO4.
Мольная (молярная) доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
- ,
где:
- νi — количество i-го компонента, моль;
- n — число компонентов;
Моляльность (молярная весовая концентрация, моляльная концентрация)
Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
- ,
где:
- ν — количество растворённого вещества, моль;
- m2 — масса растворителя, кг.
Следует обратить особое внимание, что несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу  Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Титр раствора
Основная статья: Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
- ,
где:
- m1 — масса растворённого вещества, г;
- V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Весообъёмные проценты
Соответствуют отношению массы одной части вещества (например, 1 г) к 100 частям объёма раствора (например, к 100 мл).[1] Этот способ выражения используют, например, в спектрофотометрии, если неизвестна молярная масса вещества или если неизвестен состав смеси, а также по традиции в фармакопейном анализе. [2]
[2]
Другие способы выражения концентрации растворов
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (ppm). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
Применимость способов выражения концентрации растворов, их свойства
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
Формулы перехода от одних выражений концентраций растворов к другим
От массовой доли к молярности:
- ,
где:
- ρ — плотность раствора, г/л;
- ω — массовая доля растворенного вещества в долях от 1;
- M1 — молярная масса растворенного вещества, г/моль.
От молярности к нормальности:
- ,
где:
- M — молярность, моль/л;
- z — число эквивалентности.

От массовой доли к титру:
- ,
где:
- ρ — плотность раствора, г/л;
- ω — массовая доля растворенного вещества в долях от 1;
От молярности к титру:
- ,
где:
- M — молярность, моль/л;
- M1 — молярная масса растворенного вещества, г/моль.
От молярности к моляльности:
- ,
где:
- M — молярность, моль/л;
- ρ — плотность раствора, г/мл;
- M1 — молярная масса растворенного вещества, г/моль.
От моляльности к мольной доле:
- ,
где:
- mi — моляльность, моль/кг;
- M2 — молярная масса растворителя, г/моль.
Наиболее распространённые единицы
| Эта статья содержит незавершённый перевод с английского языка. Вы можете помочь проекту, переведя её до конца. |
| Измеряемая величина | Запись | Формула | Типичная единица |
|---|---|---|---|
| Атомный процент/Атомная доля (A) | или at. % % | % | |
| Атомный процент (B) | at.% | % | |
| Массовый процент (доля) | или wt% | % | |
| Mass-volume percentage | — | % though strictly %g/mL | |
| Volume-volume percentage | — | % | |
| Молярность | M | mol/L (or M or mol/dm³) | |
| Molinity | — | mol/kg | |
| Моляльность | m | mol/kg (or m**) | |
| Мольная доля | Χ (chi) | (decimal) | |
| Formal | F | mol/L (or F) | |
| Нормальность | N | N | |
| Частей на сто (Parts per hundred) | % (or pph) | da.g/kg | |
| Частей на тысячу (Parts per thousand) | ‰ (or ppt*) | g/kg | |
| Частей на миллион | ppm | mg/kg | |
| Частей на миллиард (Parts per billion) | ppb | µg/kg | |
| Parts per trillion | ppt* | ||
| Parts per quadrillion | ppq | pg/kg |
Примечания
- ↑ Способы приготовления растворов на МедКурс.
 Ru
Ru - ↑ Бернштейн И. Я., Каминский Ю. Л. Спектрофотометрический анализ в органической химии. — 2-е изд. — Ленинград: Химия, 1986. — с. 5
Концентрация растворов (видео) — Портал аналитической химии
Концентрация — величина, характеризующая количественный состав раствора. Концентрация растворённого вещества это отношение количества растворённого вещества (либо его массы) к объёму раствора.
В тоже время величины, которые являются отношением однотипных величин (соотношение объёма растворённого вещества к объёму раствора, масс растворённого вещества к массе раствора) называют «долями». Однако на практике доли также относят к концентрациям.
Существует ряд способов для выражения концентрации растворов.
Массовая доля
Массовая доля — соотношение масс растворённого вещества к массе раствора. (в долях единицы или в процентах):
,
где:
·
m — общая масса раствора, г .
· m1 — масса растворённого вещества, г;
Массовое процентное содержание компонента, m%
m%=(mi/Σmi)*100
Объёмная доля
Объёмная доля — соотношение объёма растворённого вещества к объёму раствора. Объёмная доля определяется в долях единицы или в процентах.
,
где:
· V — общий объём раствора, л.
· V1 — объём растворённого вещества, л;
Мольная доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
,
где:
· n — число компонентов;
· νi — количество i-го компонента, моль;
Молярность
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора, единицы измерения (моль/м³),
,
где:
·
V — общий объём раствора, л.
· ν — количество растворённого вещества, моль;
Нормальная концентрация (или нормальность)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Единицы измерения моль-экв/л.
Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
,
где:
· V — общий объём раствора, л;
· ν — количество растворённого вещества, моль;
· z — число эквивалентности (фактор эквивалентности
).
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество.
К примеру, одномолярный раствор H2SO4 будет двухнормальным в реакции с образованием K2SO4 и однонормальным если он предназначается для реакции со щёлочью с образованием KHSO4.
Моляльность ( моляльная концентрация)
Моляльность — количество растворённого вещества (число моль)
в 1000 г растворителя. Единицы измерения моли на кг.
Единицы измерения моли на кг.
,
где:
· m2 — масса растворителя, кг.
· ν — количество растворённого вещества, моль;
Титр
Титр раствора — масса растворённого вещества в 1 мл раствора.
,
где:
· V — общий объём раствора, мл;
· m1 — масса растворённого вещества, г;
Формулы пересчета концентраций
Из молярности в нормальность:
,
где:
z — число эквивалентности.
· M — молярность, моль/л;
Из массовой доли в молярность:
,
где:
· M1 — молярная масса растворенного вещества, г/моль.
· ω — массовая доля растворенного вещества в долях от 1;
· ρ — плотность раствора, г/л;
Из массовой доли в титр:
,
где:
· ω — массовая доля растворенного вещества в долях от 1;
· ρ — плотность раствора, г/л;
Из молярности в титр:
,
где:
·
M1 — молярная масса растворенного вещества,
г/моль.
· M — молярность, моль/л;
Из моляльности в мольную долю:
,
где:
· mi — моляльность, моль/кг;
· M2 — молярная масса растворителя, г/моль.
Наиболее распространённые единицы
Из молярности в моляльность:
,
где:
· M — молярность, моль/л;
· ρ — плотность раствора, г/мл;
· M1 — молярная масса растворенного вещества, г/моль.
Концентрация раствора – определение, методы, формулы и расчет
Все говорят о концентрации растворов. Они также могут говорить о концентрации кофе или чая. У каждого свое представление о том, что понимается под концентрацией раствора. Вы, должно быть, замечали, что всякий раз, когда вы готовите кофе, если вы добавите много порошка, вы получите концентрированный напиток, тогда как если вы добавите мало, получится разбавленный раствор. Поэтому очень важно, чтобы вы понимали, какова концентрация раствора. В этой главе мы узнаем о том, что подразумевается под концентрацией раствора; мы также увидим, как найти концентрацию раствора и различные способы выражения концентрации раствора.
Поэтому очень важно, чтобы вы понимали, какова концентрация раствора. В этой главе мы узнаем о том, что подразумевается под концентрацией раствора; мы также увидим, как найти концентрацию раствора и различные способы выражения концентрации раствора.
Что такое концентрация раствора?
В водном растворе существуют две части, а именно растворенное вещество и растворитель. Это два основных условия концентрации раствора, которые вам необходимо знать. Нам всегда нужно вести учет количества растворенного вещества в растворе. В химии мы определяем концентрацию раствора как количество растворенного вещества в растворителе. Когда раствор содержит больше растворенного вещества, мы называем его концентрированным раствором. В то время как раствор содержит больше растворителя, мы называем его разбавленным раствором.
(Изображение будет загружено в ближайшее время)
Теперь, когда вы понимаете, что такое концентрация раствора, давайте перейдем к различным методам выражения концентрации.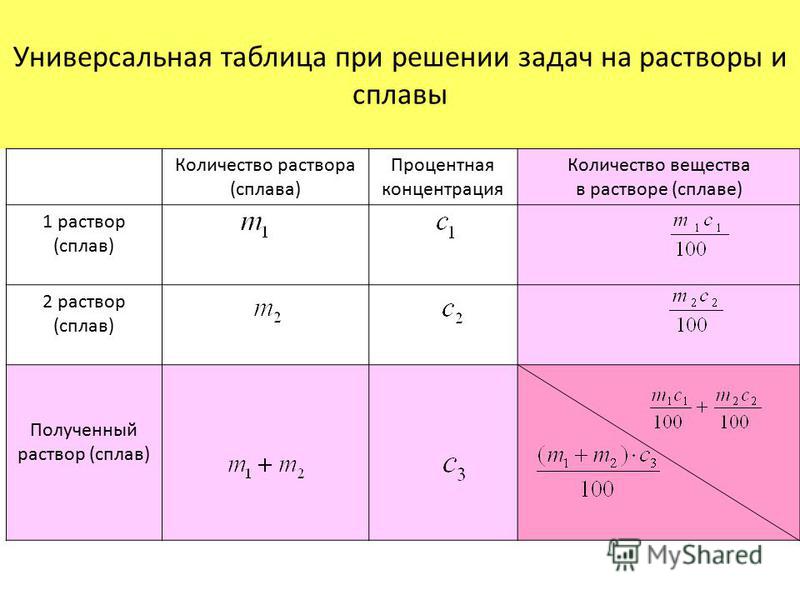 {6 }\]
{6 }\]
Массовая доля растворенного вещества в растворе. Формула для массового процента дается следующим образом.
Массовая доля A = \[\frac{\text{Масса компонента A}}{\text{Общая масса раствора}}\]x100
напр. CH 3 COOH 33 % по массе и H 2 SO 4 98,0 % по массе.
Выражается объемным процентным содержанием растворенного вещества по отношению к растворителю. Формула для объемного процента дается следующим образом.
Объемный процент A = \[\frac{\text{Объем компонента A}}{\text{Общий объем раствора}}\]x100
Масса в процентах по объему выражает количество граммов растворенного вещества в 100 мл продукта.
напр. Раствор BaCl 2 10 % масс./об. и раствор H 2 O 2 5–7 % масс./об.
Молярность (M)
Количество молей растворенного вещества, содержащихся в 1000 мл раствора. Это широко используемый метод для выражения концентраций.
Это широко используемый метод для выражения концентраций.
Молярность = \[\frac{\text{Масса растворенного вещества}}{\text{объем раствора в литрах}}\]
Моляльность (m)
Моляльность выражается количеством молей растворенного вещества, содержащегося в 1000 г растворителя. Формула для моляльности дается следующим образом.
Моляльность (м) = \[\frac{\text{Масса растворенного вещества}}{\text{Масса растворителя в кг}}\]
Нормальность (Н)
Мы можем определить это как количество эквивалентов растворенного вещества, присутствующего в растворе, и его также называют эквивалентной концентрацией. Формула нормальности дается следующим образом.
Нормальность (N) = \[\frac{\text{Масса растворенного вещества в граммах}}{\text{Эквивалентная масса} \times \text{Объем в литрах}}\]
Мольная доля:
Молярная доля (X) компонента в растворе определяется как отношение количества молей этого компонента к общему количеству молей всех компонентов в растворе. Молярная доля А выражается как X A с помощью следующего уравнения в растворе, состоящем из A, B, C, … мы можем рассчитать X А .
Молярная доля А выражается как X A с помощью следующего уравнения в растворе, состоящем из A, B, C, … мы можем рассчитать X А .
X\[_{A}\] = \[\frac{\text{моли A}}{\text{моль A + моль B + моль C +…. }}\]
Точно так же мы можем рассчитать мольную долю B, XB с помощью следующей формулы.
X\[_{B}\] = \[\frac{\text{моли B}}{\text{моль A + моль B + моль C +…. }}\]
Теперь, когда вы знаете, как найти концентрацию раствора, используя формулы растворов различных концентраций, мы попробуем решить некоторые вопросы о концентрациях решения.
Решаемые задачи
Вопрос 1) К 4 г порошкообразного препарата добавляют 2 мл воды. Конечный объем 3мл. Найдите массу в процентах по объему раствора?
Ответ 1) Дано, Масса растворенного вещества = 4 г
Объем раствора = 3 мл
Масса в процентах по объему = \[\frac{\text{Масса растворенного вещества}}{\text{Объем раствора}}\] x100 = \[\frac{4g}{3ml}\] = 133%
Таким образом, массовая доля по объему составляет 133 %.
Вопрос 2) Многие пользуются раствором Na 3 PO 4 для очистки стен перед поклейкой обоев. Рекомендуемая концентрация составляет 1,7 % (масс./об.). Найдите массу Na3PO4, необходимую для приготовления 2,0 л раствора?
Ответ 2) Дано,
Масса/объем в процентах = 1,7 %
Объем раствора = 2000 мл
Масса в объемных процентах = раствор}}\] × 100
1,7 % = \[\frac{\text{Масса растворенного вещества}}{2000 мл}\] ×100
Масса растворенного вещества = 34 г
Следовательно, требуемая масса составляет 34 г.
В химии часто требуется рассчитать концентрацию раствора. Упомянутые выше способы выражения концентрации раствора имеют важное значение. Решенные примеры полезны для лучшего понимания понятия концентрации раствора.
Термины концентрации — SEASTAR CHEMICALS
Термины концентрации, из Википедии:
Концентрация — очень распространенное понятие, используемое в химии и смежных областях. Это мера того, сколько данного вещества смешано с другим веществом. Это может относиться к любой химической смеси, но чаще всего используется в отношении растворов, где это относится к количеству растворенного вещества, растворенного в растворителе. Для концентрирования раствора необходимо добавить больше растворенного вещества или уменьшить количество растворителя (например, селективным испарением). Напротив, чтобы разбавить раствор, нужно добавить больше растворителя или уменьшить количество растворенного вещества. Существует концентрация, при которой растворенные вещества не растворяются в растворе. В этот момент говорят, что раствор насыщен. Если к насыщенному раствору добавить дополнительное растворенное вещество, оно не растворится. Вместо этого произойдет разделение фаз, что приведет либо к сосуществованию фаз, либо к суспензии. Точка насыщения зависит от многих переменных, таких как температура окружающей среды и точная химическая природа растворителя и растворенного вещества. Концентрация может быть выражена как качественно («неформально»), так и количественно («численно»).
Это мера того, сколько данного вещества смешано с другим веществом. Это может относиться к любой химической смеси, но чаще всего используется в отношении растворов, где это относится к количеству растворенного вещества, растворенного в растворителе. Для концентрирования раствора необходимо добавить больше растворенного вещества или уменьшить количество растворителя (например, селективным испарением). Напротив, чтобы разбавить раствор, нужно добавить больше растворителя или уменьшить количество растворенного вещества. Существует концентрация, при которой растворенные вещества не растворяются в растворе. В этот момент говорят, что раствор насыщен. Если к насыщенному раствору добавить дополнительное растворенное вещество, оно не растворится. Вместо этого произойдет разделение фаз, что приведет либо к сосуществованию фаз, либо к суспензии. Точка насыщения зависит от многих переменных, таких как температура окружающей среды и точная химическая природа растворителя и растворенного вещества. Концентрация может быть выражена как качественно («неформально»), так и количественно («численно»).
Содержание
- 1. Качественная запись
- 2. Количественные обозначения
- 2.1. Массовая доля
- 2.2. Массово-объемный процент
- 2.3. Объем-объем в процентах
- 2.4. Молярность
- 2.5. Моляльность
- 2.6. Нормальность
- 2.7. Официальный
- 2.8. Обозначение «частей на единицу»
- 3. Методы определения концентрации
- 4. Таблица мер концентрации
1. Качественное обозначение: Качественно растворы с относительно низкой концентрацией описываются такими прилагательными, как «разбавленный» или «слабый», тогда как растворы с относительно высокой концентрацией описываются как «концентрированные» или «сильные». Как правило, чем концентрированнее хроматический раствор, тем интенсивнее он окрашен.
Эти стекла, содержащие красный краситель, демонстрируют качественные изменения концентрации. Растворы слева «слабее» (или более разбавлены) по сравнению с «более сильными» (или более концентрированными) растворами справа.
2. Количественная запись: Количественная запись концентрации гораздо более информативна и полезна с научной точки зрения. Существует несколько различных способов количественного выражения концентрации; наиболее распространенные перечислены ниже. Примечание. Многие единицы концентрации требуют измерения объема вещества, который варьируется в зависимости от температуры и давления окружающей среды. Если не указано иное, предполагается, что все следующие измерения выполнены при стандартной температуре и давлении (то есть 25 градусов Цельсия при 1 атмосфере).
2.1. Массовая доля: обозначает массу вещества в смеси в процентах от массы всей смеси. Например: если бутылка содержит 40 граммов этанола и 60 граммов воды, то она содержит 40% этанола по массе. Коммерческие концентрированные водные реагенты, такие как кислоты и основания, часто маркируются в процентах по массе с указанием удельного веса. В более старых текстах и ссылках это иногда упоминается как массовый процент (сокращенно w/w).
2.2. Массово-объемный процент (иногда называемый массо-объемным процентом и часто сокращенно % m/v или % w/v): 90 142 обозначает массу вещества в смеси в процентах от объема всей смеси. Массово-объемные проценты часто используются для растворов, приготовленных из твердых реагентов. Это масса растворенного вещества в граммах, умноженная на сто, деленная на объем раствора в миллилитрах.
2.3. Объемный процент или % (об./об.): описывает объем растворенного вещества в мл на 100 мл полученного раствора. Это наиболее полезно, когда готовится жидкий раствор. Например, пиво содержит около 5% этанола по объему. Это означает, что каждые 100 мл пива содержат 5 мл этанола (этилового спирта).
2.4. Молярность (M): обозначает количество молей данного вещества на литр раствора. Например: 4,0 л жидкости, содержащей 2,0 моля растворенных частиц, составляют раствор 0,5 М. Такой раствор может быть описан как «0,5 молярный». (Работа с молями может быть очень выгодной, поскольку они позволяют измерять абсолютное количество частиц в растворе, независимо от их веса и объема. Это часто более полезно при выполнении стехиометрических расчетов.). См. молярный раствор для получения дополнительной информации.
Это часто более полезно при выполнении стехиометрических расчетов.). См. молярный раствор для получения дополнительной информации.
2.5. Моляльность (m): обозначает количество молей данного вещества на килограмм растворителя. Например: 2,0 кг растворителя, содержащего 1,0 моль растворенных частиц, составляют моляльность 0,5 моль/кг. Такой раствор может быть описан как «0,5 моляль». Преимущество моляльности в том, что она не меняется с температурой, так как имеет дело с массой растворителя, а не с объемом раствора. Объем увеличивается с повышением температуры, что приводит к снижению молярности. Моляльность раствора всегда постоянна независимо от физических условий, таких как температура и давление.
2.6. Нормальность (N): Нормальность — это понятие, связанное с молярностью, обычно применяемое к кислотно-щелочным растворам и реакциям. Для кислотно-щелочных реакций эквивалентом является масса кислоты или основания, которая может принять или отдать ровно один моль протонов (ионов H+). Нормальность также используется для окислительно-восстановительных реакций. В этом случае эквивалентом является количество окислителя или восстановителя, которое может принять или передать один моль электронов. В то время как молярность измеряет количество частиц на литр раствора, нормальность измеряет количество эквивалентов на литр раствора. На практике это просто означает, что молярность раствора умножается на валентность ионного растворенного вещества. Немного сложнее для окислительно-восстановительных реакций. Примечание. Нормальность всегда равна или превышает молярность кислотно-основных реакций. Однако для окислительно-восстановительных реакций нормальность обычно равна или меньше молярности.
Нормальность также используется для окислительно-восстановительных реакций. В этом случае эквивалентом является количество окислителя или восстановителя, которое может принять или передать один моль электронов. В то время как молярность измеряет количество частиц на литр раствора, нормальность измеряет количество эквивалентов на литр раствора. На практике это просто означает, что молярность раствора умножается на валентность ионного растворенного вещества. Немного сложнее для окислительно-восстановительных реакций. Примечание. Нормальность всегда равна или превышает молярность кислотно-основных реакций. Однако для окислительно-восстановительных реакций нормальность обычно равна или меньше молярности.
2.7. Формальный (F): Формальный (F) — еще одна мера концентрации, аналогичная молярности. Используется редко. Он рассчитывается по формуле весов химических веществ на литр раствора. Разница между формальной и молярной концентрацией заключается в том, что формальная концентрация указывает количество молей исходной химической формулы в растворе, без учета веществ, реально существующих в растворе. Молярная концентрация, с другой стороны, представляет собой концентрацию частиц в растворе. Например: если растворить карбонат натрия (Na 2 CO 3 ) в литре воды соединение диссоциирует на ионы Na + и CO 3 2-. Часть CO 3 2- реагирует с водой с образованием HCO 3 – и H 2 CO 3 . Если рН раствора низкий, в растворе практически не остается Na 2 CO 3 . Итак, хотя мы добавили в раствор 1 моль Na 2 CO 3 , он не содержит 1 М этого вещества. (Скорее, он содержит молярность, основанную на других компонентах раствора.) Тем не менее, можно сказать, что раствор содержит 1 F Na 2 СО 3 .
Молярная концентрация, с другой стороны, представляет собой концентрацию частиц в растворе. Например: если растворить карбонат натрия (Na 2 CO 3 ) в литре воды соединение диссоциирует на ионы Na + и CO 3 2-. Часть CO 3 2- реагирует с водой с образованием HCO 3 – и H 2 CO 3 . Если рН раствора низкий, в растворе практически не остается Na 2 CO 3 . Итак, хотя мы добавили в раствор 1 моль Na 2 CO 3 , он не содержит 1 М этого вещества. (Скорее, он содержит молярность, основанную на других компонентах раствора.) Тем не менее, можно сказать, что раствор содержит 1 F Na 2 СО 3 .
2.8. Обозначение «частей на единицу»: Обозначение «частей на единицу» используется для чрезвычайно низких концентраций. Это часто используется для обозначения относительного содержания микроэлементов в земной коре, микроэлементов в судебно-медицинской экспертизе или других анализах или уровней загрязняющих веществ в окружающей среде.
2.8.1. Части на сотню (обозначается «%» и очень редко «pph»): — обозначает одну частицу данного вещества на каждые 99 других частиц. Это общий процент. 1 часть в 10 2 .
2.8.2. Части на тысячу (обозначается «‰» [символ на мил], а иногда и «ppt»): 90 142 обозначает одну частицу данного вещества на каждые 999 других частиц. Это примерно эквивалентно одной капле чернил в чашке воды или одной секунде за 17 минут. «Части на тысячу» часто используются для описания солености морской воды. 1 часть в 10 3 .
2.8.3. Части на миллион («ppm»): обозначает одну частицу данного вещества на каждые 999 999 других частиц. Это примерно эквивалентно одной капле чернил на 40-галлонную бочку с водой или одной секунде на 280 часов. 1 часть в 10 6 .
2.8.4. Части на миллиард («ppb»): обозначает одну частицу данного вещества на каждые 999 999 999 других частиц. Это примерно эквивалентно одной капле чернил в канале, полном воды, или одной секунде за 32 года. 1 часть в 10 9 .
1 часть в 10 9 .
2.8.5. Части на триллион («ppt»): обозначает одну частицу данного вещества на каждые 999 999 999 999 других частиц. Это примерно эквивалентно одной капле чернил в бассейне олимпийских размеров или одной секунде каждые 320 столетий. 1 часть в 10 12 .
2.8.6. Части на квадриллион («ppq»): обозначает одну частицу данного вещества на каждые 999 999 999 999 999 других частиц. Это примерно эквивалентно капле чернил в озере среднего размера или одной секунде каждые 32 000 тысячелетий. Не существует известных аналитических методов, позволяющих проводить измерения с такой степенью точности; тем не менее, он до сих пор используется в некоторых математических моделях токсикологии и эпидемиологии. 1 часть в 10 15 .
ПРИМЕЧАНИЕ. Что касается заявления Википедии 2.8.6, октябрь 2005 г.: ежедневно служба контроля качества SEASTAR работает в диапазоне ppq с такими элементами, как уран, торий и редкоземельные элементы.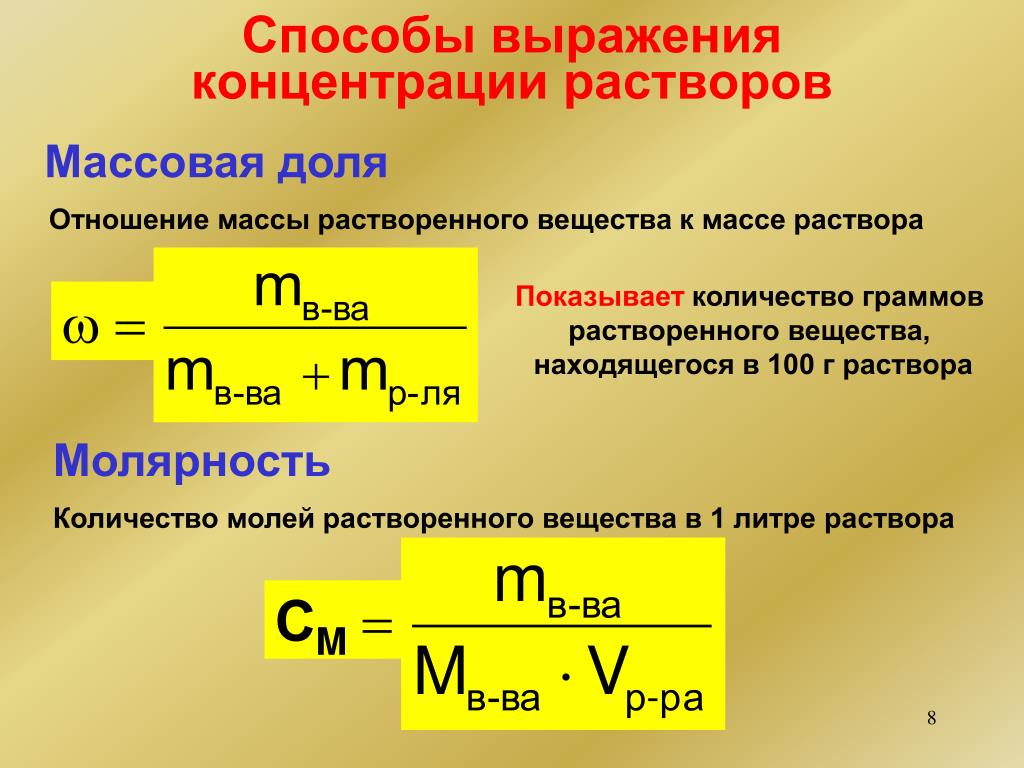 Пример инструментальных данных от 23 августа 2005 г. Пределы обнаружения нашего масс-спектрометра высокого разрешения: 22 из 74 обнаруженных изотопов @<100ppq, 18 из 74 обнаруженных изотопов @<50ppq, 4 из 74 обнаруженных изотопов @<10ppq. Приблизительно 40% этих цифр находятся в поддающихся количественному измерению пределах. Пределы обнаружения нашего метода обычно помещают эти значения в диапазон суб-ppq или суб-частей на квадриллион.
Пример инструментальных данных от 23 августа 2005 г. Пределы обнаружения нашего масс-спектрометра высокого разрешения: 22 из 74 обнаруженных изотопов @<100ppq, 18 из 74 обнаруженных изотопов @<50ppq, 4 из 74 обнаруженных изотопов @<10ppq. Приблизительно 40% этих цифр находятся в поддающихся количественному измерению пределах. Пределы обнаружения нашего метода обычно помещают эти значения в диапазон суб-ppq или суб-частей на квадриллион.
Предупреждение: хотя «ppt» обычно используется для обозначения «частей на триллион», иногда он также используется для обозначения «частей на тысячу». Если есть вероятность двусмысленности, следует описать аббревиатуру полностью. Согласно Руководству США
Национального института стандартов и технологий (NIST) по использованию Международной системы единиц (СИ), «термины, зависящие от языка, часть на миллион, часть на миллиард и часть на триллион… неприемлемы. для использования с СИ для выражения значений величин». [1], где перечислены примеры альтернативных выражений. Примечания для ясности: приведенное выше указание состоит в том, что части в обозначении относятся к количеству частиц (эквивалентно молям), тогда как в последнем столбце таблицы ниже оно дается по массе (граммы на килограмм). Те, кто использует обозначение, должны указать их использование, чтобы избежать
Примечания для ясности: приведенное выше указание состоит в том, что части в обозначении относятся к количеству частиц (эквивалентно молям), тогда как в последнем столбце таблицы ниже оно дается по массе (граммы на килограмм). Те, кто использует обозначение, должны указать их использование, чтобы избежать
путаница. В химии атмосферы части в обозначении обычно обозначаются буквой v после, например, ppmv (или ppmv в некоторых случаях), для обозначения частей на миллион по объему. В газах ppmv эквивалентна ppm по частицам (закон Авогадро). Это хорошо работает для газов, но могут возникнуть проблемы с облачными каплями, дымом или другими атмосферными твердыми частицами.
Таблица часто используемых стандартов измерения концентрации
| Измерение | Обозначение | Общая формула | Типовые единицы |
|---|---|---|---|
| Массовая доля | — | (граммы растворенного вещества X 100) / (граммы раствора) | % |
| Объемная масса в процентах | — | (граммы растворенного вещества X 100) / (миллилитры раствора) | % хотя строго %кг/л |
| Объем-объемные проценты | — | (миллилитров растворенного вещества X 100) / (мл раствора) | % |
| Молярность | М | (моль растворенного вещества) / (литры раствора) | моль/л (или М) |
| Молинити | — | молей растворенного вещества) / (килограммов раствора) | моль/кг |
| Моляльность | М | (моль растворенного вещества) / (килограммы растворителя) | моль/кг (или м) |
| Молярная доля | ÷ (чи) | (моль растворенного вещества) / (моль раствора) | (дробь) |
| Официальный | Ф | (моль нерастворенного растворенного вещества) / (литры раствора) | моль/л (или F) |
| Нормальность | Н | ((моль растворенного вещества) / (литры раствора)) X валентность растворенного вещества | Н |
| Соток | % (или частей на миллион) | (декаграмм растворенного вещества) / (килограммы раствор) | Да. г/кг г/кг |
| Частей на тысячу | ‰ (или ppt*) | (граммы растворенного вещества) / (килограммы раствора) | Г/кг |
| Частей на миллион | частей на миллион | (миллиграммы растворенного вещества) / (килограммы раствора) | мг/кг |
| Частей на миллиард | частей на миллиард | (микрограммы растворенного вещества) / (килограммы раствора) | мкг/кг |
| Частей на триллион | пт* | (нанограммы растворенного вещества) / (килограммы раствора) | нг/кг |
| Частей на квадриллион | ppq | (пикограммы растворенного вещества) / (килограммы раствора) | пг/кг |
* Хотя «ppt» обычно используется для обозначения «частей на триллион», иногда он используется для обозначения «частей на тысячу». Иногда «ppt» также используется как аббревиатура для преципитата.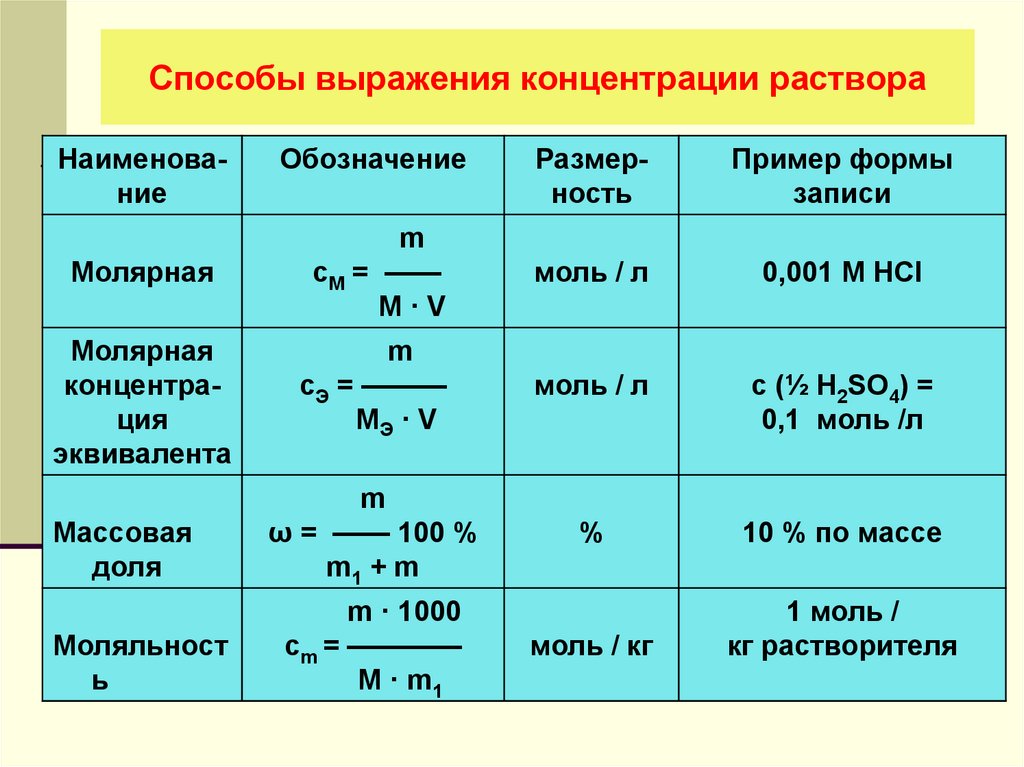 Остерегайтесь любой двусмысленности в использовании.
Остерегайтесь любой двусмысленности в использовании.
Примечание (1): В приведенной выше таблице указаны растворители и растворенные вещества; однако указанные единицы часто также применяются к другим типам смесей.
Примечание (2) : использование миллиардов, триллионов, квадриллионов выше соответствует использованию этих слов в сокращенной шкале. Получено с http://en.wikipedia.org/wiki/Concentration
Обратите внимание на следующие авторские права: http://en.wikipedia.org/wiki/Wikipedia:Авторские права
Википедия: Авторские права Из Википедии, свободной энциклопедии. Лицензия, которую использует Википедия, предоставляет свободный доступ к нашему контенту в том же смысле, в каком свободное программное обеспечение лицензируется бесплатно. Этот принцип известен как копилефт. То есть содержимое Википедии можно копировать, изменять и распространять, если новая версия предоставляет такие же свободы другим и признает авторов использованной статьи Википедии (прямая ссылка на статью удовлетворяет нашим требованиям к авторству). . Таким образом, статьи в Википедии навсегда останутся бесплатными и могут быть использованы кем угодно с определенными ограничениями, большинство из которых служат для обеспечения этой свободы. Для достижения вышеуказанных целей текст, содержащийся в Википедии, доступен для общественности в соответствии с лицензией GNU Free Documentation License (GFDL). Полный текст этой лицензии находится в Wikipedia:Text of the GNU Free Documentation License. Разрешается копировать, распространять и/или изменять этот документ в соответствии с условиями лицензии GNU Free Documentation License версии 1.2 или любой более поздней версии, опубликованной Free Software Foundation; без неизменяемых разделов, без текста на передней обложке и без текста на задней обложке. Копия лицензии включена в раздел «Лицензия свободной документации GNU». Контент в Википедии защищен заявлениями об отказе от ответственности. Английский текст GFDL является единственным юридически обязывающим документом; Далее следует наша интерпретация GFDL: права и обязанности пользователей и участников.
. Таким образом, статьи в Википедии навсегда останутся бесплатными и могут быть использованы кем угодно с определенными ограничениями, большинство из которых служат для обеспечения этой свободы. Для достижения вышеуказанных целей текст, содержащийся в Википедии, доступен для общественности в соответствии с лицензией GNU Free Documentation License (GFDL). Полный текст этой лицензии находится в Wikipedia:Text of the GNU Free Documentation License. Разрешается копировать, распространять и/или изменять этот документ в соответствии с условиями лицензии GNU Free Documentation License версии 1.2 или любой более поздней версии, опубликованной Free Software Foundation; без неизменяемых разделов, без текста на передней обложке и без текста на задней обложке. Копия лицензии включена в раздел «Лицензия свободной документации GNU». Контент в Википедии защищен заявлениями об отказе от ответственности. Английский текст GFDL является единственным юридически обязывающим документом; Далее следует наша интерпретация GFDL: права и обязанности пользователей и участников.



 Ru
Ru