KMnO4 + h3O2 + h3SO4 = O2 + MnSO4 + K2SO4 + h3O
12 июня 2018 г. Туба для обучения Химическая реакция
Пероксид калия и серная кислота (kmno4 h3o2 h3so4) доступны почти во всех химических лабораториях по всему миру. KMnO4 и h3O2 реагируют преимущественно в среде h3SO4. Чтобы сбалансировать окислительно-восстановительную реакцию, мы используем ионно-электронную технику.
Реакция пероксида водорода с перманганатом калия и серной кислотой (KMnO4 h3O2 h3SO4)
Реакция представляет собой реакцию обмена электронами. Реагенты в этой реакции отдают и забирают определенное количество электронов, чтобы получить некоторый продукт. Здесь в этой химической реакции основную роль играют KMnO4 и h3O2, так как они обмениваются электронами. С другой стороны, серная кислота (h3SO4) создает подходящую реакционную среду. Поскольку происходит электронный обмен, мы можем понять, что степень окисления реагентов должна измениться. Следовательно, рассматриваемое уравнение реакции представляет собой уравнение реакции окисления-восстановления.
h3O2 + h3SO4 + KMnO4 = O2 + h3 + MnSO4 + K2SO4
or, After balancing the Redox reaction
5H
2 O 2 + 3H 2 SO 4 + 2KMnO 4 = 5O 2 + 8H 2 O + 2MnSO 4 + K 2 SO 4электронным методом мы можем легко уравновесить эту реакцию.
Уравновешивание окислительно-восстановительной реакции ионно-электронным методом
Скелетная реакция окислительно-восстановительной реакции перманганата калия пероксида водорода и серной кислоты (kmno4 h3o2 h3so4) представляет собой-
H
2 O 2 4 + H 2 SO 4 = O 2 + H 2 O + MnSO 4 + K 2 SO 4 Н 2 O 2 высвобождает электрон, а другой реагент KMnO 4 принимает электрон. Следовательно, в этой реакции H 2 O 2 действует как восстановитель, с другой стороны, KMnO 4 действует как окислитель.
Здесь,
Окислитель: KMnO 4 или после исключения иона спектратора, MnO 4 -1
Восстановитель0021 2 O 2 или после исключения иона спектратора, O -1
Результат Половина. занимает пять электронов, которые высвобождаются восстановителем, H
2 O 2 , или после исключения иона-спектатора, O -1 , агента, присутствующего в реакции. После принятия электронов окислителем KMnO 4 восстанавливается восстановителем, H 2 O 2 .⇒ MnO 4 -1 + 8H + +5e – = 4H 2 O + Mn 2- … …. … … (1)
Полуреакция окисления
Как мы все знаем, окислительно-восстановительная реакция является одновременным процессом, что означает, что когда происходит полуреакция восстановления, одновременно происходит и полуреакция окисления. Здесь в этой реакции восстановитель H 2 O 2 высвобождает по одному электрону на каждый атом кислорода и окисляется окислителем KMnO 4 .
Здесь в этой реакции восстановитель H 2 O 2 высвобождает по одному электрону на каждый атом кислорода и окисляется окислителем KMnO 4 .
⇒ 2O -1 – 2e – = O 2 … … … … (2)
Теперь в полуреакции восстановления расходуется пять электронов, а в половине реакции окисления В результате реакции высвобождается два электрона, образуя молекулу кислорода. Чтобы получить сбалансированную полную реакцию окисления-восстановления, мы должны умножить полуреакцию окисления и полуреакцию восстановления на соответствующее число и сложить их вместе.
SO, уравнение (1) x2 + (2) x5,
2mno 4 -1 + 16H + + 10E — = 8H 2 2 O + 2MN 2- = 2 22 2-9009 2- 2- = 2 22 2- = 2 2 2 2- = 2 2.
10 O -1 – 10e – = 5O 2
⇒ 2MnO 4 -1 + 10 O -1 + 16H + = 2Mn 2- + 8H 2 O +5O 2
На этом этапе мы добавляем необходимые ионы и радикалы к вышеуказанной ионной форме полной окислительно-восстановительной реакции,
⇒ 5H 2 O 2 + 3H 2 SO 4 + 2KMnO 4 = 5O 2 + 8H 2 O + 2MnSO 4 + K 2 SO 4
Therefor, the balanced redox reaction is-⇒ 5H
2 O 2 + 3H 2 SO 4 + 2KMnO 4 = 5O 2 + 8H 2 O + 2MnSO 4 + K 2 SO 4Следуйте за нами по телефону Twitter, Facebook, LinkedIn and Tumbler
Читать Подробнее
K2CR2O7 + FESO4 + H3SO4 = CR2 (SO4) 3 + Fe2 (SO4) 3 + K2SO4S4 2S4.
4S4 2S4.4S4 2 9027 9027 9.
FeSO4 + KMnO4 + h3SO4 = Fe2(SO4)3 + MnSO4 + h3O + K2SO4
NaCl + KMnO4 + h3SO4 = Cl2 + MnSO4 + Na2SO4 + K2SO4 + h3O
Окисление йодида калия перекисью водорода
Краткое описание:
Два бесцветных раствора смешиваются, и через несколько секунд смесь внезапно становится темно-синей.
Назначение/Задача:
Процедура представляет собой пример типичной реакции часов.
Пояснение к эксперименту:
Внезапное изменение цвета от бесцветного до темно-синего можно объяснить следующей последовательностью реакций:
- 3 I- (водн.) + Н H + (водн.) → I 3 — (водный) + 2 H 2 O (л) (медленный)
- I 3 — (AQ) + 2 S 2 O 3 2- (AQ) → 3 I — (AQ) + S 4 O 6 2- 4 O 6 2- 4 O 6 2- 4 O .
 (водный) (быстрый)
(водный) (быстрый) - 2 I 3 — (водн.) + крахмал (водн.) → крахмал-I 5 — комплекс (водн.) + I — (водн.)
Уравнение (1) показывает, что в кислом растворе иодид-ионы окисляются перекисью водорода до трийодид-ионов.
Эти трииодид-ионы восстанавливаются обратно в йодид-ионы тиосульфат-ионами, уравнение (2).
Реакция (2) протекает намного быстрее, чем реакция (1) – она потребляет ионы трийодида так же быстро, как они образуются.
Это предотвращает любую очевидную реакцию уравнения (3). Однако после того, как все ионы тиосульфата были поглощены реакцией уравнения (2), ионы трииодида реагируют с крахмалом с образованием синего комплекса крахмал-пентаиодид.
Подготовка материалов:
- Исходный раствор 2,0 М серной кислоты, H 2 SO 4 : Возьмите 120 мл дистиллированной воды и добавьте 22 мл концентрированной серной кислоты – разбавьте водой до 200 мл – дайте остыть.

- Исходный раствор 1,0 М йодида калия, KI: Растворите 33,2 г KI в 160 мл дистиллированной воды – разбавьте до 200 мл. (Иодид-ионы в этом растворе будут медленно окисляться кислородом воздуха. Продуктом является молекулярный йод I2, который затемняет раствор. Это окисление воздухом можно замедлить, приготовив раствор с водой, которая была обескислорожена кипячением или пропуская через него газообразный азот, а затем храня раствор в герметичном контейнере.)
- Исходный раствор 1% крахмала: доведите до кипения 100 мл дистиллированной воды. Сделайте взвесь 2,0 г растворимого крахмала в 4 мл воды. Вылить суспензию в кипящую воду – кипятить 5 минут – разбавить до 200 мл – дать остыть.
- Стандартный раствор 3% перекиси водорода, H 2 O 2 – можно приобрести в местной аптеке.
- 0,20 г тиосульфата натрия, Na 2 S 2 O 3
- Стеклянная посуда: 2 стакана на 600 мл, мерный цилиндр на 250 мл, химический стакан на 250 мл, палочка для перемешивания
- В градуированном цилиндре на 250 мл смешайте 25 мл 2,0 М H 2 SO 4 и 25 мл 3% H 2 O 2 .
 Разбавьте раствор до 250 мл дистиллированной водой. Налейте раствор туда и обратно между градуированным цилиндром и одним из стаканов на 600 мл, чтобы смешать раствор. Оставьте раствор в стакане. (Этот раствор содержит 0,20 М в H 2 SO 4 и 0,09 М в H 2 O 2 .)
Разбавьте раствор до 250 мл дистиллированной водой. Налейте раствор туда и обратно между градуированным цилиндром и одним из стаканов на 600 мл, чтобы смешать раствор. Оставьте раствор в стакане. (Этот раствор содержит 0,20 М в H 2 SO 4 и 0,09 М в H 2 O 2 .) - В стакане на 250 мл растворить 0,20 г Na 2 S 2 O 3 в 50 мл дистиллированной воды. Промойте мерный цилиндр на 250 мл дистиллированной водой. Добавьте в цилиндр раствор Na 2 S 2 O 3 , 13 мл 1,0 М KI и 10 мл 1% раствора крахмала. Разбавьте смесь до 250 мл дистиллированной водой. Перелейте раствор туда и обратно между мерным цилиндром и оставшимся стаканом на 600 мл, чтобы перемешать раствор. Оставьте раствор в стакане. (Этот раствор 0,052 М в KI и 0,0032 М в Na
- Поместите два стакана на 600 мл рядом на демонстрационный стол и поместите палочку для перемешивания в один из стаканов.


 4S4 2S4.4S4 2 9027 9027 9.
4S4 2S4.4S4 2 9027 9027 9. (водный) (быстрый)
(водный) (быстрый)
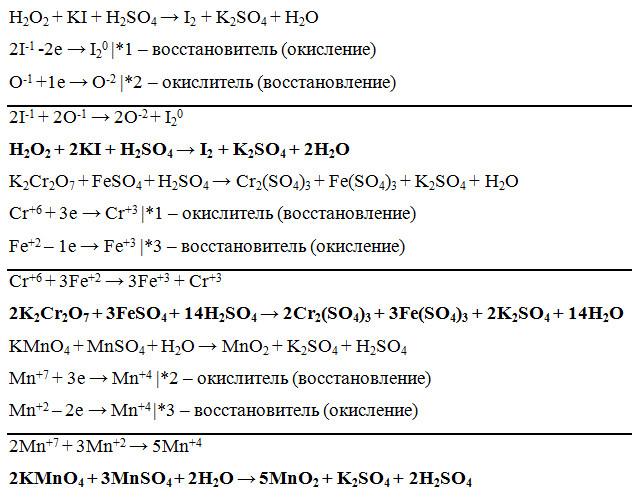 Разбавьте раствор до 250 мл дистиллированной водой. Налейте раствор туда и обратно между градуированным цилиндром и одним из стаканов на 600 мл, чтобы смешать раствор. Оставьте раствор в стакане. (Этот раствор содержит 0,20 М в H 2 SO 4 и 0,09 М в H 2 O 2 .)
Разбавьте раствор до 250 мл дистиллированной водой. Налейте раствор туда и обратно между градуированным цилиндром и одним из стаканов на 600 мл, чтобы смешать раствор. Оставьте раствор в стакане. (Этот раствор содержит 0,20 М в H 2 SO 4 и 0,09 М в H 2 O 2 .)