что, как сбалансировать и часто задаваемые вопросы —
By Авниш Рават
Химические реакции включают столкновение двух или более реагирующих частиц в правильной ориентации с образованием важных продуктов. Поговорим о химической активности H2SO4 и Ба.
Серная кислота является сильной кислотой с определенным промышленным применением. Из-за высокой смешиваемости с водой он вызывает сильную коррозию многих металлов и неметаллов. Барий — очень активный щелочноземельный металл. Этот металл используется в производстве высокотемпературных полупроводников и в производстве петардных крекеров.
Реакционная способность H2SO4 и Ba имеет значение в нефтяной промышленности, используется в красках и лаках. Кроме того, химические реакции можно исследовать по следующим критериям, обсуждаемым ниже.
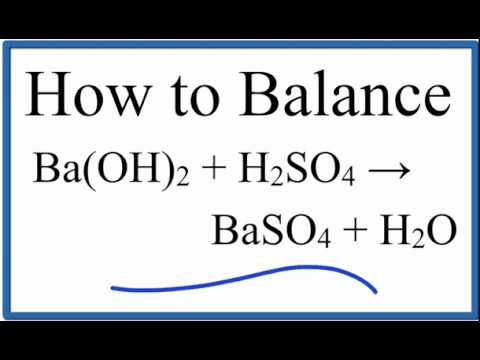
Что является произведением H2SO4 и Ба?Сульфат бария и газообразный водород образуются при H2SO4 + Ба реагирует.
H2SO4 + Ва = ВаSO4 + H2
Какой тип реакции Н2SO4 + Ба?H2SO4 + Ба — это замена реакция, при которой водород в серной кислоте замещается барием с образованием сульфата бария.
Как сбалансировать H2SO4 + Ба?Следующая реакция уравновешивается указанным алгебраическим методом:
Ва + Н2SO4 = BaSO4 + H2
- Неизвестные коэффициенты представлены переменными (A, B, C и D), которые присваиваются каждому реагенту и продукту в уравнении.
- А Ба + ЧД2SO4 = С BaSO4 + ЦТ2
- Теперь уравнение решается соответствующим числом, которое считается коэффициентом реагентов и продуктов.
- Ba = A = C, H = 2B = 2D, S = B = C, O = 4B = 4C
- Используя метод исключения Гаусса, все переменные и коэффициенты рассчитываются, и результат
- А = 1, В = 1, С = 1 и D = 1
- Итак, общее сбалансированное уравнение:
- Ва + Н2SO4 = BaSO4 + H2
Система титрования Ba + H2SO4 невозможно, потому что Ba — это металл, который нельзя использовать в титровании.
Наблюдения и советы этой статьи мы подготовили на основании опыта команды чистое ионное уравнение Ва + Н2SO4 is
Ва(с) + 2H+ (водн.) + SO4-2 (водн.) = BaSO4 (с) + Н2 (Г)
Чистое ионное уравнение создается с использованием процедур, описанных ниже:
- Сначала напишите сбалансированное химическое уравнение, затем проиллюстрируйте физические условия реагентов и продуктов.
- Ва(с) + Н2SO4 (водн.) = BaSO4 (с) + Н2 (Г)
- Итак, чистые твердые вещества и молекулы не диссоциируют, тогда как сильные кислоты, основания и соли диссоциируют на ионы
- Таким образом, результирующее ионное уравнение имеет вид
- Ва(с) + 2H+ (водн.
 ) + SO4-2 (водн.) = BaSO4 (с) + Н2 (Г)
) + SO4-2 (водн.) = BaSO4 (с) + Н2 (Г)
- H2SO4 образует сопряженное основание как HSO4–
- Ба не может образоваться сопряженные пары потому что он не содержит протона.
- H2SO4 молекулы связаны друг с другом посредством диполь-дипольные взаимодействия, ван-дер-ваальсовые дисперсионные силы и сильная водородная связьds.
- Ионы металла Ba взаимодействуют с помощью межмолекулярных сил.
H2SO4 + Ба сообщает энтальпия реакции -239. 02 кДж/моль.
02 кДж/моль.
H2SO4 + Ба не может работать как буферный раствор потому что ни сильная кислота ( H2SO4) ни металл (Ba) не могут образовывать буфер.
Н2SO4 + Ба полная реакция?H2SO4 + Ba является полной реакцией, так как сульфат бария и газообразный водород образуются в виде стабильных продуктов.
Н2SO4 + Ba экзотермическая или эндотермическая реакция?H2SO4 + Ба – это экзотермическая реакция так как при добавлении серной кислоты выделяется теплота.
Н2SO4 + Ба окислительно-восстановительная реакция?H2SO4 + Ба не окислительно-восстановительная реакция потому что только Ba подвергается реакции окисления.
H2SO4 + Ba является реакцией осаждения, так как нерастворимый сульфат бария выпадает в осадок в конце реакции.
Н2SO4 + Ba обратимая или необратимая реакция?H2SO4 + Ба – это необратимая реакция потому что продукты образовали BaSO4 не могут быть заменены обратно на реагенты.
Н2SO4 + Ва реакции смещения?H2SO4 + Ба — это реакция смещения так как наблюдается однократное смещение сульфатной группы от водорода к барию.
ВыводыРеакция серной кислоты с барием имеет несколько промышленных и коммерческих последствий. Барий пассивно реагирует с серной кислотой и тем самым останавливает реакцию, образуя на поверхности нерастворимое покрытие из сульфата бария. Сульфат бария из-за малой токсичности используется в рентгенографии.
Сульфат бария из-за малой токсичности используется в рентгенографии.
1. Действие разбавленной серной кислоты h3so4 и растворов её солей
о2.2.3. Третья аналитическая группа катионов: Ba2+, Sr2+, Ca2+.
В неё входят ионы щелочноземельных элементов IIА группы периодической системы.
Гидроксиды катионов III аналитической группы довольно сильные щелочи. Растворимость и сила гидроксидов повышается от Ca2+ Ba2+.
Общеаналитические реакции катионов группы серной кислоты.
Специфических реакций на катионы группы
серной кислоты не имеется за исключением
окрашивания пламени спиртовки катионами
стронция в карминово-красный цвет и
мало чувствительной реакции катионов
кальция Ca2+ с
K4[Fe(CN)6]
в присутствии катионов аммония. Поэтому
определение катионов данной группы
производят при помощи общеаналитических
реакций.
Таким образом, на различных значениях произведения растворимости малорастворимых соединений бария, стронция и кальция, основано их отделение друг от друга и последующее определение данных катионов из растворов.
Со всеми минеральными кислотами (за исключением HNO3, НСl и HJ) катионы бария Ba2+, стронция Sr2+ и кальция Ca2+ образуют малорастворимые соединения; из концентрированных растворов они осаждаются также гидроксидами калия и натрия KOH, NaOH в виде осадков гидроксидов Ba(OH)2 , Sr(OH)2 , Ca(OH) 2.
Серная кислота и её соли образуют белые кристаллические осадки со всеми катионами данной группы:
BaCl2 + H2SO4 = BaSO4 + 2HCl ПР BaSO4 = 1,1 *10 –10
SrCl2 + H2SO4 = SrSO4 + 2HCl ПР SrSO4 = 2,8 *10 –7
CaCl2 + H2SO4 = CaSO4 + 2HCl ПР CaSO4 = 6,1 *10 –5
Все осадки сульфатов бария, стронция и
кальция нерастворимы ни в щелочах, ни
в кислотах, но обладают различной
растворимостью в воде. А именно:
растворимость сульфата бария BaSO
А именно:
растворимость сульфата бария BaSO
В отличие от осадков BaSO4 и SrSO4 растворимость сульфата кальция CaSO4 повышается в присутствии сульфата аммония (NH4)2SO4.
CaSO4 + (NH4)2SO4 (NH4)2Ca(SO4)2
При этом образуется неустойчивая
комплексная соль (NH4)2[Ca(SO4)2]
– дисульфатокальциат (II)
аммония.
Отсюда следует, что если осаждение смеси катионов Ba2+, Sr2+ , Ca2+ проводить надо не серной кислотой, а избытком сульфата аммония (NH4)2SO4, то количество не перешедших в осадок CaSO4 катионов кальция Ca2+ будет не 0,0116 г/л намного больше. Следует иметь в виду, что в присутствии спирта (C2H5OH) или ацетона растворимость CaSO4 резко понижается. Если осаждение кальция серной кислотой проводишь в водном растворе с добавлением к нему спирта или ацетона, то катионы кальция полностью перейдут в осадок CaSO4.
Указанные свойства различной растворимости в воде сульфатов бария, стронция и кальция и изменение растворимости CaSO4 в присутствии сульфата аммония (NH4)2SO4 и спирта используются при открытии катионов данной аналитической группы из их растворов.
Например:
а) Если к раствору солей бария, стронция,
кальция, прилить насыщенного раствор
CaSO4 (0,0116 г/л), то из
него выпадает осадок BaSO4 иSrSO4 , так
как растворимость сульфатов бария,
стронция гораздо меньше 0,0116 г/л, а катионы
кальция Ca2+ при этом
осадка не образуют.
Если в анализируемом растворе катионы бария Ba2+ отсутствуют, то с насыщенным раствором CaSO4 будет выпадать осадок SrSO4 (очень медленно). Этим пользуются для открытия катионов стронция, после удаления катионов бария.
б) Если на раствор смеси катионов бария, стронция и кальция, подействовать раствором серной кислоты (2н) или сульфатом аммония (NH4)2
SO4 и полученный осадок BaSO4 , SrSO4 , CaSO4 отцентрифугировать,а к центрифугату прибавить спирт (50-60%) или ацетон, то из раствора будет выпадать осадок CaSO4 , так как растворимость сульфата кальция в спирте резко уменьшается. При действии на этот центрифугат оксалатом аммония (NH4)2C2О4 будет выпадать белый кристаллический осадок CaC2О4, т.к. растворимость CaC2О4 значительно меньше растворимости CaSO4. В практике качественного анализа этой
реакцией пользуются для открытия
катионов кальция Ca2+ из смеси не только третьей, но и всех
остальных аналитических групп.
В практике качественного анализа этой
реакцией пользуются для открытия
катионов кальция Ca2+ из смеси не только третьей, но и всех
остальных аналитических групп. С повышением температуры растворимость
сульфатов третьей группы катионов в
воде почти не изменяется, но при t
= 60-70
Следует отметить, что сульфат-ионы образуют осадки только с катионами Ba2+, Sr2+ ,Ca2+ и Pb2+ , а с катионами других аналитических групп осадков не образуют. Поэтому разбавленная H2SO4 является типичным групповым реактивом на катионы свинца, которые логично отнести к данной группе.
What, How to Balance & FAQs —
Авниш Рават
Химические реакции включают столкновение двух или более реагирующих частиц в правильной ориентации с образованием важных продуктов. Поговорим о химической активности H 2 SO 4 и Ba.
Поговорим о химической активности H 2 SO 4 и Ba.
Серная кислота – это сильная кислота, имеющая определенные промышленные применения. Из-за высокой смешиваемости с водой он вызывает сильную коррозию многих металлов и неметаллов. Барий — очень активный щелочноземельный металл. Этот металл используется в производстве высокотемпературных полупроводников и в производстве петардных крекеров.
Реакционная способность H 2 SO 4 и Ba имеет значение в нефтяной промышленности, используется в красках и лаках. Кроме того, химические реакции можно исследовать по следующим критериям, обсуждаемым ниже.
Что является продуктом H 2 SO 4 и Ba?Сульфат бария и газообразный водород образуются при реакции H 2 SO 4 + Ba .
Н 2 SO 4 + Ba = BaSO 4 + H 2
Какой тип реакции имеет H 2 SO 4 + Ba? H 2 SO 4 + Ba — это реакция замещения, в которой водород в серной кислоте замещается барием с образованием сульфата бария.
Следующая реакция уравновешивается указанным алгебраическим методом:
Ba + H 2 SO 4 = BaSO 4 + H 2
2- переменные, которые представлены коэффициентами каждый реагент и продукт в уравнении.
- A Ba + B H 2 SO 4 = C BaSO 4 + D H 2
- .
- Ba = A = C, H = 2B = 2D, S = B = C, O = 4B = 4C
- Используя метод исключения Гаусса, вычисляются все переменные и коэффициенты , и результат IS
- A = 1, B = 1, C = 1 и D = 1
- С. 4 + H 2
Система титрования Ba + H 2 SO 4 невозможна, поскольку Ba является металлом, который нельзя использовать в титровании.
Чистое ионное уравнение Ba + H 2 SO 4 2 is 2
Ба(с) + 2Н + (водн.) + SO 4 -2 (водн.) = BaSO 4 (т) + H 2 (g)
Суммарное ионное уравнение создается с использованием процедур, описанных ниже:
- Сначала напишите сбалансированное химическое уравнение, затем проиллюстрируйте физические условия реагентов и продуктов 1 Ba(s) + H 2 SO 4 (водн.) = BaSO 4 (s) + H 2 (g)
- Теперь, чистые вещества, не диссоциируют твердые молекулы и тогда как сильные кислоты, основания и соли диссоциируют на ионы
- Таким образом, результирующее ионное уравнение имеет вид (водн.
 ) = BaSO 4 (т) + H 2 (г)
) = BaSO 4 (т) + H 2 (г)
- H 2 SO 4 связаны между собой через 10 ди
- 9 молекулы полюс-дипольные взаимодействия
, ван-дер-ваальсовы дисперсионные силы и сильная водородная связь ds . - Ионы металла Ba взаимодействуют с помощью межмолекулярных сил.
H 2 SO 46
H 2 SO 4 + Ba не может работать в качестве буферного раствора, поскольку ни сильная кислота (H 2 SO 4 ), ни металл (Ba) не могут образовывать буфер.
H 2 SO 4 + Ba является полной реакцией, так как сульфат бария и газообразный водород образуются как стабильные продукты.
Является ли H 2 SO 4 + Ba экзотермической или эндотермической реакцией?H 2 SO 4 + Ba является экзотермической реакцией, поскольку при добавлении серной кислоты выделяется тепло.
Является ли H 2 SO 4 + Ba окислительно-восстановительной реакцией?H 2 SO 4 + Ba не является окислительно-восстановительной реакцией, поскольку только Ba подвергается реакции окисления.
Является ли H 2 SO 4 + Ba реакцией осаждения? H 2 SO 4 + Ba является реакцией осаждения, поскольку в конце реакции нерастворимый сульфат бария выпадает в осадок.
H 2 SO 4 + Ba является необратимой реакцией, поскольку образующиеся продукты BaSO 4 нельзя превратить обратно в реагенты.
Is H 2 SO 4 + Ba реакция замещения?H 2 SO 4 + Ba является реакцией замещения, поскольку наблюдается однократное замещение сульфатной группы с водорода на барий.
ВыводыРеакция серной кислоты с барием имеет несколько промышленных и коммерческих последствий. Барий пассивно реагирует с серной кислотой и тем самым останавливает реакцию, образуя на поверхности нерастворимое покрытие из сульфата бария. Сульфат бария из-за малой токсичности используется в рентгенографии.
Отдельные растворы Ba(OH)2 и h3SO4 оба проводят электричество…
Отдельные растворы Ba(OH)2 и h3SO4 оба проводят электричество. .. | Каналы для Pearson+
.. | Каналы для Pearson+Последние каналы
- Общая химия
Химия
- Общая химия
- Органическая химия 9 Химия GG 90 Аналитическая химия
- Биохимия
Биология
- Общая биология
- Микробиология
- Анатомия и Физиология
- Генетика
- Клеточная биология
Математика
- Алгебра колледжа
- Тригонометрия
- Предварительное исчисление
Физика
- Физика
Бизнес
- Микроэкономика
- Финансы Бухгалтерский учет44 41
Социальные науки
- Психология
Начните печатать, затем используйте стрелки вверх и вниз чтобы выбрать вариант из списка.

Общая химия6. Химические количества и водные реакцииЭлектролиты
1:39
минуты
Задача 64
Вопрос из учебника
Проверенные решения
Наши преподаватели рекомендовали это видеорешение как полезное для описанной выше задачи.
224просмотра
Было ли это полезно?
Смотреть дальше
Master Категории электролитов с кратким видео-объяснением от Жюля Бруно
Начать изучение
Похожие видео
Родственная практика
Что такое электролиты?
Объяснения профессора Дэйва
190views
Оценка электролитов и неэлектролитов
Pearson
135views
ХИМИЯ 101 — Электролитные и неэлектролитные растворы
3
3 0002 194 просмотра
Категории электролитов
Жюль Брюно
285 просмотров
Химия 9.


 ) + SO4-2 (водн.) = BaSO4 (с) + Н2 (Г)
) + SO4-2 (водн.) = BaSO4 (с) + Н2 (Г) ) = BaSO 4 (т) + H 2 (г)
) = BaSO 4 (т) + H 2 (г)