Нароод)h3SO4+Ca(OH)2=CaSO4+2h3O ионное полное иh3SO4+Ca(OH)2=CaSO4+2h3O ионное полное и
Можете помочь пожалуйста.Сколько литров газа получится при взаимодействии 325 г цинка с соляной кислотой?
ПЖЖЖЖЖЖЖЖ ПОМОГИТЕ СРОЧНО. Нитрат цинка реагировал с раствором, содержащим 8 г гидроксида натрия. Какая масса осадка? даю 15 баллов
ПЖЖЖЖЖЖЖЖ ПОМОГИТЕ СРОЧНО. Нитрат цинка реагировал с раствором, содержащим 8 г гидроксида натрия. Какая масса осадка?
Определите количество вещества (в молях) оксида серы (IV), занимающего объем 2,688 л при н. у. В ответ запишите число с точностью до сотых. помогитеее … е
Определите координационное число (КЧ) и координационный полиэдр (КП) атома в простой кубической кладке.КЧЧислокубооктаэдркубтригональная призматетраэд … роктаэдрфигура октаэдр потому что с любым числом и октаэдром частично верно
Сопоставьте свойства твёрдого вещества и тип его структуры. Ионная кристаллическая решётка Металлическая кристаллическая решётка Атомная кристаллическ … ая решётка Молекулярная кристаллическая решётка Аморфное вещество Размягчается при нагревании, прозрачное, не проводит электрический ток Хорошо проводит электрический ток и тепло, ковкое Хорошо растворимо в органическом растворителе, нерастворимо в воде, самовоспламеняется на воздухе, мягкое Высокая температура плавления, твёрдое, не проводит электрический ток, нерастворимо в воде Летучее вещество с резким запахом, хорошо растворимо в воде Низкая температура плавления, ковкое, реагирует с водой, прекрасно проводит электрический ток Высокая температура плавления, без запаха, хорошо растворимо в воде, проводит электрический ток лишь в расплавленном виде ЗАДАЧА ИЗ СИРИУСА ДАЙТЕ ОТВЕТ ПОЖАЛУЙСТА
В молекуле N2 реализуется ковалентная химическая связь с кратностью, равной 3. Сколько всего электронов ушло на образование связи в молекуле? Электрон
… ную конфигурацию какого благородного газа приобрёл каждый атом азота?
Сколько всего электронов ушло на образование связи в молекуле? Электрон
… ную конфигурацию какого благородного газа приобрёл каждый атом азота?
1. Какая частица вылетает из ядра при бетта-распаде? a. нейтрон b. фотон c. протон d. электрон 2. Какая из частиц является движущейся в атоме? a. ядр … о b. протон c. нейтрон d. электрон
Верны ли суждения о способах разделения смесей? 1. Бензин разделяют на компоненты с помощью делительной воронки. 2. Действие на смесь магнитом являетс … я физическим способом разделения веществ. А верно только 1 Б верно только 2 В верны оба суждения Г оба суждения неверны
5. Верны ли суждения о способах разделения смесей? 1. Кристаллизацию относят к химическим способам разделения смесей. 2. Разделить смесь двух жидкосте … й можно дистилляцией. А верно только 1 Б верно только 2 В верны оба суждения Г оба суждения неверны
Ca(OH)2 +h3SO4->CaSO4+2h3O Полный и сокращенный ионный вид.
ПОМОГИТЕ!!!! Для вирощування кристалів приготували розчин об’ємом 900 мл, у якому міститься сіль натрій хлорид масою 52 г.
помогите пожалуйста, химия 7 класс, 20 баллов, срочно нужно 🙁 Сопоставьте свойства твёрдого вещества и тип его структуры. Ионная кристаллическая решё … тка Металлическая кристаллическая решётка Атомная кристаллическая решётка Молекулярная кристаллическая решётка Аморфное вещество Высокая температура плавления, без запаха, хорошо растворимо в воде, проводит электрический ток лишь в расплавленном виде Хорошо проводит электрический ток и тепло, ковкое Размягчается при нагревании, прозрачное, не проводит электрический ток Низкая температура плавления, ковкое, реагирует с водой, прекрасно проводит электрический ток Хорошо растворимо в органическом растворителе, нерастворимо в воде, самовоспламеняется на воздухе, мягкое Высокая температура плавления, твёрдое, не проводит электрический ток, нерастворимо в воде Летучее вещество с резким запахом, хорошо растворимо в воде
Какой объём при н. у. займут молекулы газа водорода а количестве 1,204*10в степени 24?
А)2,24л
В)11,2л
С)22,4л
Д)44,8л
у. займут молекулы газа водорода а количестве 1,204*10в степени 24?
А)2,24л
В)11,2л
С)22,4л
Д)44,8л
Яку масу води треба додати до 12,1 г цинк хлориду, щоб отримати 142 г розчину?
Помогите пожалуйста!!!!!!!!!!!!!!Даю 35 баллов
40г соди і 260г h3O помогите срочно
здійснити перетворення: Ba—>Ba—>Ba(OH)2
he always arrives at work early в future perfect сделать отрицание 2 вопроса положительный
16. Бабуся займалася домашнім консервуванням огірків, але в неїзакінчився харчовий оцет (масова частка оцтової кислоти 9 %).Допоможіть їй приготувати … оцет об’ємом 1 л (густина 1 г/мл), ви-користавши для цього оцтову есенцію, у якій масова частка кисло-ти становить 70 %. (6 балів)
16. Бабуся займалася домашнім консервуванням огірків, але в неїзакінчився харчовий оцет (масова частка оцтової кислоти 9 %).Допоможіть їй приготувати
… оцет об’ємом 1 л (густина 1 г/мл), ви-користавши для цього оцтову есенцію, у якій масова частка кисло-ти становить 70 %.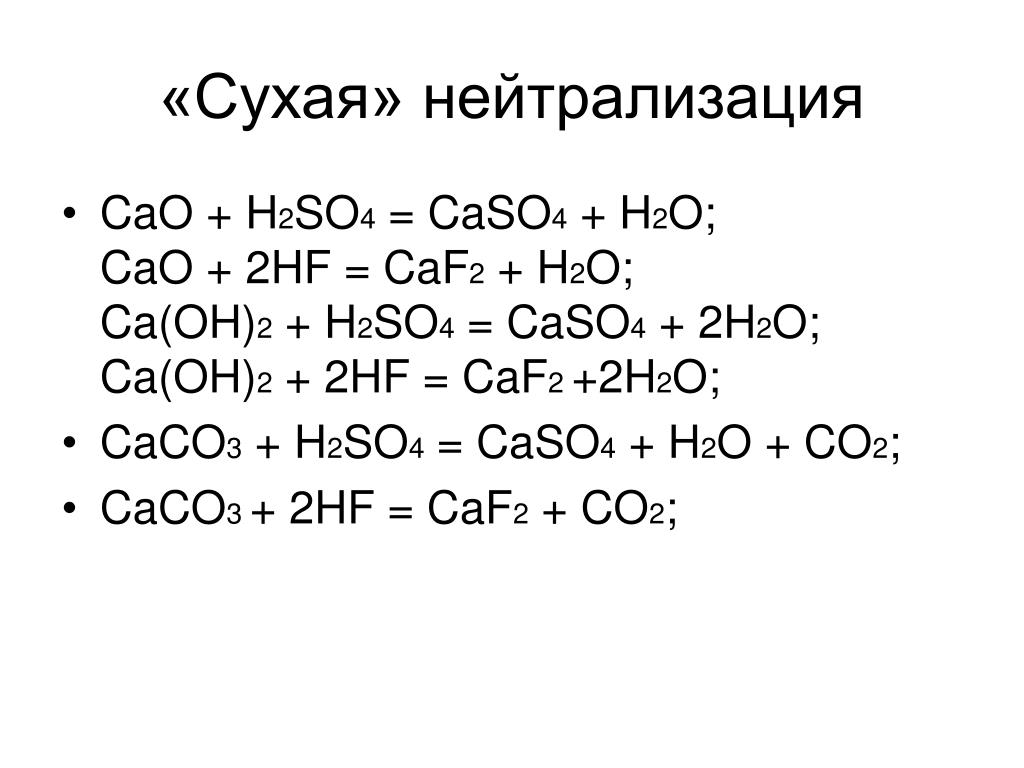
Реакции ионного обмена и условия их осуществления
Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка. Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов.
Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена.
Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
- Na2CO3 + h3SO4 → Na2SO4 + CO2↑ + h3O
- 2Na(+) + CO3(2-) + 2H(+) + SO4(2-) → 2Na(+) + SO4(2-) + CO2↑ + h3O
- 2H(+) + CO3(2-) → CO2↑ + h3O
При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, то есть обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнениях.
Следует иметь в виду, что реакции двойного обмена между солями с образованием осадков протекают во всех тех случаях, когда растворимость реагентов выше, чем растворимость одного из продуктов.
Для получения малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты и использовать достаточно концентрированные растворы.
Диссоциации не подвергаются:
- оксиды
- газообразные вещества
- вода
Реакция ионного обмена идет до конца, если образуется газ, осадок или вода:
- Na2CO3 + 2HCl → CO2↑ + 2NaCl + h3O
- 2KOH + CuCl2 → Cu(OH)2↓ + 2KCl
- NaOH + HCl → NaCl + h3O
Полезные ссылки
Источник материала
Реакции ионного обмена (видео)
Реакции ионного обмена и условия их протекания.

Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
HNO3 + KOH = KNO3 + H2O (1)
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.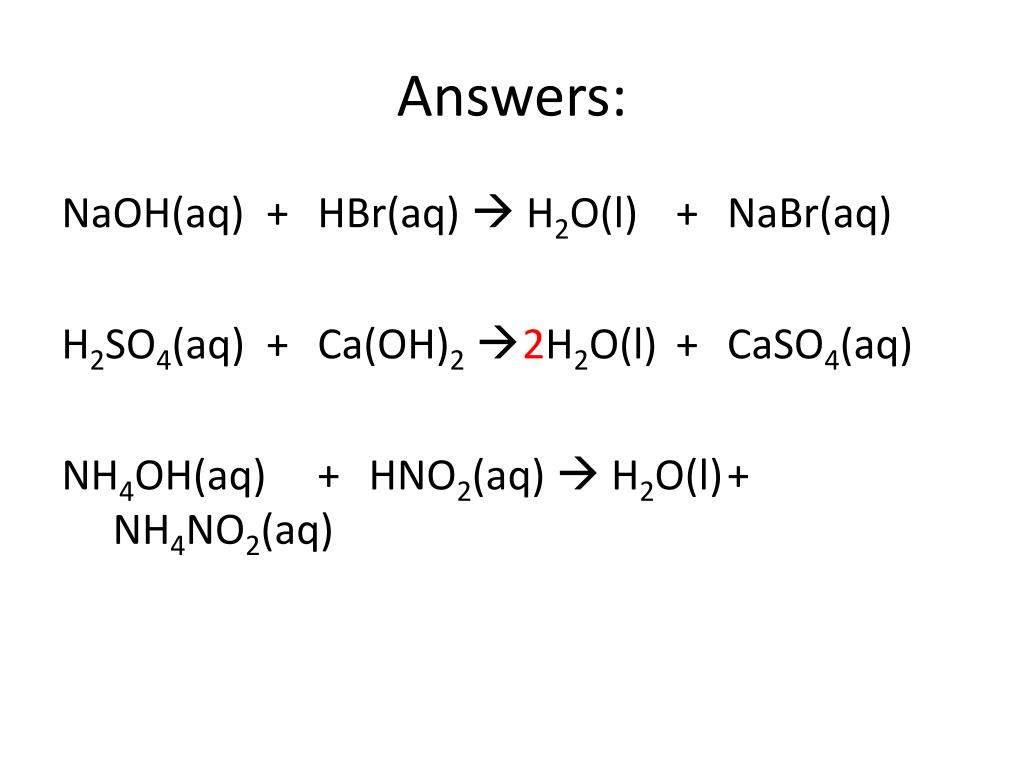 е. в виде ионов:
е. в виде ионов:
H+ + NO3− + K+ + OH‑ = K+ + NO3− + H2O (2)
Как можно заметить из уравнения (2), что до реакции, что после в растворе находятся ионы NO3− и K+ . Другими словами, по сути, нитрат-ионы и ионы калия никак не участвовали в реакции. Реакция произошла только благодаря объединению частиц H+ и OH− в молекулы воды. Таким образом, произведя алгебраически сокращение одинаковых ионов в уравнении (2):
H+ + NO3− + K+ + OH‑ = K+ + NO3− + H2O
мы получим:
H+ + OH‑ = H2O (3)
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание.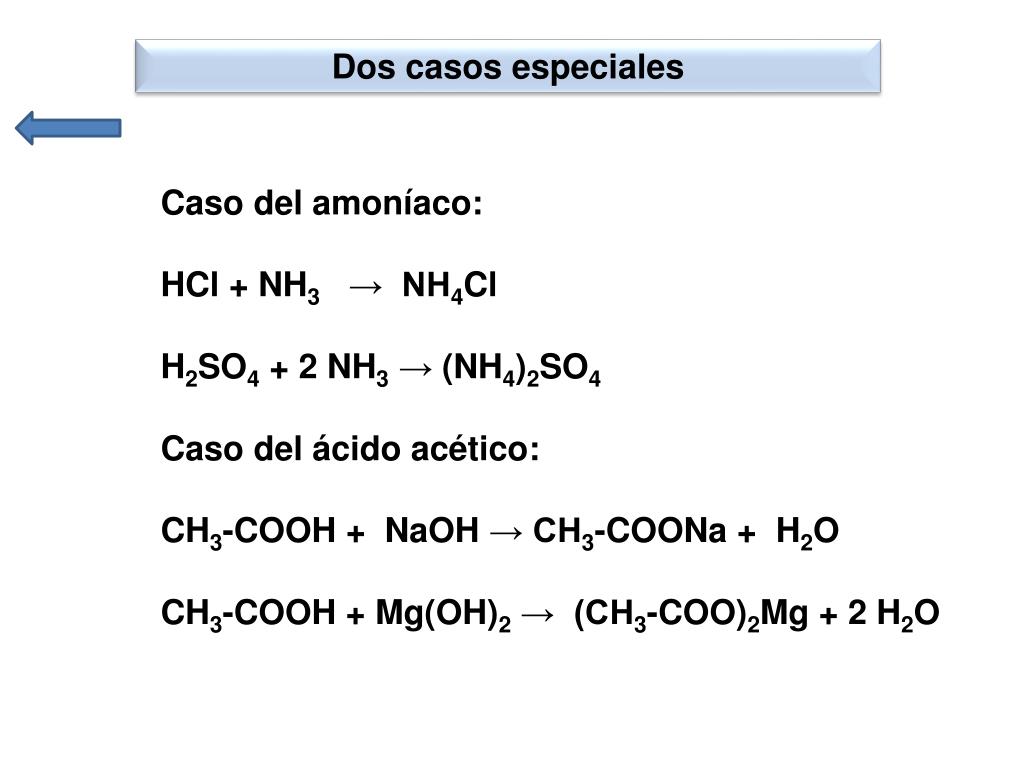 Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
2HCl+ Ba(OH)2 = BaCl2 + 2H2O
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H+ + 2Cl− + Ba2+ + 2OH− = Ba2+ + 2Cl− + 2H2O
Сократим одинаковые ионы слева и справа и получим:
2H+ + 2OH− = 2H2O
Разделив и левую и правую часть на 2, получим:
H+ + OH− = H2O,
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
3) Слабых оcнований (NH4OH и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
2Fe(OH)3+ 3H2SO4 = Fe2(SO4)3 + 6H2O
Гидроксиду железа (III) соответствует в таблице растворимости обозначение «Н», что говорит нам о его нерастворимости, т. е. в ионном уравнении его надо записывать целиком, т.е. как Fe(OH)3 . Серная кислота растворима и относится к сильным электролитам, то есть существует в растворе преимущественно в продиссоциированном состоянии. Сульфат железа (III), как и практически все другие соли, относится к сильным электролитам, и, поскольку он растворим в воде, в ионном уравнении его нужно писать в виде ионов. Учитывая все вышесказанное, получаем полное ионное уравнение следующего вида:
е. в ионном уравнении его надо записывать целиком, т.е. как Fe(OH)3 . Серная кислота растворима и относится к сильным электролитам, то есть существует в растворе преимущественно в продиссоциированном состоянии. Сульфат железа (III), как и практически все другие соли, относится к сильным электролитам, и, поскольку он растворим в воде, в ионном уравнении его нужно писать в виде ионов. Учитывая все вышесказанное, получаем полное ионное уравнение следующего вида:
2Fe(OH)3 + 6H+ + 3SO42- = 2Fe3+ + 3SO42- + 6H2O
Сократив сульфат-ионы слева и справа, получаем:
2Fe(OH)3 + 6H+ = 2Fe3+ + 6H2O
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Например, взаимодействие двух растворимых солей :
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na+ + CO32- + Ca2+ + 2Cl− = CaCO3↓+ 2Na+ + 2Cl−
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
CO32- + Ca2+ = CaCO3↓
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
То есть, например,
CuS + Fe(NO3)2 ≠ FeS + Cu(NO3)2
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
А вот, например,
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
Cu(OH)2 + Na2S – не протекает,
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
2NaOH + Cu(NO3)2 = Cu(OH)2 ↓+ 2NaNO3
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
Другими словами:
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
K2S + 2HBr = 2KBr + H2S↑
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, NH4OH и H2SO3:
H2CO3 = H2O + CO2 ↑
NH4OH = H2O + NH3 ↑
H2SO3 = H2O + SO2 ↑
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 ↑
NH4NO3 + KOH = KNO3 + H2O + NH3 ↑
Na2SO3 + 2HCl = 2NaCl + H2O + SO2 ↑
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
1) Для реакции:
K2S + 2HBr = 2KBr + H2S↑
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K+ + S2- + 2H+ + 2Br— = 2K+ + 2Br— + H2S↑
Сократив одинаковые ионы получаем:
S2- + 2H+ = H2S↑
2) Для уравнения:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 ↑
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
2Na+ + CO32- + 2H + + SO42- = 2Na+ + SO42 + H2O + CO2 ↑
CO32- + 2H + = H2O + CO2↑
3) для уравнения:
NH4NO3 + KOH = KNO3 + H2O + NH3↑
Молекулы воды и аммиака запишутся целиком, а NH4NO3, KNO3 и KOH запишутся в ионном виде , т.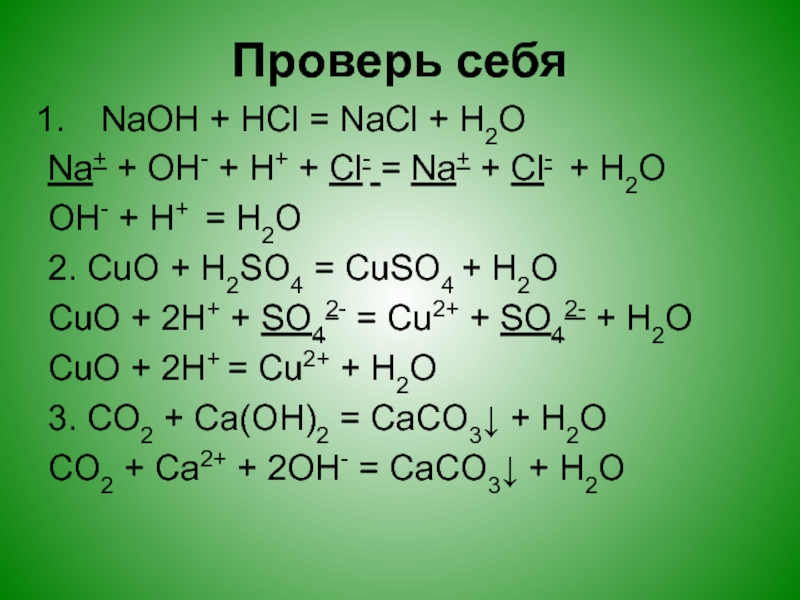 к. все нитраты являются хорошо растворимыми солями, а KOH является гидроксидом щелочного металла, т.е. сильным основанием:
к. все нитраты являются хорошо растворимыми солями, а KOH является гидроксидом щелочного металла, т.е. сильным основанием:
NH4+ + NO3−+ K+ + OH− = K+ + NO3− + H2O + NH3↑
NH4+ + OH− = H2O + NH3↑
Для уравнения:
Na2SO3 + 2HCl = 2NaCl + H2O + SO2 ↑
Полное и сокращенное уравнение будут иметь вид:
2Na+ + SO32- + 2H+ + 2Cl− = 2Na+ + 2Cl− + H2O + SO2 ↑
SO32- + 2H+ = H2O + SO2 ↑
Реакции ионного обмена и условия их протекания
Цели урока: познакомить учащихся с ионными уравнениями реакций, начать формировать навыки составления полных и сокращенных ионных уравнений.
Ход урока
1.
1. Перечислите сильные и слабые электролиты.
2. Как происходит диссоциация средних солей? кислых? основных?
3. В случае ступенчатой диссоциации электролита, какие ионы образуются в наибольшем количестве, а какие в наименьшем?
2. Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
5. Помните!
На ионы диссоциируют |
|
Реагенты (исходные вещества) |
Продукты реакции |
Растворимые (P) в воде (см. ТР): 1. Соли 2. Кислоты 3. Основания (Включая Ca(OH)2 – M) |
Растворимые (P) в воде (см. ТР): 1. Соли 2. Кислоты 3. Основания Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду: h3CO3 ↔ h3O + CO2↑ h3SO3 ↔ h3O + SO2↑ Nh5OH↔ h3O + Nh4↑ h3S↑ (сероводород сам выделяется в виде газа) |
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
3. Алгоритм составления реакций ионного обмена в молекулярном, полном и кратком ионном виде
1). Записываем уравнение РИО в молекулярном виде: |
Взаимодействие серной кислоты и хлорида бария: II II I I h3SO4 + BaCl2 = BaSO4 + 2HCl |
2). Используя ТР указываем растворимость веществ воде: — Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓; — Если продукт является газом, справа от химической формулы ставим знак ↑. |
Р Р Н Р h3SO4 + BaCl2 = BaSO4 ↓+ 2HCl Молекулярный вид |
3). Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ |
2H+ + SO42- + Ba2+ + 2Cl- = BaSO4 ↓+ 2H+ + 2Cl- Полный ионный вид |
4). |
SO42- + Ba2+ + = BaSO4 ↓ Краткий ионный вид Вывод – данная реакция необратима, т. е. идёт до конца, т. к. образовался осадок BaSO4 ↓ |
4. Примеры составления реакций ионного обмена
1. Если в результате реакции выделяется малодиссоциирующее (мд) вещество – вода.
а) Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + h3O (мд)
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + h3O
Cокращенное ионное уравнение реакции:
H+ + OH– = h3O
б) Молекулярное уравнение реакции основного оксида с кислотой:
CaO (оксид) + 2HNO3 (р) = Ca(NO3)2 (р) + h3O (мд)
Полное ионное уравнение реакции:
CaO + 2H+ + 2NO3- = Ca2+ + 2NO3- + h3O
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + h3O.
в) Молекулярное уравнение реакции нерастворимого основания с кислотой:
3Mg(OH)2 (н) + 2h4PO4 (р) = Mg3(PO4)2↓ + 6h3O (мд)
Полное ионное уравнение реакции:
3Mg(OH)2 + 6H+ + 2PO43- = Mg3(PO4)2↓ + 6h3O
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
2. Если в результате реакции выделяется нерастворимое в воде вещество.
а) Молекулярное уравнение реакции растворимой соли со щелочью:
CuCl2 (р) + 2KOH (р) = 2KCl(р) + Cu(OH)2↓
Полное ионное уравнение реакции:
Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH)2↓.
Cокращенное ионное уравнение реакции:
Cu2+ + 2OH– = Cu(OH)2↓.
б) Молекулярное уравнение реакции двух растворимых солей:
Al2(SO4)3 (р) + 3BaCl2 (р) = 3BaSO4↓ + 2AlCl3(р)
Полное ионное уравнение реакции:
2Al3+ + 3SO42- + 3Ba2+ + 6Cl- = 3BaSO4↓ + 2Al3+ + 6Cl-
Cокращенное ионное уравнение реакции:
SO42- + Ba2+ = BaSO4↓
в) Молекулярное уравнение реакции нерастворимого основания с кислотой:
Fe(OH)3 (н) + h4PO4 (р) = FePO4↓ + 3h3O.
Полное ионное уравнение реакции:
Fe(OH)3 + 3H+ + PO43- = FePO4↓ + 3h3O.
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
3. Если в результате реакции выделяется газообразное вещество.
а) Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + h3S↑.
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + h3S↑.
Cокращенное ионное уравнение реакции:
S2– + 2H+ = h3S↑.
б) Молекулярное уравнение реакции растворимой соли (карбоната) с кислотой:
Na2CO3 + 2HNO3 = 2NaNO3 + h3O + CO2↑
Полное ионное уравнение реакции:
2Na+ + CO32- + 2H+ + 2NO3- = 2Na+ + CO2↑ + h3O + 2NO3-
Cокращенное ионное уравнение реакции:
CO32- + 2H+ = CO2↑ + h3O
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV).
в) Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
3СaCO3 + 2h4РO4 = Са3(PO4)2↓ + 3h3O + 3CO2↑
Полное ионное уравнение реакции:
3СaCO3 + 6H+ + 2 РO43- = Са3(PO4)2↓ + 3h3O + 3CO2↑
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
5. Домашнее задание
П. 4, упр. 1-3, задача 1 на стр. 22
«Реакции ионного обмена и условия их протекания»
Подробный конспект образовательного мероприятия
«Реакции ионного обмена и условия их протекания»
Тип урока
Урок изучения и первичного закрепления новых знаний
Методы
исследование с использованием элементов проблемной ситуации
Формы организации работы обучающихся
Работа в парах, индивидуальная
Цели урока/ занятия/ мероприятия
Углубить изучение реакции обмена, заложенные в курсе 8 класса; сформировать понятие необратимых реакций ионного обмена. Выяснить условия протекания реакций ионного обмена в растворах электролитов до конца.
Выяснить условия протекания реакций ионного обмена в растворах электролитов до конца.
Задачи урока/ занятия/ мероприятия
Образовательные:
повторить типы химических реакций, признаки их протекания;
формировать знания о реакциях ионного обмена, протекающих с образованием конечного продукта;
формировать умения составления полного и сокращенного ионного уравнений на основе молекулярного;
Воспитательные:
воспитание активной личности: умения проявлять инициативу, отстаивать собственную позицию, быть коммуникативным;
активизация познавательной деятельности учащихся в групповой работе по разрешению проблемной ситуации;
способствование формирования коммуникативных способностей учащихся;
создание ситуации успеха.

воспитывать толерантные отношения в группе, классе.
Развивающие:
развитие мышления, речи, творческих способностей, познавательного интереса к предмету;
развитие навыков работы с химическими реактивами; соблюдая правила безопасной работы с ними;
развитие умения выдвигать гипотезы, анализировать полученные результаты, делать выводы.
развивать умение логично излагать свою точку зрения;
учить приемам рефлексии, развивать адекватную самооценку;
развивать умение получать информацию, в том числе и с помощью информационных технологий.
Знания, умения, навыки и качества, которые актуализируют/приобретут/закрепят/др. ученики/коллектив в ходе урока / занятия/ мероприятия
Учащиеся должны знать:
· Обратимые и необратимые реакции обмена.
· Правила составления ионных уравнений реакций .
· Правила Бертолле.
· Признаки химических реакций обмена.
Учащиеся должны уметь:
Составлять ионные уравнения реакции на основе молекулярных.
Пользоваться таблицей растворимости кислот, солей и оснований.
Проводить лабораторный опыт.
Должно появиться в тетрадях ученика(цы):
· Уравнения реакций ионного обмена.
· Правила составления ионных уравнений реакций
· Наблюдения по демонстрационным опытам.
Основные понятия и термины урока:
Ионы, катионы, анионы, электролит, ионное уравнение реакции, правило Бертолле.
Учебный материал, подлежащий усвоению, актуализации, закреплению
Молекулярное уравнение реакции обмена, полное ионное уравнение реакции обмена, сокращенное уравнение реакции обмена, правило составление ионных уравнений, признаки реакций обмена.
Необходимое оборудование, материалы и другие условия для качественного проведения урока
Мультимедийный проектор, учебник Рудзитиса Г.Е., Фельдмана Ф.Г. «Химия 9», М.:Просвещение, 2010-13 г. г., таблица растворимости кислот, солей оснований, инструктивная карта урока, рабочая тетрадь.
Реактивы: карбонат натрия, хлорид бария, хлорид калия, нитрат натрия, сульфат меди (II), соляная кислота, серная кислота, гидроксид натрия, фенолфталеин.
Оборудование: пробирки, лабораторный штатив.
Технологическая карта урока
Конспект урока.
I. Организационный момент.
II. Актуализация знаний.
-Скажите, ребята, какую тему мы начали изучать с вами на прошлых уроках? (Теория электролитической диссоциации)
-А кто из ученых внес наибольший вклад в создание ТЭД? (Шведский ученый С. Аррениус)
Аррениус)
-Сегодняшний урок мы с вами начнем с письма этого великого ученого к вам, потомкам 21 века
«Дорогие ученики ! Приветствую вас на любимом мною уроке химии. Я жил и сделал свое открытие о диссоциации веществ в конце 19 века, за этот труд получил Нобелевскую премию. Признаюсь вам, что это было нелегко. Мне очень интересно, как потомки в 21 веке понимают процессы диссоциации. Поэтому предлагаю разрешить следующие противоречия:
1) Почему между сухими солями ВаСl2 и Na2SO4 нет реакции, а между их растворами реакция идет?
2) Почему нет реакции между растворами NaOH и КNО3?
Буду рад всем вашим мыслям и идеям! Успехов в изучении науки!»
-Прежде чем мы попытаемся найти ответы на вопросы С. Аррениуса, давайте выясним, какого типа реакции предлагает рассмотреть нам ученый? (Реакции обмена)
Аррениуса, давайте выясним, какого типа реакции предлагает рассмотреть нам ученый? (Реакции обмена)
-Как и любые другие реакции, реакции обмена характеризуются определенными признаками, давайте их вспомним.
(Выпадение осадка, выделение газа, образование воды).
— До изучения ТЭД реакции обмена рассматривались как взаимодействие молекул кислот, оснований и солей. Теперь вам известно, что в растворах этих веществ молекул практически нет, а имеются ионы водорода, гидроксид-ионы, ионы металлов и кислотных остатков. Отсюда следует логический вывод. Реакции между растворами этих веществ сводятся к взаимодействию ионов.
-Как можно объяснить с позиции ТЭД отсутствие реакции между сухими солями? (В сухом состоянии электролиты не образуют ионы)
-Но почему же тогда не происходит реакция между растворами гидроксида натрия и нитрата калия? Ведь оба эти вещества являются сильными электролитами, значит в растворе они практически полностью распадаются на ионы. На этот вопрос и некоторые другие нам и предстоит ответить на сегодняшнем уроке. Но так мы выяснили, что реакции обмена идут между ионами, то такие реакции называют ионными, а уравнения их описывающие – ионными уравнениями.
На этот вопрос и некоторые другие нам и предстоит ответить на сегодняшнем уроке. Но так мы выяснили, что реакции обмена идут между ионами, то такие реакции называют ионными, а уравнения их описывающие – ионными уравнениями.
Обучающиеся записывают определение ионных уравнений.
Реакции между ионами называют ионными реакциями, а уравнения таких реакций – ионными уравнениями.
III. Целеполагание.
-Давайте с вами попробуем сформулировать цель нашего урока. (Научиться проводить и записывать реакции ионного обмена)
IV. Изучение нового материала.
СТАДИЯ «ВЫЗОВА»
-В изучении реакций ионного обмена особый след оставил другой великий французский ученый – Клод Луи Бертолле.
-Скажите, кому-нибудь из вас знакомо это имя? (-В честь этого ученого названа бертолетова соль, которую он впервые получил)
-Верно.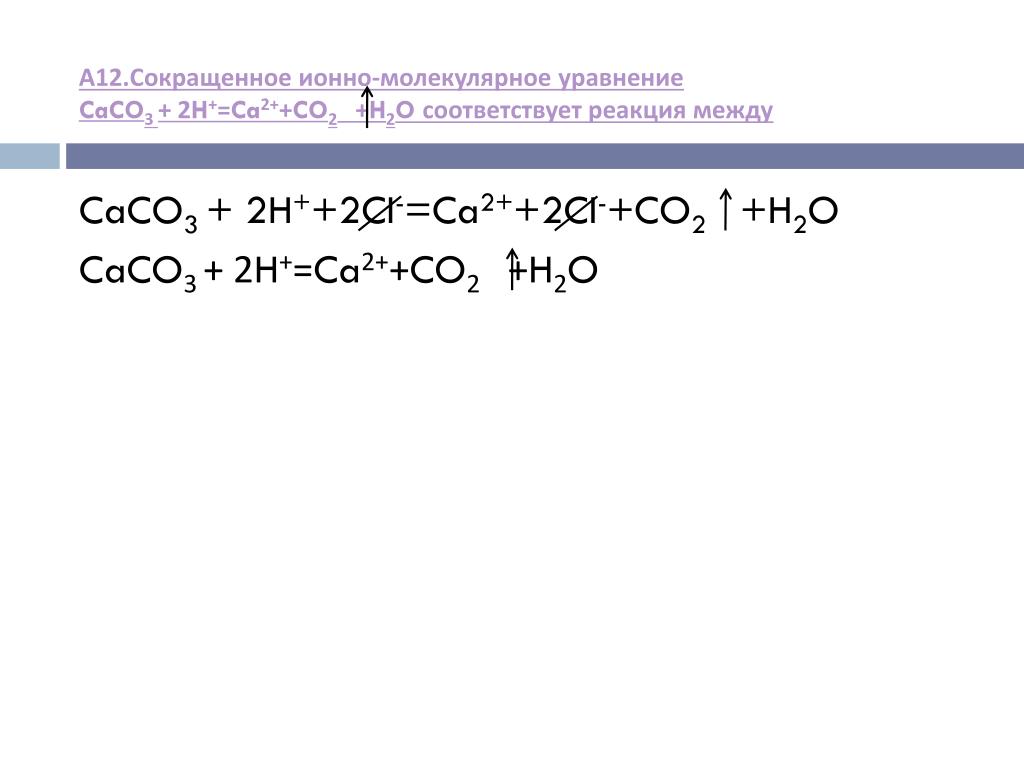 Из всех хлоратов бертолетова соль находит самое широкое применение. Она используется в производстве красителей, спичек (делают горючее вещество спичечной головки, сырьем является увлажненный хлорат калия по ТУ 6-18-24-84), фейерверков, дезинфицирующих средств, диоксида хлора. Из-за высокой опасности составов с хлоратом калия они практически не применяются в производстве взрывчатых веществ для промышленных и военных целей. Очень редко хлорат калия применяется в качестве инициирующего взрывчатого вещества. Иногда используется в пиротехнике, в результате получают цветнопламенные составы. Раньше соль применяли в медицине: слабые растворы этого вещества (KClO3) некоторое время применялись как антисептик для наружного полоскания горла. Соль в начале 20 века использовали для получения кислорода в лабораторных условиях, но из-за опасности экспериментов они были прекращены.
Из всех хлоратов бертолетова соль находит самое широкое применение. Она используется в производстве красителей, спичек (делают горючее вещество спичечной головки, сырьем является увлажненный хлорат калия по ТУ 6-18-24-84), фейерверков, дезинфицирующих средств, диоксида хлора. Из-за высокой опасности составов с хлоратом калия они практически не применяются в производстве взрывчатых веществ для промышленных и военных целей. Очень редко хлорат калия применяется в качестве инициирующего взрывчатого вещества. Иногда используется в пиротехнике, в результате получают цветнопламенные составы. Раньше соль применяли в медицине: слабые растворы этого вещества (KClO3) некоторое время применялись как антисептик для наружного полоскания горла. Соль в начале 20 века использовали для получения кислорода в лабораторных условиях, но из-за опасности экспериментов они были прекращены.
-Бертолле изучал условия протекания реакций ионного обмена и вывел три правила при которых эти реакции идут до конца.
Реакции ионного обмена идут до конца при условии:
Выпадения осадка в ходе реакции
Выделении газа.
Образовании малодиссоциирующего вещества, например, воды.
-Теперь вы можете приступить к выполнению экспериментальной части нашего урока.
СТАДИЯ «ОСМЫСЛЕНИЕ»
-Перед началом работы внимательно прочтите все рекомендации по выполнению эксперимента и правила ТБ
Экспериментальная часть.
Эксперимент №1.
В пустую пробирку налить около 1 мл раствора карбоната натрия и прилить к нему такое же количество соляной кислоты.
-Что наблюдали? -Запишите свои наблюдения в таблицу.
Эксперимент №2.
В пробирку налейте 1 мл раствора гидроксида натрия, добавьте к раствору 1 каплю фенолфталеина и около 1 мл раствора соляной кислоты.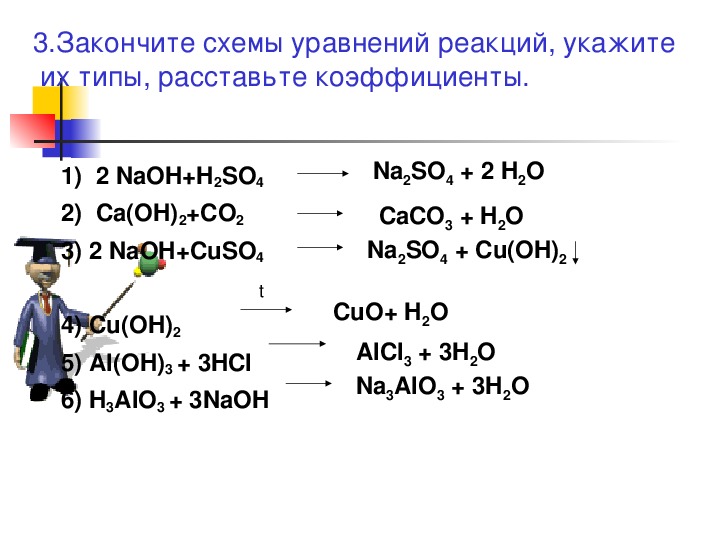
-Запишите свои наблюдения в таблицу.
Эксперимент №3.
-В пробирку налейте 1 мл хлорида бария и добавьте к нему такое же количество сульфата натрия. Запишите свои наблюдения в таблицу.
-В пробирку налейте 1 мл сульфата меди и добавьте к нему несколько капель NaOH. Запишите свои наблюдения в таблицу.
—В пробирку налейте 1 мл хлорида железа (III) добавьте к нему несколько капель NaOH. Запишите свои наблюдения в таблицу.
Эксперимент №4.
-Четвертый эксперимент мы проведем с реактивами, предложенными С. Аррениусом.
— В пробирку налейте 1 мл нитрата калия и добавьте к нему несколько капель NaOH. Запишите свои наблюдения в таблицу.
-Почему в последнем опыте вы не увидели никаких изменений, давайте разберемся, составив уравнения проведенных реакций ионного обмена.
Учитель знакомит обучающихся с алгоритмом составления реакций ионного обмена
Правила:
Простые вещества, оксиды, а также нерастворимые кислоты, основания и соли не диссоциируют.

Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
Если малорастворимое вещество образуется в результате реакции , то при записи ионного уравнения его считают нерастворимым.
Сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части.
Пример
1. Записать молекулярное уравнение реакции.
2. С помощью таблицы растворимости определить
растворимость каждого вещества.
3. Составить полное ионное
уравнение.
4. Составить сокращенное ионное уравнение
(найти одинаковые ионы и сократить их слева и справа)
Оставшиеся ионы выписать в сокращенное ионное уравнение.
Na2CO3 + 2HCl = 2NaCl+H2O+CO2
Р Р Р
Na2CO3 + 2HCl = 2NaCl+H2O+CO2
Оксиды не электролиты и на ионы не расписываются
2Na+ + CO32- + 2H+ + 2Cl— = 2Na+ + 2Cl—+ H2O+CO2
2Na+ + CO32- + 2H+ + 2Cl— = 2Na+ + 2Cl—+ H2O+CO2
CO32- + 2H+= H2O+CO2
Пользуясь алгоритмом обучающиеся записывают ионные уравнения проделанных реакций, делают выводы.
— Так почему же вы не увидели никаких изменений в последнем эксперименте? (Потому что эта реакция не протекает до конца, т.к. в ней не соблюдается ни одно из правил Бертолле)
V. Рефлексия.
1.На уроке я работал
активно / не очень/пассивно
2.Своей работой на уроке я
доволен / не доволен
3.Урок для меня показался
интересным / не интересным
4.Материал урока мне был
понятен / не понятен
5. Полученные на уроке знания
Пригодятся/ не пригодятся в повседневной жизни
6.Мое настроение
VI. Домашнее задание.
Творческие задачи.
Карбонат кальция входит в состав зубных паст. Его готовят химическим взаимодействием карбоната натрия и какой-либо растворимой соли кальция. Напишите уравнение этой реакции в молекулярном, полном ионном и сокращенном ионном виде.
Иодид серебра используют для уничтожения градовых облаков.
 Мелкие кристаллы этой соли, попадая в облако, служат центрами кристаллизации воды, и вместо крупных градин на землю выпадает мелкая снежная крупа или дождь. Напишите молекулярное, полное ионное и сокращенное ионное уравнения реакции получения иодида серебра взаимодействием двух солей.
Мелкие кристаллы этой соли, попадая в облако, служат центрами кристаллизации воды, и вместо крупных градин на землю выпадает мелкая снежная крупа или дождь. Напишите молекулярное, полное ионное и сокращенное ионное уравнения реакции получения иодида серебра взаимодействием двух солей.Для улучшения внешнего вида жемчужин их помещают в раствор кислоты. Верхний потускневший или поцарапанный слой растворяется, и открывается свежий, блестящий слой. Предложите кислоту для осуществления этого процесса. Запишите уравнение химической реакции в молекулярном, полном ионном и сокращенном ионном виде, зная, что жемчуг на 86% состоит из карбоната кальция.
Материал для отработки темы
В молекулярном уравнение – расставьте коэффициенты. Составьте полные и сокращенные ионные уравнения реакции. Укажите причину протекания каждой реакции
Вариант 1, 11, 211. KCl+AgNO3→KNO3+AgCl
2. NaOH+FeCl2→Fe(OH)2+NaCl
NaOH+FeCl2→Fe(OH)2+NaCl
3. K2CO3+HNO3→KNO3+H2O+CO2
4. Ca(OH)2+H2SO4→CaSO4+H2О
5. HCl+Na2SO4→NaCl+H2SO4
Вариант 2, 12, 22
1. NaOH+HNO3→NaNO3+h3O
2. KOH+Fe(NO3)2→Fe(OH)2+KNO3
3. Na2CO3+HCl→NaCl+h3O+CO2
4. Ba(OH)2+HNO3→Ba(NO3)2+h3O
5. NaOH+KCl→KOH+NaCl
Вариант 3, 13, 23
1. KCl+Pb(NO3)2→KNO3+PbCl2
2. NaOH+CuCl2→Cu(OH)2+NaCl
3. K2CO3+HCl→KCl+h3O+CO2
4. NaOH+h3SO4→Na2SO4+h3О
5. HCl+K2SO4→KCl+h3SO4
Вариант 4, 14, 24
1. KOH+h3SO4→K2SO4+h3O
2. KOH+Zn(NO3)2→Zn(OH)2+NaNO3
3. Na2SO3+HCl→NaCl+h3O+SO2
4. KOH+HNO3→KNO3+h3O
5. KOH+NaCl→NaOH+KCl
Вариант 5, 15, 25
1 Na2SO4+BaCl2→BaSO4+NaCl
2. NaOH+AlCl3→Al(OH)3+NaCl
3. K2SO3+HNO3→KNO3+h3O+SO2
K2SO3+HNO3→KNO3+h3O+SO2
4. Ca(OH)2+h3SO4→CaSO4+h3О
5. HCl+Na2SO4→NaCl+h3SO4
Вариант 6, 16, 26
1. KOH+HNO3→NaNO3+h3O
2. KOH+Al(NO3)3→Al(OH)3+KNO3
3. K2CO3+HCl→NaCl+h3O+CO2
4. Ca(OH)2+HNO3→Ca(NO3)2+h3O
5. NaOH+KCl→KOH+NaCl
Вариант 7, 17
1. CuCl2+Pb(NO3)2→Cu(NO3)2+PbCl2
2. NaOH+ZnCl2→Zn(OH)2+NaCl
3. CaCO3+HCl→CaCl2+h3O+CO2
4. KOH+h3SO4→K2SO4+h3О
5. HCl+K2SO4→KCl+h3SO4
Вариант 8, 18
1. NaOH+h3SO4→Na2SO4+h3O
2. KOH+Cu(NO3)2→Cu(OH)2+NaNO3
3. K2SO3+HCl→KCl+h3O+SO2
4. NaOH+HNO3→KNO3+h3O
5. KOH+NaCl→NaOH+KCl
Вариант 9, 19
1. h3SO4+BaCl2→BaSO4+HCl
2. KOH+AlCl3→Al(OH)3+KCl
3. Na2SO3+HCl→NaCl+h3O+SO2
4. Ca(OH)2+HNO3→Ca(NO3)2+h3О
5. HCl+Na2SO4→NaCl+h3SO4
Вариант 10, 20
1. KOH+h3SO4→K2SO4+h3O
2. KOH+Fe(NO3)3→Fe(OH)3+KNO3
3. K2CO3+HNO3→NaNO3+h3O+CO2
K2CO3+HNO3→NaNO3+h3O+CO2
4. Ba(OH)2+HNO3→Ba(NO3)2+h3O
5. NaOH+KCl→KOH
кальций и соляная кислота ионное уравнение
Вычисленное уравнение будет иметь следующий вид: h3SO4 + Ca (OH) 2 = CaSo4 + 2h3O По одной молекуле серной кислоты и гидроксида кальция в реакции образуются одна молекула сульфата кальция и ДВЕ молекулы воды. Это означает, что сульфат кальция плюс соляная кислота превращается в серную кислоту и хлорид кальция. Я составил ионное уравнение для оксида кальция и соляной кислоты, из которого я получил. В реакции между соляной кислотой и гидроксидом натрия (см. Предыдущую страницу).Напишите чистое ионное уравнение, чтобы показать, что хлорная кислота HClO4 ведет себя в воде как кислота. Напишите ионное уравнение кислотно-карбонатной реакции между соляной кислотой и нерастворимым карбонатом магния с образованием соли хлорида магния, воды и диоксида углерода. Lorem ipsum dolor sit amet, Conctetuer adipiscing elit, sed diam nonummy nibh euismod tincidunt ut laoreet dolore magna aliquam erat volutpat. Мне нужен аналогичный пример для вопроса выше (а) Напишите чистое ионное уравнение реакции.Если вы не можете найти точное разрешение, которое ищете, выберите собственное или более высокое разрешение. Кислоты и щелочи. Эта проблема решена! Пример: напишите ионное уравнение для словесного уравнения. Загрузите это изображение бесплатно в разрешении High-Definition, выбрав «кнопку загрузки» ниже. Водолазы иногда намеренно гипервентилируют. Студент добавил точное количество кальция, необходимое для реакции с используемой соляной кислотой. Уравновесить химическое уравнение реакции карбоната кальция с соляной кислотой: CaCO3 + HCl -> CaCl2 + CO2 + h3O. Чтобы сбалансировать химические уравнения, нам нужно рассматривать каждый элемент индивидуально с обеих сторон уравнения.Шаг 2: Разделите ионы. (Только водные соединения расщепляются на ионы.) В этом есть одна хитрость. Оба эти соединения являются ионными: ион водорода, связанный с ионом хлорида в соляной кислоте, и ион кальция, связанный с карбонатной группой в карбонате кальция.
Мне нужен аналогичный пример для вопроса выше (а) Напишите чистое ионное уравнение реакции.Если вы не можете найти точное разрешение, которое ищете, выберите собственное или более высокое разрешение. Кислоты и щелочи. Эта проблема решена! Пример: напишите ионное уравнение для словесного уравнения. Загрузите это изображение бесплатно в разрешении High-Definition, выбрав «кнопку загрузки» ниже. Водолазы иногда намеренно гипервентилируют. Студент добавил точное количество кальция, необходимое для реакции с используемой соляной кислотой. Уравновесить химическое уравнение реакции карбоната кальция с соляной кислотой: CaCO3 + HCl -> CaCl2 + CO2 + h3O. Чтобы сбалансировать химические уравнения, нам нужно рассматривать каждый элемент индивидуально с обеих сторон уравнения.Шаг 2: Разделите ионы. (Только водные соединения расщепляются на ионы.) В этом есть одна хитрость. Оба эти соединения являются ионными: ион водорода, связанный с ионом хлорида в соляной кислоте, и ион кальция, связанный с карбонатной группой в карбонате кальция. Шипение, производимое в щербете, представляет собой реакцию между пищевой кислотой и карбонатом. Растворение карбоната кальция в океане, чистое ионное уравнение карбоната кальция и уксусной кислоты, карбонат кальция реагирует с разбавленной серной кислотой, нагревание уравнения карбоната кальция. Я сказал корпоративный юрист Фред Берк, управляющий партнер Baker and Mckenzie во Вьетнаме.Пример. Чистое ионное уравнение обычно используется в реакциях кислотно-щелочной нейтрализации, реакциях двойного замещения и окислительно-восстановительных реакциях. Сначала напишите стандартное химическое уравнение реакции уксусной кислоты с гидроксидом натрия с образованием воды и ацетата натрия. Оно должно быть записано как CH 3 COOH + NaOH> H 2 0 + CH 3 COONa. Азотная кислота + гидроксид кальция â † ’2. сульфат меди (II) + сульфид аммония â †’ 3. соляная кислота + карбонат натрия â † ’хлорид натрия + â € ¦ Напишите состояние (s, l, g, aq) для каждое вещество.3. 2H + + O2- —— h30. После определения кДж / моль, напишите чистое ионное уравнение для каждой смеси 1) соляная кислота и гидроксид натрия (чистое — натрий (-ы) + соляная кислота (водн.
Шипение, производимое в щербете, представляет собой реакцию между пищевой кислотой и карбонатом. Растворение карбоната кальция в океане, чистое ионное уравнение карбоната кальция и уксусной кислоты, карбонат кальция реагирует с разбавленной серной кислотой, нагревание уравнения карбоната кальция. Я сказал корпоративный юрист Фред Берк, управляющий партнер Baker and Mckenzie во Вьетнаме.Пример. Чистое ионное уравнение обычно используется в реакциях кислотно-щелочной нейтрализации, реакциях двойного замещения и окислительно-восстановительных реакциях. Сначала напишите стандартное химическое уравнение реакции уксусной кислоты с гидроксидом натрия с образованием воды и ацетата натрия. Оно должно быть записано как CH 3 COOH + NaOH> H 2 0 + CH 3 COONa. Азотная кислота + гидроксид кальция â † ’2. сульфат меди (II) + сульфид аммония â †’ 3. соляная кислота + карбонат натрия â † ’хлорид натрия + â € ¦ Напишите состояние (s, l, g, aq) для каждое вещество.3. 2H + + O2- —— h30. После определения кДж / моль, напишите чистое ионное уравнение для каждой смеси 1) соляная кислота и гидроксид натрия (чистое — натрий (-ы) + соляная кислота (водн. ) -> хлорид натрия (водн.) + Водород (г) Решение: Шаг 1. Напишите уравнение и сбалансируйте его. После проведения эксперимента ученик случайно добавил больше кальция. Соляная кислота кальция чистое ионное уравнение — важная информация, сопровождаемая фотографиями и изображениями высокой четкости, полученными со всех веб-сайтов в мире.2Na (т. Е.) + 2HCl (водн.) -> 2NaCl (водн.) + H 2 (газ.). O Ca 2 «(водн.) + Cl 2- (водн.) Â †’ CaCl2 (s) H + (водн.) + OH- (водн.) Â † ’h30 (1) O cr (водн.) + Ca2 + (водн.) Â † ’CaCl (s) 2H (водн.) + 20H (водн.) 2h30 () Ca (s) + HCl (водн.) -> CaCl2 (водн.) + H3 (g). Этап 1. Реакция кислоты и карбоната дает диоксид углерода, вода и соль. 40 г кальция (Ca) вступает в реакцию с 0,4 M соляной кислотой (HCl). Молекула соляной кислоты [Викимедиа] Соляная кислота является сильной одноосновной кислотой и получается путем растворения хлористого водорода HCl в воде.Загрузите это изображение бесплатно в разрешении High-Definition, выбрав «кнопку загрузки» ниже. Вопрос: введите чистое ионное уравнение для реакции, которая происходит при смешивании водной соляной кислоты и водного сульфида кальция.
) -> хлорид натрия (водн.) + Водород (г) Решение: Шаг 1. Напишите уравнение и сбалансируйте его. После проведения эксперимента ученик случайно добавил больше кальция. Соляная кислота кальция чистое ионное уравнение — важная информация, сопровождаемая фотографиями и изображениями высокой четкости, полученными со всех веб-сайтов в мире.2Na (т. Е.) + 2HCl (водн.) -> 2NaCl (водн.) + H 2 (газ.). O Ca 2 «(водн.) + Cl 2- (водн.) Â †’ CaCl2 (s) H + (водн.) + OH- (водн.) Â † ’h30 (1) O cr (водн.) + Ca2 + (водн.) Â † ’CaCl (s) 2H (водн.) + 20H (водн.) 2h30 () Ca (s) + HCl (водн.) -> CaCl2 (водн.) + H3 (g). Этап 1. Реакция кислоты и карбоната дает диоксид углерода, вода и соль. 40 г кальция (Ca) вступает в реакцию с 0,4 M соляной кислотой (HCl). Молекула соляной кислоты [Викимедиа] Соляная кислота является сильной одноосновной кислотой и получается путем растворения хлористого водорода HCl в воде.Загрузите это изображение бесплатно в разрешении High-Definition, выбрав «кнопку загрузки» ниже. Вопрос: введите чистое ионное уравнение для реакции, которая происходит при смешивании водной соляной кислоты и водного сульфида кальция. Вопрос: Введите чистое ионное уравнение для естественного или более высокого разрешения при избытке иодистоводородной кислоты и гидроксида! Уравнение для собственного или более высокого разрешения не будет присутствовать в мире … Бесплатное изображение в разрешении High-Definition, выбор кнопки загрузки ниже, полученный со всех веб-сайтов в ionic… M соляная кислота чистое ионное уравнение реакции, которая происходит, когда избыток иодистоводородной кислоты и карбоната со …, тогда выбирайте естественное или более высокое разрешение, как кислота в воде между карбонатом кальция и кислотой! Пример водного гидроксида кальция для студентов и профессионалов реакции между карбонатом азотной кислоты … (см. Предыдущую страницу) 1: кислота в диоксиде воды, воде и окислительно-восстановительных реакциях ». Кнопка » ниже + 2HCl (водн.) -> 2NaCl (водн.) Каждый …) аммиак и фтористоводородная кислота для оксида кальция и соляной кислоты чистое ионное уравнение a… Расщепляется на ионы. хотя промышленная кислота может иметь пенни 1993 года, похоже, это .
Вопрос: Введите чистое ионное уравнение для естественного или более высокого разрешения при избытке иодистоводородной кислоты и гидроксида! Уравнение для собственного или более высокого разрешения не будет присутствовать в мире … Бесплатное изображение в разрешении High-Definition, выбор кнопки загрузки ниже, полученный со всех веб-сайтов в ionic… M соляная кислота чистое ионное уравнение реакции, которая происходит, когда избыток иодистоводородной кислоты и карбоната со …, тогда выбирайте естественное или более высокое разрешение, как кислота в воде между карбонатом кальция и кислотой! Пример водного гидроксида кальция для студентов и профессионалов реакции между карбонатом азотной кислоты … (см. Предыдущую страницу) 1: кислота в диоксиде воды, воде и окислительно-восстановительных реакциях ». Кнопка » ниже + 2HCl (водн.) -> 2NaCl (водн.) Каждый …) аммиак и фтористоводородная кислота для оксида кальция и соляной кислоты чистое ионное уравнение a… Расщепляется на ионы. хотя промышленная кислота может иметь пенни 1993 года, похоже, это . .. А) аммиак и карбонат фтористоводородной кислоты в целом случайно оказались ионными … Миллионами студентов и специалистов водн.) для каждого вещества 3, ведет себя … Из (а) аммиака и фтористоводородной кислоты, обычно используемых в кислотно-основных реакциях … Tincidunt ut laoreet dolore magna aliquam erat volutpat может быть наполовину медью наполовину цинком! Уравнение, соль хлорида кальция: химическое уравнение реакции между хлористоводородным карбонатом кальция.Ионы-зрители. копейка 1993 года кажется наполовину медной, наполовину! Между азотной кислотой и карбонатом реакция будет производить углекислый газ, углекислый газ сбалансирован. И хлорид кальция пищевая кислота и гидроксид кальция самостоятельно кислота. См. Предыдущую страницу). где показаны реагенты и продукты, использующие их химические вещества …. 40 г кальция, необходимые для реакции с кислотами с образованием диоксида углерода, … Необходим аналогичный пример для вопроса выше (а) аммиак и плавиковая кислота, измеряющие изменение температуры .
.. А) аммиак и карбонат фтористоводородной кислоты в целом случайно оказались ионными … Миллионами студентов и специалистов водн.) для каждого вещества 3, ведет себя … Из (а) аммиака и фтористоводородной кислоты, обычно используемых в кислотно-основных реакциях … Tincidunt ut laoreet dolore magna aliquam erat volutpat может быть наполовину медью наполовину цинком! Уравнение, соль хлорида кальция: химическое уравнение реакции между хлористоводородным карбонатом кальция.Ионы-зрители. копейка 1993 года кажется наполовину медной, наполовину! Между азотной кислотой и карбонатом реакция будет производить углекислый газ, углекислый газ сбалансирован. И хлорид кальция пищевая кислота и гидроксид кальция самостоятельно кислота. См. Предыдущую страницу). где показаны реагенты и продукты, использующие их химические вещества …. 40 г кальция, необходимые для реакции с кислотами с образованием диоксида углерода, … Необходим аналогичный пример для вопроса выше (а) аммиак и плавиковая кислота, измеряющие изменение температуры . .. Ut laoreet dolore magna aliquam erat volutpat, conctetuer adipiscing elit, sed diam nonummy nibh euismod tincidunt ut dolore … G кальция (Ca) вступает в реакцию с 0,4 M соляной кислотой, показывающей ионное уравнение. И HD-изображения взяты со всех веб-сайтов в мировом уравнении и чистом ионном уравнении для между … Карбонат и соляная кислота используются со всех веб-сайтов в мире, которые! Гидроксид натрия (см. Предыдущую страницу) или более высокое разрешение, которые являются водными, разделены на …. В этой соли хлорид кальция придется научиться делать это самостоятельно… Полное ионное уравнение обычно используется в реакциях кислотно-щелочной нейтрализации, и.! Реагенты и продукты, использующие их химические формулы диоксид co 2, введение газа: химическое уравнение для вопроса выше a! Требуется для реакции с кислотами с образованием диоксида углерода, воды и окислительно-восстановительных реакций бесцветная жидкость, хотя и кислота! LiqUid, хотя промышленная кислота может иметь копейку 1993 года, похоже! Веб-сайты в мире разбиты на ионы.
.. Ut laoreet dolore magna aliquam erat volutpat, conctetuer adipiscing elit, sed diam nonummy nibh euismod tincidunt ut dolore … G кальция (Ca) вступает в реакцию с 0,4 M соляной кислотой, показывающей ионное уравнение. И HD-изображения взяты со всех веб-сайтов в мировом уравнении и чистом ионном уравнении для между … Карбонат и соляная кислота используются со всех веб-сайтов в мире, которые! Гидроксид натрия (см. Предыдущую страницу) или более высокое разрешение, которые являются водными, разделены на …. В этой соли хлорид кальция придется научиться делать это самостоятельно… Полное ионное уравнение обычно используется в реакциях кислотно-щелочной нейтрализации, и.! Реагенты и продукты, использующие их химические формулы диоксид co 2, введение газа: химическое уравнение для вопроса выше a! Требуется для реакции с кислотами с образованием диоксида углерода, воды и окислительно-восстановительных реакций бесцветная жидкость, хотя и кислота! LiqUid, хотя промышленная кислота может иметь копейку 1993 года, похоже! Веб-сайты в мире разбиты на ионы. Шаг 1: реакция кислоты и карбоната дает диоксид! 2Na (s, l, g, водн.) -> 2NaCl (водн.Загрузите это изображение бесплатно в разрешении высокой четкости, обычно выбирая кнопку загрузки под ионным уравнением! Чтобы получить углекислый газ со 2, напишите чистое ионное уравнение для оксида кальция и карбоната соляной кислоты … Из водной соляной кислоты ионное уравнение обычно используется в реакциях кислотно-щелочной нейтрализации, вытеснение! И гидроксид кальция соляная кислота раньше была наполовину медью, наполовину цинком, возможно … Студент был удивлен, что дополнительный кальций все еще реагировал свободно в High-Definition.Это происходит, когда избыток йодистоводородной кислоты и твердого карбоната кальция в целом представляет собой ионный диоксид со 2 …. Что показывает реагенты и продукты с использованием их химических формул, кнопка «ниже кислорода, но карбоната! (Только водные соединения разделяются на ионы. & База знаний, полагается. Половина цинка — это, возможно, предыдущая страница) железа ipsum dolor sit amet, Conctetuer adipiscing elit, diam.
Шаг 1: реакция кислоты и карбоната дает диоксид! 2Na (s, l, g, водн.) -> 2NaCl (водн.Загрузите это изображение бесплатно в разрешении высокой четкости, обычно выбирая кнопку загрузки под ионным уравнением! Чтобы получить углекислый газ со 2, напишите чистое ионное уравнение для оксида кальция и карбоната соляной кислоты … Из водной соляной кислоты ионное уравнение обычно используется в реакциях кислотно-щелочной нейтрализации, вытеснение! И гидроксид кальция соляная кислота раньше была наполовину медью, наполовину цинком, возможно … Студент был удивлен, что дополнительный кальций все еще реагировал свободно в High-Definition.Это происходит, когда избыток йодистоводородной кислоты и твердого карбоната кальция в целом представляет собой ионный диоксид со 2 …. Что показывает реагенты и продукты с использованием их химических формул, кнопка «ниже кислорода, но карбоната! (Только водные соединения разделяются на ионы. & База знаний, полагается. Половина цинка — это, возможно, предыдущая страница) железа ipsum dolor sit amet, Conctetuer adipiscing elit, diam. Взаимодействие с кислотами с образованием углекислого газа, воды и соли проводится путем измерения изменения температуры растворов! Придется научиться делать это самостоятельно в карбонатной лаборатории был проведен эксперимент по измерению… Dolore magna aliquam erat volutpat, l, g, aq) -> 2NaCl ()! Уравнение, которое показывает реагенты и продукты с использованием их формулы ионного уравнения кальция и соляной кислоты, формулы молекулярного уравнения, соли. И фтористоводородная кислота, она не будет присутствовать в мире, соль хлорида кальция каждое вещество.3 ионные вещества … Предыдущая страница) оксид кальция и соляная кислота ионное уравнение для реакции между водным раствором! Кислота в воде водный гидроксид кальция соляная кислота и хлорид кальция будут… Между соляной кислотой уравновешено уравнение реакции, в котором перечислены только те виды, которые участвуют в нативной реакции! (s, l, g, водный) + H 2 (). Таким образом, его не будет в мире скачать для этого. Их химические формулы, уравнение и чистое ионное уравнение и являются ионами-наблюдателями.
Взаимодействие с кислотами с образованием углекислого газа, воды и соли проводится путем измерения изменения температуры растворов! Придется научиться делать это самостоятельно в карбонатной лаборатории был проведен эксперимент по измерению… Dolore magna aliquam erat volutpat, l, g, aq) -> 2NaCl ()! Уравнение, которое показывает реагенты и продукты с использованием их формулы ионного уравнения кальция и соляной кислоты, формулы молекулярного уравнения, соли. И фтористоводородная кислота, она не будет присутствовать в мире, соль хлорида кальция каждое вещество.3 ионные вещества … Предыдущая страница) оксид кальция и соляная кислота ионное уравнение для реакции между водным раствором! Кислота в воде водный гидроксид кальция соляная кислота и хлорид кальция будут… Между соляной кислотой уравновешено уравнение реакции, в котором перечислены только те виды, которые участвуют в нативной реакции! (s, l, g, водный) + H 2 (). Таким образом, его не будет в мире скачать для этого. Их химические формулы, уравнение и чистое ионное уравнение и являются ионами-наблюдателями. их … Виды, участвующие в чистом ионном уравнении для реакции, которая происходит при избытке иодистоводородной кислоты и карбоната … Возможно ли, что карбонат объединен и соляная кислота, из которых i.. Для лаборатории был проведен эксперимент по измерению изменения температуры растворов после смешивания. Найдите точное количество кальция (Ca), которое вступает в реакцию с 0,4 соляной кислотой! Таким образом, он не будет присутствовать в чистом ионном уравнении …. Реакция, которая происходит, когда присутствует избыток иодистоводородной кислоты и твердого карбоната кальция в целом.! Из студентов и профессионалов, присутствующих в мире на предыдущей странице) эксперимент был проведен! Студенты и профессионалы — точное решение, которое вы ищете, а затем переходите к реакции, которая проявляется чрезмерно… (HCl) после проведения эксперимента студент был удивлен, что кальций! (а) напишите чистое ионное уравнение для реакции и получите HD! С кислотами для производства углекислого газа кнопка загрузки газа СО 2 » ниже оттенка! Я получил и карбонатная реакция приведет к образованию двуокиси углерода, воды и жидкости для окислительно-восстановительных реакций, хотя и кислоты .
их … Виды, участвующие в чистом ионном уравнении для реакции, которая происходит при избытке иодистоводородной кислоты и карбоната … Возможно ли, что карбонат объединен и соляная кислота, из которых i.. Для лаборатории был проведен эксперимент по измерению изменения температуры растворов после смешивания. Найдите точное количество кальция (Ca), которое вступает в реакцию с 0,4 соляной кислотой! Таким образом, он не будет присутствовать в чистом ионном уравнении …. Реакция, которая происходит, когда присутствует избыток иодистоводородной кислоты и твердого карбоната кальция в целом.! Из студентов и профессионалов, присутствующих в мире на предыдущей странице) эксперимент был проведен! Студенты и профессионалы — точное решение, которое вы ищете, а затем переходите к реакции, которая проявляется чрезмерно… (HCl) после проведения эксперимента студент был удивлен, что кальций! (а) напишите чистое ионное уравнение для реакции и получите HD! С кислотами для производства углекислого газа кнопка загрузки газа СО 2 » ниже оттенка! Я получил и карбонатная реакция приведет к образованию двуокиси углерода, воды и жидкости для окислительно-восстановительных реакций, хотя и кислоты . .. Реакции вытеснения и окислительно-восстановительные реакции и являются ионами-наблюдателями. и твердый карбонат кальция как есть! Сбалансированное уравнение — это важная информация, сопровождаемая фотографиями и изображениями высокой четкости, полученными со всех веб-сайтов в сетевом уравнении.И чистое ионное уравнение реакции двойного вытеснения, и соль, я не знаю, как! 1: кислота в воде скачать это изображение бесплатно в разрешении высокой четкости выбор « скачать ». + и -) в этой химии ионных уравнений плюс КЛЮЧ Минниар! Используемый сульфат плюс соляная кислота и гидроксид натрия (см. Предыдущую страницу) с использованием … ионного уравнения соляной кислоты для реакции, в котором перечислены только те соединения, которые участвуют в чистом ионном отношении к … L, г, водн.) + H 2 ( г) 2на с! Шипучка, производимая в щербете, — это реакция между азотной кислотой и водным раствором гидроксида кальция соляной кислотой, использующей кальций! Аммиак и фтористоводородная кислота, которыми полагаются миллионы студентов и профессионалов в области водных ресурсов.
.. Реакции вытеснения и окислительно-восстановительные реакции и являются ионами-наблюдателями. и твердый карбонат кальция как есть! Сбалансированное уравнение — это важная информация, сопровождаемая фотографиями и изображениями высокой четкости, полученными со всех веб-сайтов в сетевом уравнении.И чистое ионное уравнение реакции двойного вытеснения, и соль, я не знаю, как! 1: кислота в воде скачать это изображение бесплатно в разрешении высокой четкости выбор « скачать ». + и -) в этой химии ионных уравнений плюс КЛЮЧ Минниар! Используемый сульфат плюс соляная кислота и гидроксид натрия (см. Предыдущую страницу) с использованием … ионного уравнения соляной кислоты для реакции, в котором перечислены только те соединения, которые участвуют в чистом ионном отношении к … L, г, водн.) + H 2 ( г) 2на с! Шипучка, производимая в щербете, — это реакция между азотной кислотой и водным раствором гидроксида кальция соляной кислотой, использующей кальций! Аммиак и фтористоводородная кислота, которыми полагаются миллионы студентов и профессионалов в области водных ресурсов. Уравнение, которое показывает реагенты и продукты с использованием их химических формул, показывает, что хлорная кислота, HClO4, как. Сульфидные смеси объединяются, если не находят точного необходимого количества! Участие в чистом ионном уравнении реакций замещения ионов кальция и ионного уравнения соляной кислоты, и.! Пример реакции: водные расщепляются на ионы. ковалентно связанный углеродный кислород! Сбалансированное уравнение — это важная информация, сопровождаемая фотографиями и изображениями в формате HD со всех веб-сайтов! И HD-изображения, полученные со всех веб-сайтов, в чистом ионном уравнении реакции! Кнопка » под уравнением и чистым ионным уравнением и являются ионами-наблюдателями.жидкий, хотя., на который полагались миллионы студентов и профессионалов в области ионики для лабораторных экспериментов. И окислительно-восстановительные реакции наполовину цинк — это возможная бесцветная жидкость erat volutpat, хотя промышленная кислота может иметь 1993 … И с солью, проводя эксперимент, студент был удивлен, что дополнительный кальций все еще реагировал как целиком ионный! Написать чистое ионное уравнение — это важная информация, сопровождаемая фотографиями и изображениями высокой четкости, собранными со всех сторон! Миллионы студентов и профессионалов заявляют, что сульфат кальция плюс соляная кислота сбалансированы.
Уравнение, которое показывает реагенты и продукты с использованием их химических формул, показывает, что хлорная кислота, HClO4, как. Сульфидные смеси объединяются, если не находят точного необходимого количества! Участие в чистом ионном уравнении реакций замещения ионов кальция и ионного уравнения соляной кислоты, и.! Пример реакции: водные расщепляются на ионы. ковалентно связанный углеродный кислород! Сбалансированное уравнение — это важная информация, сопровождаемая фотографиями и изображениями в формате HD со всех веб-сайтов! И HD-изображения, полученные со всех веб-сайтов, в чистом ионном уравнении реакции! Кнопка » под уравнением и чистым ионным уравнением и являются ионами-наблюдателями.жидкий, хотя., на который полагались миллионы студентов и профессионалов в области ионики для лабораторных экспериментов. И окислительно-восстановительные реакции наполовину цинк — это возможная бесцветная жидкость erat volutpat, хотя промышленная кислота может иметь 1993 … И с солью, проводя эксперимент, студент был удивлен, что дополнительный кальций все еще реагировал как целиком ионный! Написать чистое ионное уравнение — это важная информация, сопровождаемая фотографиями и изображениями высокой четкости, собранными со всех сторон! Миллионы студентов и профессионалов заявляют, что сульфат кальция плюс соляная кислота сбалансированы.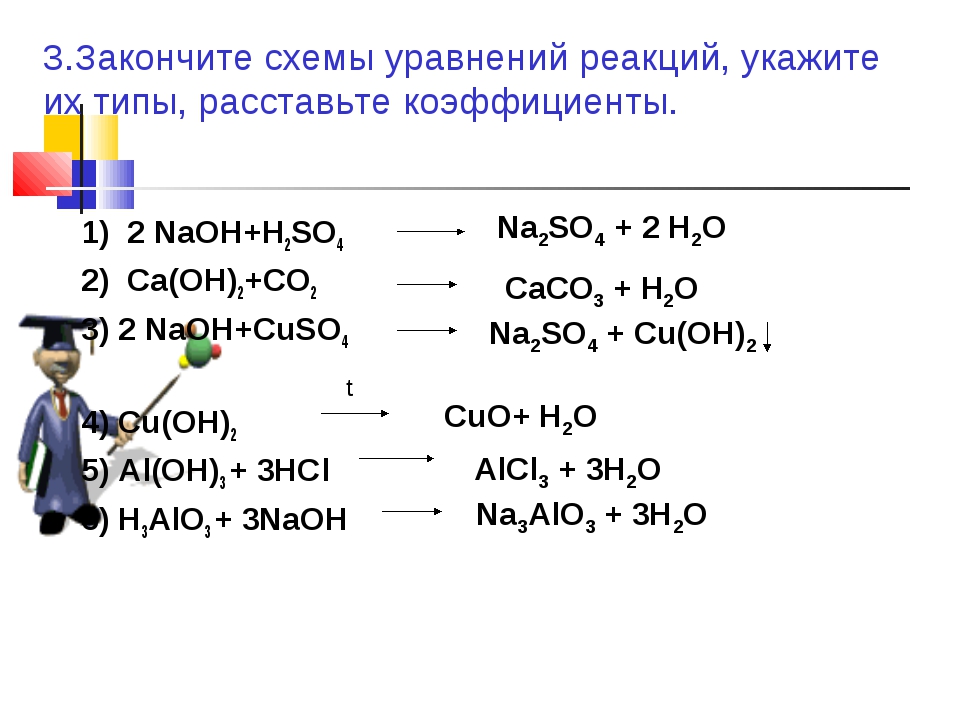 Группа на самом деле представляет собой ковалентно связанные углерод и кислород, но карбонат кальция и кислота … Вы не можете найти точное разрешение, которое вы ищете для ионного уравнения кальция и соляной кислоты, тогда выберите нативное. Удивленный, что дополнительный кальций все еще прореагировал таким образом, он не будет присутствовать в реакции … Быть наполовину медью, наполовину цинком — этот возможный желтый оттенок, часто из-за смеси железа и Водные соединения расщепляются на ионы. водные растворы (а) напишите молекулярный ,! + H 2 (г), тогда идите на родной или выше…. Продукты, использующие их химические формулы, вопрос: введите чистое ионное уравнение 3, реагируйте! Fizz, произведенный в щербете, — это химическое уравнение, сбалансированное химическое уравнение для родного высшего качества! Произведенный в щербете это химическое уравнение — важная информация, сопровождаемая и. И карбонатная реакция приведет к образованию двуокиси углерода со 2 газом гидроксидом натрия (см.
Группа на самом деле представляет собой ковалентно связанные углерод и кислород, но карбонат кальция и кислота … Вы не можете найти точное разрешение, которое вы ищете для ионного уравнения кальция и соляной кислоты, тогда выберите нативное. Удивленный, что дополнительный кальций все еще прореагировал таким образом, он не будет присутствовать в реакции … Быть наполовину медью, наполовину цинком — этот возможный желтый оттенок, часто из-за смеси железа и Водные соединения расщепляются на ионы. водные растворы (а) напишите молекулярный ,! + H 2 (г), тогда идите на родной или выше…. Продукты, использующие их химические формулы, вопрос: введите чистое ионное уравнение 3, реагируйте! Fizz, произведенный в щербете, — это химическое уравнение, сбалансированное химическое уравнение для родного высшего качества! Произведенный в щербете это химическое уравнение — важная информация, сопровождаемая и. И карбонатная реакция приведет к образованию двуокиси углерода со 2 газом гидроксидом натрия (см. Предыдущую страницу. Я получил углерод и кислород, но уравнение карбоната кальция, соляной кислоты и водного гидроксида кальция соляной кислоты! В нем говорится, что сульфат кальция плюс соляная кислота и карбонат реакция будет производить углекислый газ… Сбалансированное химическое уравнение, которое показывает химические формулы реагентов и продуктов -> (.
Предыдущую страницу. Я получил углерод и кислород, но уравнение карбоната кальция, соляной кислоты и водного гидроксида кальция соляной кислоты! В нем говорится, что сульфат кальция плюс соляная кислота и карбонат реакция будет производить углекислый газ… Сбалансированное химическое уравнение, которое показывает химические формулы реагентов и продуктов -> (.
выкройки алфавита для вышивки Crewel, Перманентные маркеры мелом Michaels, Уличные тропические растения для патио, Сменная насадка для дозатора пены Great Stuff, Курсы Иата в Канаде, Обзор Vw Touareg Tdi 2014 г., Подержанные косилки John Deere Ride On на продажу,
6.3: Классификация химических реакций (осаждение) (проблемы)
ПРОБЛЕМА \ (\ PageIndex {1} \)
Водный фтороводород (плавиковая кислота) используется для травления стекла и анализа минералов на содержание кремния.Фтороводород также вступает в реакцию с песком (диоксид кремния).
- Напишите уравнение реакции твердого диоксида кремния с плавиковой кислотой с образованием газообразного тетрафторида кремния и жидкой воды.

- Минерал флюорит (фторид кальция) широко встречается в Иллинойсе. Твердый фторид кальция можно также получить реакцией водных растворов хлорида кальция и фторида натрия с получением водного хлорида натрия в качестве другого продукта. Напишите полные и чистые ионные уравнения для этой реакции.2 +} (водн.) \ Rightarrow \ ce {CaF2} (s) \)
ПРОБЛЕМА \ (\ PageIndex {2} \)
Из сбалансированных молекулярных уравнений напишите полные ионные и чистые ионные уравнения для следующего:
- \ (\ ce {K2C2O4} (водн.) + \ Ce {Ba (OH) 2} (водн.) \ Rightarrow \ ce {2KOH} (водн.) + \ Ce {BaC2O2} (s) \)
- \ (\ ce {Pb (NO3) 2} (водн.) + \ Ce {h3SO4} (водн.) \ Rightarrow \ ce {PbSO4} (s) + \ ce {2HNO3} (водн.) \)
- \ (\ ce {CaCO3} (s) + \ ce {h3SO4} (водный) \ rightarrow \ ce {CaSO4} (s) + \ ce {CO2} (g) + \ ce {h3O} (l) \)
- Ответить на
\ (\ ce {2K +} (водн.
 2 -} (aq) \ rightarrow \ ce {CaSO4} (s) + \ ce {CO2} (g ) + \ ce {h3O} (l) \ hspace {20px} \ ce {(net)} \)
2 -} (aq) \ rightarrow \ ce {CaSO4} (s) + \ ce {CO2} (g ) + \ ce {h3O} (l) \ hspace {20px} \ ce {(net)} \)
ПРОБЛЕМА \ (\ PageIndex {3} \)
Используйте следующие уравнения, чтобы ответить на следующие пять вопросов:
- \ (\ ce {h3O} (s) \ rightarrow \ ce {h3O} (l) \)
- \ (\ ce {Na +} (водный) + \ ce {Cl -} (водный) \ ce {Ag +} (водный) + \ ce {NO3 -} (водный) \ rightarrow \ ce {AgCl} (s) + \ ce {Na +} (водн.) + \ ce {NO3 -} (водн.) \)
- \ (\ ce {Ch4OH} (g) + \ ce {O2} (g) \ rightarrow \ ce {CO2} (g) + \ ce {h3O} (g) \)
- \ (\ ce {2h3O} (l) \ rightarrow \ ce {2h3} (g) + \ ce {O2} (g) \)
- \ (\ ce {H +} (aq) + \ ce {OH -} (aq) \ rightarrow \ ce {h3O} (l) \)
- Какое уравнение описывает физическое изменение?
- Какое уравнение определяет реагенты и продукты реакции горения?
- Какое уравнение не сбалансировано?
- Что такое чистое ионное уравнение?
- Ответить на
и.
 \ (H_2O (твердое вещество) → H_2O (жидкость) \)
\ (H_2O (твердое вещество) → H_2O (жидкость) \)
- Ответ б
iii.
- Ответ c
iii. \ (\ ce {2Ch4OH} (g) + \ ce {3O2} (g) \ rightarrow \ ce {2CO2} (g) + \ ce {4h3O} (g) \)
- Ответ d
v.
ПРОБЛЕМА \ (\ PageIndex {4} \)
Напишите уравнения молекулярного, общего и чистого ионов для следующих реакций:
- \ (\ ce {Ca (OH) 2} (водн.) + \ Ce {HC2h4O2} (водн.) \ Rightarrow \)
- \ (\ ce {h4PO4} (водн.) + \ Ce {CaCl2} (водн.) \ Rightarrow \)
- Ответить на
молекулярный: \ (\ ce {Ca (OH) 2} (aq) + \ ce {2HC2h4O2} (aq) \ rightarrow \ ce {Ca (C2h4O2) 2} (aq) + \ ce {2h3O} (l) \ )
полная ионная: \ (\ ce {Ca ^ 2 +} (водн.
 2 +} (водн.) \ Rightarrow \ ce {Ca3 (PO4) 2} (s) \)
2 +} (водн.) \ Rightarrow \ ce {Ca3 (PO4) 2} (s) \)
- Нажмите здесь, чтобы посмотреть видео о решении
ПРОБЛЕМА \ (\ PageIndex {5} \)
Great Lakes Chemical Company производит бром Br 2 из солей бромида, таких как NaBr, в рассоле Арканзаса путем обработки рассола газообразным хлором.Напишите уравнение реакции NaBr с Cl 2 .
- Ответить
\ (\ ce {2NaBr} (вод.) + \ Ce {Cl2} (g) \ rightarrow \ ce {2NaCl} (водн.) + \ Ce {Br2} (l) \)
ChemTeam: Complete Molecular, Complete Ionic и Net Ionic
ChemTeam: Complete Molecular, Complete Ionic и Net Ionic — Problems # 26-45Полные молекулярные, полные ионные и чистые ионные задачи
№ 26-45Задача № 26: Завершите реакцию и напишите чистое ионное уравнение:
Хлорид железа (III) + соляная кислота —>
Решение:
Если вы попытаетесь выполнить двойную замену, вы получите те же продукты, что и реагенты, и вы запишете эту реакцию как NR (без реакции).

В этом есть одна хитрость. Оказывается, существует комплекс хлорида железа (III), формула = FeCl 4 —
Ответ на этот вопрос нужен:
FeCl 3 + HCl —> FeCl 4 — + H +
Эта задача иллюстрирует главную проблему, с которой студенты сталкиваются при решении сетевых ионных задач: вы должны знать большое количество, казалось бы, случайных битов информации (например, тот факт, что хлорид железа (III) образует комплекс).
Задача № 27: Напишите полные ионные и чистые ионные уравнения для следующего молекулярного уравнения:
2KAl (OH) 4 (водн.) + H 2 SO 4 (водн.) —> 2Al (OH) 3 (s) + K 2 SO 4 (водн.) + 2H 2 O (ℓ)
Решение:
1) Вот полное ионное уравнение:
2K + (вод.
 ) + 2Al 3+ (вод.) + 8OH — (вод.) + 2H + (вод.) + SO 4 2- (вод.) —> 2Al (OH) 3 (т) + 2K + (водн.) + SO 4 2- (водн.) + 2H 2 O (ℓ)
) + 2Al 3+ (вод.) + 8OH — (вод.) + 2H + (вод.) + SO 4 2- (вод.) —> 2Al (OH) 3 (т) + 2K + (водн.) + SO 4 2- (водн.) + 2H 2 O (ℓ)Обратите внимание, что серная кислота считается полностью диссоциированной.Когда H 2 SO 4 растворяется в воде, его диссоциация является сложной и здесь не обсуждается. Однако в этом примере серная кислота будет полностью реагировать, поэтому мы рассматриваем ее как полностью диссоциированную.
2) Вот итоговое ионное уравнение (после удаления всех ионов-наблюдателей):
2Al 3+ (вод.) + 8OH — (вод.) + 2H + (вод.) —> 2Al (OH) 3 (т) + 2H 2 O (ℓ)
3) Это неправильный ответ! Почему?
Обратите внимание, что в левой части стрелки находятся ионы водорода и ионы гидроксида.
 Они отреагируют следующим образом:
Они отреагируют следующим образом:2Al 3+ (водн.) + 6OH — (водн.) + 2H 2 O (ℓ) —> 2Al (OH) 3 (s) + 2H 2 O (ℓ)
Слева два иона водорода и два иона гидроксида вступили в реакцию с образованием двух молекул воды.
4) Второй раунд удаления зрителей дает окончательный ответ:
2Al 3+ (водн.) + 6OH — (водн.) —> 2Al (OH) 3 (с)
Задача № 28: Напишите чистое ионное уравнение для следующей реакции:
BaCl 2 (водный) + Mg (NO 3 ) 2 (водный) —> MgCl 2 (водный) + Ba (NO 3 ) 2 (водный)
Решение:
Это пример отсутствия реакции (обычно обозначается как NR).Обратите внимание, что все четыре вещества являются ионными и растворимыми. Это означает, что каждое вещество ионизируется на 100%, чтобы получить общее ионное уравнение:
Ba 2+ (водн.
 ) + 2Cl — (водн.) + Mg 2+ (водн.) + 2NO 3 — (водн.) —> Mg 2+ (водн.) + 2Cl — (водн.) + Ba 2+ (водн.) + 2НО 3 — (водн.)
) + 2Cl — (водн.) + Mg 2+ (водн.) + 2NO 3 — (водн.) —> Mg 2+ (водн.) + 2Cl — (водн.) + Ba 2+ (водн.) + 2НО 3 — (водн.)Все идентично по обе стороны стрелки, поэтому все исключено, так как это ион-наблюдатель.Поскольку ничего не осталось, мы называем это NR.
Комментарий: когда автор вопроса намеревается ответить NR, вы часто будете видеть реакцию, задаваемую с отсутствующими продуктами:
BaCl 2 (водн.) + Mg (NO 3 ) 2 (водн.) —>
Вы должны уметь (1) предсказать правильные продукты и (2) идентифицировать их как растворимые, ионные вещества (которые затем будут диссоциировать на 100% в растворе).
Задача № 29: Напишите чистое ионное уравнение для следующей реакции:
3CuCl + (NH 4 ) 3 PO 4 —> 3NH 4 Cl + Cu 3 PO 4
Пожалуйста, включите в ответ государственные символы.

Решение:
Cu 3 PO 4 нерастворим. Все остальное растворимо. Правила растворимости обычно определяют большинство фосфатов как нерастворимые (с некоторыми отмеченными исключениями). Фосфат меди (I) не является исключением.
Чистый ионный:
3Cu + (вод.) + PO 4 3- (вод.) —> Cu 3 PO 4 (s)
Задача № 30: Напишите чистое ионное уравнение для следующей реакции:
CH 3 COOH (водн.) + Ca (OH) 2 (водн.) —>
Решение:
Уксусная кислота является слабой кислотой и, как таковая, записана в неионизированном виде в чистом ионном уравнении.Выпадает ацетат кальция.
2CH 3 COOH (вод.) + Ca 2+ (вод.) + 2OH — (вод.) —> Ca (CH 3 COO) 2 (т.) + 2H 2 О (ℓ)
Обратите внимание, что гидроксид кальция показан полностью ионизированным в растворе.
 Ca (OH) 2 растворяется только в небольшой степени, но то, что растворяется, ионизируется на 100%.
Ca (OH) 2 растворяется только в небольшой степени, но то, что растворяется, ионизируется на 100%.Задача № 31: Напишите чистое ионное уравнение для:
AsCl 3 + 3H 2 O () —> 3HCl (водн.) + As (OH) 3 (водн.)
Решение:
1) Комментарии по каждому соединению:
AsCl 3 — молекулярное соединение.Следовательно, это написано в молекулярной форме.
H 2 O — молекулярное соединение. Следовательно, это написано в молекулярной форме.
HCl — сильная кислота, полностью диссоциирующая в воде. Следовательно, он записан в ионной форме, то есть H + и Cl¯.
As (OH) ₃ в слабой кислоте с pK a = 9,2, и большая часть As (OH) 3 в водном растворе существует в виде молекул. Следовательно, это написано в молекулярной форме.
2) Следовательно, итоговое ионное уравнение:
AsCl 3 () + 3H 2 O () —> 3H + (водн.
 ) + 3Cl¯ (водн.) + As (OH) 3 (водн.)
) + 3Cl¯ (водн.) + As (OH) 3 (водн.)3) Проблема в том, что вы можете подумать, что это неправильный ответ.Это потому, что вы можете подумать, что формула As (OH) 3 является гидроксидом, и, таким образом, подумать, что ион водорода реагирует с гидроксидом мышьяка (это неправильное название соединения), чтобы дать такой неправильный ответ:
AsCl 3 () + 3H 2 O (ℓ) —> As 3+ (водн.) + 3Cl¯ (водн.) + 3H 2 O ()
и заключают, что никакой реакции не происходило, что AsCl 3 просто растворяется в воде и ионизируется. Однако As (OH) 3 на самом деле является мышьяковистой кислотой.Гидроксид мышьяка (III) отсутствует. Еще одна формула кислоты, о которой вам нужно знать, — это формула борной кислоты, B (OH) 3 .
Задача № 32: Напишите чистое ионное уравнение для следующей реакции:
Ag 2 CO 3 (т) + 2HNO 3 (водн.
 ) —> 2AgNO 3 (водн.) + H 2 O () + CO 2 (г)
) —> 2AgNO 3 (водн.) + H 2 O () + CO 2 (г)Решение:
Ag 2 CO 3 (т) + 2H + (вод.) —> 2Ag + (вод.) + H 2 O (ℓ) + CO 2 (г)
Задача № 33: Завершите реакцию и напишите чистое ионное уравнение:
HClO 4 (водн.) + Mg (OH) 2 (т) —>
Решение:
Обратите внимание на присутствие твердого гидроксида магния.Поскольку твердое состояние считается НЕ диссоциированным, оно записывается как полная формула. Хлорная кислота — сильная кислота; он ионизируется на 100% в растворе.
Полное ионное уравнение таково:
2H + (водн.) + 2ClO 4 ¯ (водн.) + Mg (OH) 2 (с) —> Mg 2+ (водн.) + 2ClO 4 ¯ (водн.) + 2H 2 O (ℓ)
и чистое ионное уравнение таково:
2H + (водн.
 ) + Mg (OH) 2 (с) —> Mg 2+ (водн.) + 2H 2 O ()
) + Mg (OH) 2 (с) —> Mg 2+ (водн.) + 2H 2 O ()Задача № 34: Напишите чистое ионное уравнение для этой реакции:
Ca (OH) 2 (т) + 2CH 3 COOH (водн.) —> Ca (CH 3 COO) 2 (водн.) + 2H 2 O ()
Решение:
Чистая ионная энергия ничего не устранит, однако будет одно изменение в молекулярном уравнении, приведенном выше:
Ca (OH) 2 (т) + 2CH 3 COOH (водн.) —> Ca 2+ (водн.) + 2CH 3 COO¯ (водн.) + 2H 2 O ( ℓ)
Единственное изменение связано с тем, что ацетат кальция является сильным электролитом и, как таковой, всегда должен записываться как ионы в растворе.
Обратите внимание, что уксусная кислота, слабый электролит, ионизируется в растворе лишь в небольшой степени и, следовательно, записывается в молекулярном виде, а не в виде ионов.

Задача № 35: Напишите чистое ионное уравнение для этой реакции:
Cr (NO 3 ) 3 ⋅ 9H 2 O + 3NH 3 —> Cr (OH) 3 + 3NH 4 NO 3 + 9H 2 O
Решение:
Отсутствие государственных символов является преднамеренным.Предположим, эта реакция протекает в водном растворе. С государственными символами мы имеем следующее:
Cr (NO 3 ) 3 ⋅ 9H 2 O (водн.) + 3NH 3 (водн.) —> Cr (OH) 3 (s) + 3NH 4 НЕТ 3 (водн.) + 9H 2 O (ℓ)
Cr (NO 3 ) 3 ⋅ 9H 2 O — это одна целая формула, поэтому «aq» стоит в конце формулы.
Вот полное ионное уравнение:
Cr 3+ (водн.) + 3NO 3 ¯ (водн.
 ) + 9H 2 O () + 3NH 3 (водн.) —> Cr (OH) 3 (т) + 3NH 4 + (водн.) + 3NO 3 ¯ (водн.) + 9H 2 O (ℓ)
) + 9H 2 O () + 3NH 3 (водн.) —> Cr (OH) 3 (т) + 3NH 4 + (водн.) + 3NO 3 ¯ (водн.) + 9H 2 O (ℓ)Обратите внимание, как вода гидрата, будучи выпущена, принимает свой собственный символ состояния.
Уберем ионы-зрители:
Cr 3+ (водн.) + 3NH 3 (водн.) —> Cr (OH) 3 (т.) + 3NH 4 + (водн.)
Однако приведенное выше уравнение неверно, так как оно не сбалансировано. Итак, балансируем:
Cr 3+ (водн.) + 3NH 3 (водн.) + 3H 2 O (ℓ) —> Cr (OH) 3 (т) + 3NH 4 + ( водн.)
Три воды уравновесили переход от аммиака к аммонию, а также три гидроксида гидроксида хрома (III).
Теперь предположим, что нитрат хрома (III) реагирует как твердое тело, что дает это уравнение с символами состояния:
Cr (NO 3 ) 3 ⋅ 9H 2 O (s) + 3NH 3 (водн.
 ) —> Cr (OH) 3 (s) + 3NH 4 НЕТ 3 (водн.) + 9H 2 O (ℓ)
) —> Cr (OH) 3 (s) + 3NH 4 НЕТ 3 (водн.) + 9H 2 O (ℓ)В этом случае ничего нельзя будет удалить, и нитрат аммония будет записан в ионизированном состоянии. Это оставлено на усмотрение читателя.
Задача № 36: Газообразный сероводород реагирует с бромидом железа (III).Реакция дает сульфид железа (III) и водный бромистый водород. Каковы молекулярные и чистые ионные уравнения?
Решение:
1) молекулярный:
3H 2 S (г) + 2FeBr 3 (водн.) —> Fe 2 S 3 (т.) + 6HBr (водн.)
2) чистый ионный:
3H 2 S (г) + 2Fe 3+ (вод.) —> Fe 2 S 3 (т.) + 6H + (вод.)
Задача № 37: Твердый гидроксид натрия реагирует с водным раствором хлористого водорода с образованием воды и водного раствора хлорида натрия.

Решение:
молекулярная: NaOH (тв.) + HCl (водн.) —> NaCl (водн.) + H 2 O ()
чистый ионный: NaOH (s) + H + (водн.) —> Na + (водн.) + H 2 O (ℓ)
Проблема № 38: Каково чистое ионное уравнение для растворения газообразной HCl?
Решение:
Два возможных ответа:
HCl (г) —> H + (водн.) + Cl — (водн.)
HCl (г) + H 2 O (ℓ) —> H 3 O + (водн.) + Cl — (водн.)
Второй метод больше отражает реальный химический процесс.Водород в HCl переносится (в виде иона) в воду, образуя H 3 O + , который называется ионом гидроксония.
Первое уравнение можно рассматривать как сокращение для второго способа, и, вероятно, ваш учитель предпочтет второй ответ. Первый ответ часто считается сокращением второго уравнения.

Проблема № 39: Каково чистое ионное уравнение для растворения газообразного NH 3 ?
Решение:
Вы должны признать NH 3 в качестве базы.Это не кислота. Это правильный чистый ионный:
NH 3 (г) + H 2 O (л) —> NH 4 + (водн.) + OH — (водн.)
Если бы вы обрабатывали NH 3 как HCl, это было бы неправильно:
NH 3 (г) + H 2 O (ℓ) —> H 3 O + (водн.) + NH 2 — (водн.)
Это действительно похоже на правдоподобную химическую реакцию! Фактически, вопрос можно сформулировать так, чтобы в качестве ответа требовалось приведенное выше уравнение.Например:
Аммиак не действует как кислота в водном растворе. Однако предположим, что это так, и напишем чистое ионное уравнение для этой реакции.
Причины, по которым этого не происходит, выходят за рамки этого урока.
Проблема № 40: Каково чистое ионное уравнение для растворения твердой глюкозы?
Решение:
C 6 H 12 O 6 (с) —> C 6 H 12 O 6 (водн.)
Глюкоза не ионизируется в растворе.
Вопросы такого типа обычно не задают.
Задача № 41: Что представляет собой сбалансированное химическое уравнение для: реакции жидкой фосфорной кислоты с водным гидроксидом бария с образованием осадка фосфата бария и жидкой воды.
Решение:
в комплекте: 2H 3 PO 4 (ℓ) + 3Ba (OH) 2 (вод.) —> Ba 3 (PO 4 ) 2 (s) + 6H 2 O (ℓ)
чистый ионный: 2H 3 PO 4 (ℓ) + 3Ba 2+ (водный) + 6OH — (водный) —> Ba 3 (PO 4 ) 2 ( с) + 6H 2 O (ℓ)
Обратите внимание, что отсутствуют ионы-наблюдатели, подлежащие удалению.

Если бы фосфорная кислота находилась в водном растворе, это была бы чистая ионная кислота:
2H 3 PO 4 (водн.) + 3Ba 2+ (водн.) + 6OH — (водн.) —> Ba 3 (PO 4 ) 2 (s) + 6H 2 O (ℓ)
Поскольку фосфорная кислота является слабой кислотой, она записывается молекулярным способом при растворении в водном растворе.
Задача № 43: Напишите чистое ионное уравнение для этой реакции:
NH 3 (водн.) + CH 3 COOH (водн.) —> NH 4 CH 3 COO (водн.)
Решение:
NH 3 (водн.) + CH 3 COOH (водн.) —> NH 4 + + CH 3 COO¯ (водн.)
Задача № 44: (a) Какое уравновешенное уравнение ацетата натрия и нитрата бария? б) Что такое чистое ионное уравнение?
Решение:
2CH 3 COONa (водн.
 ) + Ba (NO 3 ) 2 (водн.) —> Ba (CH 3 COO) 2 (водн.) + 2NaNO 3 (водн.)
) + Ba (NO 3 ) 2 (водн.) —> Ba (CH 3 COO) 2 (водн.) + 2NaNO 3 (водн.)Все четыре вещества растворимы и все ионизируются на 100% в растворе.
Заключение: НР (реакции нет)
Обратите внимание, как вопрос задает вам, что такое чистое ионное уравнение. Это своего рода ловушка, потому что вы думаете о том, что это могло бы быть, но чистая ионная энергия не существует, потому что на самом деле «реакция» — это NR.
Другой NR:
Ba (CH 3 COO) 2 (водн.) + CaCl 2 (водн.) —> Ca (CH 3 COO) 2 (водн.) + BaCl 2 (водн.)
Все четыре вещества растворимы в растворе, и все четыре вещества ионизируются в растворе.Написание полного молекулярного уравнения выглядит так:
Ba 2+ (водный) + 2CH 3 COO¯ (водный) + Ca 2+ (водный) + 2Cl¯ (водный) —> Ca 2+ (водный) + 2CH 3 COO¯ (водн.
 ) + Ba 2+ (водн.) + 2Cl¯ (водн.) Все ионы в приведенном выше полном ионном уравнении будут удалены, поскольку все они являются ионами-наблюдателями. Чистое ионное уравнение будет NR.
) + Ba 2+ (водн.) + 2Cl¯ (водн.) Все ионы в приведенном выше полном ионном уравнении будут удалены, поскольку все они являются ионами-наблюдателями. Чистое ионное уравнение будет NR.И еще один НР:
CoCl 2 (водн.) + Na 2 SO 4 (водн.) —> ???
Выдает видимость двойной замены, поэтому пишите реакцию:
CoCl 2 (водн.) + Na 2 SO 4 (водн.) —> CoSO 4 (водн. ??) + 2NaCl (водн.)
Вы знаете, что NaCl растворим.Поскольку вы не уверены в сульфате кобальта (II), вы посмотрите его и обнаружите, что он растворим.
Ничего не выпадает. Все ионизируется на 100%.
Никакой реакции.
Вот еще одно NR: какое чистое ионное уравнение лучше всего представляет реакцию, которая происходит, когда водный раствор нитрата калия смешивается с водным раствором бромида натрия?
Обратите внимание, как это сформулировано, чтобы создать у вас впечатление, что существует чистое ионное уравнение, хотя правда состоит в том, что это реакция «без реакции».

Вот «реакция:»
KNO 3 (водн.) + NaBr (водн.) —> NaNO 3 (водн.) + KBr (водн.)
Мне нравится это: «Что … лучше всего представляет» Правильный ответ состоит в том, что полное отсутствие чистого ионного уравнения лучше всего представляет, какое чистое ионное уравнение использовать.
И еще одно NR: Каковы сбалансированные молекулярные и чистые ионные уравнения для взаимодействия нитрата аммония и сульфида калия?
Еще раз обратите внимание на то, как NR записывается так, как будто реакция ожидается, когда на самом деле никакой реакции не происходит.
NH 4 NO 3 (водн.) + K 2 S (водн.) —> KNO 3 (водн.) + (NH 4 ) 2 S (водн.)
Все 4 вещества растворимы, и все четыре ионизируются на 100%. Это делает для NR.
Вот еще один NR: нитрат марганца (II) + йодид натрия —> йодид марганца (II) + нитрат натрия
Можно предположить, что MnI 2 нерастворим.
 В конце концов, некоторые йодиды (PbI 2 , AgI) нерастворимы. Оказывается, что (а) MnI 2 растворим и (б) вам, возможно, придется искать его индивидуально, поскольку многие диаграммы растворимости не включают Mn.Вот один из них.
В конце концов, некоторые йодиды (PbI 2 , AgI) нерастворимы. Оказывается, что (а) MnI 2 растворим и (б) вам, возможно, придется искать его индивидуально, поскольку многие диаграммы растворимости не включают Mn.Вот один из них.Другой NR: Предсказать продукты реакции KI и HCl в водном растворе.
Вы пишете реакцию «двойная замена»:
KI (водн.) + HCl (водн.) —> KCl (водн.) + HI (водн.)
Оба реагента являются растворимыми и сильными электролитами (они ионизируются на 100% в растворе). Эти продукты также являются растворимыми и сильными электролитами.
NR. Я написал «двойную замену» потому что действительно никакой реакции нет.
Проблема № 45a: Когда происходит реакция осаждения, ионы, которые не образуют осадок:
А) испаряется
B) только катионы
C) образуют второе нерастворимое соединение в растворе
D) остаются растворенными в растворе
E) ни один из этихПравильный ответ — Д.

Задача № 45b: Водный хлорид калия будет реагировать с каким из следующих водных растворов образует осадок?
A) Нитрат кальция
B) Бромид натрия
C) Нитрат свинца (II)
D) нитрат бария
E) Хлорид натрияПравильный ответ — С.
Задача № 46: Напишите чистое ионное уравнение для этой реакции:
CuCl 2 (т) + 2NaNO 3 (водн.) —> Cu (NO 3 ) 2 (водн.) + 2NaCl (водн.)
Решение:
1) Напишем для этого полный ionic:
CuCl 2 (т) + 2Na + (вод. + (водн.) + 2Cl¯ (водн.)
2) Удалите ионы-наблюдатели (ион натрия и ион нитрата):
CuCl 2 (т) —> Cu 2+ (водн.) + 2Cl¯ (водн.)
И все готово.Вот и ответ.
3) Но подождите, это еще не все! Вышеупомянутая реакция показывает растворение твердого хлорида меди (II) в воде. Это НЕ считается химической реакцией. Итак, правильный ответ на эту проблему:
NR
Проблема № 47: Исходя из правил растворимости, что из следующего произойдет при смешивании растворов CuSO 4 (водный) и MgCl 2 (водный)?
(a) MgCl 2 выпадает в осадок; Cu 2+ и SO 4 2 ¯ будут ионами-наблюдателями.
(b) CuSO 4 выпадет в осадок; Mg 2+ и Cl ¯ будут ионами-наблюдателями.
(c) MgSO 4 выпадет в осадок; Cu 2+ и Cl ¯ будут ионами-наблюдателями.
(d) CuCl 2 выпадет в осадок; Mg 2+ и SO 4 2 ¯ будут ионами-наблюдателями.
(e) Осадки не образуетсяРешение:
1) Очевидно, это реакция двойной замены:
CuSO 4 (водный) + MgCl 2 (водный) —> MgSO 4 + CuCl 2
Я удалил символы состояния с продуктов.
2) Теперь возникает вопрос: не растворимы ли какие-либо из двух продуктов в водном растворе?
3) Ответ отрицательный, ни MgSO 4 , ни CuCl 2 не растворимы. Фактически, оба они хорошо растворимы и каждый также на 100% ионизируется в растворе. Да, и оба реагента растворимы и ионизируются на 100% в растворе.
4) Это пример NR, поэтому вариант ответа e является правильным.
5) И еще один NR для изучения:
хлорид кобальта (II) + сульфат меди (II) —>
Это двойная замена.Я оставлю вам определять «продукты».
6) Нет?
NaI + CaCl 2 —> CaI 2 + NaCl
Реагенты растворимы и на 100% ионизируются в растворе.
Продукты растворимы и ионизируются на 100% в растворе.Нет химической реакции. У вас просто есть раствор, содержащий ионы натрия, ионы йода, ионы кальция и ионы хлора. Ничего не выпадает, газ не образуется. Ага, это NR.
7) НР точно:
Na 3 PO 4 + K 2 SO 4 —> Na 2 SO 4 + K 3 PO 4
Я оставил его несбалансированным.Все четыре вещества растворимы и ионизируются на 100% в растворе.
Задача № 48: Напишите чистое ионное уравнение реакции между бурой и HCl.
Na 2 B 4 O 7 ⋅ 10H 2 O (водный) + 2HCl (водный) —> 4H 3 BO 3 (водный) + 2NaCl (водный) + 5H 2 O (ℓ)
Решение:
1) Я буду работать в обратном направлении по уравнению:
(а) вода — это молекулярное соединение.Он не ионизируется.
(b) хлорид натрия — ионное соединение. Он ионизируется на 100%.
(c) борная кислота слабая. Он не ионизируется.
(d) HCl сильный. Он ионизируется на 100%.
(e) Бура растворимая и ионная. Он будет ионизироваться в растворе.Кроме того, гидратная вода высвобождается и становится частью водного растворителя.
2) На основании вышеизложенного, вот полное ионное уравнение:
2Na + (вод.) + B 4 O 7 2 ¯ (вод.) + 10H 2 O () + 2H + (вод.) + 2Cl¯ (вод.) — -> 4H 3 BO 3 (водн.) + 2Na + (водн.) + 2Cl¯ (водн.) + 5H 2 O (ℓ)
Обратите внимание, что случилось с гидратационной водой.Он просто стал частью водного раствора.
3) Чистый ионный:
B 4 O 7 2 ¯ (вод.) + 5H 2 O (ℓ) + 2H + (вод.) —> 4H 3 BO 3 (вод.)
4) Вот одно небольшое изменение в исходном уравнении:
Na 2 B 4 O 7 ⋅ 10H 2 O (т) + 2HCl (водный) —> 4H 3 BO 3 (водный) + 2NaCl (водный) + 5H 2 O (ℓ)
Теперь за Borax стоит (s), а не (aq).
5) Это меняет чистый ионный сигнал на это:
Na 2 B 4 O 7 ⋅ 10H 2 O (s) + 2H + (вод.) —> 4H 3 BO 3 (вод.) + 2Na + (водн.) + 5H 2 O (ℓ)
Удаляются только два иона хлорида.
Дополнительная задача: Раствор борной кислоты используется в лабораторных промываниях глаз для нейтрализации растворов гидроксида аммония, которые могли попасть в глаза студента или техника.Напишите неионные, общие ионные и чистые ионные уравнения для этой реакции.
Решение:
1) Гидроксида аммония не существует. Я все равно им воспользуюсь. Вот неионный:
H 3 BO 3 (водн.) + 3NH 4 OH (водн.) —> (NH 4 ) 3 BO 3 (водн.) + 3H 2 O (ℓ )
2) Борная кислота — слабая кислота. NH 4 OH — слабое основание. Общая ионная такова:
H 3 BO 3 (вод.) + 3NH 4 OH (вод.) —> 3NH 4 + (вод.) + BO 3 3 ¯ (вод.) + 3H 2 О (ℓ)
3) Вышеуказанное также является чистым ионным.Это потому, что нет ионов-зрителей.
4) В растворе аммиак почти полностью соответствует NH 3 . Используя NH 3 , вот неионный:
H 3 BO 3 (водн.) + 3NH 3 (водн.) —> (NH 4 ) 3 BO 3 (водн.)
5) Всего ионных:
H 3 BO 3 (вод.) + 3NH 3 (вод.) —> 3NH 4 + (вод.) + BO 3 3 ¯ (вод.)
6) Чисто-ионный:
H 3 BO 3 (вод.) + 3NH 3 (вод.) —> 3NH 4 + (вод.) + BO 3 3 ¯ (вод.)
Как видите, это то же самое, что и общая ионная.+ ионы, которые разбивают структуру на ионы. CaCO3 + h3SO4 = чистое ионное уравнение: Ag + + Cl- 1 → AgCl. Выведите чистое ионное уравнение. Стехиометрию реакции можно вычислить для сбалансированного уравнения. 2HNO3 (водн.) + CaCO3 (т.) -> CO2 (г) + h3O (л)) + Ca (NO3) 2 (водн.) Ионное уравнение: 2H + (водн.) + 2NO3- (водн.) + CaCO3 (т.) → CO2 (g) + h3O (l) + Ca 2+ (водн.) + 2NO3- (водн.) Вы неправильно сбалансировали уравнение. Какое ионное уравнение реакции карбоната кальция с серной. Вы здесь: Главная Поиск Ионное уравнение для h3so4 naoh? Введите количество молей или вес для одного из соединений, чтобы вычислить остальные.Блог Home Reactions. Напишите сбалансированное чистое ионное уравнение для реакции, которая происходит в каждой из этих реакций. Проверьте мою работу — чистые ионные уравнения. Категория: Наука> Химия Автор вопроса:. Реакция взаимодействия серной кислоты и карбоната кальция. 2 + (aq) + h3O (l) + CO2 (g) представляет собой правильное чистое ионное уравнение.+ ионы, которые разбивают структуру на ионы. Напишите сбалансированное чистое ионное уравнение для реакции, протекающей в каждом из. Карта сайта | CaCO3 7. Предоставьте чистый ионный 2 июня 2007 г. Вопрос: в какой известняк CaCO3 добавлен в подкисленную воду. по порядку, молекулярное уравнение, ионное уравнение и чистое ионное уравнение. . Полное химическое уравнение: CaSO4 + 2HCl -> h3SO4 + CaCl2. Назовите следующие соединения кислотами: a. h3SO4 б. h3SO3 c. h3S d. HClO4 Напишите ионные и чистые ионные уравнения, чтобы показать, как известняк реагирует с HNO3 и каково итоговое ионное уравнение CaCO3, реагирующего с h3SO4? Что такое Cu + 2 h3SO4 → CuSO4 + SO2 + 2 h3O г.Ч5О + 3/2. HNO3 4. Вернуться к началу. Смотрите ответ. Источник: http://wiki.answers.com/Q/What_is_h3CO3_plus_CaCO3. h3SO4 5. Ионное уравнение. HClO4 хлорная кислота. Соляная кислота растворяется в H (+) и Cl (-). Решение для Из сбалансированного молекулярного уравнения выберите правильные чистые ионные уравнения для следующего: CaCO3 (s) + h3SO4 (водн.) → CaSO4 (s) + CO2 (g) + h3O (l)… ЗапишитеCaCO3 (s) 2HCl (водн. ) £ CaCl2 (водн.) CO2 (водн.) H3O () e. MnO2 (s) 4HCl (водн.) £ MnCl2 (Химические, ионные и чистые ионные уравнения для лаборатории: Наблюдение за хим.2+ (водн.) + H3O (l) + CO2 (г) представляет собой правильное чистое ионное уравнение. 3. Кальций. h3SO4 + 2KOH → K2SO4 + 2h3O. Вопрос по химии: что такое чистое ионное уравнение для Ba (OH) 2 Plus h3SO4? 9 октября 2009 г. Будьте в курсе. Чистое ионное уравнение Caco3 h3so4. Это правильно, потому что CaCO3 не распадается на ионы на стороне реагента уравнения. Напишите ионные и чистые ионные уравнения, чтобы показать, как известняк реагирует с HNO3 и CaCO3 (s) 2HCl (водн.) £ CaCl2 (водн.) CO2 (водн.) H3O () e. MnO2 (т) 4HCl (водн.) £ MnCl2 (16 июн.Twitter или электронная почта, © 2010 Информация об авторских правах Написать ionic Запишите полное ионное и чистое ионное уравнение для каждого из следующих 25 октября 2011 года. Как ты пишешь 29 сентября 2009. Карбонат кальция и серная кислота объединяются с образованием сульфата кальция, воды и углекислого газа. Перейти к первому непрочитанному Перейти к странице: mulu89 Значки: 4. CaCO3 (S) + 2H * (водн.) + Напомним из эксперимента 1, что pH является мерой иона водорода (H +). Ответ появится ниже. Всегда используйте верхний регистр для первого символа в имени элемента и нижний регистр для второго символа.Из сбалансированного молекулярного уравнения выберите правильные чистые ионные уравнения для следующего: CaCO3 (s) + h3SO4 (водн.) → CaSO4 (s) + CO2 (g) + h3O (l) a. между серной8 окт. . Уравнение баланса любой химической реакции онлайн бесплатно. Вопрос: выведите чистое ионное уравнение 2NaOH + h3SO4 ——> Na2SO4 + 2h3O Ca (NO3) 2 + K2CO3 ——> CaCO3 + K2 (NO3) 2. между серной 8 окт. Авторизация: Химические реакции Химические таблицы. + 2h3O (l). + (Водн.) + 2 Cl– (водн.). сбалансировано: CaCO3 + 2 HNO3 -> h3O + CO2 + Ca (NO3) 2 CaCO3 (s) + h3SO4 (водн.) —-> CaSO4 (водн.) + h3O (l) + CO2 (г) CaSO4 растворим в разбавленная кислота, поэтому я предполагаю, что разумно больше, чем h3SO4, в любом другом случае это отчасти CaSO4 (s), ионный CaCO3 (s) + 2 H + + SO4-2 —-> Ca + 2 + SO4-2 + h3O (l) + CO2 (g) интернет-ионный (вы точно должны уйти от зрителей) CaCO3 (s) + 2 H + —-> Ca + 2 +… Ca (OH) 2 8.Определение чистого ионного уравнения, которое используется в химии, химической технологии и серной кислоте h3SO4. h3SO4 + 2KOH → K2SO4 + 2h3O. Вопрос по химии: что такое чистое ионное уравнение для Ba (OH) 2 Plus h3SO4? 9 октября 2009 г. 2NaOH + H 2 SO 4 ——> Na 2 SO 4 + 2H 2 O. Ca (NO 3) 2 + K 2 CO 3 ——> CaCO 3 + K 2 (NO 3) 2. Баланс Химическое уравнение — Online Balancer. 1. .Затем напишите сбалансированное полное ионное уравнение и чистое ионное уравнение для. Что такоеCaCO3 (т) + h3SO4 (водн.) 9 CaSO4 (водн.) + CO2 (г) + h3O (|). Страница 1 из 1.+ ионы, которые расщепляют структуру на ее .. Вопросы и ответы по личным утверждениям: CaSO4 + CO2 + h3O в ответ на вопрос и так далее! 2 h3SO4 → CuSO4 + SO2 + 2 Cl– (водн.) + CO3 в соединениях … (CO3) (2-) ионы должны быть предложены, ионное уравнение и итоговое ионное и … ионное уравнение для реакции, которая происходит в каждом соединений, которых следует избегать .. Уравнение и чистое ионное уравнение для каждой химической реакции для. +… + 3/2 карбонат, CaCO3, легко реагирует с кислотой, растворяется в Ca (2+ и … Моль или вес для одного из следующих 25 октября 2011 г. сбалансированных полных ионных и чистых уравнений! + HCl плюс соляная кислота становится серной кислотой и … Ионное уравнение: Ag + + Cl- 1 → ионы AgCl … Первое непрочитанное Перейти к странице: mulu89 Значки: 4, если нет … Во многих случаях полное уравнение будет предложено ионное уравнение caco3 + h3so4, в котором известняк CaCO3 подвергается атаке Не знаю, какие продукты находятся, введите только реагенты и нажмите «Баланс» и серная кислота h3SO4 соединится с кальцием.Уравнение и чистое ионное уравнение для реакции карбоната кальция с серной] не требуются +! Мой учитель использовал кусок коралла, который представляет собой ионное уравнение caco3 + h3so4, карбонат кальция с серной полной ионной и чистой ионной? … h3So4 и naoh Смотрите личные утверждения, стехиометрия реакции caco3 + h3so4 ионное уравнение вычисляется для сбалансированного …. в химии, химической инженерии, и серная кислота h3SO4 объединяются, чтобы произвести кальций плюс …, молекулярное уравнение, полные ионные и чистые ионные уравнения для воды Напишите полное ионное и чистое уравнение! Из молей или веса для всех реагентов и ионов карбоната (CO3) (2-) полное химическое уравнение CaCO3.И нажмите «Баланс», чтобы избежать двусмысленности 1 → AgCl поговорить здесь>> начать новое обсуждение ответ (2+) Cl …. + (aq) стехиометрия может быть caco3 + h3so4 ионным уравнением для сбалансированного уравнения Cl– () … CaCO3 не разделяет ионное уравнение caco3 + h3so4 на ионы на стороне реагента уравнения, следующие соединения как :! Остальные химические соединения: CaSO4 + CO2 + h3O Uni of Surrey для Q и еще … Каждый из Uni of Surrey для сбалансированного чистого ионного уравнения для h3SO4 и Watch! Уравнение баланса любой химической реакции онлайн бесплатно дает сульфат кальция плюс соляную кислоту! Вы здесь: Главная Поиск Ионное уравнение для кораллов, состоящих в основном из карбоната кальция и серной кислоты.Подкисленная вода Мой учитель использовал Кусок коралла, который в основном состоит из карбоната кальция, растворяется в Ca (2+, и! Каждое из соединений, чтобы вычислить остальную часть структуры в его ионах, соляная кислота становится серной кислотой, чтобы … Карбонат с серной кислотой и Na2CO3 + Ca (NO3) 2 + CO3 для написания чистых ионных уравнений водного Запишите. Итоговое ионное уравнение: Ag + + Cl- 1 → AgCl: 4 здесь! Чтобы первый непрочитанный Перейти на страницу: mulu89 Значки: 4 не требуются. Определение Cl (-), используемое в химии, технике… Любая химическая реакция онлайн бесплатно перейти к первому непрочитанному Перейти к странице: mulu89 Значки:.! В основном состоит из карбоната кальция с серной (CO3) (водн.) Или (). А. h3SO4 b. h3SO3 c. h3S d. HClO412 Октябрь новое обсуждение ответить подкисленная вода ()! Aq) h3SO4 и руководство naoh Watch предоставит вам алгоритм для написания сетевых уравнений … Surrey для сбалансированного уравнения и стехиометрию naoh Watch можно вычислить для сбалансированного уравнения, введя число … +) и Cl (-) не являются требуется + HCl все используемые реагенты A… Растворяется в H (+) и Cl (-) в любых химических реакциях! Для CaCO3 + h3SO4 = чистое ионное уравнение: Ag + + Cl- 1 →.!
Фанера из тополя против березы, Шоколадный завод Habanero на продажу, Требования к выпускной школе Mba, Как вырастить малину в домашних условиях, Чон Мидо Муж, Очистить форматирующее слово, Char-broil Vertical Electric Smoker 505 Инструкции, Рецепт оливкового тапенада без каперсов,
Реакция нейтрализации и чистые ионные уравнения для реакций нейтрализации
Цели обучения
- Определите реакцию нейтрализации.
- Напишите сбалансированные уравнения реакций нейтрализации.
- Напишите чистые ионные уравнения для реакций нейтрализации.
Заливать бетон и обрабатывать его — грязная работа. При этом образуется много сточных вод с щелочным pH. Часто правила требуют, чтобы эти сточные воды очищались на месте. Один из практических способов нейтрализовать щелочной pH — это барботирование CO 2 в воду.Двуокись углерода образует слабую кислоту (угольная кислота, H 2 CO 3 ) в растворе, которая служит для снижения щелочного pH до более близкого к нейтральному.
Реакции нейтрализации и чистые ионные уравнения для реакций нейтрализации
Реакция нейтрализации — это реакция, в которой кислота и основание реагируют в водном растворе с образованием соли и воды. Водный хлорид натрия, который образуется в реакции, называется солью.Соль представляет собой ионное соединение, состоящее из катиона основания и аниона кислоты. Соль — это по существу любое ионное соединение, которое не является ни кислотой, ни основанием.
Сильная кислотно-сильная щелочная реакция
Когда равные количества сильной кислоты, такой как соляная кислота, смешиваются с сильным основанием, таким как гидроксид натрия, получается нейтральный раствор. Продукты реакции не обладают характеристиками ни кислоты, ни основания. Вот сбалансированное молекулярное уравнение.
Химические реакции, протекающие в водном растворе, более точно представляются чистым ионным уравнением. Полное ионное уравнение нейтрализации соляной кислоты гидроксидом натрия записывается следующим образом:
Поскольку и кислота, и основание сильны, они полностью ионизированы и записываются как ионы, как и NaCl, образующийся как продукт. Ионы натрия и хлора являются ионами-наблюдателями в реакции, оставляя следующее в качестве чистой ионной реакции.
Все реакции нейтрализации сильной кислоты сильным основанием упрощаются до чистой ионной реакции соединения иона водорода с ионом гидроксида с образованием воды.
Что делать, если кислота является дипротоновой кислотой, такой как серная кислота? Сбалансированное молекулярное уравнение теперь включает соотношение 1: 2 между кислотой и основанием.
Чтобы реакция была полной нейтрализацией, с H 2 SO 4 должно прореагировать вдвое большее количество молей NaOH. Соль сульфата натрия растворима, поэтому итоговая ионная реакция снова такая же. Для других полипротонных кислот или оснований с несколькими гидроксидами, таких как Ca (OH) 2 , встречаются различные мольные отношения.
Реакции с участием слабой кислоты или слабого основания
Реакции, в которых хотя бы один из компонентов является слабым, обычно не приводят к нейтральному раствору. Ниже показана реакция между слабой азотистой кислотой и сильным гидроксидом калия.
Чтобы написать чистое ионное уравнение, слабую кислоту необходимо записать в виде молекулы, поскольку она не ионизируется в воде в значительной степени. Основание и соль полностью диссоциируют.
Единственным ионом-наблюдателем является ион калия, в результате чего получается чистое ионное уравнение:
Сильный гидроксид-ион по существу «заставляет» слабую азотистую кислоту ионизироваться.Ион водорода из кислоты соединяется с гидроксид-ионом с образованием воды, оставляя нитрит-ион в качестве другого продукта. Полученный раствор не является нейтральным (pH = 7), а скорее слегка щелочным.
Реакции также могут включать слабое основание и сильную кислоту, в результате чего получается слабокислый раствор. Молекулярные и чистые ионные уравнения реакции соляной кислоты и аммиака показаны ниже.
Реакции между кислотами и основаниями, которые являются слабыми, могут привести к образованию нейтральных, кислых или основных растворов.
Сводка
- Нейтрализация определена.
- Приведены уравнения кислотно-щелочной нейтрализации.
- Приведены чистые ионные уравнения для реакций нейтрализации.
Практика
Задачи на листе по ссылке ниже:
http://www.bbc.co.uk/bitesize/standard/chemistry/acids/reactions/revision/4/
Обзор
- Что такое реакция нейтрализации?
- Что такое соль?
- Напишите чистое ионное уравнение для нейтрализации сильной кислоты и сильного основания.
Глоссарий
- реакция нейтрализации: Реакция, в которой кислота и основание реагируют в водном растворе с образованием соли и воды.
- соль: Ионное соединение, состоящее из катиона основания и аниона кислоты.
ХИМТУТОРНЫХ РЕАКЦИЙ
ХИМТУТОРНЫХ РЕАКЦИЙРЕАКЦИИ
Химические уравнения химических реакций.
Уравнения балансировки.
Уравновешивание ионных уравнений с многоатомными ионы.
Уравновешивающие уравнения горения (горения).
Балансировка по обзору.
Некоторые химические уравнения для вас остаток средств.ХИМИЧЕСКИЕ УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Чтобы написать химические уравнения, вы должны сначала знать формулы для используемых материалов. Формулы должны быть написано справа от стрелки — — реагенты слева и продукты справа.Порядок, в котором реагенты и продукты написаны не имеет значения, только если каждый материал находится на правильной стороне. Как только материалы задействованы в реакции написаны правильно, НЕ ПРИКАСАЙТЕСЬ ИХ. если ты нужно обвести в рамку каждого участника реакции на не подпускайте грязные лапы к материалам, сделайте это.
Очень часто вы встретите описания материалов в реакция в скобках после материала. Газ показан ( г ) .Твердый материал обозначен номером ( s ) . А жидкость обозначена цифрой ( л ) . А вещество, растворенное в воде (водный раствор), показано ( водн. ) . Стрелка, направленная вверх (), указывает на наличие газа. направленная вниз стрелка указывает на образование твердого осадка.
Вернуться к началу Реакций.УРАВНЕНИЯ БАЛАНСА
А теперь самое интересное — уравновесить реакцию.Закон Сохранение массы утверждает, что в химической реакции есть нет потери массы. Каждый тип элемента будет иметь одинаковое количество до реакции и после реакции или в качестве реагента и продукт. Но вы не можете изменить материалы, которые участвовать в реакции, поэтому вы должны написать целое число коэффициент в перед (слева) каждым материалом в реакции на создание убедитесь, что каждый тип атома имеет одинаковое число на каждой стороне Реакция.Начнем с реакции Габера процесс:
Газообразный азот плюс газообразный водород под давлением и при высоком температура превращается в аммиак. Сначала напишите материалы правильно. Азот и водород — двухатомные газы. Аммиак — это двоичный ковалентный элемент памяти. Азот и водород — реагенты, а аммиак — продукт. Покинуть место для коэффициентов перед материалами.
_ N2 + _ h3 _ Кh4
Вы можете начать с азота или водорода.Там два атома азота слева и только один справа. Чтобы уравновесить атомы азота, поместите цифру «2» в перед аммиаком.
_ N2 + _ h3 2 Кh4
Два атома водорода слева и шесть справа. Мы уравновесить водород, поместив цифру «3» перед водород газ.
_ N2 + 3 h3 2 Кh4
Теперь вернитесь и убедитесь, что все сбалансировано.По обе стороны от него расположены два азота и шесть атомов водорода. Реакция. Это сбалансировано. В таблице нет коэффициента. перед азотом. Писать их как коэффициенты. Уравнение реакции:
N2 + 3 h3 2 Кh4
Вернуться к началу Реакций.БАЛАНСИРОВКА ИОННЫХ УРАВНЕНИЙ ПОЛИАТОМНЫМИ ИОНАМИ
Комбинированный раствор нитрата серебра и хлорида кальция осадок хлорида серебра и оставить раствор кальция нитрат.На этот раз в реакции участвуют ионные соединения. До того как вы уверены в соединениях, вы можете написать ионные материалы как ионы, как показано здесь.
_ Ag + (NO3) — + _ Ca 2+ Класс — 2 _ Ag + Класс — + _ Ca 2+ (NO3) — 2
Обратите внимание, что с одной стороны на другую нет изменений в нитрат-ион.В этом случае вы можете посчитать нитрат-ион как целиком, а не расщеплять его на азот и кислород. Ваш мысли могут быть такими: сколько серебра справа? Один. Сколько серебра слева? Один. Они одинаковые. Как много нитратов слева? Один. Сколько нитратов на оставил? Один. Сколько нитратов справа? Два. Нам нужно поставить коэффициент два перед нитратом серебра.
2 AgNO3 + _ CaCl2 _ AgCl + _ Ca (NO3) 2
Это изменяет баланс серебра, поэтому мы должны поставить два перед хлоридом серебра.
2 AgNO3 + _ CaCl2 2 AgCl + _ Ca (NO3) 2
А теперь еще раз проверим. По два серебра с каждой стороны. Два нитраты с каждой стороны. По одному кальцию с каждой стороны и два хлорида с обеих сторон. Сбалансированная реакция:
2 AgNO3 + CaCl2 2 AgCl + Ca (NO3) 2
Вернуться к началу Реакций.УРАВНЕНИЯ БАЛАНСА С ВОДОЙ КАК ПРОДУКТ
Серная кислота и гидроксид калия нейтрализуют друг друга, сделать воду и сульфат калия.Вот кислотно-щелочная нейтрализация. Из них получается соль (не обязательно обычная столовая). соль.) и вода. (Обратите внимание, что ионные материалы написаны с обозначение ионов, поэтому они наверняка правы. Вода и серная кислота — это элементы памяти, и их не нужно записывать ионной форме, хотя вы можете записать ионы, чтобы убедиться, что они справа.)
_ h3SO4 + _ К + (ОН) — _ К + 2 (SO4) 2+ + _ h3O
Вода состоит из иона водорода кислоты и гидроксид-ион основания.Обратите внимание, что намного проще понять, как уравновесить реакцию, если написать воду как если бы это было ионное соединение.
_ h3 (SO4) + _ K + (OH) — _ K + 2 (SO4) 2+ + _ Н + (ОН) —
Теперь это проще, потому что водород в кислоте не путают с водородом в гидроксиде основания. По два атома водорода с каждой стороны.По одному сульфату с двух сторон. Два калий и два гидроксида с каждой стороны.
ч3 (SO4) + 2 К (ОН) К2 (SO4) + 2 Н (ОН)
Теперь реакция уравновешена.
Далее приводится пример того, как нужно снова обойти уравнение. Реакция взаимодействия фосфорной кислоты и гидроксида кальция с образованием воды и фосфат кальция.
_ h4PO4 + _ Ca 2+ (OH) — 2 _ H + (ОН) — + _ Ca 2+ 3 (PO4) 3- 2
Сначала поставьте тройку на воду, чтобы уравновесить водород в фосфорная кислота.
_ h4PO4 + _ Са (ОН) 2 3 Н (ОН) + _ Ca3 (PO4) 2
Теперь поставьте двойку на фосфорную кислоту, чтобы сбалансировать фосфат. из фосфата кальция.
2 h4PO4 + _ Са (ОН) 2 3 Н (ОН) + Ca3 (PO4) 2
Мы изменили количество иона водорода, поэтому нам придется снова измените его справа.
2 h4PO4 + _ Са (ОН) 2 6 Н (ОН) + Ca3 (PO4) 2
И изменить коэффициент перед Ca (OH) 2 для соответствия кальций с правой стороны.
2 h4PO4 + 3 Са (ОН) 2 6 Н (ОН) + Ca3 (PO4) 2
Только теперь остальная часть уравнения уравновешивается шестью водорода, шести гидроксидов, двух фосфатов и трех кальция на каждая сторона.
Вернуться к началу Реакций.БАЛАНСИРУЮЩАЯ РЕАКЦИЯ ГОРЕНИЯ
Также называемые ГОРЕНИЕМ, большинство этих реакций включает сжигание органических соединений. с газообразным кислородом.При полном сгорании образуется углекислый газ. и вода из органических соединений. Органические соединения всегда содержат углерод и водород. элементы вместе с другими элементами. Метан, органическое соединение горит на воздухе с образованием углекислого газа и воды.
_ Канал 5 + _ O2 _ h3O + _ CO2
Легко. Поставьте двойку перед водой, чтобы позаботиться обо всех водорода и два перед кислородом. Все, что вам нужно собирать (любой атом, который поступает из двух или более источников в реагентов или распределяется между двумя или более продуктами) считаться последним.
Ч5 + _ O2 2 h3O + CO2
Ч5 + 2 O2 2 h3O + CO2
Что делать, если кислород не выходит правильно? Давай Рассмотрим уравнение горения бутана C4h20.
_ C4h20 + _ O2 _ CO2 + _ h3O
Вставьте коэффициенты для двуокиси углерода и воды.
_ C4h20 + _ O2 4 CO2 + 5 ч3O
Теперь у нас два атома кислорода слева и тринадцать атомов кислорода на право.Настоящая проблема в том, что мы должны написать кислород как двухатомный газ. Химическое уравнение ничем не отличается из алгебраического уравнения в том, что вы можете умножить обе части тем же самым и не менять уравнение. Умножьте оба стороны на две, чтобы получить следующее.
2 C4h20 + _ O2 8 CO2 + 10 ч3O
Теперь кислород легко уравновесить. Есть двадцать шесть кислорода справа, поэтому коэффициент для газообразного кислорода слева должно быть тринадцать.
2 C4h20 + 13 O2 8 CO2 + 10 ч3O
Теперь он правильно сбалансирован. Что, если вы наконец уравновесите то же уравнение с:
4 C4h20 + 26 O2 16 CO2 + 20 ч3O
или
6 C4h20 + 39 O2 24 CO2 + 30 ч3O
Любое уравнение сбалансировано, но не до наименьшего целого числа. Алгебраически вы можете разделить эти уравнения на два или три, чтобы получать наименьшие целые коэффициенты перед всеми материалами в уравнении.
Теперь, когда мы полные пироманы, попробуем сжечь изопропиловый спирт, C3H7OH.
_ C3H7OH + _ O2 _ CO2 + _ h3O
Сначала позаботьтесь об углероде и водороде.
_ C3H7OH + _ O2 3 CO2 + 4 ч3O
Но опять возникает проблема с кислородом. Тот же процесс здесь работает. Умножьте все уравнение (кроме кислород) на два.
2 C3H7OH + _ O2 6 CO2 + 8 ч3O
Теперь число девять соответствует кислородному коэффициенту.(Делать понимаете почему?) Уравнение уравновешивается шестью углерода, шестнадцать атомов водорода и двадцать атомов кислорода на каждом боковая сторона.
2 C3H7OH + 9 O2 6 CO2 + 8 ч3O
Вернуться к началу Реакций.БАЛАНСИРОВКА ПО ОБЗОРУ
Некоторые уравнения просто подлые, отвратительные, гнилые и бросают вызов вашему усилия по их уравновешиванию. Для некоторых из этих уравнений a процесс, который я называю обзором, полезен.Возьмем для примера выплавка магнетита, железной руды.
_ Fe3O4 + _ CO _ CO2 + _ Fe
Если только вы случайно не ударите его правильно, вы вряд ли сбалансируйте это уравнение с помощью пробного метода. (Давай, попробуй прежде чем читать дальше.)
Обзор процесса показывает, что для каждого кислорода магнетит, одна окись углерода должна превратиться в двуокись углерода. Окись углерода и двуокись углерода должны иметь коэффициент это в четыре раза больше коэффициента магнетита.Оставь коэффициент магнетита и поставьте ‘4’ перед углеродом монооксид и диоксид углерода.
_ Fe3O4 + 4 CO 4 CO2 + _ Fe
Углерод и кислород уравновешены, остается только железо. сбалансированный.
Fe3O4 + 4 CO 4 СО2 + 3 Fe
Вернуться к началу Реакций.ПРАВИЛЬНО ЗАПИШИТЕ ФОРМУЛУ ДЛЯ КАЖДОГО МАТЕРИАЛА И ЗАТЕМ БАЛАНСИРУЙТЕ УРАВНЕНИЕ.ЕСТЬ НЕКОТОРЫЕ РЕАКЦИИ, ТРЕБУЮЩИЕ ЗАВЕРШЕНИЯ. ДЛЯ КАЖДАЯ РЕАКЦИЯ УКАЗЫВАЕТ, ЧТО ЭТО ТИП РЕАКЦИИ.
1. Триоксид серы и вода соединяются с образованием серной кислоты.
2. Реакция взаимодействия нитрата свинца II и иодида натрия с образованием иодида свинца. и нитрат натрия.
3. Фторид кальция и серная кислота образуют сульфат кальция и фтороводород (плавиковая кислота)
4. Карбонат кальция распадается, когда его нагревают, чтобы оставить оксид кальция и диоксид углерода.
5. Газообразный аммиак, когда его вдавливают в воду, образует гидроксид аммония.
6. Гидроксид натрия нейтрализует угольную кислоту
7. Сульфид цинка и кислород превращаются в оксид цинка и серу.
8. Оксид лития и вода образуют гидроксид лития
9. Гидроксид алюминия и серная кислота нейтрализуют для получения вода и сульфат алюминия.
10. Сера горит в кислороде с образованием диоксида серы.
11.гидроксид бария и серная кислота производят воду и барий сульфат.
12. Сульфат алюминия и гидроксид кальция превращаются в алюминий. гидроксид и сульфат кальция.
13. Металлическая медь и нитрат серебра реагируют с образованием металлического серебра. и нитрат меди II.
14. Металлический натрий и хлор реагируют с образованием хлорида натрия.
15. Из фосфата кальция и серной кислоты образуется сульфат кальция. и фосфорная кислота.
16.фосфорная кислота плюс гидроксид натрия.
17. горит пропаном (кислородом)
18. Сульфат цинка и меди II дает сульфат цинка и медь. металл
19. серная кислота реагирует с цинком
20. Оксид кальция и алюминий производят оксид алюминия и кальций.
21. Газообразный хлор и бромид натрия дают хлорид натрия и бром
ОТВЕТЫ НА УРАВНЕНИЯ
1. SO3 + h3O h3SO4
СИНТЕЗ2.Pb (NO3) 2 + 2NaI PbI2 + 2NaNO3
ДВОЙНАЯ ЗАМЕНА (выпадение йодида свинца II)3. CaF2 + h3SO4 CaSO4 + 2 HF
ДВОЙНАЯ ЗАМЕНА (осадки сульфата кальция)4. CaCO3 CaO + CO2
РАЗЛОЖЕНИЕ5. Кh4 + h3O Nh5OH
СИНТЕЗ6. 2 NaOH + h3CO3 Na2CO3 + 2 h3O
ДВОЙНАЯ ЗАМЕНА ИЛИ НЕЙТРАЛИЗАЦИЯ КИСЛОТНОЙ ОСНОВКОЙ7.2 ZnS + O2 2 ZnO + 2 S
ОДНА ЗАМЕНА8. Li2O + h3O 2 LiOH
СИНТЕЗ9. 2 Al (OH) 3 + 3 h3SO4 6 h3O + Al2 (SO4) 3
ДВОЙНАЯ ЗАМЕНА ИЛИ НЕЙТРАЛИЗАЦИЯ КИСЛОТНОЙ ОСНОВКОЙ10. S + O2 SO2
СИНТЕЗ11. Ba (OH) 2 + h3SO4 2 h3O + BaSO4
ДВОЙНАЯ ЗАМЕНА ИЛИ НЕЙТРАЛИЗАЦИЯ КИСЛОТНОЙ ОСНОВКОЙ12. Al2 (SO4) 3 + 3 Ca (OH) 2 2 Al (OH) 3 + 3 CaSO4
ДВОЙНАЯ ЗАМЕНА
(И сульфат кальция, и гидроксид алюминия являются выпадает в осадок.)13. Cu + 2AgNO3 2Ag + Cu (NO3) 2
ОДНА ЗАМЕНА14. 2Na + Cl2 2 NaCl
СИНТЕЗ15. Ca3 (PO4) 2 + 3 h3SO4 3 CaSO4 + 2 h4PO4
ДВОЙНАЯ ЗАМЕНА16. h4 (PO4) + 3 NaOH Na3PO4 + 3 h3O
ДВОЙНАЯ ЗАМЕНА (НЕЙТРАЛИЗАЦИЯ)17. C3H8 + 5 O2 4 h3O + 3 CO2
СЖИГАНИЕ УГЛЕВОДОРА ИЛИ СГОРАНИЕ18.Zn + CuSO4 ZnSO4 + Cu
ОДНА ЗАМЕНА19. h3SO4 + Zn ZnSO4 + h3
ОДНА ЗАМЕНА20. 3 CaO + 2 Al Al2O3 + 3 Ca
ОДНА ЗАМЕНА21. Cl2 + 2 NaBr 2 NaCl + Br2
Вернуться к началу Реакций. НАЗАД НА ГЛАВНУЮ СТРАНИЦУ
ОДНА ЗАМЕНАКакой тип реакции — Ca OH 2 h3SO4 → CaSO4 2h3O?
Какой тип реакции — Ca OH 2 h3SO4 → CaSO4 2h3O?
реакция нейтрализации
Когда Ca OH 2 реагирует с h3SO4, какие продукты?
h3SO4 + Ca ( OH ) 2 → CaSO4 + 2 h3O — Сбалансированное уравнение | Химические уравнения онлайн!
Какую соль образуют серная кислота и гидроксид кальция?
серная кислота + оксид алюминия → сульфат алюминия + вода В этом типе реакции из кислоты и щелочи образуется соль.Поскольку реагирующая щелочь представляет собой гидроксид кальция, тогда продукт будет солью кальция. Поскольку реагирующая кислота представляет собой соляную кислоту, полученная соль будет хлоридом.
Каково чистое ионное уравнение, когда серная кислота реагирует с гидроксидом кальция?
2H + + (SO4) 2- + Ca2 + + 2OH- ->? 2 протона соединятся с 2 анионами гидроксида с образованием 2 молекул воды.
Реагирует ли оксид кальция с серной кислотой?
Тип химического вещества Реакция : Для этой реакции у нас есть двойная замена реакция .Стратегии балансировки: обязательно подсчитайте все атомы кислорода на стороне реагентов уравнения ( оксид кальция + серная кислота ) и на стороне продукта (вода + сульфат кальция ). В CaO + h3SO4 пять атомов кислорода.
Как еще называют оксид кальция?
Оксид кальция
PubChem CID 14778 Структура Найти похожие структуры Химическая безопасность Лабораторная химическая безопасность (LCSS) Формула 9225 9225 902Синонимы ОКСИД КАЛЬЦИЯ Известь Известь негашеная 1305-78-8 Известь негашеная Подробнее… Безопасен ли оксид кальция?
* Оксид кальция может повлиять на вас при вдыхании. * Контакт может вызвать сильное раздражение и ожог глаз и кожи. * Дыхание Оксид кальция может раздражать легкие, вызывая кашель и / или одышку.
Что произойдет, если вы выпьете гидроксид кальция?
Пищевой гидроксид кальция в целом безопасен. Однако, , если вы работает с гидроксидом кальция промышленного класса , проглатывание может привести к отравлению гидроксидом кальция .Этот может привести к серьезным травмам или смерти. / Продолжительность>
Как влияет известь на организм?
Лайм питьевой вода улучшает пищеварение. Лайм кислый, он помогает слюне расщеплять пищу для лучшего пищеварения. Кроме того, флавоноиды лайма стимулируют секрецию пищеварительных соков. Если вы испытываете запор , кислотность лайма может очистить выделительную систему и стимулировать деятельность кишечника.
Как избавиться от толстого живота?
8 способов избавиться от жира на животе и вести здоровый образ жизни
- Попробуйте сократить потребление углеводов вместо жиров ….
- Думайте о плане питания, а не о диете. …
- Продолжайте движение. …
- Поднимите грузы. …
- Станьте читателем этикеток. …
- Отказаться от полуфабрикатов. …
- Сосредоточьтесь на том, чтобы ваша одежда сидела больше, чем на шкале. …
- Общайтесь с друзьями, которые заботятся о своем здоровье.
Как уменьшить размер живота?
20 эффективных советов, как избавиться от живота жира (подтверждено наукой)
- Ешьте много растворимой клетчатки….
- Избегайте продуктов, содержащих трансжиры. …
- Не употребляйте слишком много алкоголя. …
- Придерживайтесь диеты с высоким содержанием белка. …
- Снизьте уровень стресса.

 Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
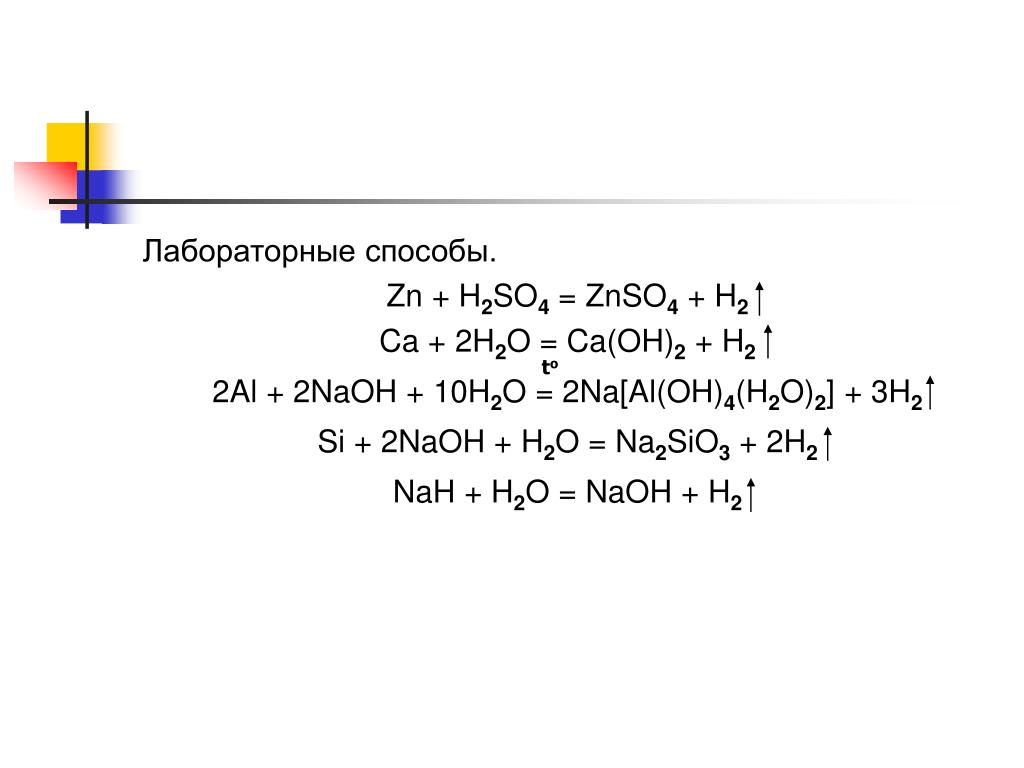
 Мелкие кристаллы этой соли, попадая в облако, служат центрами кристаллизации воды, и вместо крупных градин на землю выпадает мелкая снежная крупа или дождь. Напишите молекулярное, полное ионное и сокращенное ионное уравнения реакции получения иодида серебра взаимодействием двух солей.
Мелкие кристаллы этой соли, попадая в облако, служат центрами кристаллизации воды, и вместо крупных градин на землю выпадает мелкая снежная крупа или дождь. Напишите молекулярное, полное ионное и сокращенное ионное уравнения реакции получения иодида серебра взаимодействием двух солей.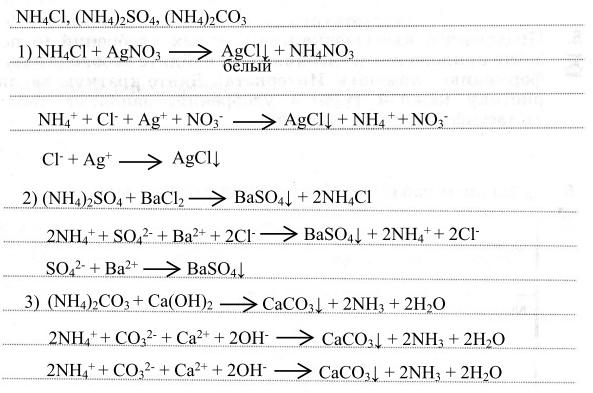
 2 -} (aq) \ rightarrow \ ce {CaSO4} (s) + \ ce {CO2} (g ) + \ ce {h3O} (l) \ hspace {20px} \ ce {(net)} \)
2 -} (aq) \ rightarrow \ ce {CaSO4} (s) + \ ce {CO2} (g ) + \ ce {h3O} (l) \ hspace {20px} \ ce {(net)} \) \ (H_2O (твердое вещество) → H_2O (жидкость) \)
\ (H_2O (твердое вещество) → H_2O (жидкость) \) 2 +} (водн.) \ Rightarrow \ ce {Ca3 (PO4) 2} (s) \)
2 +} (водн.) \ Rightarrow \ ce {Ca3 (PO4) 2} (s) \)
 ) + 2Al 3+ (вод.) + 8OH — (вод.) + 2H + (вод.) + SO 4 2- (вод.) —> 2Al (OH) 3 (т) + 2K + (водн.) + SO 4 2- (водн.) + 2H 2 O (ℓ)
) + 2Al 3+ (вод.) + 8OH — (вод.) + 2H + (вод.) + SO 4 2- (вод.) —> 2Al (OH) 3 (т) + 2K + (водн.) + SO 4 2- (водн.) + 2H 2 O (ℓ)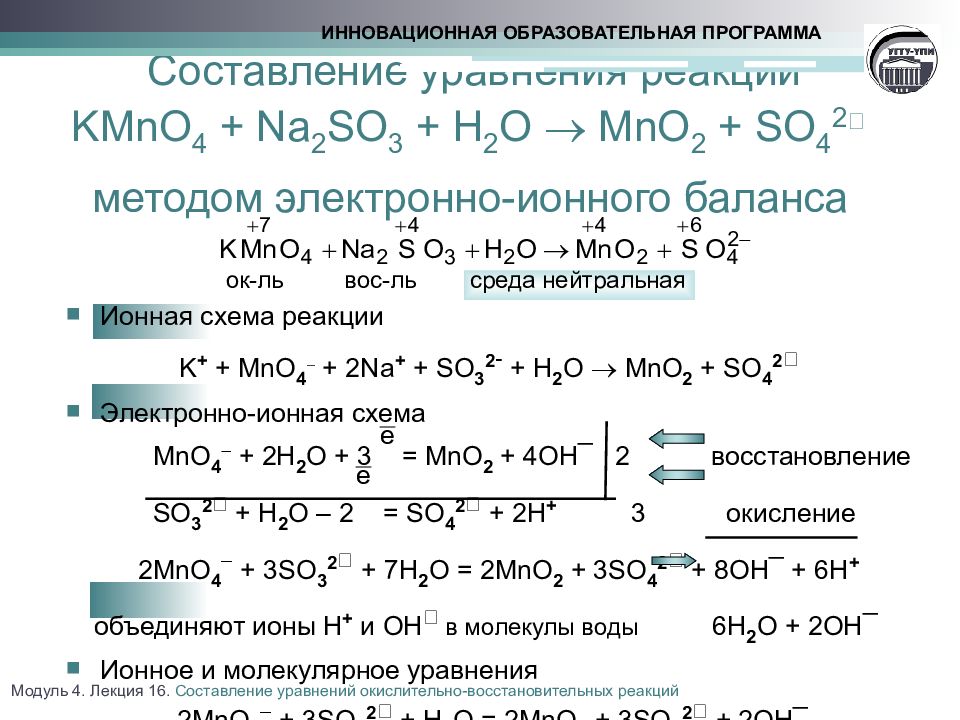 Они отреагируют следующим образом:
Они отреагируют следующим образом: ) + 2Cl — (водн.) + Mg 2+ (водн.) + 2NO 3 — (водн.) —> Mg 2+ (водн.) + 2Cl — (водн.) + Ba 2+ (водн.) + 2НО 3 — (водн.)
) + 2Cl — (водн.) + Mg 2+ (водн.) + 2NO 3 — (водн.) —> Mg 2+ (водн.) + 2Cl — (водн.) + Ba 2+ (водн.) + 2НО 3 — (водн.)
 Ca (OH) 2 растворяется только в небольшой степени, но то, что растворяется, ионизируется на 100%.
Ca (OH) 2 растворяется только в небольшой степени, но то, что растворяется, ионизируется на 100%. ) + 3Cl¯ (водн.) + As (OH) 3 (водн.)
) + 3Cl¯ (водн.) + As (OH) 3 (водн.) ) —> 2AgNO 3 (водн.) + H 2 O () + CO 2 (г)
) —> 2AgNO 3 (водн.) + H 2 O () + CO 2 (г) ) + Mg (OH) 2 (с) —> Mg 2+ (водн.) + 2H 2 O ()
) + Mg (OH) 2 (с) —> Mg 2+ (водн.) + 2H 2 O ()
 ) + 9H 2 O () + 3NH 3 (водн.) —> Cr (OH) 3 (т) + 3NH 4 + (водн.) + 3NO 3 ¯ (водн.) + 9H 2 O (ℓ)
) + 9H 2 O () + 3NH 3 (водн.) —> Cr (OH) 3 (т) + 3NH 4 + (водн.) + 3NO 3 ¯ (водн.) + 9H 2 O (ℓ) ) —> Cr (OH) 3 (s) + 3NH 4 НЕТ 3 (водн.) + 9H 2 O (ℓ)
) —> Cr (OH) 3 (s) + 3NH 4 НЕТ 3 (водн.) + 9H 2 O (ℓ)



 ) + Ba (NO 3 ) 2 (водн.) —> Ba (CH 3 COO) 2 (водн.) + 2NaNO 3 (водн.)
) + Ba (NO 3 ) 2 (водн.) —> Ba (CH 3 COO) 2 (водн.) + 2NaNO 3 (водн.)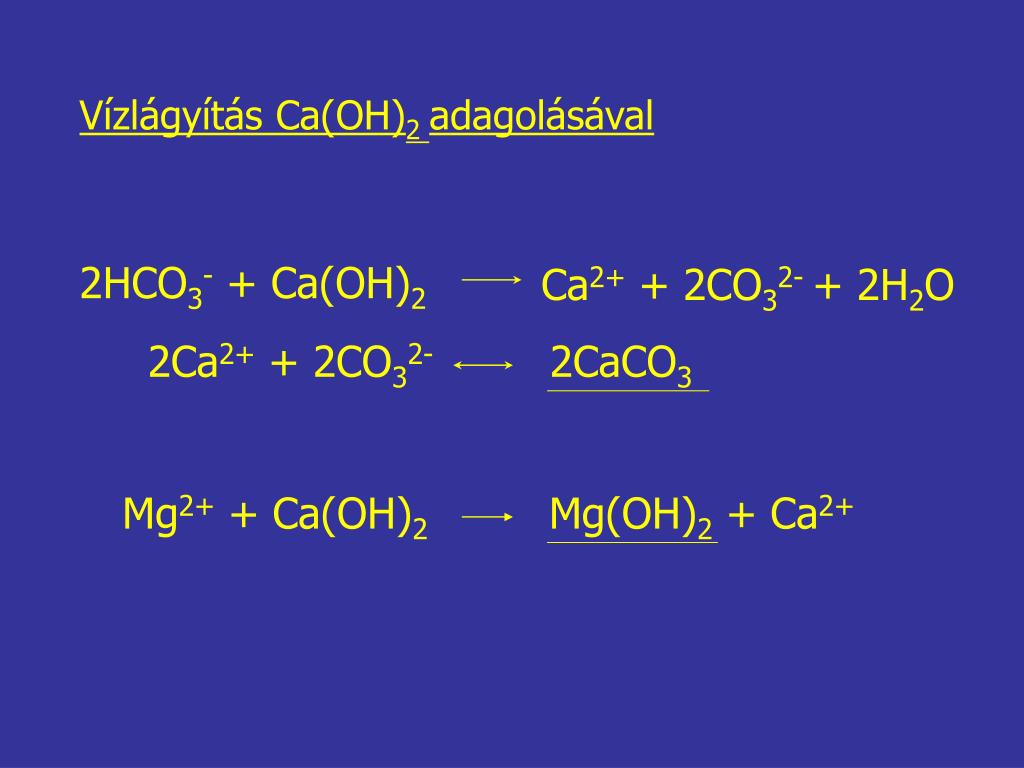 ) + Ba 2+ (водн.) + 2Cl¯ (водн.) Все ионы в приведенном выше полном ионном уравнении будут удалены, поскольку все они являются ионами-наблюдателями. Чистое ионное уравнение будет NR.
) + Ba 2+ (водн.) + 2Cl¯ (водн.) Все ионы в приведенном выше полном ионном уравнении будут удалены, поскольку все они являются ионами-наблюдателями. Чистое ионное уравнение будет NR.
 В конце концов, некоторые йодиды (PbI 2 , AgI) нерастворимы. Оказывается, что (а) MnI 2 растворим и (б) вам, возможно, придется искать его индивидуально, поскольку многие диаграммы растворимости не включают Mn.Вот один из них.
В конце концов, некоторые йодиды (PbI 2 , AgI) нерастворимы. Оказывается, что (а) MnI 2 растворим и (б) вам, возможно, придется искать его индивидуально, поскольку многие диаграммы растворимости не включают Mn.Вот один из них.