Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
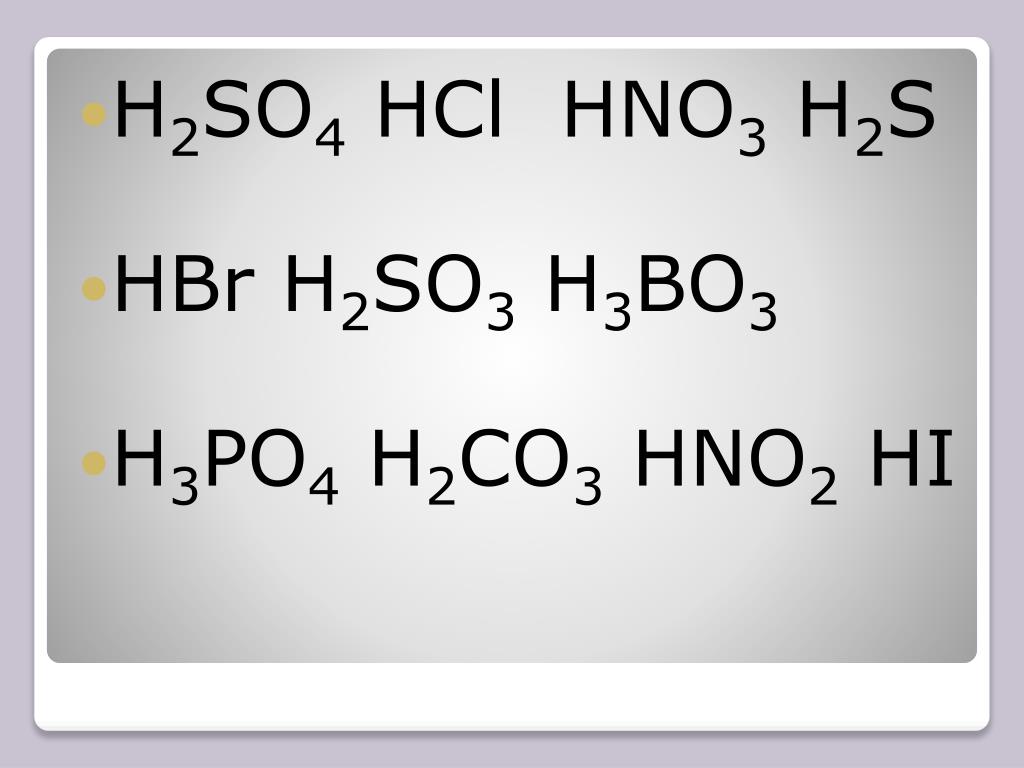
Помогите написать уравнения реакций с помощью которых можно осуществить следующие превращения: SiO2-Si-Ca2Si-Sih5-SiO2-Si; б).
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
В каком году была сформулирована теория — предшественница кислородной теории горения.
Решено
1) решить цепочку N2—>NO—>NO2—>HNO3—>Nh4 2) HNO3—>NO2 3) HNO3—>Ca(NO3)2 4) N2—>Nh4—>(Nh5)2SO—>Nh4—>N2 5) Nh4—>NO
Структурная формула всех изомеров С7Н16
Пользуйтесь нашим приложением
Серная кислота h3SO4, концентрированная, 500 мл для продажи. Покупайте в научной компании.
- Дом
- Химические вещества
- Общие химические вещества
Серная кислота, концентрированная, 16 унций
Цена: 26,95 долларов США
Кол-во: — +
- Описание
- Также в категории
Концентрированная серная кислота (95-97%) очень активна и растворяет большинство металлов. Поэтому он по-разному используется при аффинаже драгоценных металлов. Он не растворяет золото, но отлично растворяет такие металлы, как медь, серебро и железо, поэтому может быть полезен в некоторых типах процессов аффинажа золота. Серная кислота также является популярной кислотой, используемой в процессах гальванопокрытия золота.
Поэтому он по-разному используется при аффинаже драгоценных металлов. Он не растворяет золото, но отлично растворяет такие металлы, как медь, серебро и железо, поэтому может быть полезен в некоторых типах процессов аффинажа золота. Серная кислота также является популярной кислотой, используемой в процессах гальванопокрытия золота.
Серная кислота представляет собой сильно коррозионную густую маслянистую жидкость от бесцветного до темно-коричневого цвета в зависимости от степени чистоты. Смешивается с водой. Это сильный раздражитель тканей.
ОСТОРОЖНО.
Молярность: 18.0M
Удельный вес: 1,84
Концентрированная серная кислота объемом 16 унций поставляется только в пункты назначения в пределах 48 смежных штатов США и Канады с использованием стандарта Доставка через FedEx или UPS • Доставка по воздуху запрещена. • Покупатели в Канаде должны рассчитывать на дополнительные пошлины, налоги и сборы за услуги по таможенному оформлению, подлежащие уплате при доставке.
• Покупатели в Канаде должны рассчитывать на дополнительные пошлины, налоги и сборы за услуги по таможенному оформлению, подлежащие уплате при доставке.
Перманганат калия, 500 г
NC-3304
$34,95
Соляная кислота, концентрированная, 16 унций
NC-0515
24,95 доллара США
Кристаллы нитрата серебра, 10 г
NC-1176
24,95 доллара США
Бромтимоловый синий индикатор pH, 4 унции.
NC-1906
$14,95
ПОЛИТИКА ВОЗВРАТА:
Неоткрытые химические вещества в оригинальной упаковке могут быть возвращены в течение 30 дней с момента отправки при условии предварительного согласования. Звоните 800-372-6726. Клиенты несут ответственность за стоимость доставки.
Звоните 800-372-6726. Клиенты несут ответственность за стоимость доставки.
МЕЖДУНАРОДНЫЕ ДОСТАВКИ:
Химические вещества, за которые взимается плата за опасность, ограничены 48 смежными штатами США. Использование только наземных (запретных для полетов) химикатов ограничено 48 смежными штатами США и Канада.
СЕРТИФИКАТЫ АНАЛИЗА:
Сертификаты анализа химических веществ предоставляются по запросу. Воспользуйтесь нашей страницей запроса по этой ссылке
Серная кислота (h3SO4) – структура, формула, молекулярная масса и применение
Серная кислота или серная кислота представляет собой минеральную кислоту, состоящую из одного атома серы, четырех атомов кислорода и двух атомов водорода. Химическая или молекулярная формула серной кислоты: H 2 SO 4 . Серная кислота является одним из наиболее важных химических веществ, используемых в коммерческих целях. Он также известен как маттлинговая кислота, сульфат водорода или купорос. Серная кислота является очень сильной кислотой и вязкой жидкостью. Это бесцветная, маслянистая жидкость без запаха, едкая по своей природе. Серная кислота является компонентом кислотных дождей, поскольку она растворима в воде.
Серная кислота является очень сильной кислотой и вязкой жидкостью. Это бесцветная, маслянистая жидкость без запаха, едкая по своей природе. Серная кислота является компонентом кислотных дождей, поскольку она растворима в воде.
Серная кислота представляет собой сильнокислотную жидкость. В результате он используется для очистки металлов, извлечения примесей из нефти, производства химических веществ, таких как азотная кислота и соляная кислота, а также производства красителей, лекарств, моющих средств и взрывчатых веществ, среди других процессов. Молярная масса серной кислоты составляет 98,079 г/моль. Плотность Серной кислоты составляет 1,83 г/см 3 . Молекула H 2 SO 4 ковалентна, имеет тетраэдрическую структуру и моноклинную кристаллическую структуру.
Что такое серная кислота?
Серная кислота является высокореактивным химическим веществом. Серная кислота используется во многих отраслях промышленности, таких как автомобильные аккумуляторы на основе свинца, производство различных химикатов, клея и взрывчатых веществ, очистка нефти, отверждение металлов и т.
д. Следовательно, из-за такого широкого применения ее называют « Король химикатов ». Химическая формула серной или серной кислоты: H 2 SO 4 .
Как показано ниже, серная кислота (H 2 SO 4 ) представляет собой ковалентное соединение, состоящее из атома серы, присоединенного к двум атомам кислорода и двум молекулам гидроксила (-ОН).
Свойства серной кислоты (H
2 SO 4 )Физические свойства серной кислоты
- H 2 SO 4 представляет собой вязкую, густую, бесцветную маслянистую жидкость
- Сернистая кислота имеет плотность 1,84 г/мл, температуру кипения 337 °С и температуру плавления 10 °С.
- Концентрированная серная кислота на 98% состоит из воды и является наиболее стабильной формой. Многие другие концентрации с разными названиями доступны для различных целей, например, аккумуляторная кислота с концентрацией 29–32 %, камерная кислота с концентрацией 62–70 % и башенная кислота с концентрацией 78–80 %.

- Имеет удельный вес 1,84 при 298 K.
- Лакмус окрашивается в синий цвет, а значения pH серной кислоты в ммоль/л указаны в таблице ниже,
| Значения pH | 1 мМ | 10 мМ | 100 мМ |
| Серная кислота, ммоль/л | 2,75 | 1,87 | 1,01 |
- сильно разъедает, что делает его опасным для прикосновения.
Химические свойства серной кислоты
- H 2 SO 4 представляет собой сильную кислоту, которая полностью диссоциирует на ионы в своем водном растворе, как,
H 2 SO 4 ⇢ H 2 + + SO 4 -2 900 91
- Серная кислота является хорошим окислителем, так как окисляет другие вещества, отдавая его атомы кислорода в химической реакции.
 Как показано ниже, он окисляет углерод и серу.
Как показано ниже, он окисляет углерод и серу.
2H 2 SO 4 + C ⇢ 2H 2 O + 2SO 2 + CO 2
2H 2 SO 4 + S ⇢ 2H 2 O + 3SO 2
- Серная кислота энергично реагирует с вода в сильно экзотермической реакции (т. е. с выделением тепла).
- Серная кислота является двухосновной кислотой и выделяет два иона водорода на молекулу.
- Серная кислота обладает гигроскопическими свойствами, что означает, что H 2 SO 4 может впитывать влагу из окружающей среды и контролировать ее. Этот эффект делает его хорошим обезвоживающим средством.
- Менее летучий. Вот почему он способствует получению более летучих кислот из их комплементарных солей.
Структура серной кислоты
Два атома кислорода образуют двойные связи с атомом серы, а две гидроксильные группы (ОН) образуют одинарные связи с атомом серы. Из-за своей способности высвобождать два протона это дипротонная кислота. Как показано ниже, молекула имеет тетраэдрическую структуру и является ковалентной.
Из-за своей способности высвобождать два протона это дипротонная кислота. Как показано ниже, молекула имеет тетраэдрическую структуру и является ковалентной.
Получение серной кислоты
Серная кислота обычно готовится и производится следующими двумя широко используемыми методами.
- Контактный процесс
- Свинцовый камерный процесс
Контактный процесс производства серной кислоты
Контактный процесс включает три этапа производства серной кислоты: сжигание сернистых или сульфидных руд в воздух.
С(с) + О 2 (g) → SO 2 (g)
- Реакция диоксида серы с кислородом в присутствии катализатора V 2 O 5 с образованием триоксида серы (SO 3 ) как,
2SO 2 (г) + O 2 (г) → 2SO 3 (г)
- Превращение триоксида серы в серную кислоту,
SO 3 + H 2 SO 4 (олеум) → H 2 S 2 O 7
H 2 S 2 O 7 (л) + H 2 9008 5 O (л) → 2H 2 SO 4 (серная кислота)
Серная кислота, полученная контактным способом, имеет чистоту 96–98%.
Процесс со свинцовой камерой
Одним из самых популярных производственных процессов является метод со свинцовой камерой. Он производит от 50 до 60 кислот класса B. В этой процедуре используется влажный SO 2 в присутствии оксидов азота (динамический импульс). В результате он подвергается окислению кислородом воздуха с образованием триоксида серы. Эта реакция выражается как
2SO 2 + O 2 → 2SO 3
Затем проводят взаимодействие воды и триоксида серы, в результате чего образуется H 2 SO 4 . Эта реакция записывается как
SO 3 + H 2 O → H 2 SO 4
Молекулярная Масса серной кислоты
Серная кислота имеет химическую формулу H 2 SO 4 . Согласно этой формуле одна молекула серной кислоты (H 2 SO 4 ) содержит 2 моля водорода, 1 моль серы и 4 моля атомов кислорода. В результате молекулярная масса H 2 SO 4 будет равна сумме масс двух молей водорода, одного моля серы и четырех молей кислорода. Поскольку атомная масса водорода равна 1 u, атомная масса серы равна 32 u, а атомная масса кислорода равна 16 u, молекулярная масса серной кислоты может быть рассчитана следующим образом:
В результате молекулярная масса H 2 SO 4 будет равна сумме масс двух молей водорода, одного моля серы и четырех молей кислорода. Поскольку атомная масса водорода равна 1 u, атомная масса серы равна 32 u, а атомная масса кислорода равна 16 u, молекулярная масса серной кислоты может быть рассчитана следующим образом:
Молекулярная масса H 2 SO 4 = Масса 2 молей атомов водорода + Масса 1 моля серы + Масса 4 молей атомов кислорода
= 2 × 1 + 32 + 4 × 16
= 2 + 32 + 64
= 98 ед.
Таким образом, молекулярная масса серной кислоты равна 98 ед., а молекулярная масса серной кислоты равна 98 г/моль.
Реакции серной кислоты
- Диссоциация- При варке чистой безводной серной кислоты образуются триоксид серы и вода. 9S серная кислота- Это обычная двухосновная кислота, которая при воздействии на нее окрашивает синий лакмус в малиновый цвет.
Делится на две группы солей.
NaOH + H 2 SO 4 → NaHSO 4 + H 2 O
2NaOH + H 2 SO 4 → Na 2 SO 4 + 2H 2 O
- Сульфирующее действие серной кислоты- Концентрированная серная кислота соединяется с различными органическими молекулами, такими как бензол, толуол и другие, с образованием, например, сульфокислоты.
C 6 H 6 + H 2 SO 4 → C 6 H 5 SO 9008 4 3 H + H 2 O
- Реакции осаждения с серой Кислота- Образует нерастворимые сульфаты, которые осаждаются, например, при взаимодействии с водными растворами бария, свинца и других солей.
H 2 SO 4 + BaCl 2 → BaSO 4 ↓ + 2HCl
- Реакция с триоксидом серы- Олеум, широко известный как дымящаяся серная кислота, образуется при его растворении.
триоксид серы.
H 2 SO 4 + SO 3 → H 2 S 2 O 7
Использование серной кислоты
Серная кислота известна как один из наиболее важных реагентов и имеет несколько промышленных применений. Вот несколько примеров:
- Таким способом производятся такие удобрения, как сульфат аммония, суперфосфат извести и другие.
- В производстве красок, взрывчатых веществ и фармацевтических препаратов.
- H 2 SO 4 используется в производстве кислот, таких как HCl и HNO 3 .
- Например, в производстве пигментов, красок и полимеров.
- Например, в бумажной и текстильной промышленности.
- Нитроцеллюлоза используется в производстве товаров.
- Применение в металлургии (пример: очистка металлов перед эмалированием, гальванопокрытием и цинкованием).
- В кожевенном бизнесе.

- В отсеках для хранения.
- В нефтегазовом секторе.
- В бизнесе моющих средств.
- Работает как осушитель.
- В качестве реагента в лаборатории.
Часто задаваемые вопросы о серной кислоте
Вопрос 1: Каково применение серной кислоты?
Ответ:
Удобрения, красители, взрывчатые вещества и фармацевтические препараты производятся с использованием серной кислоты. Он также используется для получения таких кислот, как HCl и HNO3. Он часто используется в металлургической промышленности (пример: очистка металлов перед эмалированием, гальванопокрытием и цинкованием).
Вопрос 2: Почему серную кислоту называют королем химических веществ?
Ответ:
Серная кислота, которую иногда называют «королем химических веществ», является одним из наиболее важных веществ. Оно также известно как купоросное масло, так как когда-то его делали из зеленого купороса.
Он очень агрессивен и более реактивен, чем другие кислоты. В результате он имеет широкий спектр применения, включая использование в лабораториях, батареях, моющих средствах и производстве многочисленных лекарств.
Вопрос 3: Что произойдет при взаимодействии серной кислоты с водными растворами солей бария?
Ответ:
Образует нерастворимые сульфаты, которые осаждаются при взаимодействии с водными растворами солей бария. Вопрос 4: Что произойдет, когда серная кислота прореагирует с триоксидом серы?
Ответ:
Серная кислота растворяет триоксид серы с образованием олеума, часто известного как дымящаяся серная кислота.
H 2 SO 4 + SO 3 → H 2 S 2 O 7
Вопрос 5: Какова структура серной кислоты?
Ответ:
В серной кислоте два атома водорода прочно связаны с двумя атомами кислорода, в результате чего образуются две группы ОН.

 02.17
02.17 д. Следовательно, из-за такого широкого применения ее называют « Король химикатов ». Химическая формула серной или серной кислоты: H 2 SO 4 .
д. Следовательно, из-за такого широкого применения ее называют « Король химикатов ». Химическая формула серной или серной кислоты: H 2 SO 4 .
 Как показано ниже, он окисляет углерод и серу.
Как показано ниже, он окисляет углерод и серу.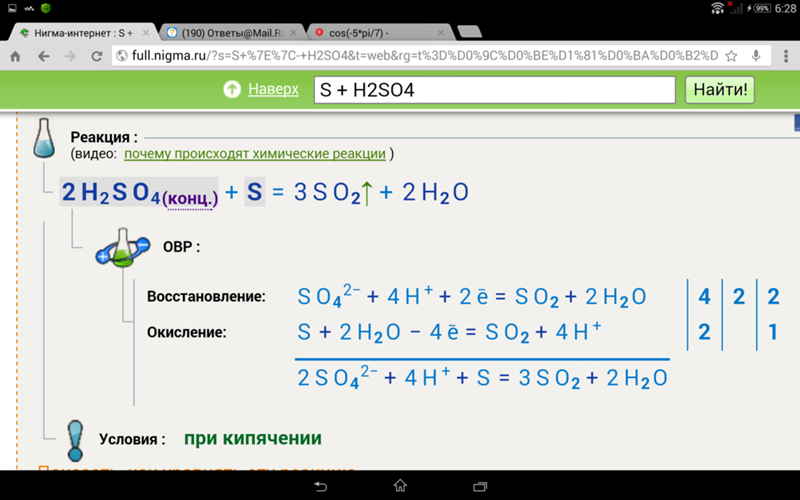
 Делится на две группы солей.
Делится на две группы солей. триоксид серы.
триоксид серы.