| |||||||||||
По мнению автора лучший ответ отсутствует.
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
аналитическая химия какое количество бария нужно взять,чтобы при его взаимодействии с 1 л воды образовался 2% раствор гидроксида бария
Решено
При соединении 2 1г железа…
сколько мл концентрированной соляной кислоты(p=1,19г/мл),содержащей. ..
..
Здійснити перетворення(8 клас)
Гидролиз NA3PO4
Пользуйтесь нашим приложением
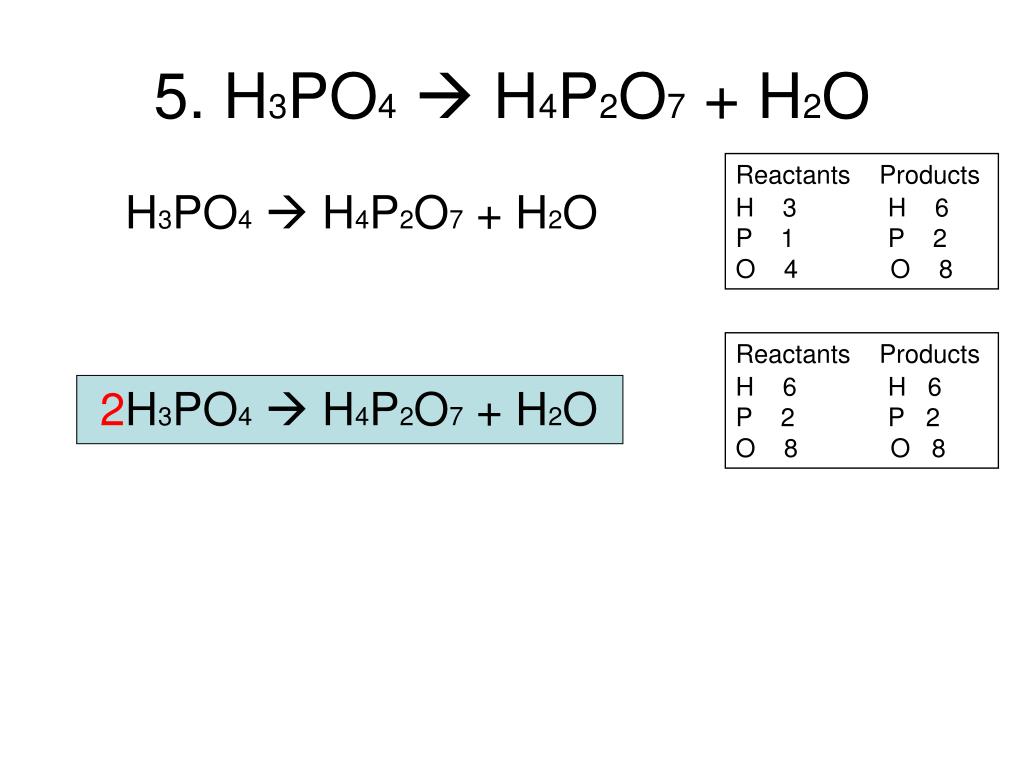
P → P2O5 → h4PO4 → Ag3PO4 ОВр и ионное уравнение.Помо… -reshimne.ru
Новые вопросы
Ответы
1)4P+5O2=2P2O5
2)h3+P2O5=h4PO4
3)2h4PO4+6Ag=2Ag3PO4+3h3
Похожие вопросы
В молекуле ацетилена каждый атом углерода образует…
Почему в названии альдегидов по систематической номенклатуре не указывается положение карбонильного атома углерода?…В молекуле пропина???…
При взаимодействии 1 моль какого металла с избытком разбавленной серной кислоты выделится наибольшее количество водорода? A)Na B)Ca C)Al D) Fe E)Zn. ..
..
Найти относительную массу
1. ( 2Cu 2O)
2. Na2S
3. Cr2O3…
ПОМОГИТЕ СРОЧНОООО!!!!
по уравнению h3+CI2=2HCI определи сколько граммов хлора необходимо для взаимодействия с 2 граммами водорода и найди массу образовавшегося хлороводорода….
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
ПравоФранцузский язык
Немецкий язык
МХК
ОБЖ
Психология
Что означает h4PO4? Бесплатный словарь
Затем в почву внесли 2,0 г [кг-1] известняка (RNV 75%), чтобы поднять рН почвы до 6,0; 100 мг [кг-1] P2O5 (источник: h4PO4) и 50 мг [кг-1] N (источник: мочевина), согласно CQFS (2004).
Физиологическая характеристика подвоев виноградной лозы, выращенных в почве с возрастающими дозами цинка/Caracterizacao fisiologica de porta-enxertos de videira cultivados em solo com Doses Crescentes de Zinco
Во-вторых, неорганический фосфат в любой жидкости, такой как слюна или жидкость зубного налета, присутствует в 4 различных формы, а именно h4PO4, h3PO4-, HPO42- и PO43-, и пропорции полностью зависят от pH.
Реминерализация: подход к сохранению зуба
Когда h4PO4 использовали в концентрации 35% в течение 3 минут, он продемонстрировал лучшую прочность сцепления со штифтами на основе эпоксидной смолы без изменений поверхности штифта при исследовании СЭМ. Albashaireh et al.
Эффект различных видов обработки поверхности сборных волокнистых штифтов: обзор литературы
Реактив Грисса состоит из равных объемов 0,1% дигидрохлорида нафтилэтилендиамина в дистиллированной воде и 1% сульфаниламида в 5% H4PO4. Эти два компонента смешивали за 12 часов до использования и хранили в холодном месте.
Эти два компонента смешивали за 12 часов до использования и хранили в холодном месте.
Оксид азота как потенциальный биомаркер воспалительного заболевания кишечника ], saturadas com uma solucao contendo 5% (v/v) h4PO4 и 4% (v/v) глицерина.
Выщелачивание и улетучивание азота в почве Sandy Typic Hapludalf, возделываемой виноградной лозой, подвергнутой азотным удобрениям0003
Удаление метиленового синего с помощью углерода, полученного из косточек персика, с помощью периодического и колоночного исследования активации h4PO4.
Получение активированного угля из угля термохимическими методами и его применение на промышленных стоках для снижения ХПК рениевых нитей с силикагелем (Gerstenberger and Haase 1997).
Точный возраст и петрология силурийско-девонских плутонов в реке Бенджамин — район Чарло, северный Нью-Брансуик
Анилин (AN), пероксидисульфат аммония (APS), соляная кислота (HC1), фосфорная кислота (h4PO4), азотная кислота ( HNO3) и серная кислота (h3S04j были приобретены у Industry of Fine Chemicals, Лайян, Китай.
Синтез полианилинового нановолокна и антикоррозионные свойства полианилин-эпоксидного композитного покрытия для стали Q235
Микро- или нанопористые поверхности также могут производиться потенциостатическим или гальваностатическим анодированием титана в сильных кислотах (h3SO4, h4PO4, HNO3, HF) при высокой плотности тока (200 А/м2) или потенциала (100 В)9.0003
Поверхностные характеристики титановых дентальных имплантатов для быстрой остеоинтеграции
К 0,1 мл раствора меда (50 % вес./об.) добавляли 5 мл реагента Кумасси бриллиантового синего (200 мг Кумасси бриллиантового синего G-250, растворенных в 100 мл 95% этанола и 200 мл 85% фосфорной кислоты (h4PO4), полученный раствор разбавляли до конечного объема 2 л).
Взаимосвязь между антиоксидантной и антимикробной активностью некоторых видов румынского монофлорного меда с химическим составом, цветом и содержанием полифенолов
h4PO4 Структура Льюиса, молекулярная геометрия, гибридизация и полярность
Фосфат водорода, h4PO4 является важным химическим соединением. Фосфорная кислота, также известная как ортофосфорная кислота, представляет собой слабую кислоту без цвета и запаха с 85% водным раствором. Он также доступен в прозрачном твердом состоянии с плотностью 1,834 г/куб.см.
Фосфорная кислота, также известная как ортофосфорная кислота, представляет собой слабую кислоту без цвета и запаха с 85% водным раствором. Он также доступен в прозрачном твердом состоянии с плотностью 1,834 г/куб.см.
Фосфорная кислота широко используется в повседневной жизни. Он находит применение в стоматологии при пломбировании и придании шероховатости поверхности зубов. Помимо этого, он имеет широкий спектр применения в мире удобрений.
Он также используется в антикоррозионной обработке, микрообработке, производстве дезинфицирующих средств и полупроводниковых соединений.
Опасность для здоровья включает сильное раздражение кожи и повреждение глаз.
Структура Льюиса h4PO4
Чтобы изучить природу связи внутри любой химической молекулы, первым и главным шагом является получение общего представления о ее структуре.
Структурная диаграмма Льюиса дает нам простое представление любого заданного молекулярного состава с помощью методологии электронных точек.
На приведенной выше диаграмме показана структура Льюиса обычной молекулы NO или оксида азота.
Здесь, как мы видим, у нас есть двухмерный схематический эскиз, который может помочь нам понять электронное устройство в недетализированной, но четкой манере.
Мы использовали точечные обозначения для обозначения валентных электронов и неподеленных пар, окружающих составляющие атомы. Мы использовали символы атомов и прямые линии для обозначения типа образованной связи.
Давайте посмотрим, как мы можем найти наиболее совершенный эскиз структуры Льюиса для h4PO4:
Этапы рисования структуры Льюиса для h4PO4
Шаг 1 : Узнайте общее число валентных электронов.
Одна молекула гидрофосфата содержит три атома водорода, один атом фосфора и четыре атома кислорода.
P принадлежит к 5 группе периодической таблицы, поэтому имеет 5 валентных электронов. O принадлежит к группе халькогенов или группе 6, следовательно, имеет 6 валентных электронов.
Атом водорода имеет только атомный номер 1, следовательно, валентность. Общее число валентных электронов в h4PO4
= 1*3 + 5 + 6*4 = 32.
Шаг 2: Определите центральный атом.
Вышеупомянутая таблица дает нам значения электроотрицательности всех основных элементов группы в периодической таблице.
При образовании любой молекулы, как правило, наименее электроотрицательный элемент занимает центральное положение, за некоторыми исключениями.
Вероятно, это связано с тем, что электроположительные элементы с большей вероятностью способствуют обмену электронами и образованию связей, помогающих поддерживать стабильность.
Здесь у нас есть P как наименее электроотрицательный элемент, и он станет центральным атомом. Поскольку у нас есть трехатомная молекула, мы расположили атомы следующим образом:
Шаг 3: Нарисуйте молекулярную структуру с помощью электронных точек.
Теперь мы окружили молекулярные атомы с помощью точечных обозначений.
Шаг 4: Проверьте правило октетов.
Элементы основных групп периодической таблицы имеют тенденцию достигать конфигурации октетов в своих самых внешних оболочках, т. е. они имеют тенденцию следовать конфигурациям валентных оболочек благородных газов того же периода.
Например, для Углерод имеет тенденцию достигать конфигурации октета неона (атомный номер: 10).
Итак, давайте теперь проверим валентные оболочки вокруг атомов в структуре Льюиса.
Как мы можем ясно видеть, все атомы достигли выполнения октетов, таких как P и O, каждый из атомов имеет восемь электронов.
Однако водород имеет только два электрона, окружающих его, но он также достиг конфигурации благородного газа
(в данном случае это гелий, атомный номер: 2).
Этап 5: Тип формирования облигаций.
После выполнения октета проверим тип образования связи внутри молекулы гидрофосфата.
Поскольку между каждой парой атомов находятся два электрона, мы будем придерживаться одинарной связи.
Шаг 6: Проверка официального платежа.
Мы не можем проверить, получили ли мы наиболее подходящую конфигурацию структуры Льюиса, пока мы не проверим формальные значения заряда.
Заряд связанному атому приписывается в предположении, что он поровну распределяется между всеми связанными атомами внутри данной молекулы. Это называется формальным обвинением.
Формальный сбор P = 5 – 0,5*8 – 0 = +1.
Формальный заряд O вверху = 6 – 0,5*2 – 6 = -1.
Формальный заряд каждого из остальных атомов O = 6 – 0,5*4 – 4 = 0,
Формальный заряд каждого атома H = 1 – 0,5*2 – 0 = 0,
Поскольку формальный заряд P равен +1 , мы можем внести некоторые изменения, чтобы сделать его менее ценным.
Исключение из правила октета
В структуре Льюиса мы сместим верхние электроны от атома O вверху к атому P, чтобы образовать двойные связи.
Это приведет к тому, что P будет иметь число валентных электронов, равное 10, что является исключением из правила октетов.
Формальный заряд O наверху теперь равен 0. Формальный заряд P = 0.
Наиболее подходящая структура Льюиса для h4PO4:
h4PO4 Молекулярная геометрия
Электроны представляют собой частицы с одинаковым зарядом, образующие отрицательно заряженное облако, окружающее атомные ядра внутри многоатомной молекулы.
Это вызывает отталкивание, которое необходимо свести к минимуму для стабильности и равновесия. Это известно как теория VSEPR или теория отталкивания электронов валентной оболочки.
Теперь для h4PO4 нам нужно узнать количество областей электронной плотности, окружающих центральный атом молекулы.
Здесь центральным атомом является фосфор.
Если мы посмотрим на структуру Льюиса, то обнаружим, что вокруг P есть четыре области электронной плотности: три области OH и одна область O.
На P нет неподеленной пары.
Итак, согласно теории ВСЕПР, мы получаем тетраэдрическое расположение.
Гибридизация
Гибридизация орбит: краткое введение
Орбиталь можно определить как математическую вероятность присутствия электронов в любом данном региональном пространстве.
У нас есть несколько атомных орбиталей (АО) разных форм и уровней энергии, таких как s, p, d, f.
Когда АО объединяются и сливаются с образованием гибридных орбиталей, таких как sp, sp2, sp3d и т. д., этот процесс известен как орбитальная гибридизация. Это важная концепция химической связи.
Гибридизация h4PO4
Теперь давайте посмотрим на молекулу и поймем концепцию сигма- и пи-связей. Одинарная связь состоит из одной сигма-связи, то есть сигма-пары.
Однако двойная связь состоит из одной сигма- и одной пи-пары. Пи-пара не принимает участия в процессе гибридизации.
Давайте посмотрим на сигмы в h4PO4.
Центральный атом P связан одинарной связью с тремя атомами O (образуя связи O-H или гидроксильные связи) и дважды связан с одним атомом O.
Итак, три одинарные связи и одна двойная связь состоят из четырех сигм.
Гибридизация молекулы h4PO4 – sp3.
Полярность
Что вы подразумеваете под полярностью?
При расчете формального заряда мы предполагаем, что электроны распределяются между связывающими атомами в равных пропорциях, но в действительности это происходит не во всех случаях.
Если мы рассмотрим молекулу, подобную h3 или Cl2, поскольку обе молекулы подобны и имеют одинаковые значения электроотрицательности, мы можем сказать, что электронные пары здесь распределены поровну.
Но если мы рассмотрим HCl, поскольку H и Cl имеют разные значения электроотрицательности, то будет наличие частичных зарядов.
Атом с меньшим значением электроотрицательности будет иметь частичный положительный заряд (δ+), а более электроотрицательный атом будет иметь частичный отрицательный заряд (δ-).
Это известно как полярность. HCl является полярной молекулой, тогда как Cl2 и h3 неполярны.
Полярность h4PO4
Давайте посмотрим на диаграмму Полинга Электроотрицательность:
Значение электроотрицательности P: 2,19
Значение электроотрицательности O: 3,44
Значение электроотрицательности H: 2,20
h4PO4 представляет собой асимметричную тетраэдрическую молекулу с разными значениями электроотрицательности, следовательно, она полярна.

 12.13
12.13