Методом электронного баланса подберите коэффициенты в схе… -reshimne.ru
Новые вопросы
Ответы
Na2SO3 + KIO3 + h3SO4 → I2 + Na2SO4 + K2SO4 + h3O
S(+4) -2e=S(+6)|10|5 восстановитель
2I(+5)+10e=I2(0)|2|1 окислитель
5Na2SO3 +2KIO3 + h3SO4 → I2 +5Na2SO4 + K2SO4 + h3O
Похожие вопросы
Составьте формулы: оксида цинка; хлорида алюминия; гидроксида кальция….
Определить вид химической связи, тип кристаллической решётки и степень окисления h3O, HCL, h3SO4 ,CaO
…
К 170 г 42%-ного раствора соли добавили 40 мл воды.какой стала процентная концентрация раствора?…
Срочно надо на завтра!!! 2 задание. …
…
Укажите оксид
1. h4P
2 MgO
3KOH
4 Al2S3…
C5h6 изомеры и их названия по номенклатуре…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
ПравоФранцузский язык
Немецкий язык
МХК
ОБЖ
Психология
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/ElMEic2MJ-U» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Сбалансируйте следующие реакции: $ SbC{{l}_{3}}+KI{{O}_{3}}+HCl\to SbC{{l}_{5}}+ICl+{{H}_{ 2}}O+KCl $ (A) $ 2SbC{{l}_{3}}+KI{{O}_{3}}+6HCl\к 2SbC{{l}_{5}}+ICl+3 {{H}_{2}}O+KCl $ (B) $ SbC{{l}_{3}}+KI{{O}_{3}}+4HCl\к 2SbC{{l}_{5 }}+ICl+3{{H}_{2}}O+KCl $ (C) $ 2SbC{{l}_{3}}+KI{{O}_{3}}+4HCl\к 2SbC{ {l}_{5}}+5ICl+2{{H}_{2}}O+KCl $ (D) Ничего из вышеперечисленного.
Дата последнего обновления: 01 января 2023 г.
•
Всего просмотров: 211,2 тыс.
•
Просмотров сегодня: 21,10 тыс.
Ответ
Проверено
211,2 тыс.+ просмотров
Подсказка: Выполните четыре простых шага, чтобы сбалансировать химическое уравнение — мы пишем несбалансированное уравнение, чтобы показать реагенты и продукты, а затем запишем количество атомов каждого элемента, которые есть с каждой стороны стрелки реакции. Мы добавляем коэффициенты (числа перед формулами), чтобы количество атомов каждого элемента было одинаковым в обеих частях уравнения. Легче всего сбалансировать атомы водорода и кислорода в последнюю очередь.
Мы добавляем коэффициенты (числа перед формулами), чтобы количество атомов каждого элемента было одинаковым в обеих частях уравнения. Легче всего сбалансировать атомы водорода и кислорода в последнюю очередь.
Полное пошаговое решение:
Когда атомы приобретают или теряют электроны, образуя ионы, или объединяются с другими атомами, образуя молекулы, их символы изменяются или комбинируются для создания химических формул, которые должным образом представляют эти виды. Расширение этого символизма для представления как идентичности, так и относительных количеств веществ, претерпевающих химические (или физические) изменения, требует написания и балансировки химического уравнения.
Мы делаем четыре простых шага, чтобы сбалансировать химическое уравнение:
Записываем неуравновешенное уравнение. Реагенты всегда идут слева от стрелки. Их разделяет знак плюс. Далее идет стрелка, указывающая направление реакции (реагенты переходят в продукты). Товары всегда находятся справа от стрелки. Порядок, в котором записаны реагенты и продукты, не имеет значения.
Порядок, в котором записаны реагенты и продукты, не имеет значения.
Уравнение, данное нам в вопросе:
$ SbC{{l}_{3}}+KI{{O}_{3}}+HCl\to SbC{{l}_{5}}+ICl+ {{H}_{2}}O+KCl $ .
Запишем, сколько атомов каждого элемента находится по обе стороны от стрелки реакции. Для этого нужно иметь в виду, что нижний индекс указывает на количество атомов. Например, $C{{l}_{2}}$ имеет 2 атома хлора. Когда нет нижнего индекса, это означает, что есть 1 атом. Уравнение не сбалансировано, если количество атомов на каждой стороне не одинаково!
На следующем шаге мы добавляем коэффициенты для уравновешивания массы в химическом уравнении. При балансировке уравнений мы никогда не меняем нижние индексы. Коэффициенты — это множители целых чисел. Если, например, мы напишем $ 2{{H}_{2}}O $ , это означает, что у нас в 2 раза больше атомов в каждой молекуле воды, то есть 4 атома водорода и 2 атома кислорода. Существует стратегия, которая поможет нам быстрее сбалансировать уравнения. Это называется балансировкой путем осмотра.
По сути, мы смотрим, сколько атомов у нас есть в каждой части уравнения, и добавляем коэффициенты к молекулам, чтобы сбалансировать количество атомов.
Баланс атомов, присутствующих в одной молекуле реагента и продукта в первую очередь.
Степень окисления $Sb$ изменяется с 3 на 5. Изменение степени окисления $Sb$ равно 2.
Степень окисления $I$ изменяется с 5 на 1. Изменение степени окисления $I $ равно 4.
Увеличение степени окисления уравновешивается уменьшением степени окисления путем умножения.
$ 2SbC{{l}_{3}}+KI{{O}_{3}}+6HCl\к 2SbC{{l}_{5}}+ICl+{{H}_{2}}O+ KCl$.
Балансируйте любые атомы кислорода или водорода в последнюю очередь.
Атомы O уравновешиваются добавлением 2 молекул воды со стороны продукта.
$ 2SbC{{l}_{3}}+KI{{O}_{3}}+6HCl\к 2SbC{{l}_{5}}+ICl+2{{H}_{2}} O+KCl $
Атомы водорода сбалансированы.
Таким образом, сбалансированное уравнение: $ 2SbC{{l}_{3}}+KI{{O}_{3}}+6HCl\to 2SbC{{l}_{5}}+ICl+2{{ H}_{2}}O+KCl $ .
Следовательно, вариант А является правильным ответом.
Примечание:
Закон сохранения массы утверждает, что масса не создается и не разрушается в результате химической реакции. Нам нужно добавить коэффициенты перед химическими формулами, чтобы настроить количество атомов, чтобы они были одинаковыми с обеих сторон.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Фосфин получают из следующей руды А Кальций класс 12 химия JEE_Main
Актуальные сомнения
Определить количество витамина С в персике
Подходящий метод определения витамина С (аскорбиновой кислоты,
С 6 H 8 O 6 ) представляет собой титрование йодатом калия
(КИО 3 ). В этой реакции йодат калия используется в качестве титранта и при добавлении
к раствору аскорбиновой кислоты, который содержит сильную кислоту и йодид калия (KI),
йодат калия реагирует с йодидом калия с выделением молекулярного йода (I 2 )
как показано в реакции ниже:
В этой реакции йодат калия используется в качестве титранта и при добавлении
к раствору аскорбиновой кислоты, который содержит сильную кислоту и йодид калия (KI),
йодат калия реагирует с йодидом калия с выделением молекулярного йода (I 2 )
как показано в реакции ниже:
[1] KIO 3 + 5KI + 6H + → 3И 2 + 6К + + 3Н 2 О
При титровании, пока раствор содержит аскорбиновую кислоту, I 2 полученный в уравнении 1, расходуется в быстрой реакции с аскорбиновой кислотой (уравнение 2),
во время которого дегидроаскорбиновая кислота (C
[2] С 6 H 8 O 6 + I 2 → C 6 H 6 O 6 + 2I — + 2H +
Как только вся аскорбиновая кислота будет израсходована, любой избыток йода (I 2 ) останется. в растворе. Этот избыток йода вступает в реакцию с крахмалом, образуя 90–160 интенсивно синего цвета.
комплекс , указывающий, что конечная точка достигнута.
в растворе. Этот избыток йода вступает в реакцию с крахмалом, образуя 90–160 интенсивно синего цвета.
комплекс , указывающий, что конечная точка достигнута.
Экспериментальная установка схематически показана справа.
Виртуальный склад лаборатории содержит следующие решения:
- Твердый йодат калия — (KIO 3 ). Вам нужно будет создайте исходный раствор, чтобы выполнить титрование. (Примечание: молярная масса йодата калия составляет 214,001 г/моль.)
- Раствор йодида калия — Предоставляется в виде концентрированного раствора KI в воды. Поскольку вам необходимо использовать избыточный KI, количество не должно быть точно измерил. Используйте 5 мл раствора KI для каждого титрования.
- 2M HCl — добавление кислоты необходимо для обеспечения кислотных условий
требуется при йодометрическом титровании (см.
 уравнение 1). Используйте 4 мл раствора HCl в
каждое титрование.
уравнение 1). Используйте 4 мл раствора HCl в
каждое титрование. - Раствор крахмала — вступает в реакцию с водным раствором йода с образованием интенсивного синего цвета. цвет, указывающий, что конечная точка достигнута. Используйте 3 мл раствора крахмала в каждое титрование
- Раствор аскорбиновой кислоты, 0,01136 М — Эта концентрация была выбрана, поскольку она дает вам 10 мг аскорбиновой кислоты в каждых 5,00 мл раствора (вы можете сделать расчет чтобы подтвердить это). Вы можете использовать это решение для тренировки расчетов титрования.
- Персиковый раствор — Каждые 10 мл раствора равны 1 среднему персику (100 г).
Используя вышеуказанные материалы, проведите эксперимент по титрованию, чтобы определить концентрацию
абсорбентной кислоты на один средний персик (10мл раствора).

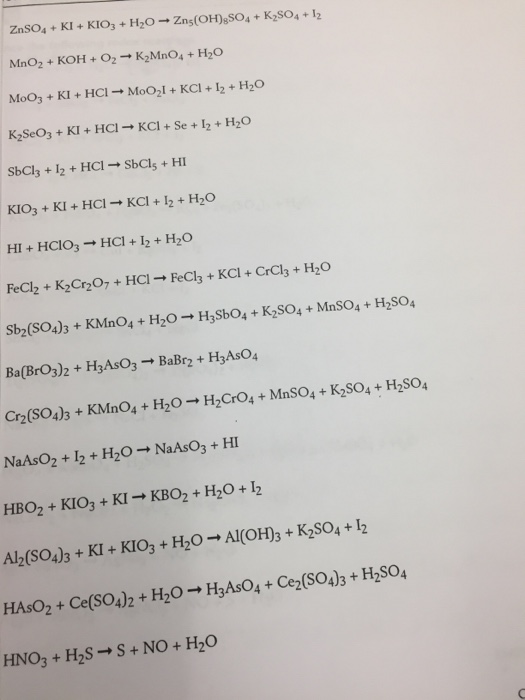 уравнение 1). Используйте 4 мл раствора HCl в
каждое титрование.
уравнение 1). Используйте 4 мл раствора HCl в
каждое титрование.