что, как сбалансировать и часто задаваемые вопросы
Соляная кислота (HCl) является сильной кислотой и перманганатом калия (KMnO4) представляет собой кристаллическую соль. Давайте обсудим некоторые интересные факты о HCl и KMnO.4 реакции.
Соляную кислоту также называют соляной кислотой. Будучи сильной кислотой, он растворяется в воде и диссоциирует на H+ и Cl— ионов соответственно. Он появляется в жидкой форме и имеет молярную массу 36.458 г/моль. КМnО4 также известен как перманганат калия. Он растворяется в воде и диссоциирует на K+ и MnO4– ионов.
В этой статье мы сосредоточимся на различных аспектах «HCl + KMnO4реакция, как продукт, тип реакции, уравновешивание реакции и т.д.
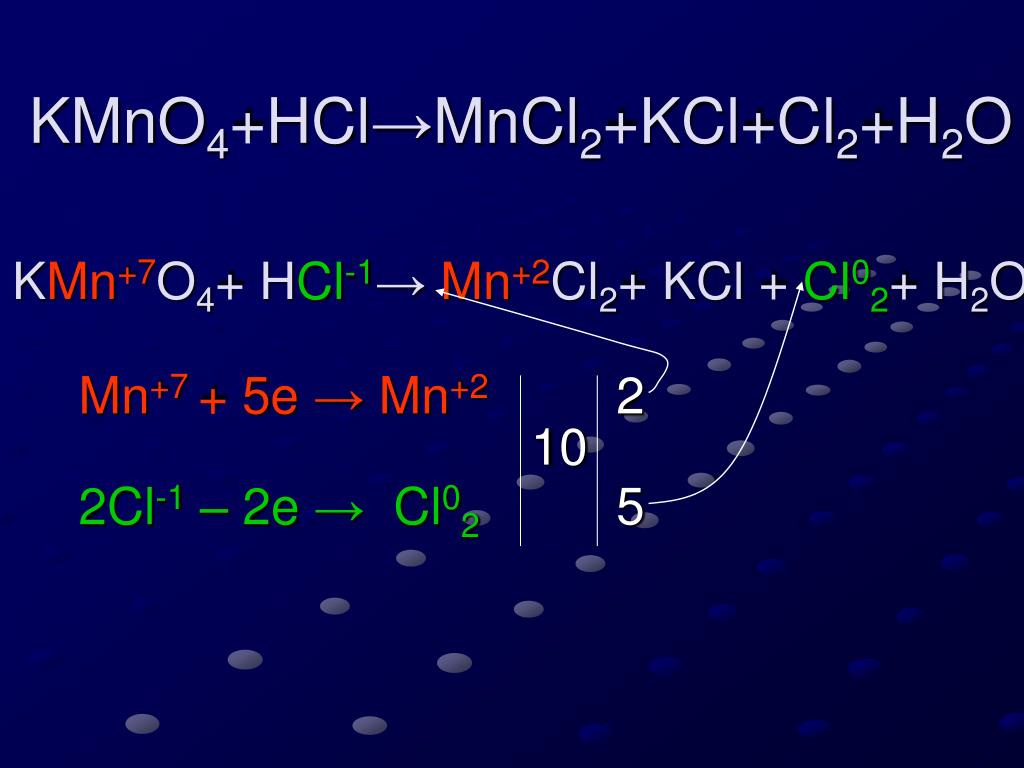
Что является продуктом HCl и KMnO4?Соляная кислота (HCl) реагирует с перманганатом калия (KMnO4) для производства хлорида калия (KCl), хлорида марганца (MnCl2), хлор (Cl2) и вода ( H2О) как побочный продукт.
2КМно4 + 16НСl → 2KCl + 2MnCl2 + 8H2О + 5Cl2
Какой тип реакции HCl + KMnO4?HCl + KMnO4 — это окислительно-восстановительная реакция. Поскольку в этой реакции KMnO4 есть окислитель, который окисляет HCl до Cl2 путем восстановления до MnCl2. Степень окисления Mn снижается с +7 до +2.
Как сбалансировать HCl + KMnO4?Чтобы сбалансировать уравнение, выполните следующие действия:
Шаг 1: Определите атомы
Сначала определите атомы, участвующие в реакции. В данном случае это атомы K, Mn, O, H и Cl.
Шаг 2: Найдите коэффициент атомов
Коэффициенты атомов или соединений, участвующих в реакции, должны быть найдены и изменены, чтобы сбалансировать уравнение.
Шаг 3: Сбалансируйте реакцию
Чтобы получить сбалансированное уравнение, коэффициенты атомов или соединений должны быть одинаковыми по обе стороны реакции.
После выполнения вышеупомянутых шагов окончательная реакция выглядит следующим образом.
2КМно4 + 16НСl → 2KCl + 2MnCl2 + 8H2О + 5Cl2
HCl + KMnO4 титрованиеHCl и KMnO4 нельзя титровать вместе, так как HCl будет реагировать с KMnO4 производить Cl2. Далее, Кл2 будет вмешиваться в титрование.
HCl + KMnO4 чистое ионное уравнениеОбщая реакция делится на ионные реакции, где реагенты показаны в виде соответствующих ионов. Далее все ионные реакции уравновешиваются. Это можно объяснить следующей реакцией.
HCl, будучи кислотой, имеет сопряженный база. Но КМnО4 будучи окислителем, не имеет сопряженной пары.
Сопряженная параHCl и KMnO4 межмолекулярные силы- Межмолекулярные силы, существующие между двумя молекулами HCl, равны Лондонские дисперсионные силы и диполь-дипольные взаимодействия.
- В КМнО4, межмолекулярная сила, существующая между двумя молекулами, представляет собой ионно-дипольная сила.
Энтальпия реакции HCl + KMnO4 невозможно предсказать.
HCl + KMnO4 буферный раствор?Компания буферный раствор для этих двух растворенных веществ невозможно, потому что HCl не является слабой кислотой. Для буферного раствора требуется комбинация слабой кислоты и сопряженного с ней основания.
Для буферного раствора требуется комбинация слабой кислоты и сопряженного с ней основания.
HCl + KMnO4 представляет собой полную окислительно-восстановительную реакцию.
HCl + KMnO4 экзотермическая или эндотермическая реакция?Невозможно предсказать, будет ли HCl + KMnO4 реакция экзотермическая или эндотермическая.
HCl + KMnO4 окислительно-восстановительная реакция?HCl + KMnO4 представляет собой окислительно-восстановительную реакцию, где KMnO4 восстанавливается, а HCl окисляется.
Окислительно-восстановительная реакцияHCl + KMnO4 реакция осаждения?HCl + KMnO4 не является реакцией осаждения, так как в этой реакции не происходит образования осадка.
HCl + KMnO4 необратимая реакция?HCl + KMnO4 является необратимой реакцией.
HCl + KMnO4 не является реакцией смещения.
ЗаключениеТаким образом, HCl + KMnO4 реакция является возможной реакцией с образованием KCl и MnO2, наряду с освобождением Cl2 газ. КМnО4 является окислителем, который окисляет HCl. HCl и KMnO4 нельзя использовать вместе при титровании, так как они диссоциируют.
KMnO4+HCl=KCl+MnCl2+Cl2+h3O тотықтырғыштың алдына қойылатын коэффициент саны?
Сайтты қолдану үшін FAQ танысып шығыңыз!
ДианаЕрлановнаМектепсұрақ қойды | 4.5k қаралды
тест шеше алмай жатырмын, еш жерде нақты мәлімет жоқ. ауырып жатқандықтан сабаққа бара алмай жүрмін..көмектесіңіздерші?
- химиялық реакция
- тотықтырғыш
- тотығу дәрежелері
1 жауап
Айжана_Жангельдиноважауап берді
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8h3O тотықтырғыш KMnO4алдындағы коэфицент 2 ге тең
Жақсы Жауап
Ұқсас сұрақтар
1 жауап
MnO2+HCl=Cl2+MnCl2+h3O берілген реакциялардың тотығу дәрежесі
Aknura_NuralievaХимия 20.02.2014 сұрақ қойды | 2.8k қаралды
- реакция
- тотығу дәрежесі
1 жауап
KClO3+HCl=Cl2-MnCl2+h3O берілген реакциялардың тотығу дәрежесі?
Aknura_NuralievaХимия 20.02.2014 сұрақ қойды | 2.7k қаралды
- химия
- есеп
1 жауап
N2 , HJ,h3, NaF, Cl2, CaF2 осылардын тотығу дәрежелері?
Белгісіз Университет, колледж 13.10.2020 сұрақ қойды | 3.8k қаралды
- химия
- тотығу дәрежелері
- қажет
0 жауап
Реакциялардан тотықтырғыш пен тотықсыздандырғышты анықтандар?
Аружан_АлжановаХимия
17. 11.2013
сұрақ қойды
|
1.0k қаралды
11.2013
сұрақ қойды
|
1.0k қаралды
- реакция
- тотықтырғыш
- тотықсыздандырғыш
0 жауап
Хром атомының электрондық және графиктік формулалары, тотығу дәрежелері т.бfriend2200Химия 30.09.2015 сұрақ қойды | 5.2k қаралды
- тотығу дәрежелері
- формула
- қосылыс
- Санаттар
- Мектеп сұрақтары
29.2k
- Мектеп 9.0k
- Қазақ тілі 5.7k
- Математика 3.1k
- Химия 2.5k
- Информатика 627
- Аспан әлемі, Ғарыш 191
- Геометрия 1.4k
- Физика 2.6k
- Биология 901
- Психология 197
- География 822
- ҰБТ жайлы 987
- Үй тапсырмасы 1.1k
- Серпін-2050 жобасы 73
- Университет, колледж 4.1k
- Тарих сұрақтары 2.0k
- Компьютер, Интернет 16.5k
- Авто 1.1k
- Қаржы, Бизнес 2.1k
- Саясат, Мемлекет 1.7k
- Заң
2.

- Өмір, Тіршілік 4.9k
- Тағам, Аспаздық 990
- Жұмыс 1.4k
- Экология, Табиғат 1.4k
- Денсаулық 6.5k
- Спорт 3.1k
- Танысу, Махаббат 2.7k
- Көңіл-көтеру 1.7k
- Өнер 1.5k
- Қыдыру, Демалыс 453
- Кітап, Әдебиет 3.4k
- Құрылыс, Жобалау 391
- Музыка, Ән 5.8k
- Ұялы телефон 5.3k
- Әлеуметтік желі 1.6k
- Кино, Теледидар 3.1k
- Сурет, Видео 1.4k
- Тұлға, Адам 3.0k
- Салт-дәстүр 1.0k
- Логикалық сұрақтар 3.3k
- Жалпы сұрақ 14.0k
- Онлайн конференция 16
Что, как сбалансировать и часто задаваемые вопросы — Lambda Geeks
Соляная кислота (HCl) — сильная кислота, а перманганат калия (KMnO 4 ) — кристаллическая соль. Обсудим некоторые интересные факты о реакциях HCl и KMnO 4 .
Соляная кислота также называется соляной кислотой. Являясь сильной кислотой, она растворяется в воде и диссоциирует на ионы Н + и Cl — соответственно. Он появляется в жидкой форме и имеет молярную массу 36,458 г/моль. КМnО 4 также известен как перманганат калия. Растворяется в воде и диссоциирует на ионы K + и MnO 4 – .
Он появляется в жидкой форме и имеет молярную массу 36,458 г/моль. КМnО 4 также известен как перманганат калия. Растворяется в воде и диссоциирует на ионы K + и MnO 4 – .
В этой статье мы сосредоточимся на различных аспектах реакции «HCl + KMnO 4 », таких как продукт, тип реакции, уравновешивание реакции и т. д.
Что является продуктом HCl и КМНО 4 ?Соляная кислота (HCl) реагирует с перманганатом калия (KMnO 4 ) для производства хлорида калия (KCl), хлорида марганца (MnCl 2 ), хлора (Cl 2 ) и воды (H 2 O) в качестве побочного продукта.
2KMNO 4 + 16HCl → 2KCL + 2MNCL 2 + 8H 2 O + 5CL 2
Что тип реакции HCL + KMN . Что тип. HCl + KMnO 4 представляет собой окислительно-восстановительную реакцию . Потому что в этой реакции KMnO 4 является окислителем , который окисляет HCl до Cl 2 , восстанавливая себя до MnCl 2 . Степень окисления Mn снижается с +7 до +2.
Потому что в этой реакции KMnO 4 является окислителем , который окисляет HCl до Cl 2 , восстанавливая себя до MnCl 2 . Степень окисления Mn снижается с +7 до +2.
Чтобы сбалансировать уравнение, выполните следующие шаги:
Шаг 1: Определите атомы
Сначала определите атомы, участвующие в реакции. В данном случае это атомы K, Mn, O, H и Cl.
Шаг 2: Найдите коэффициент атомов
Необходимо найти коэффициенты атомов или соединений, участвующих в реакции, и изменить их, чтобы сбалансировать уравнение.
Шаг 3: Уравновесьте реакцию
Чтобы получить сбалансированное уравнение, коэффициенты атомов или соединений должны быть одинаковыми в обеих частях реакции.
После выполнения вышеуказанных шагов окончательная реакция выглядит следующим образом
2KMnO 4 + 16HCl → 2KCl + 2MnCl 2 + 8H 2 O + 5Cl 2
HCl + KMnO 4 titration HCl and KMnO 4 нельзя титровать вместе, так как HCl будет реагировать с KMnO 4 с образованием Cl 2 . Кроме того, Cl 2 будет мешать титрованию .
Кроме того, Cl 2 будет мешать титрованию .
Общая реакция разделена на ионные реакции, где реагенты представлены в виде соответствующих ионов. Далее все ионные реакции уравновешиваются. Это можно объяснить следующей реакцией.
Ионное уравнение HCl + KMnO 4 сопряженные парыHCl, будучи кислотой, имеет сопряженное основание. Но KMnO 4 , будучи окислителем, не имеет сопряженной пары.
Conjugate Pair HCl and KMnO 4 intermolecular forces- The intermolecular forces present between two molecules of HCl are London dispersion forces and dipole-dipole interactions .

- В KMnO 4 межмолекулярная сила, присутствующая между двумя молекулами, представляет собой ионно-дипольную силу .
Энтальпия реакции HCl + KMnO 4 не может быть предсказана.
Является ли HCl + KMnO 4 буферным раствором ?Буферный раствор для этих двух растворенных веществ невозможен, поскольку HCl не является слабой кислотой. Для буферного раствора требуется комбинация слабой кислоты и сопряженного с ней основания.
Является HCl + KMnO 4 полная реакция ?HCl + KMnO 4 представляет собой полную окислительно-восстановительную реакцию.
Является ли HCl + KMnO 4 экзотермической или эндотермической реакцией ? Невозможно предсказать, является ли реакция HCl + KMnO 4 экзотермической или эндотермической.
HCl + KMnO 4 – окислительно-восстановительная реакция, где KMnO 4 восстанавливается, а HCl окисляется.
Окислительно-восстановительная реакция Является ли HCl + KMnO 4 реакцией осаждения ?HCl + KMnO 4 не является реакцией осаждения, поскольку в этой реакции не происходит образования осадка.
Является ли HCl + KMnO 4 необратимой реакцией ?HCl + KMnO 4 является необратимой реакцией.
Является HCl + KMnO 4 реакция смещения ?HCl + KMnO 4 не является реакцией замещения.
Заключение Таким образом, возможна реакция HCl + KMnO 4 с образованием KCl и MnO 2 с выделением газа Cl 2 . KMnO 4 – окислитель, окисляющий HCl. HCl и KMnO 4 нельзя использовать вместе при титровании, так как они диссоциируют.
KMnO 4 – окислитель, окисляющий HCl. HCl и KMnO 4 нельзя использовать вместе при титровании, так как они диссоциируют.
Спектрофотометрическое определение пипазетата HCl и декстрометорфана HBr с использованием перманганата калия
. 2008 г., декабрь 4(4):294-302.
Айман Абу Эль-Фету Гауда 1 , Рагаа Эль-Шейх, Зейнеб Эль-Шафей, Нагда Хоссны, Рам Эль-Аззази
принадлежность
- 1 Химический факультет, Факультет естественных наук, Университет Загазиг, Загазиг, Египет;
- PMID: 23675101
- PMCID: PMC3614715
Бесплатная статья ЧВК
Айман Абу Эль-Фету Гауда и др. Int J Biomed Sci.
2008 Декабрь
Int J Biomed Sci.
2008 Декабрь
Бесплатная статья ЧВК
. 2008 г., декабрь 4(4):294-302.
Авторы
Айман Абу Эль-Фету Гауда 1 , Рагаа Эль-Шейх, Зейнеб Эль-Шафей, Нагда Хоссны, Рам Эль-Аззази
принадлежность
- 1 Химический факультет, Факультет естественных наук, Университет Загазиг, Загазиг, Египет;
- PMID: 23675101
- PMCID: PMC3614715
Абстрактный
Описаны быстрые, простые и чувствительные проверенные спектрофотометрические методы анализа пипазетата HCl (PiCl) и декстрометорфана HBr (DEX) либо в чистом виде, либо в фармацевтических препаратах.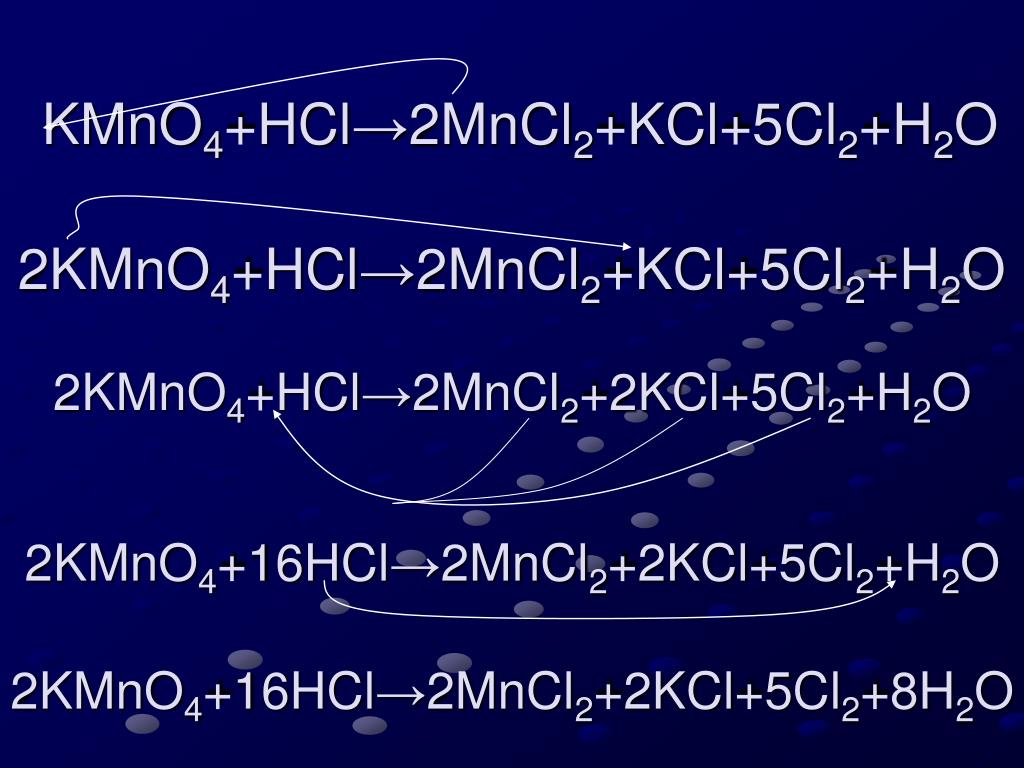

Ключевые слова: декстрометорфан HBr; реакции окисления; фармацевтические составы; пипазетат HCl; перманганат калия; спектрофотометрия.
Цифры
Рисунок 1
Химическая структура…
Рисунок 1
Химическая структура исследуемых препаратов.
фигура 1 Химическая структура исследуемых препаратов. Рисунок 2
Спектры поглощения окисления…
Рисунок 2
Спектры поглощения продукта окисления от 8,0 мкг мл -1 PiCl, KMnO…
фигура 2 Спектры поглощения продукта окисления между 8,0 мкг мл -1 PiCl, KMnO 4 и (а) АМ, (б) АО, (в) индиго и (г) МБ при нагревании при 60 ± 2°С на 5,0 мин.
Рисунок 3
Влияние времени нагрева на…
Рисунок 3
Влияние времени нагрева на окисление 8,0 мкг мл -1 PiCl-краситель…
Рисунок 3Влияние времени нагрева на окисление 8,0 мкг мл -1 PiCl-красителя при оптимальных длинах волн λ max каждого красителя.
Рисунок 4
Эффект громкости 5,0…
Рисунок 4
Влияние объема 5,0 × 10 -4 M KMnO 4 на…
Рисунок 4 Влияние объема 5,0 × 10 -4 М KMnO 4 на образование продукта реакции: 8,0 мкг мл -1 DEX с МБ и 10 мкг мл -1 PiCl с АО.
Рисунок 5
Влияние добавленного мл…
Рисунок 5
Влияние добавления мл серной кислоты (2,0 М) на поглощение PiCl…
Рисунок 5Влияние добавленного мл серной кислоты (2,0 М) на поглощение PiCl с (5,0 × 10 -4 М) KMnO 4 и красителями (5,0 × 10 -4 М).
Рисунок 6
Эффект добавления красителей (5,0…
Влияние добавленных красителей (5,0 × 10 -4 М) на оптическую плотность 10…
Рисунок 6 Влияние добавленных красителей (5,0 × 10 -4 М) на оптическую плотность 10 мкг мл -1 PiCl с KMnO 4 (5,0 × 10 -4 М).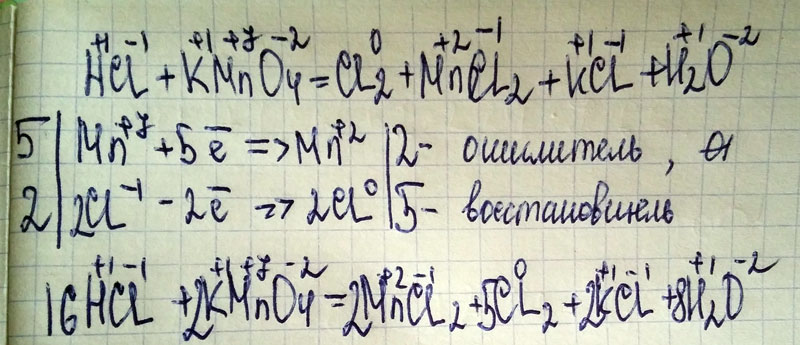
Рисунок 7
График непрерывных вариаций для…
Рисунок 7
График непрерывных вариаций для реакции между 5,0 × 10 -4 M PiCl…
Рисунок 7График непрерывных вариаций реакции между 5,0×10 -4 М PiCl и 5,0×10 -4 М KMnO 4 с красителями (5,0×10 -4 М).
Рисунок 8
Возможные последовательности окисления-восстановления…
Рисунок 8
Возможные последовательности Окислительно-восстановительной реакции.
Возможные последовательности окислительно-восстановительной реакции.
См. это изображение и информацию об авторских правах в PMC
.Похожие статьи
Спектрофотометрическое определение пипазетата HCl, декстрометорфана HBr и дротаверина HCl в их фармацевтических препаратах.
Амин А.С., Эль-Шейх Р., Захран Ф., Гауда А.А. Амин А.С. и соавт. Spectrochim Acta A Mol Biomol Spectrosc. 2007 июль; 67 (3-4): 1088-93. doi: 10.1016/j.saa.2006.09.027. Epub 2006, 28 сентября. Spectrochim Acta A Mol Biomol Spectrosc. 2007. PMID: 17092767
Применение N-бромсукцинимида для чувствительного спектрофотометрического определения пипазетата HCl как противокашлевого препарата в чистом виде и лекарственных формах.

Абурехаб М.А.С., Шахин М.Х.К., Шейх Р.Э., Эллатеиф А., Фавзи С.М., Гауда А.А. Абурехаб МАС и др. Энн Фарм о. 2021 ноябрь;79(6):652-663. doi: 10.1016/j.pharma.2021.02.008. Epub 2021 3 марта. Энн Фарм о. 2021. PMID: 33675737
Спектрофотометрическая оценка рисперидона в таблетках.
Джаянна Б.К., Деварадж Т.Д., Рупа К.П., Нагендраппа Г., Кумар Х.Р., Гауда Н. Джаянна Б.К. и др. Индийская Дж. Фарм. 2014 сен; 76 (5): 452-5. Индийская Дж. Фарм. 2014. PMID: 25425761 Бесплатная статья ЧВК.
Оптимизация и валидация спектрофотометрических методов определения финастерида в лекарственных и биологических формах.
Амин А.С., Касем М.А. Амин А.С. и соавт. Фармметоды. 2012 Январь; 3(1):48-55.
 дои: 10.4103/2229-4708.97726.
Фармметоды. 2012.
PMID: 23781478
Бесплатная статья ЧВК.
дои: 10.4103/2229-4708.97726.
Фармметоды. 2012.
PMID: 23781478
Бесплатная статья ЧВК.Оптимизированы и валидированы спектрофотометрические методы определения ралоксифена в фармацевтических препаратах с использованием перманганата.
Basavaiah K, Tharpa K, Anil Kumar UR, Rajedraprasad N, Hiriyanna Sg, Vinay KB. Басавая К. и др. Арч Фарм Рез. 2009 г.Сен; 32 (9): 1271-9. doi: 10.1007/s12272-009-1913-7. Epub 2009 26 сентября. Арч Фарм Рез. 2009. PMID: 19784584
Посмотреть все похожие статьи
использованная литература
- Рейнольдс ДЖЕФ, редактор. Мартиндейл, Дополнительная фармакопея. 30-й. Лондон: Фармацевтическая пресса; 1999. с. 8140.
- Зарапкер С.

- Зарапкер С.


 дои: 10.4103/2229-4708.97726.
Фармметоды. 2012.
PMID: 23781478
Бесплатная статья ЧВК.
дои: 10.4103/2229-4708.97726.
Фармметоды. 2012.
PMID: 23781478
Бесплатная статья ЧВК.