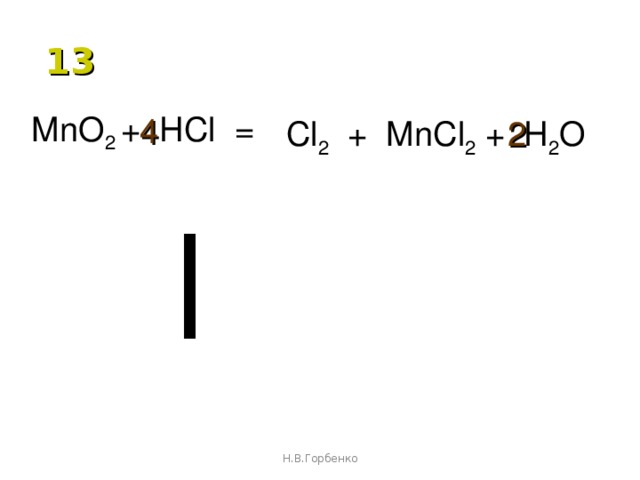▷ MnO2 + HCl → MnCl2 + h3O + Cl2 (метод растворения REDOX) де cambios дие себе Hace кон лос ajustes. Se supone que estos métodos deberían ayudarnos a reducir la carga de trabajo pero no sucede, sin embargo, sí eres де-лос-миос, Эрес-де-лас-персоны дие disfrutan resolverlo. En otras reacciones química basta con usar fracciones para llegar a un proceso corto, Esta Fue La Exepción.
Paso 1. Comprobar si la reacción esta balanceada, identificar qué elementos están en la misma proporción e identificarlos (ayudará de mucho mas тарде).
MNO 2 + HCL → MNCL 2 + H 2 O + CL 2
1- MN — 1
2- O -1
2- O -1
2- 1
2- O -10009
1- Cl — 4
Без балансировки
Paso 2. Colocar el número de oxidación a cada elemento
Colocar el número de oxidación a cada elemento
*¿No sabes cómo se coloca cada número de oxidación?
▷ ИДЕНТИФИКАЦИОННЫЙ ✅ ЭЛЬ НОМЕР ОКИСЛИТЕЛЬНОГО НОМЕРА UN COMPUESTO TRUCO ❤️
Paso 3. Идентификационный номер separa los elementos que se reducen y se oxidan respectivamente, colocar cuantos electronices de diferencia hay entre cada уно де эльос.
Paso 4. Реализация дисбаланса электронов, toma en cuenta que sumar electronics restan los números de oxidación;
Paso 5. Cruzar los coeficientes que tienen los electronices a la otra fila;
Paso 6. Multiplica el coeficiente por toda la fila, cada coeficiente se multiplica por su fila, de tal manera que obtengas una sola fila, tanto reactivos como productos;
Podrás observar que que los electronices se anulan por ser semejantes
Ahora debemos agregar los coeficientes de la semireacción en los elementos coreientes al compuesto que contenga los elementos con dicha valencia .
Пасо 7. Si la reacción no queda balanceada, hacer las modificaciones tanteando yрассматривать лос-сигуиентес puntos;
- Primero balanceamos el elemento que no sea Hidrógeno u Oxígeno si lo hay
- Después balanceamos al hidrogeno
- Por último balanceamos al Oxígeno
MnO 2 + 2HCl → MnCl 2 + H 2 O + 2Cl 2
1- Mn — 1
2- O — 1
2 — H — 2
2- CL — 6
NO BALANCEADA
AHORA Debemos hacer Los Ajustes para para leacción, tomaremos in -in -in -in -in -in -in -in -a -ajustes ;
- MnO 2 + 6HCl → MnCl 2 + H 2 O + 2Cl 2
- MnO 2 + 6HCl → MnCl 2 + 3H 2 O + 2Cl 2
- MnO 2 + 6HCl → MnCl 2 + 3H 2 O + 2Cl 2
- MnO 2 + 6HCl → MnCl 2 + 4H 2 O + 2Cl 2
- MNO 2 + 8HCl → 2MNCL 2 + 4H 2 O+ 2CL 2
- 2MNO 2 + 8H88 2
- .
 2
213 2 2 2
- 2
13 2 2
- 9008 2 2
.13 2
- 2 2
- 2
2- 2
. 2Cl 2
- .
2MnO 2 +8HCl → 2MNCL 2 +4H 2 O+2CL 2
2- MN — 2
4- O — 4
9000 2 8000999999999999999999999999999999999999999999999999999 99999999999999999999999 99999999999999
8- CL — 8
Balanceada
- Умножьте заданную массу реагента на величину, обратную его молярной массе (моль/г). даст вам моли реагента Это то же самое, что разделить данную массу на молярную массу
- Умножьте моль реагента на молярное соотношение между реагентом и #»Cl»_2″# из сбалансированное уравнение с #»Cl»_2″# в числителе.
- Умножьте mol #»Cl»_2″# на молярную массу. Это даст вам масса #»Cl»_2″#.

_
⭐⭐⭐⭐⭐ (VOTOS: 2134 567 | Ставка)
ESTE SITIO WEM ES Más Valorada PORERAD газ можно получить в лаборатории реакцией соляной кислоты с оксидом марганца(IV): 4HCl(водн.)+MnO2(т) —> MnCl2(водн.)+2h3O(ж)+Cl2(г) ?
Сбалансированное уравнение
#»4HCl(водн.) + MnO»_2(«т»)##rarr##»MnCl»_2(«водн. «) + «2H»_2″O(«л») + Cl»_2(«g»)#
«) + «2H»_2″O(«л») + Cl»_2(«g»)#
Молярные массы
#M_»HCl»=(1xx»1,008 г/моль H») + (1xx»35,453 г/моль Cl»)=»36,461 г/моль «#
#M_»MnO2″=(1xx»54,938 г/моль Mn») + (2xx»15,999 г/моль O»)=»86,936 г/моль»#
#M_»Cl2″=(2xx» 35,453 г/моль Cl»_2″)»=»70,906 г/моль»#
Существует три основных этапа перехода от массы реагента к массе #»Cl»_2″#.
#color(red)»масса реагента»##rarr##color(red)(«мол реагента»#
#color(red)(«мол реагента»##rarr##color(blue)»mol Cl»_2″#
#color(blue)»mol Cl»_2″##rarr##color(green)»mass Cl»_2″#
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
#color(red)»mass MnO»_2″##rarr##color(red)(«mol MnO»_2″#
#42.7color(red)cancel(color(black)(«g MnO»_2 ))xx(1″моль MnO»_2)/(86,936цвет(красный)отменить(цвет(черный)(«г MnO»_2)))=»0,49117 моль MnO»_2″#
Я храню пару чтобы уменьшить ошибки округления, я буду округлять массу газообразного хлора до трех значащих цифр.
#color(red)»mol MnO»_2″##rarr##color(blue)(«mol Cl»_2″#
#0.49117color(red)cancel(color(black)(«mol MnO»_2 ))xx(1″моль Cl»_2)/(1цвет(красный)отмена(цвет(черный)(«моль MnO»_2)))=»0,49117 моль Cl»_2″#
#цвет(синий)(» моль Cl»_2″##rarr##цвет(зеленый)(«масса Cl»_2″#
#0,49117цвет(красный)отмена(цвет(черный)(«моль Cl»_2))xx(70,906″г Cl «_2)/(1color(red)cancel(color(black)(«mol Cl»_2)))=»34,8 г Cl»_2″# (округлено до трех значащих цифр)
~~~~~~~~ ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
#color(red)(«mass HCl»##rarr##color(red)(«mol HCl»#
#47.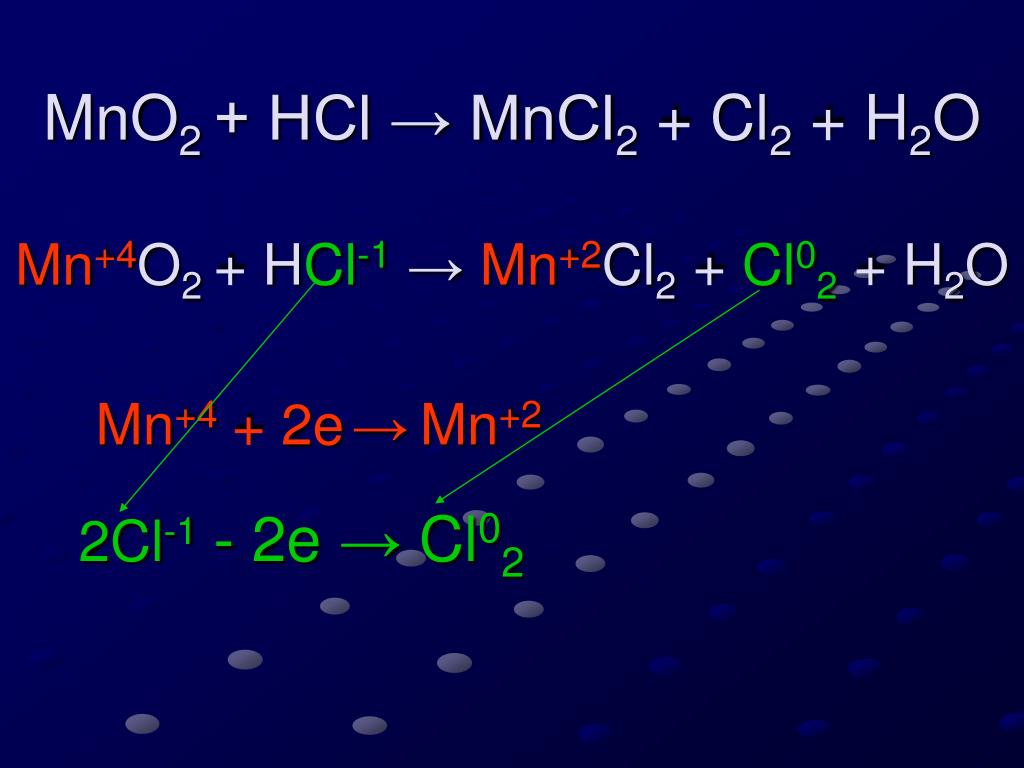

 2
2