Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
| Похожие вопросы |
Решено
В прямоугольном треугольнике гипотенуза равна 41 см, а один из катетов 9 см.
Пользуйтесь нашим приложением
Реакции ионного обмена и условия их протекания
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Тема урока:
Реакции ионного обмена иусловия их протекания.
2. Цель урока:
Изучение реакций ионного обмена иусловий их протекания.
https://youtu.be/8vHOrE4AAlU
3. Эпиграф
Три пути ведут к познанию: путьразмышления – самый благородный,
путь подражания – самый лёгкий, путь
опыта – самый горький!
4.
 Ответьте на вопросы1.Какие вещества называются
Ответьте на вопросы1.Какие вещества называютсяэлектролитами? Приведите примеры.
2. Какие вещества называются
неэлектролитами? Приведите примеры.
3. В каком году и кто разработал теорию
электролитической диссоциации?
5. Выполните задания
1.Перечисленные вещества разделитена 2 столбика: в один запишите
электролиты, в другой – неэлектролиты:
р-р КОН, тв.КОН, крист. сахара, Н2SO4,
спирт, дист.вода.
2. Запишите уравнение диссоциации
следующих веществ: КNO3, Ba(OH)2,
HCL, h3SO4
7. Выберите выигрышный путь, как в игре «крестики – нолики, где три вещества являются: 1 вариант – электролитами, 2 вариант –
неэлектролитами.КОН
(раствор)
NaNO3
СО2
AgCl
HNO3
Na2SO4
С12Н22О11
(сахароза)
C2H5OH
(этиловый
спирт)
SiO2
КОН
(раствор)
СО2
С12Н22О11
(сахароза)
NaNO3
AgCl
C2H5OH
(этиловый
спирт)
HNO3
Na2SO4
SiO2
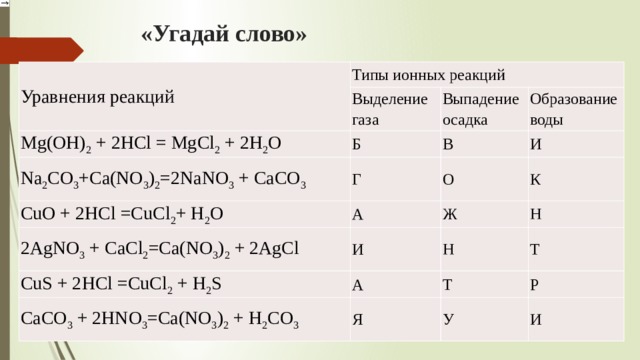
11. Реакции между ионами называются ионными реакциями, а уравнения таких реакций – ионными уравнениями.

12. Реакции ионного обмена (РИО) протекают до конца в случае
Выпаденияосадка
Выделения газа
Образования
малодиссоциирующего
вещества(М), например вода.
13. Правила составления ионных уравнений
Простые вещества, оксиды, а также нерастворимыекислоты, основания, соли не диссоциируют.
Для реакции берут растворы веществ, поэтому даже
малорастворимые вещества находятся в растворах в
виде ионов.
Если в результате реакции образовалось
малорастворимое вещество, то при записи ионного
уравнения его считают нерастворимым.
14. Алгоритм составления ионного уравнения
Записать молекулярное уравнение реакции.С помощью таблицы растворимости
определить растворимость каждого
вещества.
Составить полное ионное уравнение (найти
одинаковые ионы и сократить их слева и
справа)
Составить сокращенное ионное уравнение
15. Лабораторная работа Тема: Реакции ионного обмена
Взаимодействиерастворов NaOH и
CuSO4
Взаимодействие
растворов Na2CO3 и HCl
Взаимодействие
растворов NaOH и HCl
16.
 Взаимодействие растворов NaOH и CuSO4 вставьте ионы!!!!!!2NaOH + CuSO4
Взаимодействие растворов NaOH и CuSO4 вставьте ионы!!!!!!2NaOH + CuSO4Na SO4 +Cu(OH)
2
2
Уравнение в молекулярном виде
2Na +2OH + Cu+SO4
2 Na + SO4 +Cu(OH)2
Уравнение в полном ионном виде
Cu + 2OH
Cu(OH)
2
голубой
Уравнение в сокращенном ионном виде
Время 1.04 -1.12
17. Взаимодействие растворов Na2CO3 и HCl вставьте ионы!!!!!!
Na2CO3 + 2HCl2NaCl +h3O + CO2
2Na + CO3 + 2H + 2Cl
2Na + 2Cl +h3O + CO2
CO3 + 2H
h3O + CO2
бурное вскипание
18. Взаимодействие растворов NaOH и HCl (реакция нейтрализации)
NaOH + HClNaCl + h3O
Фенолфт.
Na + OH + H + Cl
OH + H
H 2O
Na + Cl + h3O
исчезновение малиновой окраски
23. Оцените свою работу по направлениям
«Я» — как я себя чувствовал в процессеурока, доволен ли я своей работой;
«Мы» — насколько комфортно и
эффективно мне было работать в
группе;
«Дело» — достиг ли я цели обучения, в
чём испытал затруднения, как
преодолеть проблемы.

24. Домашнее задание
§ 4, упр.1https://youtu.be/0RCFox-oR_o
https://youtu.be/Sx0tldH9Grk
Соляная кислота + нитрат серебра HCl+ AgNO3 — HNO3 + AgCl
H +Cl +Ag + NO3 — H + NO3 + AgCl
Cl +Ag — AgCl
белые хлопья
K2 SO4 + Ba(NO3)2 =
CaCO3 + h3SO3 = CaSO3 + h3O + CO2 ↑
CaCO3 + 2HNO3 = Ca(NO)2 + h3O + CO2 ↑
NaHCO3 + HCl = NaCl + h3O + CO2 ↑
2Na3PO4 + 3CaCl2 = Ca3(PO4)2 ↓ + 6 NaCl
NaHCO3+Ch4COOH=Ch4COONa+h3O+ CO2↑
25. «Скажи мне, и я забуду, покажи мне, и я может быть запомню, вовлеки меня, и я пойму» Конфуций
English Русский Правила
What, How to Balance & FAQs —
By Padmakshi Kotoky
Соляная кислота является сильной реактивной кислотой, которая имеет тенденцию взаимодействовать с такими основаниями, как карбонат натрия. Давайте подробно изучим их реакцию.
HCl + Na 2 CO 3 является фундаментальной реакцией между сильной кислотой и слабым основанием. Соляная кислота обычно образуется из водного раствора газообразного хлороводорода. Карбонат натрия (Na 2 CO 3 ), также известный как стиральная сода, представляет собой неорганическое химическое вещество, которое смешивается с водой и выглядит как белое кристаллическое твердое вещество без запаха.
Соляная кислота обычно образуется из водного раствора газообразного хлороводорода. Карбонат натрия (Na 2 CO 3 ), также известный как стиральная сода, представляет собой неорганическое химическое вещество, которое смешивается с водой и выглядит как белое кристаллическое твердое вещество без запаха.
В этом изделии должны быть приведены различные характеристики этой реакции, такие как продукты, тип реакции, титрование, энтальпия реакции и т. д.
Хлорид натрия образуется вместе с водой и двуокисью углерода, , при взаимодействии HCl с Na 2 CO 3 .
2HCl (водный) + NA 2 CO 3 (AQ) -> 2NACL (AQ) + H 2 O (L) + CO 2 (G )
77. Что тип. реакции HCl + Na 2 CO 3 HCl + Na 2 CO 3 является кислотно-основной реакцией, также называемой реакцией нейтрализации, где HCl является сильной кислотой, а Na 2 CO 3 — слабое основание.
Уравнение дисбаланта: HCL + NA 2 CO 3 =
Для уравнивания вышеупомянутой реакции применяются следующие шаги:
- Чтобы реакция была сбалансированной, количество атомов каждого элемента, присутствующего как на стороне реагента, так и на стороне продукта, должно быть равным.
| Atoms | Reactant Side | Product Side |
|---|---|---|
| Sodium | 2 | 1 |
| Chlorine | 1 | 1 |
| Carbon | 1 | 1 |
| Водород | 1 | 2 |
| Кислород | 3 | 3 |
- Стехиометрические коэффициенты добавляются к несбалансированным атомам на стороне реагента и продукта по мере необходимости.

- Чтобы сбалансировать атом натрия, NaCl умножают с коэффициентом 2.
- Атомы углерода и кислорода уже сбалансированы по обе стороны реакции.
- Наконец, атом водорода уравновешивается путем умножения HCl с коэффициентом 2.
- Следовательно, сбалансированное химическое уравнение:
- 2HCl + Na 2 CO 3 = 2NaCl + H 2 O + CO 2
HCl + Na 2 CO 3 Титрование подпадает под категорию сильнокислотного титрования слабым основанием и может осуществляться следующим образом.
Аппаратура и необходимые химические вещества
Бюретка 50 мл, пипетка, коническая колба 250 мл, мерная колба, штатив для бюретки, химический стакан, воронка, дистиллированная вода, соляная кислота, карбонат натрия
Индикатор
Это титрование проводится с использованием индикатора метилового оранжевого, чтобы отметить конечную точку физического перехода в растворе.
Процедура
- Стандартный раствор Na 2 CO 3 готовят путем растворения нескольких граммов его в дистиллированной воде.
- Бюретка заполняется стандартизированным раствором Na 2 CO 3 после промывки и ополаскивания.
- Раствор HCl переносят в чистую промытую колбу для титрования с помощью пипетки и добавляют к ней 2 капли метилового оранжевого.
- Раствор карбоната натрия добавляют в колбу для титрования по каплям. Колбу энергично встряхивают до изменения цвета раствора на светло-розовый. Это изменение цвета указывает на конечную точку реакции.
- Затем отмечают окончательные показания и количество Na 2 CO 3 раствора, используемого для нейтрализации раствора HCl.
- Предыдущие шаги повторяются до тех пор, пока не будут получены три согласующихся показания.

- Объем требуемого химического вещества рассчитывается с использованием формулы M 1 V 1 = M 2 V 2
Суммарное ионное уравнение HCl + Na 2 CO 3 IS: CO 3 2- (AQ) + 2H + (AQ) = H 2 O (L) + CO 2 2 2 O (L) + CO 2 2 O (L) + CO 2. (g)
Ниже приведены шаги для получения суммарного ионного уравнения:
- Во-первых, полное сбалансированное уравнение записывается вместе с их физическими состояниями.
- 2HCl (водный) + Na 2 CO 3 (AQ) = 2NACL (AQ) + H 2 O (L) + CO 2 (G )
- 9 Теперь на раздел.
 в ионы. Таким образом, Сбалансированное чистое ионное уравнение между HCL и NA 2 CO 3 После устранения ионов зрителей следующим образом:
в ионы. Таким образом, Сбалансированное чистое ионное уравнение между HCL и NA 2 CO 3 После устранения ионов зрителей следующим образом: - CO 3 2- (AQ) + 2H 2H 2H 2H 2H 2H 2H 2H 2H 2H 2H 2H 2H 2H 2H3H 2H 2H 3H 2H 2H. + (водн.) = Н 2 O (L) + CO 2 (g)
- 9
- . Конкугат BASE
- . Конкугат BASE
- 9
- . СОЗДАНИЯ ОСОБАТА. , поскольку HCl отдает протон с образованием иона Cl – .
- Конъюгатная кислота CO 3 2- Ион- HCO 3 — С NA 2 CO 3 Диспасы в воде до формы 2 CO 3 .
 0309 + и СО 3 2- ионы.
0309 + и СО 3 2- ионы.
- Диполь-дипольные взаимодействия и London Dispersion Sits являются межмольными силами.
- Ионные электростатические силы притяжения существуют между молекулами Na 2 CO 3 .
Энтальпия реакции HCl + Na 2 CO
8 9 -2 кДж/моль.
Значения энтальпии связиCompounds Number of moles Bond Enthalpy, ΔH⁰ f (kJ/mol) HCl 2 -167.  15
15Na 2 CO 3 1 -1157.3 NaCl 2 -407.25 H 2 O 1 -285.8 CO 2 1 -393.5 - Энтальпия реакции рассчитывается с использованием формулы: ΔH⁰ F (реакция) = σ ΔH⁰ F (Продукты) — σ ΔH⁰ F (Реакты) — σ ΔH⁰ F (Реакты) — σ ΔH⁰ F (Реакты)
- Изменение энтальпии = [2*(-407,25) + 1*(-285,8) + 1*(-393,5)] – [2*(-167,15) + 1*(-1157,3)] = -2,2 кДж/ моль
HCl + Na 2 CO 3 которое просто нейтрализуется основанием, что приводит к образованию соли .
Is HCl + Na 2 CO 3 a Полная реакция
HCl + Na 2 CO 3 является полной реакцией, так как реагирующие соединения завершаются и полностью расходуются при равновесии с образованием стабильной соли с пузырьками CO 2 Выделяется газ . Таким образом, дальнейшая реакция невозможна.
Is HCl + Na 2 CO 3 Экзотермическая или эндотермическая реакцияHCl + Na 2 CO 3 является экзотермической реакцией , так как изменение энтальпии этой реакции отрицательно, и энергия выделяется в виде тепла. окислительно-восстановительная реакция наблюдается как со стороны реагента, так и со стороны продукта.
Is HCl + Na 2 CO 3 a Реакция осажденияHCl + Na 2 CO 3 не является реакцией осаждения, поскольку образующийся NaCl представляет собой соль, которая легко растворяется в воде, а не осадок.
Is HCl + Na 2 CO 3 a Обратимая или необратимая реакция
HCl + Na 2 CO 3 реакция не может быть превращена в необратимые продукты реакции. Образовавшийся углекислый газ свободно покидает раствор, сильно сдвигая равновесие вперед.
Is HCl + Na 2 CO 3 Реакция замещенияHCl + Na 2 CO 3 представляет собой двойную реакцию замещения молекулярных и ионообменных частей. Механизм двойного вытеснения
ЗаключениеРеакция Na 2 CO 3 с HCl представляет собой хорошо известный самопроизвольный процесс нейтрализации с выделением газа, который приводит к образованию соли NaCl. Образование солей в значительной степени используется в производстве различных химикатов в самых разных отраслях промышленности, прямо или косвенно.
Он также демонстрирует медицинские приложения.
Соляная кислота (HCl) реагирует с карбонатом натрия (Na2CO3), образуя хлорид натрия (NaCl), воду (h3O) и углекислый газ 2HCl(водн.)+Na2CO3(водн.)→2NaCl(водн.)+h3O(ж)+CO2(г) Часть А Какой объем 1,75 М HCl в литрах? необходимо реагировать полностью (без остатка) с 0,750 л 0,100 М Na2CO3? Выразите свой ответ тремя значащими цифрами и включите соответствующие единицы. Часть Б Образец неизвестного раствора HCl объемом 557 мл вступает в реакцию. полностью с Na2CO3 с образованием 20,1 г CO2. Что была концентрация раствора HCl? Выразите свой ответ тремя значащими цифрами и включите соответствующие единицы.
Вопрос
Пошаговый ответ
Соляная кислота (HCl) реагирует с карбонатом натрия (Na2CO3), образуя хлорид натрия (NaCl), воду (h3O) и углекислый газ (СО2). Это уравнение уравновешено, как написано…
Соляная кислота (HCl) реагирует с карбонатом натрия (Na2CO3), образуя хлорид натрия (NaCl), воду (h3O) и углекислый газ (СО2).
 Это уравнение сбалансировано, как написано:
2HCl(водн.)+Na2CO3(водн.)→2NaCl(водн.)+h3O(ж)+CO2(г)
Часть А
Какой объем 1,75 М HCl в литрах?
необходимо реагировать полностью (без остатка) с
0,750 л 0,100 М Na2CO3?
Выразите свой ответ тремя значащими цифрами и включите
соответствующие единицы.
Часть Б
Образец неизвестного раствора HCl объемом 557 мл вступает в реакцию.
полностью с Na2CO3 с образованием 20,1 г CO2. Что
была концентрация раствора HCl?
Выразите свой ответ тремя значащими цифрами и включите
соответствующие единицы.
Это уравнение сбалансировано, как написано:
2HCl(водн.)+Na2CO3(водн.)→2NaCl(водн.)+h3O(ж)+CO2(г)
Часть А
Какой объем 1,75 М HCl в литрах?
необходимо реагировать полностью (без остатка) с
0,750 л 0,100 М Na2CO3?
Выразите свой ответ тремя значащими цифрами и включите
соответствующие единицы.
Часть Б
Образец неизвестного раствора HCl объемом 557 мл вступает в реакцию.
полностью с Na2CO3 с образованием 20,1 г CO2. Что
была концентрация раствора HCl?
Выразите свой ответ тремя значащими цифрами и включите
соответствующие единицы.Видеоответ:
Решено проверенным экспертом
Вопрос о наилучшем совпадении:
Соляная кислота (HCl) реагирует с карбонатом натрия (Na2CO3), образуя хлорид натрия (NaCl), воду (h3O) и углекислый газ (СО2). Это уравнение сбалансировано, как написано: 2HCl(водн.)+Na2CO3(водн.)→2NaCl(водн.)+h3O(ж)+CO2(г) Часть А Какой объем 1,75 М HCl в литрах? необходимо реагировать полностью (без остатка) с 0,750 л 0,100 М Na2CO3? Выразите свой ответ тремя значащими цифрами и включите соответствующие единицы.
Часть Б Образец неизвестного раствора HCl объемом 557 мл вступает в реакцию. полностью с Na2CO3 с образованием 20,1 г CO2. Что была концентрация раствора HCl? Выразите свой ответ тремя значащими цифрами и включите соответствующие единицы.
Рекомендуемые видео
Стенограмма
нам дано следующее химическое уравнение. Я думаю, я должен сказать уравнение, которое я написал прямо здесь. Это сбалансированное химическое уравнение для части А. Оно говорит, что объем А составляет 1,75 молярных хкл в лидерах. Позвольте мне написать это снова. Найти объем лидеров, необходимый для полной реакции с 0,750 л 0,100-молярного карбоната натрия. Выразите свой ответ до трех значащих цифр с помощью единиц. Ладно, это будет не так уж плохо. Мм хм. Мы собираемся начать с нашего данного И мы собираемся сделать еще немного работы здесь. У меня 0,750 л Н. А. до гр. 0. 3. Я знаю, что моя концентрация 0,100 моль на литр. И вы можете видеть, что теперь я нахожусь в молях от N.A. до C. 03.


- . Конкугат BASE

 03.21
03.21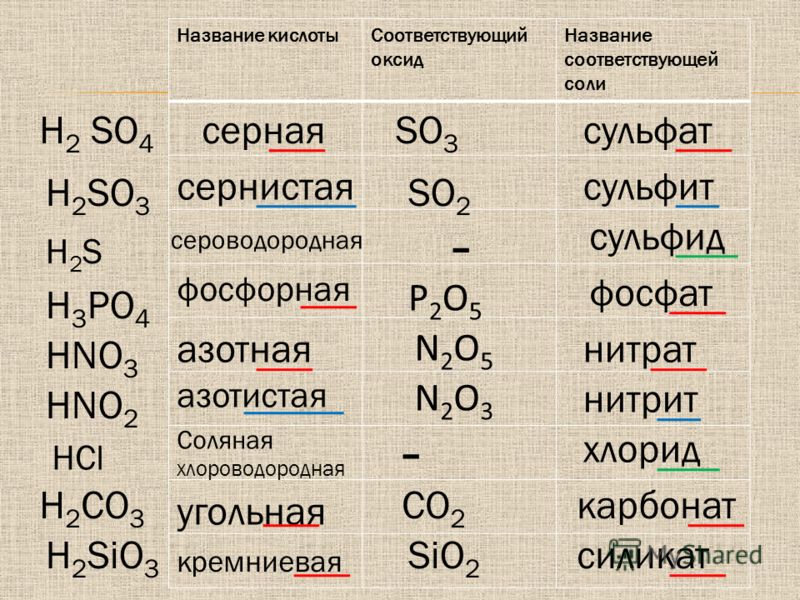
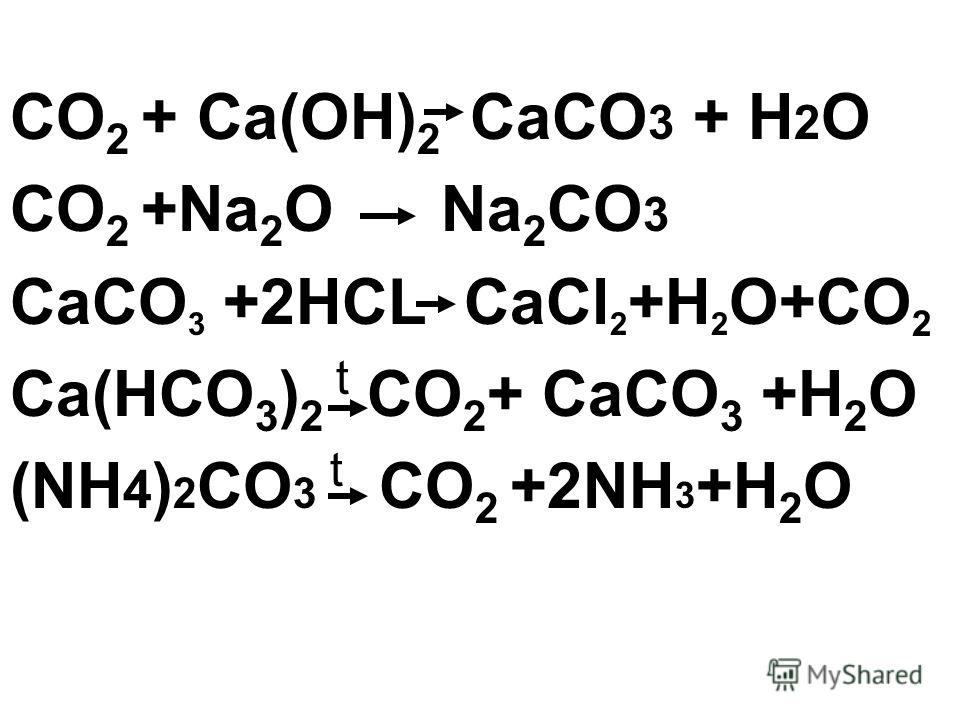
 0309 + и СО 3 2- ионы.
0309 + и СО 3 2- ионы.  15
15


 Это уравнение сбалансировано, как написано:
2HCl(водн.)+Na2CO3(водн.)→2NaCl(водн.)+h3O(ж)+CO2(г)
Часть А
Какой объем 1,75 М HCl в литрах?
необходимо реагировать полностью (без остатка) с
0,750 л 0,100 М Na2CO3?
Выразите свой ответ тремя значащими цифрами и включите
соответствующие единицы.
Часть Б
Образец неизвестного раствора HCl объемом 557 мл вступает в реакцию.
полностью с Na2CO3 с образованием 20,1 г CO2. Что
была концентрация раствора HCl?
Выразите свой ответ тремя значащими цифрами и включите
соответствующие единицы.
Это уравнение сбалансировано, как написано:
2HCl(водн.)+Na2CO3(водн.)→2NaCl(водн.)+h3O(ж)+CO2(г)
Часть А
Какой объем 1,75 М HCl в литрах?
необходимо реагировать полностью (без остатка) с
0,750 л 0,100 М Na2CO3?
Выразите свой ответ тремя значащими цифрами и включите
соответствующие единицы.
Часть Б
Образец неизвестного раствора HCl объемом 557 мл вступает в реакцию.
полностью с Na2CO3 с образованием 20,1 г CO2. Что
была концентрация раствора HCl?
Выразите свой ответ тремя значащими цифрами и включите
соответствующие единицы.