что, как сбалансировать и часто задаваемые вопросы
Хлороводород (HCl) и сульфат натрия (Na2SO4) оба являются неорганическими химическими веществами, где HCl находится в жидкой форме, а Na2SO4 представляет собой белое твердое вещество. Поговорим о HCl и Na.2SO4 реакции.
HCl или соляная кислота представляют собой химическое соединение, присутствующее в разбавленной и концентрической формах и используемое для анализа других химических веществ. Na2SO4 известен как сульфат соды и хорошо растворяется в воде.
В следующих разделах этой статьи мы поговорим о продуктах HCl и Na.2SO4 с их сопряженными парами, типом реакции, титрованием и чистыми ионными продуктами в деталях.
Что является продуктом HCl и Na2SO4Образовавшиеся продукты являются хлорид натрия (NaCl) и серная кислота (H2SO4) по реакции HCl и Na2SO4.
HCl + Na2SO4= NaCl + H2SO4
Какой тип реакции HCl+? Na2SO4Реакция HCl с Na2SO4 — это двойная замена тип реакции. В реакции катионы H+ и 2Na+ и анионы Cl– и так4– объединяются, образуя два разных продукта: NaCl и H2SO4, и заменить оба реагента.
Как сбалансировать HCl + Na2SO4Чтобы сбалансировать HCl + Na2SO4 необходимо выполнить следующие действия
- Шаг 1. Поскольку коэффициентов 4, обозначьте их как A, B, C и D. – А HCl + В Na2SO4 = C NaCl + D H2SO4
- Шаг 2 — изменить атомы с подходящими номерами, так как коэффициенты уже помечены – A = D = H, B = C = Na, C = A = Cl, D = B = SO4
- Шаг 3 – Умножьте коэффициент атомов на подходящее число.
 – А = D = 2, В = С = 1, С = А = 2, D = В = 1
– А = D = 2, В = С = 1, С = А = 2, D = В = 1
- Шаг 4 — уменьшите результат наименьшего целочисленного значения, окончательное уравнение — 2 HCl + Na2SO4 = 2 NaCl + H2SO4
Компания титрование между HCl и Na2SO4 невозможно, потому что они образуют NaCl и H2SO4 как продукты, и из-за образования кислоты невозможно рассчитать конечную точку и концентрацию неизвестного раствора.
HCl + Na2SO4 чистое ионное уравнениеnЧистое ионное уравнение – H+ + Кл–+ На+ + ТАК4– = На+ + Кл– + H+ + SO4–
- Во-первых, напишите полное уравнение с соответствующими состояниями
(л) HCl + (т) Na2SO4 = (т) NaCl + (л) H2SO4
- Теперь разделите атомы на ионы, что является чистой ионной реакцией.

H+ + Кл– + На+ + ТАК4– = На+ + Кл– + H+ + SO4–
HCl + Na2SO4 сопряженные пары- Сопряженная пара кислоты HCl представляет собой Cl– Использование темпера с изогнутым основанием.
- Сопряженная пара Na2SO4 основание НSO4– кислота.
- Компания межмолекулярные силы которые связывают HCl, являются диполь-дипольные взаимодействия и лондоновская дисперсионная сила притяжения.
- Ин На2SO4 применяются следующие межмолекулярные силы: сильная электростатическая сила и слабая электростатическая сила
Компания энтальпия реакции равен нулю для реакции, HCl + Na2SO4 = NaCl + H2SO4 потому что изменение энергии реакции положительно, что означает, что никакая внешняя энергия не передается реагентам.
Реакция HCl и Na2SO4 не может действовать как буферный раствор, потому что продуктами реакции являются NaCl, который является сильным основанием, и H2SO4 которая является сильной кислотой, а сильная кислота и основание вместе не могут быть буферным раствором.
HCl + Na2SO4 полная реакцияHCl + Na2SO4 является полной реакцией. Продуктами реакции являются NaCl и H.2SO4 один представляет собой полный комплекс соли (NaCl), а другой — сильную кислоту (H2SO4) оба представляют собой полные комплексы химических соединений.
HCl + Na2SO4 экзотермическая или эндотермическая реакцияРеакция HCl и Na2SO4 есть экзотермическая реакция. Разрыв связей между HCl и Na2SO4 нагревается, выделяя приличное количество энергии.
HCl+Na2SO4 — это окислительно-восстановительная реакция как продукт реакции HCl + Na2SO4 представляет собой NaCl, который восстанавливается, тогда как H2SO4 окисляется в конце реакции.
HCl + Na2SO4 реакция осажденияHCl + Na2SO4 не реакция осаждения. Продукты NaCl и H2SO4 который сам по себе является жидкостью, но NaCl представляет собой соль, хорошо растворимую в жидкости, и не происходит осаждения какого-либо химического соединения.
HCl + Na2SO4 обратимая или необратимая реакцияHCl + Na2SO4 необратимая реакция. Конечными продуктами являются NaCl и H.2SO4 оба представляют собой полные комплексы химических соединений и не могут быть превращены в реагенты.
HCl + Na2SO4 является реакцией смещения. В этой реакции Na2+ ион вытесняет H+ с образованием NaCl, а ион водорода также вытесняет SO4- чтобы сформировать H2SO4 как конечный продукт.
ЗаключениеСильная кислота HCl в основном используется для анализа различных органических соединений или кислотно-щелочного анализа. На2SO4 используется в качестве сушильного материала при производстве моющих средств, а также при производстве бумажной массы в крафт-процессе.
Ионные уравнения — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
(Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Cu2+
Al3+
ИОННЫЕ УРАВНЕНИЯ.
NO3Na+
СO32-
ОПЫТ № 1.
ПРОВЕДИТЕ РЕАКЦЮ МЕЖДУ
РАСТВОРАМИ
хлорида натрия и нитрата серебра
ЗАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ
NaCl + AgNO3 = NaNO3 + AgCl
ЧТО ТАКОЕ ДИССОЦИАЦИЯ?
ЗАПИШИТЕ УАВНЕНИЯ ДИССОЦИАЦИИ
ВЕЩЕСТВ:
NaCl =
AgNO3 =
http://him.1september.ru/
УРАВНЕНИЯ ДИССОЦИАЦИИ (РАСПАДА)
NaCl =
Na+
+
Cl-
AgNO3 = Ag+ + NO3-
Na+
Ag+
NO3-
Что находится в растворах
хлорида натрия и нитрата серебра?
Между чем будет происходить
взаимодействие (реакция) в растворах
веществ?
Между какими ионами произошло
взаимодействие и что образовалось?
СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ
Ag++ Cl- = AgCl↓
ЧТО ПОКАЗЫВАЕТ СОКРАЩЕННОЕ
ИОННОЕ УРАВНЕНИЕ?
Если дописать в левую и правую части
сокращенного ионного уравнения
Ag+ + Cl- = AgCl↓
ионы, между которыми не произошло
взаимодействие
получим
ПОЛНОЕ ИОННОЕ УРАВНЕНИЕ
Na++ Cl- + Ag++ NO3- = AgCl↓+ Na++ NO3 —
ВЫВОДЫ:
1.
 РЕАКЦИ В РАСВОРАХ ЭЛЕКТРОЛИТОВ
РЕАКЦИ В РАСВОРАХ ЭЛЕКТРОЛИТОВИДУТ МЕЖДУ ИОНАМИ
2. РЕАКЦИИ МЕЖДУ ИОНАМИ
НАЗЫВАЮТСЯ РЕАКЦИЯМИ ИОННОГО
ОБМЕНА
3. УРАВНЕНИЯ ТАКИХ РЕАКЦИЙ
НАЗЫВАТСЯ ИОННЫМИ УРАВНЕНИЯМИ
УЧИМСЯ ПИСАТЬ ИОННЫЕ УРАВНЕНИЯ
Молекулярное уравнение
Р
Р
Р
Н
NaCl + AgNO3 = NaNO3 + AgCl↓
распадаются (диссоциируют)
на ионы,
РР––распадаются
(диссоциируют)
на ионы,
записываем
в виде
ионовионов
записываем
в виде
(м/д,н/э)
н/э)––не
не распадаются,
распадаются,
НН(м/д,
переписываем без
переписываем
безизменения
изменения
Полное ионное уравнения
Na+ + Cl- + Ag+ + NO3- = Na+ + NO3- + AgCl↓
Полное ионное уравнение
Na+ + Cl- + Ag+ + NO3- = Na+ + NO3- + AgCl↓
Сократите в правой и левой части
уравнения одинаковые ионы
Сокращенное ионное уравнение
Ag+ + Cl- = AgCl↓
Молекулярное уравнение
NaCl + AgNO3 = NaNO3 + AgCl↓
Полное ионное уравнения
Na+ + Cl- + Ag+ + NO3- = Na+ + NO3- + AgCl↓
Сокращенное ионное уравнение
Ag+ + Cl- = AgCl↓
ОПЫТ 2.

ПРОВЕДИТЕ РЕАКЦИЮ МЕЖДУ
РАСТВОРАМИ
гидроксида калия и соляной кислоты
(в раствор гидроксида калия добавьте
ЗАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ в
молекулярном, полном ионном,
сокращенном ионном виде.
Молекулярное уравнение
Р
Р
Р м/д
KOH + HCl = KCl + h3O
Полное ионное уравнения
K+ + OH- + H++ Cl- = K+ + Cl- + h3O
Сокращенное ионное уравнение
OH- + H+ = h3O
Между какими ионами произошло
взаимодействие и что образовалось?
ОПЫТ № 3.
ПРОВЕДИТЕ РЕАКЦИЮ МЕЖДУ
РАСТВОРАМИ
карбоната натрия и соляной кислоты
ЗАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ в
молекулярном, полном ионном,
сокращенном ионном виде
h3CO3 = CO2↑+ h3O
Молекулярное уравнение
Р
р
Р
м\д
н\э
Na2CO3 + 2HCl = 2NaCl + h3O + CO2↑
Молекулярное уравнение
Na2CO3 + 2HCl = 2NaCl + h3O + CO2↑
Полное ионное уравнение
2Na+ + СO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + h3O + СO2↑
Сокращенное ионное уравнение
СO32— + 2H+ = h3O + СO2↑
Между какими ионами произошло
взаимодействие и что образовалось?
ОПЫТ № 4.

ПРОВЕДИТЕ РЕАКЦИЮ МЕЖДУ
РАСТВОРАМИ
сульфата натрия и хлорида калия
ЗАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ в
молекулярном, полном ионном,
сокращенном ионном виде
Молекулярное уравнение
Р
Р
Р
Р
Na2SO4 + 2KCl = 2NaCl + K2SO4
Полное ионное уравнение
2Na++SO42- + 2K++2Cl- = 2Na++ Cl- + 2K++ SO42-
В каких случаях реакции ионного
обмена идут до конца?
ВЫВОД:
РЕАКЦИИ ИОННОГО ОБМЕНА В
РАСТВОРАХ ЭЛЕКТРОЛИТОВ ИДУТ ДО
КОНЦА, ЕСЛИ
• ОБРАЗУЕТСЯ НЕРАСТВОРИМОЕ
ВЕЩЕСТВО (ОСАДОК)
• ВЫДЕЛЯЕТЯ ГАЗ
• ОБРАЗУЕТСЯ
МАЛОДИССОЦИИРУЮЩЕЕ
ВЕЩЕСТВО
Задание 1.
Между растворами каких веществ возможна
реакция ионного обмена?
а)
б)
в)
г)
Na2SO4 и
Al2(SO4)3 и
NaNO3 и
h3SO4 и
HNO3
BаCl2
K2SO4
NaNO3
Задание 2.
Между какими веществами реакция ионного
а) гидроксид меди (II) и серная кислота;
б) гидроксид калия и серная кислота;
в) силикат калия и соляная кислота;
г) карбонат кальция и соляная кислота.

Задание 3.
Реакция между какими электролитами идет до
конца с образованием осадка?
а) гидроксид калия и нитрат натрия
б) карбонат натрия и соляная кислота
в) нитрат меди (II) и гидроксид натрия
г) гидроксид меди (II ) и серная кислота
Молекулярное уравнение
CuSO4 + 2NaOH = Cu(OH)2↓ + 2NaCl
Полное ионное уравнение
Cu2+ + SO42- + 2Na+ + 2OH- = Cu(OH)2↓ + 2Na+ +2Cl-
Сокращенное ионное уравнение
Cu2+ + 2OH- = Cu(OH)2↓
Молекулярное уравнение
Cu(OH)2 + 2HCl = CuCl2 + 2h3O
Полное ионное уравнение
Cu(OH)2 + 2H+ + 2Cl— = Cu2+ + 2Cl— + 2h3O
Сокращенное ионное уравнение
Cu(OH)2 + 2H+ = Cu2+ + 2h3O
Молекулярное уравнение
Al2(SO4)3+ NaCl = Na2SO4 + AlCl3
Молекулярное уравнение
Al2(SO4)3+ 6NaCl = 3Na2SO4 + 2AlCl3
Полное ионное уравнение
2Al3+ + 3SO42-+ 6Na+ +6Cl- = 2Al3+ + 3SO42-+ 6Na+ +6Cl-
English Русский Правила
Что, как балансировать и часто задаваемые вопросы Na
2 SO 4 представляет собой белое твердое вещество. Поговорим о реакциях HCl и Na 2 SO 4 .
Поговорим о реакциях HCl и Na 2 SO 4 .HCl или соляная кислота представляет собой химическое соединение, присутствующее в разбавленной и концентрической формах и используемое для анализа других химических веществ. Na 2 SO 4 известен как сульфат соды и хорошо растворим в воде.
В следующих разделах этой статьи мы подробно поговорим о продуктах HCl и Na 2 SO 4 с их сопряженными парами, типе реакции, титровании и чистых ионных продуктах.
Что является продуктом HCl и Na 2 SO 4Продукты, образующиеся , представляют собой хлорид натрия (NaCl) и серную кислоту ( H 2 SO 4 ) реакцией HCl и Na 2 SO 4 .
HCl + NA 2 SO 4 = NaCl + H 2 SO 4
Какой тип реакции — HCL + 2066 2 SO 4 .
Реакция HCl с Na 2 SO 4 представляет собой реакцию двойного замещения. В реакции катионы H + и 2Na + и анионы Cl – и SO 4 – объединяются, образуя два разных продукта: NaCl и H 2 SO 4 900 оба реагента.
Как сбалансировать HCL + NA 2 SO 4Для баланса HCL + NA 2 SO 4 Следующие шаги должны быть последовали
Следующие шаги.0138 Шаг 1. Так как коэффициенты равны 4, обозначьте их как A, B, C и D – A HCl + B Na 2 SO 4 = C NaCl + D H 2 SO 4- Шаг 2 – изменить атомы с подходящими номерами, так как коэффициенты уже пронумерованы – A = D = H, B = C = Na, C = A = Cl, D = B = SO 4
- Шаг 3 – Умножьте атомный коэффициент на подходящее число – A = D = 2, B = C = 1, C = A = 2, D = B = 1
- Шаг 4 – уменьшить результат наименьшего целочисленного значения, итоговое уравнение – 2 HCl +Na 2 SO 4 = 2 NaCl +H 2 SO 4
TIT TITRATIO 2 SO 4 невозможно, так как они образуют NaCl и H 2 SO 4 в виде продуктов и из-за образования кислоты невозможно рассчитать конечную точку и концентрацию неизвестного раствора.
The net ionic equation is – H + + Cl – + Na + + SO 4 – = Na + + Cl – + H + + SO 4 –
- Сначала напишите полное уравнение с соответствующими состояниями H 2 SO 4
- Now, split the atoms into ions which is the net ionic reaction
H + + Cl – + Na + + SO 4 – = Na + + CL — + H + + SO 4 —
HCL + NA 2 SO 4 СОЗДА. Кислота HCl представляет собой Cl – основание .
- Сопряженная пара основания Na 2 SO 4 представляет собой кислоту H SO 4 – .
- Межмолекулярные силы, которые связывают HCl, представляют собой диполь-дипольные взаимодействия и лондоновскую дисперсионную силу притяжения.
- в NA 2 SO 4 Следующие межмолекулярные силы применяются, сильная электростатическая сила и слабая электростатическая сила
Энтальпия реакции равна нулю для реакции, HCl + Na 2 SO 4 = NaCl + H 2 SO 4 потому что изменение энергии реакции положительное, что означает, что положительно никакой внешней энергии реагентам не передается.
Реакция HCl и Na 2 SO 4 которые не могут выступать в качестве продуктов реакции буферного раствора является сильным основанием и H 2 SO 4 , который является сильной кислотой, а сильная кислота и основание вместе не могут быть буферным раствором.
Is HCl + Na 2 SO 4 полная реакцияHCl + Na 2 SO 4 полная реакция. Продуктами реакции являются NaCl и H 2 SO 4 , один представляет собой полный комплекс соли (NaCl), а другой представляет собой сильную кислоту (H 2 SO 4 ), оба являются полными комплексами химических соединений. .
Is HCl + Na 2 SO 4 экзотермическая или эндотермическая реакция Реакция HCl и Na 2 SO 4 экзотермическая реакция. Разрыв связей между HCl и Na 2 SO 4 нагревается за счет выделения большого количества энергии.
Разрыв связей между HCl и Na 2 SO 4 нагревается за счет выделения большого количества энергии.
HCl + Na0006 2 SO 4 представляет собой NaCl, который восстанавливается, тогда как H 2 SO 4 окисляется в конце реакции.
Is HCl + Na 2 SO 4 реакция осажденияHCl + Na 2 SO 4 не является реакцией осаждения. Продуктами являются NaCl и H 2 SO 4 , которые сами по себе являются жидкостью, но NaCl представляет собой соль, которая хорошо растворяется в жидкости, и не происходит осаждения каких-либо химических соединений.
Is HCl + Na 2 SO 4 обратимая или необратимая реакция HCl + Na 7 необратимая реакция.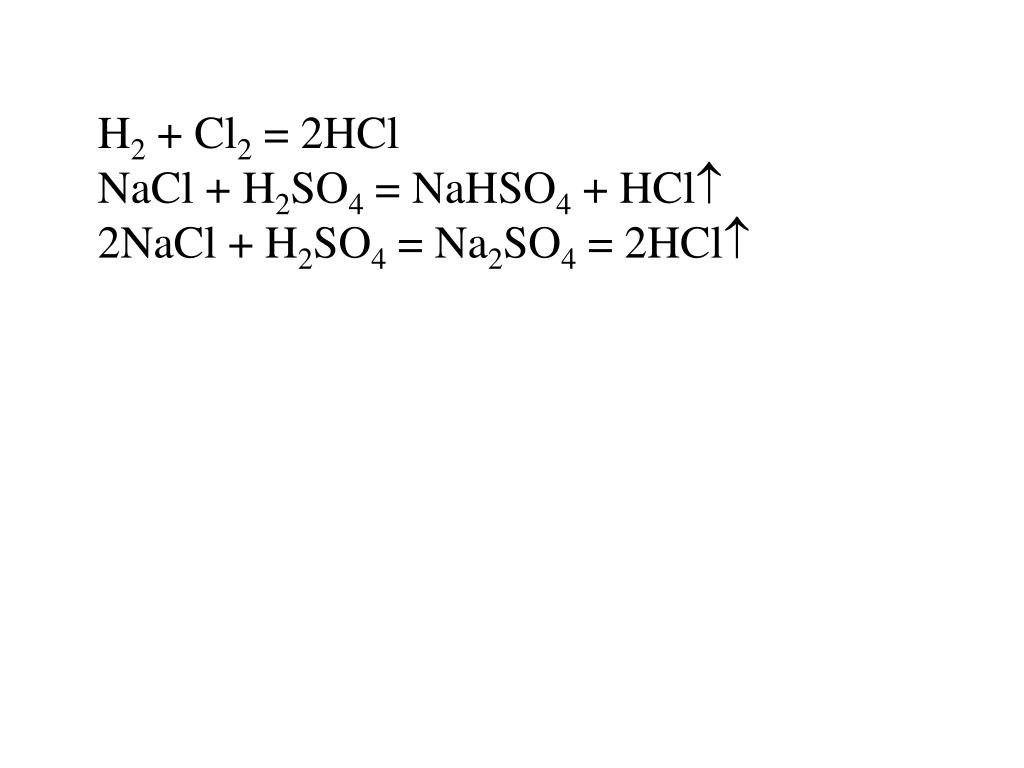 Конечными продуктами являются NaCl и H 2 SO 4 , оба представляют собой полные комплексы химических соединений и не могут быть превращены в реагенты.
Конечными продуктами являются NaCl и H 2 SO 4 , оба представляют собой полные комплексы химических соединений и не могут быть превращены в реагенты.
HCl + Na 2 SO 4 представляет собой реакцию замещения. В этой реакции ион Na 2+ вытесняет ион H + с образованием NaCl, а ион водорода также вытесняет SO 4- с образованием H 2 SO 4 в качестве конечного продукта.
ЗаключениеСильная кислота HCl в основном используется для анализа различных органических соединений или кислотно-щелочного анализа. Na 2 SO 4 используется в качестве осушителя при производстве моющих средств, а также при производстве бумажной массы в крафт-процессе.
химия
ссылка на Na2so4 Льюис Структура и характеристики: 17 Полные фактыNa2so4 Льюис Структура и характеристики: 17 Полные факты
Натриевая соль серной кислоты известна как сульфат натрия. Изучим некоторые факты о структуре Льюиса Na2so4.
Na2SO4 — это химическая формула сульфата натрия. Молекулярная масса…
Изучим некоторые факты о структуре Льюиса Na2so4.
Na2SO4 — это химическая формула сульфата натрия. Молекулярная масса…
Продолжить чтение
ссылка на Как ковалентная HCL: Почему, как и подробные объясненияКак ковалентная HCL: Почему, как и подробные объяснения
В этой статье мы обсудим, как ковалентна HCl: почему, как и подробное объяснение, а также опишем структуру Льюиса HCL. Соляная кислота представляет собой простую двухатомную молекулу, состоящую из…
Продолжить чтение
NETIONIC.HTM
NETIONIC.HTM Краткое изложение многоатомных ионов и правила растворимости приведены в конце этого руководства.
Краткое изложение многоатомных ионов и правила растворимости приведены в конце этого руководства.  ) PbCl 2
) PbCl 2 В этот момент можно исключить те ионы, которые не участвовали в реакции. Обратите внимание, что нитрат-ионы и ионы водорода остаются неизменными по обе стороны реакции.
Остается чистое ионное уравнение, показывающее только те химические соединения, которые участвуют в химическом процессе:
 ) + Na 2 SO 4 (водн.) ?
) + Na 2 SO 4 (водн.) ? Один из способов решить эту проблему — исследовать, какие ионы вместе плавают в растворе: Ba 2+ , Br — , Na + и SO 4 2- . Мы знали, что ионы бария и ионы брома растворимы вместе, но будут ли ионы натрия или ионы сульфата соединяться с ионами бария, образуя нерастворимое соединение? Ионы бария и ионы натрия, имеющие положительный заряд, будут отталкивать друг друга, поэтому ожидается, что между ними не образуется никакого соединения. С другой стороны, ионы сульфата и ионы бария могут легко образовывать сульфат бария. Теперь остается только свериться с правилами растворимости, чтобы узнать, растворим или не растворим сульфат бария. По этим правилам растворимы все сульфаты, кроме стронция, бария и свинца; серебро и сульфат кальция частично растворимы. Как видите, сульфат бария будет нерастворимым. Следовательно, ионы натрия должны соединяться с ионами брома с образованием бромида натрия.

 – А = D = 2, В = С = 1, С = А = 2, D = В = 1
– А = D = 2, В = С = 1, С = А = 2, D = В = 1
