Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Ртуть
Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Нахождение в природе
- 2.1 Месторождения
- 3 В окружающей среде
- 4 Изотопы
- 5 Получение
- 6 Физические свойства
- 7 Химические свойства
- 7.1 Характерные степени окисления
- 7.2 Свойства металлической ртути
- 8 Применение ртути и её соединений
- 8.
 1 Медицина
1 Медицина - 8.2 Техника
- 8.3 Металлургия
- 8.4 Химическая промышленность
- 8.5 Сельское хозяйство
- 8.
- 9 Токсикология ртути
- 9.1 Гигиеническое нормирование концентраций ртути
- 9.2 Демеркуризация
- 9.3 Запрет использования содержащей ртуть продукции
История
Астрономический символ планеты Меркурий
Ртуть известна с древних времён. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твёрдость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 году. Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий. Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.
Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.
Происхождение названия
Русское название ртути происходит от праслав. *rьtǫtь, связанного с лит. rìsti «катиться». Символ Hg заимствован от латинского алхимического названия этого элемента hydrargyrum (от др.-греч. ὕδωρ «вода» и ἄργυρος «серебро»).
Нахождение в природе
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg).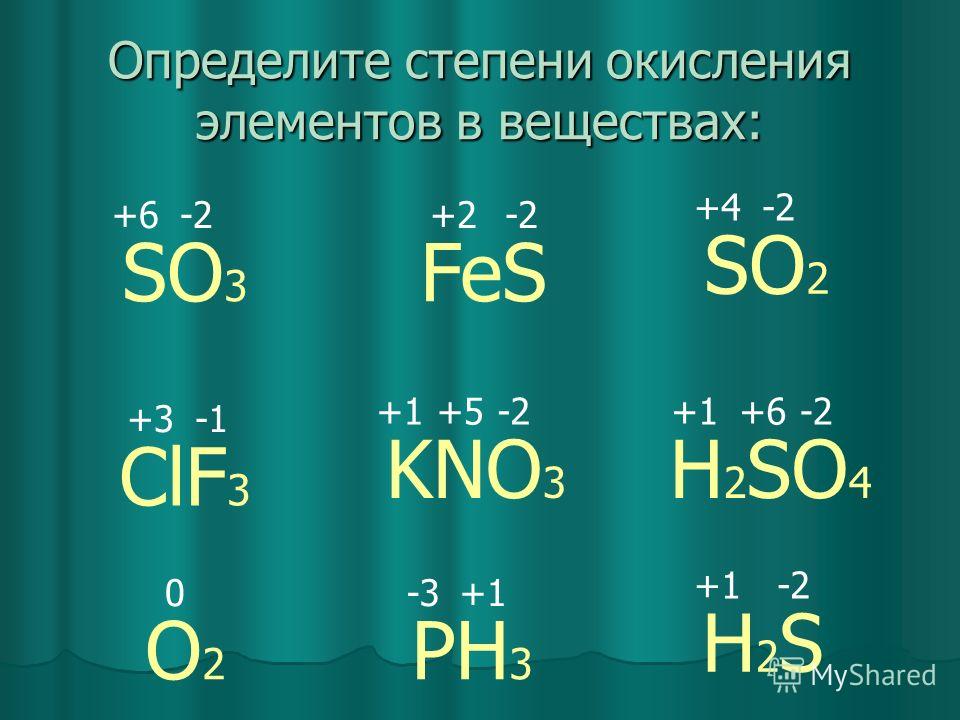 В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
Месторождения
Ртуть считается редким металлом.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
В окружающей среде
Содержание ртути в ледниках за 270 лет
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие, как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Изотопы
Основная статья: Изотопы ртути
Природная ртуть состоит из смеси 7 стабильных изотопов: 196Hg (распространённость 0,155 %), 198Hg (10,04 %), 199Hg (16,94 %), 200Hg (23,14 %), 201Hg (13,17 %), 202Hg (29,74 %), 204Hg (6,82 %). Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210.
Получение
Ртуть получают обжигом киновари (сульфида ртути II) или металлотермическим методом:
- HgS + O2 ⟶ Hg + SO2↑
- HgS + Fe ⟶ FeS↓ + Hg
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия во владениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества.
ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов (VI—IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски.
Физические свойства
100 граммовая гирька, не тонет в металлическая ртути, из-за разницы по плотности
Металлическая ртуть
Переливание ртути из сосуда в сосуд
Ртуть — единственный металл, который находится в жидком состоянии при комнатной температуре. Температура плавления составляет 234,32 K (-38,83 °C), кипит при 629,88 K (356,73 °C), критическая точка — 1750 K (1477 °C), 152 МПа (1500 атм). Обладает свойствами диамагнетика. Образует со многими металлами жидкие и твёрдые сплавы — амальгамы. Стойкие к амальгамированию металлы: V, Fe, Mo, Cs, Nb, Ta, W, Co.
Плотность ртути при нормальных условиях — 13 546 кг/м3, при других температурах — в таблице:
| Температура в °С | Плотность (ρ), 103 кг/м3 | Температура в °С | Плотность (ρ), 103 кг/м3 |
| 0 | 13,5950 | 50 | 13,4725 |
| 5 | 13,5827 | 55 | 13,4601 |
| 10 | 13,5704 | 60 | 13,4480 |
| 15 | 13,5580 | 65 | 13,4358 |
| 20 | 13,5457 | 70 | 13,4237 |
| 25 | 13,5335 | 75 | 13,4116 |
| 30 | 13,5212 | 80 | 13,3995 |
| 35 | 13,5090 | 90 | 13,3753 |
| 40 | 13,4967 | 100 | 13,3514 |
| 45 | 13,4845 | 300 | 12,875 |
Химические свойства
Характерные степени окисления
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
|---|---|---|---|---|
| +1 | Hg2O | <Hg2(OH)2или Hg2O•H2O>* | Слабоосновный | Склонность к диспропорционированию |
| +2 | HgO | <Hg(OH)2>** | Очень слабое основание, иногда — амфотерный |
- *Гидроксид не получен, существуют только соответствующие соли.

- **Гидроксид существует только в очень разбавленных (<10−4моль/л) растворах.
Диаграмма Пурбе системы Hg-HgO
Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg22+ со связью металл-металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании:
- Hg22+ → Hg + Hg2+
подщелачивании:
- Hg22+ + 2OH− → Hg + HgO + H2O
добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся.
На холоде ртуть +2 и металлическая ртуть, наоборот, сопропорционируют. Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I):
Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I):
- Hg + Hg(NO3)2 → Hg2(NO3)2
В степени окисления +2 ртуть образует катионы Hg2+, которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (<10−4моль/л) растворах. В более концентрированных растворах он дегидратируется:
- Hg2+ + 2OH− → HgO + H2O
В очень концентрированной щёлочи оксид ртути частично растворяется с образованием гидроксокомплекса:
- HgO + OH− + H2O → [Hg(OH)3]−
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Из элементов IIБ группы именно у ртути появляется возможность разрушения очень устойчивой 6d10 — электронной оболочки, что приводит к возможности существования соединений ртути IV, но они крайне малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной, чем к характерной. В частности, при взаимодействии атомов ртути и смеси неона и фтора при температуре 4 К получен HgF4. Однако более новые исследования не подтвердили его существование.
Свойства металлической ртути
Ртуть — малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке с образованием тетрахлорортутной кислоты:
- 3Hg + 2HNO3 + 12HCl → 3H2[HgCl4] + 2NO↑ + 4H2O
и азотной кислоте:
- Hg + 4HNO3 → Hg(NO3)2 + 2NO2↑ + 2H2O
Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути:
- Hg + 2H2SO4 → HgSO4 + SO2↑ + 2H2O
При растворении избытка ртути в азотной кислоте на холоде образуется нитрат диртути Hg2(NO3)2.
При нагревании до 300 °C ртуть вступает в реакцию с кислородом:
- 2Hg + O2 →300∘C 2HgO
При этом образуется оксид ртути II красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ.
- 2HgO →>340∘C 2Hg + O2↑
Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода.
При нагревании ртути с серой образуется сульфид ртути II:
- Hg + S →t∘C HgS
Ртуть также реагирует с галогенами (причём на холоде — медленно).
Ртуть можно окислить также щелочным раствором перманганата калия:
- Hg + 2KMnO4 + 3KOH → K[Hg(OH)3] + 2K2MnO4
и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути.
Словенский город Идрия — крупнейший в Европе центр добычи ртути с XV века
Применение ртути и её соединений
Медицина
В связи с высокой токсичностью ртуть почти полностью вытеснена из медицинских препаратов. Её соединения (в частности, мертиолят) иногда используются в малых количествах как консервант для вакцин. Сама ртуть сохраняется в ртутных медицинских термометрах (один медицинский термометр содержит до 2 г ртути).
Её соединения (в частности, мертиолят) иногда используются в малых количествах как консервант для вакцин. Сама ртуть сохраняется в ртутных медицинских термометрах (один медицинский термометр содержит до 2 г ртути).
Однако вплоть до 1970-х годов соединения ртути использовались в медицине очень активно:
- хлорид ртути I (каломель) — слабительное;
- меркузал и промеран — сильные мочегонные;
- хлорид ртути II, цианид ртути II , амидохлорид ртути и жёлтый оксид ртути II — антисептики (в том числе в составе мазей).
Известны случаи, когда при завороте кишок больному вливали в желудок стакан ртути. По мнению древних врачевателей, предлагавших такой метод лечения, ртуть благодаря своей тяжести и подвижности должна была пройти по кишечнику и под своим весом расправить его перекрутившиеся части.
Планета Меркурий (проявление ртути) в виде врача с лекарством. Миниатюра XV в.
Препараты ртути применяли с XVI в. (в СССР вплоть до 1963 года) для лечения сифилиса. Это было обусловлено тем, что бледная трепонема, вызывающая сифилис, обладает высокой чувствительностью к органическим и неорганическим соединениям, блокирующим сульфгидрильные группы тиоловых ферментов микроба — соединениям ртути, мышьяка, висмута и йода. Однако такое лечение было недостаточно эффективно и весьма токсично для организма больного, приводя к полному выпадению волос и высокому риску развития серьезных осложнений; причем возможности повышения дозы препаратов ртути или мышьяка при недостаточной противосифилитической активности стандартных доз ограничивались именно токсичностью для организма больного. Также применялись методики общей меркуризации организма, при которой больной помещался в нагревающуюся емкость, куда подавались пары ртути. Данная методика, хотя и была относительно эффективна, но побочные эффекты и риск смертельного отравления ртутью привел к постепенному вытеснению её из клинической практики.
Это было обусловлено тем, что бледная трепонема, вызывающая сифилис, обладает высокой чувствительностью к органическим и неорганическим соединениям, блокирующим сульфгидрильные группы тиоловых ферментов микроба — соединениям ртути, мышьяка, висмута и йода. Однако такое лечение было недостаточно эффективно и весьма токсично для организма больного, приводя к полному выпадению волос и высокому риску развития серьезных осложнений; причем возможности повышения дозы препаратов ртути или мышьяка при недостаточной противосифилитической активности стандартных доз ограничивались именно токсичностью для организма больного. Также применялись методики общей меркуризации организма, при которой больной помещался в нагревающуюся емкость, куда подавались пары ртути. Данная методика, хотя и была относительно эффективна, но побочные эффекты и риск смертельного отравления ртутью привел к постепенному вытеснению её из клинической практики.
Амальгаму серебра применяли в стоматологии в качестве материала зубных пломб до появления светоотверждаемых материалов.
Ртуть-203 (T1/2 = 53 сек) используется в радиофармакологии.
Техника
- Ртуть используется как рабочее тело в ртутных термометрах (особенно высокоточных), так как (а) обладает довольно широким диапазоном, в котором находится в жидком состоянии, (б) её коэффициент термического расширения почти не зависит от температуры и (в) обладает сравнительно малой теплоёмкостью. Сплав ртути с таллием используется для низкотемпературных термометров.
- Парами ртути заполняют люминесцентные лампы, поскольку пары светятся в тлеющем разряде. В спектре испускания паров ртути много ультрафиолетового света и, чтобы преобразовать его в видимый, стекло люминесцентных ламп изнутри покрывают люминофором. Без люминофора ртутные лампы являются источником жёсткого ультрафиолета (254 нм), в каковом качестве и используются для обеззараживания помещений. Такие лампы делают из кварцевого стекла, пропускающего ультрафиолет, поэтому они называются кварцевыми.
- Ртутные электрические вентили (игнитроны) в мощных выпрямительных устройствах, электроприводах, электросварочных устройствах, тяговых и выпрямительных подстанциях и т.
 п. со средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ.
п. со средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ. - Ртуть и сплавы на её основе используются в герметичных выключателях, включающихся при определённом положении.
- Ртуть используется в датчиках положения.
- В некоторых химических источниках тока (например, ртутно-цинковых), в эталонных источниках напряжения (Нормальный элемент Вестона).
- Ртуть также иногда применяется в качестве рабочего тела в тяжелонагруженных гидродинамических подшипниках.
- Ртуть ранее входила в состав некоторых биоцидных красок для предотвращения обрастания корпуса судов в морской воде. Сейчас запрещается использовать такого типа покрытия.
- Йодид ртути I используется как полупроводниковый детектор радиоактивного излучения.
- Фульминат ртути II («гремучая ртуть») издавна применяется в качестве инициирующего ВВ (Детонаторы).
- Бромид ртути I применяется при термохимическом разложении воды на водород и кислород (атомно-водородная энергетика).
- Перспективно использование ртути в сплавах с цезием в качестве высокоэффективного рабочего тела в ионных двигателях.

- До середины XX века ртуть широко применялась в барометрах, манометрах и сфигмоманометрах (отсюда традиция измерять давление в миллиметрах ртутного столба).
- Низкое давление насыщенного пара определяет использование ртути в качестве вакуумного материала. Так, ртутные вакуумные насосы были основными источниками вакуума в XIX и начале XX веков.
- Ранее ртуть использовали для золочения поверхностей методом амальгамирования, однако в настоящее время от этого метода отказались из-за токсичности ртути.
- Соединения ртути использовались в шляпном производстве для выделки фетра.
Металлургия
- Металлическая ртуть применяется для получения целого ряда важнейших сплавов.
- Ранее различные амальгамы металлов, особенно золота и серебра, широко использовались в ювелирном деле, в производстве зеркал.
- Металлическая ртуть служит катодом для электролитического получения ряда активных металлов, хлора и щелочей. Сейчас вместо ртутных катодов используют электролиз с диафрагмой.

- Ртуть используется для переработки вторичного алюминия (см. амальгамация)
- Ртуть хорошо смачивает золото, поэтому ей обрабатывают золотоносные глины для выделения из них этого металла. Эта технология распространена, в частности, в Амазонии.
Химическая промышленность
- Соли ртути использовали в качестве катализатора промышленного получения ацетальдегида из ацетилена (реакция Кучерова), однако в настоящее время ацетальдегид получают прямым каталитическим окислением этана или этена.
- Реактив Несслера используется для количественного определения аммиака.
- При производстве хлора и едких щелочей путем электролиза иногда применяется жидкий ртутный катод.
Сельское хозяйство
Высокотоксичные соединения ртути — каломель, сулему, мертиолят и другие — используют для протравливания семенного зерна и в качестве пестицидов.
Токсикология ртути
Основная статья: Отравление ртутью
NFPA 704 для данного вещества (синее — опасность для здоровья, красное — огнеопасность, жёлтое — реакционноспособность)
Ртуть и все её соединения ядовиты. Воздействие ртути — даже в небольших количествах — может вызывать серьёзные проблемы со здоровьем и представляет угрозу для внутриутробного развития плода и развития ребёнка на ранних стадиях жизни. Ртуть может оказывать токсическое воздействие на нервную, пищеварительную и иммунную системы, а также на легкие, почки, кожу и глаза. ВОЗ рассматривает ртуть в качестве одного из десяти основных химических веществ или групп химических веществ, представляющих значительную проблему для общественного здравоохранения.
Воздействие ртути — даже в небольших количествах — может вызывать серьёзные проблемы со здоровьем и представляет угрозу для внутриутробного развития плода и развития ребёнка на ранних стадиях жизни. Ртуть может оказывать токсическое воздействие на нервную, пищеварительную и иммунную системы, а также на легкие, почки, кожу и глаза. ВОЗ рассматривает ртуть в качестве одного из десяти основных химических веществ или групп химических веществ, представляющих значительную проблему для общественного здравоохранения.
Наиболее ядовиты пары́ и растворимые соединения ртути. Сама металлическая ртуть менее опасна, однако она постепенно испаряется даже при комнатной температуре. Пары могут вызвать тяжёлое отравление. Ртуть и её соединения (сулема, каломель, киноварь, цианид ртути) поражают нервную систему, печень, почки, желудочно-кишечный тракт, при вдыхании — дыхательные пути (а проникновение ртути в организм чаще происходит именно при вдыхании её паров, не имеющих запаха). По классу опасности ртуть относится к первому классу (чрезвычайно опасное химическое вещество). Опасный загрязнитель окружающей среды, особенно опасны выбросы в воду, поскольку в результате деятельности населяющих дно микроорганизмов происходит образование растворимой в воде и токсичной метилртути, накапливающейся в рыбе. Ртуть — типичный представитель кумулятивных ядов.
Опасный загрязнитель окружающей среды, особенно опасны выбросы в воду, поскольку в результате деятельности населяющих дно микроорганизмов происходит образование растворимой в воде и токсичной метилртути, накапливающейся в рыбе. Ртуть — типичный представитель кумулятивных ядов.
Органические соединения ртути (диметилртуть и др.) в целом намного токсичнее, чем неорганические, прежде всего из-за их липофильности и способности более эффективно взаимодействовать с элементами ферментативных систем организма.
Гигиеническое нормирование концентраций ртути
Предельно допустимые уровни загрязнённости металлической ртутью и её парами:
- ПДК в населённых пунктах (среднесуточная) — 0,0003 мг/м³
- ПДК в жилых помещениях (среднесуточная) — 0,0003 мг/м³
- ПДК воздуха в рабочей зоне (макс. разовая) — 0,01 мг/м³
- ПДК воздуха в рабочей зоне (среднесменная) — 0,005 мг/м³
- ПДК сточных вод (для неорганических соединений в пересчёте на двухвалентную ртуть) — 0,005 мг/л
- ПДК водных объектов хозяйственно-питьевого и культурного водопользования, в воде водоёмов — 0,0005 мг/л
- ПДК рыбохозяйственных водоёмов — 0,00001 мг/л
- ПДК морских водоёмов — 0,0001 мг/л
Демеркуризация
Основная статья: Демеркуризация
Очистка помещений и предметов от загрязнений металлической ртутью и источников ртутных паров называется демеркуризацией. В быту широко применяется демеркуризация с помощью серы и хлорного железа FeCl3.
В быту широко применяется демеркуризация с помощью серы и хлорного железа FeCl3.
Запрет использования содержащей ртуть продукции
Основная статья: Минаматская конвенция о ртути
С 2020 года международная конвенция, названная в честь массового отравления ртутью и подписанная многими странами, запретит производство, экспорт и импорт нескольких различных видов ртутьсодержащих продуктов, применяемых в быту, в том числе электрических батарей, электрических выключателей и реле, некоторых видов компактных люминесцентных ламп (КЛЛ), люминесцентных ламп с холодным катодом или с внешним электродом, ртутных термометров и приборов измерения давления. Конвенция вводит регулирование использования ртути и ограничивает ряд промышленных процессов и отраслей, в том числе горнодобывающую (особенно непромышленную добычу золота), производство цемента.
Ртуть в окружающей среде может находиться в степенях окисления 0, +1, a…
Recent Channels
- General Chemistry
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Biology
- General Биология
- Микробиология
- Анатомия и физиология
- Генетика
- Cell Biology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Business
- Microeconomics
- Macroeconomics
- Financial Accounting
Social Sciences
- Psychology
Начните вводить текст, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
- 10. Периодические свойства элементов
- Периодический тренд: Энергия ионизации
Задача
Соответствующее решение
2 м
Воспроизвести видео:
Всем привет, в этом примере нам нужно рассчитать экспериментальную энергию ионизации и единицы джоулей на моль для стронция 10. . Если их экспериментальные заряды составляют 7,35 электрон-вольт и 5,69 электрон-вольт. Итак, начиная с нашего расчета энергии ионизации для 10, мы помним, что мы начали бы это, приняв его заряд, указанный в подсказке, равным 7,35 электровольт. Мы собираемся вспомнить заряд электрона, который составляет 1,602 умножить на 10 до минус 19.й силовых жулей за электрическое хранилище. Что позволит нам отменить наши единицы электрон-вольт. Но поскольку мы хотим, чтобы наши последние юниты были убиты jules Permal, мы должны умножить на коэффициент преобразования, где мы помним, что для одного драгоценного камня у нас есть наш префикс килограмм, что означает 10 кило драгоценных камней в отрицательной третьей степени.
 Далее мы собираемся умножить на, потому что мы сможем аннулировать наши драгоценности. Итак, мы хотим получить два кг на моль, вспоминая число авокадо, которое говорит нам, что у нас есть шесть целых 22 умножить на 10 атомов в 23-й степени. Итак, теперь мы получим значение, равное 549.кг драгоценных камней Permal как наша энергия ионизации для стронция на атом стронция. Итак, для наших окончательных ответов у нас есть эти два значения, которые были помещены здесь, чтобы завершить этот пример. Поэтому я надеюсь, что все, что я объяснил, было понятно. Если у вас есть какие-либо вопросы, пожалуйста, оставьте их ниже. В противном случае я увижу всех в следующем практическом видео.0005
Далее мы собираемся умножить на, потому что мы сможем аннулировать наши драгоценности. Итак, мы хотим получить два кг на моль, вспоминая число авокадо, которое говорит нам, что у нас есть шесть целых 22 умножить на 10 атомов в 23-й степени. Итак, теперь мы получим значение, равное 549.кг драгоценных камней Permal как наша энергия ионизации для стронция на атом стронция. Итак, для наших окончательных ответов у нас есть эти два значения, которые были помещены здесь, чтобы завершить этот пример. Поэтому я надеюсь, что все, что я объяснил, было понятно. Если у вас есть какие-либо вопросы, пожалуйста, оставьте их ниже. В противном случае я увижу всех в следующем практическом видео.0005Современная теория атомной теории: Ионизационная энергия
по гильот -химии
54Views
Периодические тенденции: Ионизация энергия
по научной классе
131Views
.
Периодические тренды: электроотрицательность, энергия ионизации, атомный радиус и сродство к электрону
by London Jenks
117views
Энергия ионизации и атомный радиус
Тайлер ДеВитт
70просмотров
Тенденции периодической таблицы
Дуэлл Химия
89просмотров
Периодическая таблица ОБЪЯСНЕНИЕ | Химические семейства и периодические тренды
от The Science Classroom
103views
Периодические тренды: электроотрицательность, энергия ионизации, атомный радиус Электроотрицательность
от профессора Дейва объясняет
66views
Периодическая тенденция: Ионизация Энергии
от Жюля Бруно
286views
ПЕРИОСИЧЕСКАЯ ТРЕНДА: Ионизация.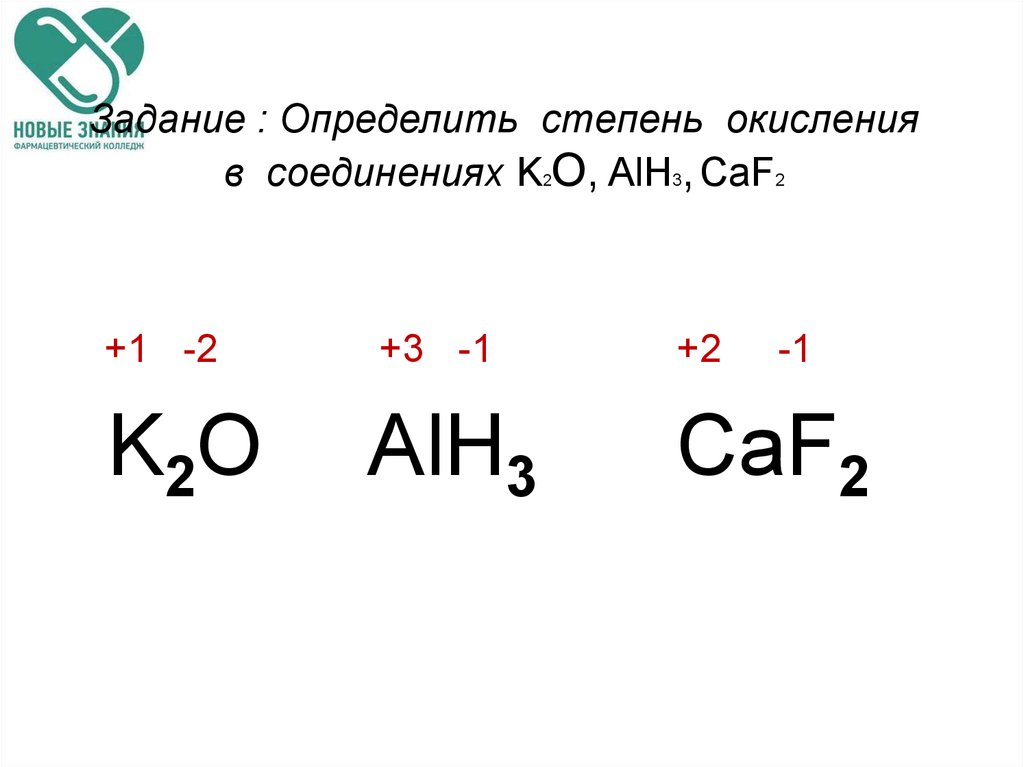 Пример 10005
Пример 10005
. by Jules Bruno
163views
Периодический тренд: энергия ионизации
by Jules Bruno
137views
Mercury | Определение, использование, плотность и факты
Mercury
Посмотреть все СМИ
- Ключевые люди:
- Георг Брандт
- Похожие темы:
- переработка ртути эндокринный разрушитель нейротоксин отравление ртутью Болезнь Минамата
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
ртуть (Hg) , также называемая ртутью , химический элемент, жидкий металл группы 12 (IIb, или группы цинка) периодической таблицы.
| atomic number | 80 |
|---|---|
| atomic weight | 200. 592 592 |
| melting point | −38.83 °C (−37.89 °F) |
| boiling point | 356,62 °С (673,91 °F) |
| удельный вес | 13,5 при 20 °C (68 °F) |
| валентность | 1, 2 |
| электронная конфигурация | 2-8-18-3 (2-8-25-3) f 14 5 d 10 6 s 2 |
также был известен на Востоке как Меркурий 1 в Египте 9005
. Название ртуть возникло в алхимии 6-го века, в которой символ планеты использовался для обозначения металла; химический символ Hg происходит от латинского Hydrargyrum , «жидкое серебро». Хотя его токсичность была признана на раннем этапе, его основное применение было в медицинских целях.
Ртуть — единственный элементарный металл, который находится в жидком состоянии при комнатной температуре. (Цезий плавится при температуре около 28,5 ° C [83 ° F], галлий примерно при 30 ° C [86 ° F] и рубидий примерно при 39 ° C [102 ° F].) Ртуть серебристо-белого цвета, медленно тускнеет во влажном воздухе. , и замерзает в мягкое твердое вещество, такое как олово или свинец, при температуре -38,83 ° C (-37,89 ° F). Он кипит при 356,62 ° C (673,91 ° F).
(Цезий плавится при температуре около 28,5 ° C [83 ° F], галлий примерно при 30 ° C [86 ° F] и рубидий примерно при 39 ° C [102 ° F].) Ртуть серебристо-белого цвета, медленно тускнеет во влажном воздухе. , и замерзает в мягкое твердое вещество, такое как олово или свинец, при температуре -38,83 ° C (-37,89 ° F). Он кипит при 356,62 ° C (673,91 ° F).
Сплавы с медью, оловом и цинком образуют амальгамы или жидкие сплавы. Амальгама с серебром используется в качестве пломбы в стоматологии. Ртуть не смачивает стекло и не прилипает к нему, и это свойство в сочетании с ее быстрым и равномерным объемным расширением во всем жидком диапазоне сделало ее полезной в термометрах. (Ртутные термометры были вытеснены более точными электронными цифровыми термометрами в начале 21 века.) Барометры и манометры также использовали его высокую плотность и низкое давление пара. Однако токсичность ртути привела к ее замене в этих приборах. Золото и серебро легко растворяются в ртути, и в прошлом это свойство использовалось для извлечения этих металлов из их руд.
Викторина «Британника»
Викторина «118 названий и символов периодической таблицы»
Хорошая электропроводность ртути делает ее исключительно полезной в герметичных электрических переключателях и реле. Электрический разряд через пары ртути, содержащиеся в трубке или колбе из плавленого кварца, создает голубоватое свечение, богатое ультрафиолетовым светом, явление, используемое в ультрафиолетовых, люминесцентных и ртутных лампах высокого давления. Некоторое количество ртути используется при приготовлении фармацевтических препаратов, а также сельскохозяйственных и промышленных фунгицидов.
В 20 веке использование ртути в производстве хлора и гидроксида натрия путем электролиза рассола зависело от того факта, что ртуть, используемая в качестве отрицательного полюса или катода, растворяет выделяющийся натрий с образованием жидкой амальгамы. Однако в начале 21 века заводы с ртутными элементами для производства хлора и гидроксида натрия в основном были выведены из эксплуатации.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Ртуть встречается в земной коре в среднем в количестве около 0,08 грамма (0,003 унции) на тонну породы. Основная руда — красный сульфид, киноварь. Самородная ртуть встречается в виде отдельных капель, а иногда и в более крупных жидких массах, обычно с киноварью, вблизи вулканов или горячих источников. Найдены также крайне редкие природные сплавы ртути: мошелландсбергит (с серебром), потарит (с палладием), амальгама золота. Более 90 процентов мировых поставок ртути поступает из Китая; часто это побочный продукт добычи золота.
Киноварь добывают шахтным или открытым способом и очищают флотацией. Большинство методов извлечения ртути основаны на летучести металла и на том факте, что киноварь легко разлагается на воздухе или известью с образованием свободного металла. Ртуть извлекают из киновари путем ее обжига на воздухе с последующей конденсацией паров ртути. Из-за токсичности ртути и угрозы жесткого контроля за загрязнением внимание уделяется более безопасным методам извлечения ртути.

 1 Медицина
1 Медицина
 п. со средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ.
п. со средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ.
