Как решать (составлять) молекулярные уравнения
В ходе изучения химии часто возникают вопросы, связанные с составлением молекулярных уравнений реакций. Какие вещества реагируют друг с другом и как узнать, идет ли реакция? Нужно ли расставлять коэффициенты в уравнении реакции?
Молекулярные уравнения – это запись, которая позволяет понимать какие молекулы, и в каком количестве вступали в реакцию и в какие новые молекулы они превратились в ходе химической реакции.
4Mg + 5H2SO4 (конц.) = 4MgSO4 + H2S ↑ + 4H2O
Перед нами химическая реакция, где Mg + H2SO4 (конц.) – исходные (израсходованные) вещества, то есть вещества, вступившие в химическую реакцию, а MgSO4 + H2S ↑ + H2O – это вещества, которые образовались в ходе химической реакции. Они называются продуктами реакции. Часто составления химических реакций достаточно знать к каким классам относятся исходные вещества, что бы понимать будет ли между ними реакция, если вещество проявляет кислотные свойства, то оно будет реагировать с веществом с основными свойствами. Амфотерные соединения проявляют химическую двойственность, что позволяет им реагировать как с веществами с кислотными свойствами, так и с основными. Кроме общих химических свойств для различных классов веществ (металлы, неметаллы, оксиды кислотные, амфотерные и основные, кислоты, основания, амфотерные гидроксиды) существуют и специфические свойства,характерные для определенных веществ.
Амфотерные соединения проявляют химическую двойственность, что позволяет им реагировать как с веществами с кислотными свойствами, так и с основными. Кроме общих химических свойств для различных классов веществ (металлы, неметаллы, оксиды кислотные, амфотерные и основные, кислоты, основания, амфотерные гидроксиды) существуют и специфические свойства,характерные для определенных веществ.
Разберем общие правила, которые позволят составлять молекулярные уравнения.
1. Реакции замещения идут лишь, когда более активный металл замещает, то есть встает на место менее активного металла в сложном веществе. Для определения активности следует использовать «электрохимический ряд напряжения металлов», в котором металл, находящийся левее активнее, то есть сильнее металла, стоящего правее, а значит, кто левее сможет вытеснять из сложных веществ, например солей, те металлы, которые правее.
2Al + 3Zn = Al2O3 + 3Zn
Электрохимический ряд напряжения металлов в порядке ослабления активности металлов, ослаблении восстановительных свойств
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
2. Реакции ионного обмена идут до конца, когда в ходе химической реакции образуется в продуктах реакции газ, осадок или вода. Важно отметить, что может быть одновременное образование воды и осадка, или двух осадков. Выделение газа, образование осадка это видимые признаки химической реакции. В таблице растворимости можно посмотреть является ли основание, соль или кислота нерастворимым соединением.
Реакции ионного обмена идут до конца, когда в ходе химической реакции образуется в продуктах реакции газ, осадок или вода. Важно отметить, что может быть одновременное образование воды и осадка, или двух осадков. Выделение газа, образование осадка это видимые признаки химической реакции. В таблице растворимости можно посмотреть является ли основание, соль или кислота нерастворимым соединением.
Na2SO4 + BaCl2 = BaSO4 ↓ + 2NaCl
3. Важным правилом при составлении молекулярных уравнений является расстановка стехиометрических коэффициентов. Количество атомов одного и того же элемента в левой части от знака равно должно быть равным количеству атомов в правой части уравнения.
Ca(OH)2 + 2CO2= Ca(HCO3)2
В данном случае, количество атомов кальция в левой и правой части = 1, количество углерода равно 2, водород тоже уравнен, в исходных веществах и в продуктах реакции по 2 водорода, а кислорода по 6 атомов.
4. В ходе некоторых реакций образуются неустойчивые вещества, которые сразу же разлагаются, а значит нужно написать в продуктах реакции сразу выделяющийся газ и воду.
H2CO3 = CO2 ↑ +H2O
H2SO3 = SO2 ↑ +H2O
NH4OH = NH3 ↑ + H2O
Пример:
H2SO4 + K2CO3 = K2SO4 + H2CO3 – неверная запись молекулярного уравнения
H2SO4 + K2CO3 = K2SO4 + CO2 ↑ + H2O – верное уравнение.
5. Если в ходе химической реакции образуется газ, то стоит поставить знак «↑», что символизирует, что образующийся газ улетел. Если образуется осадок, то «↓», что будет означать, что в ходе реакции образовалось нерастворимое в воде соединение.
«Химические уравнения» — Яндекс Кью
Популярное
Сообщества
Химические уравнения
Стать экспертом- Популярные
- Открытые
- Все вопросы
- Новые ответы
Наталья3г
12,6 K
Люблю задавать и отвечать на вопросы.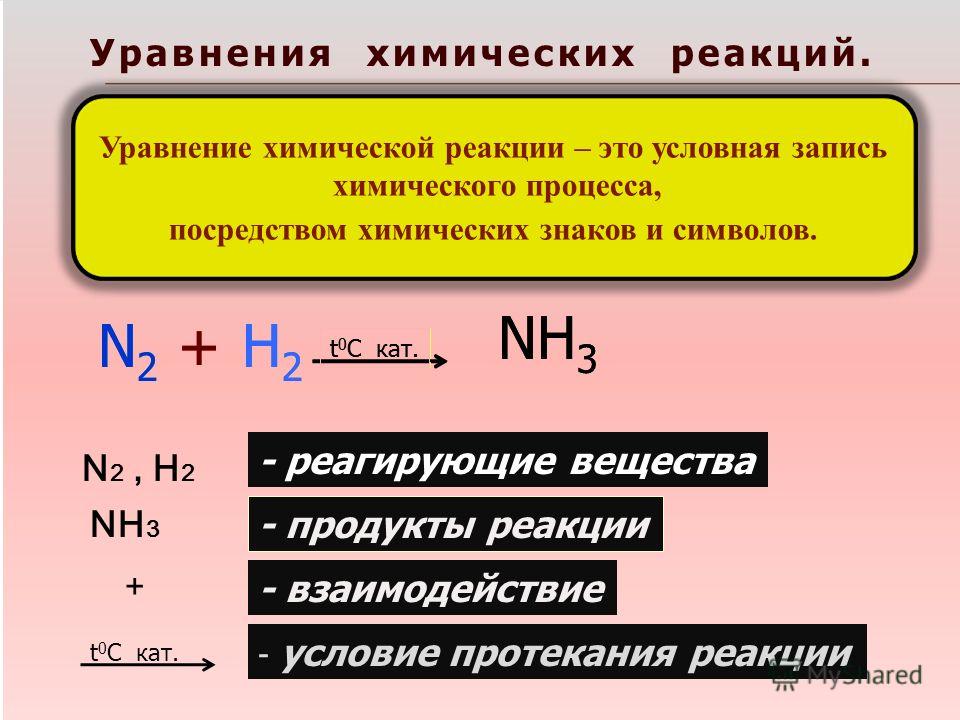 Интересуюсь химией и другими знаниями. Много читаю. Хочу знать больше! Любопытная особа.
Интересуюсь химией и другими знаниями. Много читаю. Хочу знать больше! Любопытная особа.
Анонимный вопрос · 1 ответ
4HCl(г) + O2(г) <=> 2h3O + 2Cl2(г) Как изменится скорость реакции, если объем в системе увеличить в 2 раза? Увеличение объёма в системе в 2 раза равносильно уменьшению давления системы в… Читать далее
Александр Грубер4г
6,3 K
Engineer — programmer ⚡⚡ Разбираюсь в компьютерах, технике, электронике, интернете и технологиях.
Анонимный вопрос · 1 ответ
Уравнения реакций превращения кальций Ca в гидрид кальций Cah3, а затем в гидрооксид кальция Ca(OH)2 следующие:
- Ca + h3 -> Cah3;
- Cah3 + 2h3O -> Ca(OH)2 + 2h3.
Наталья Брянцева4г
5,7 K
Химия для нехимиков самыми простыми словами
спрашиваетмаргоша бубович · 1 ответ
Записываем уравнение и ставим над и под формулами массы:
2Na+Cl2=2NaCl
Над натрием ставим Х грамм, нам это надо найти
Под натрием ставим 2*23=46 г (масса двух молекул натрия)
Над хлоридом.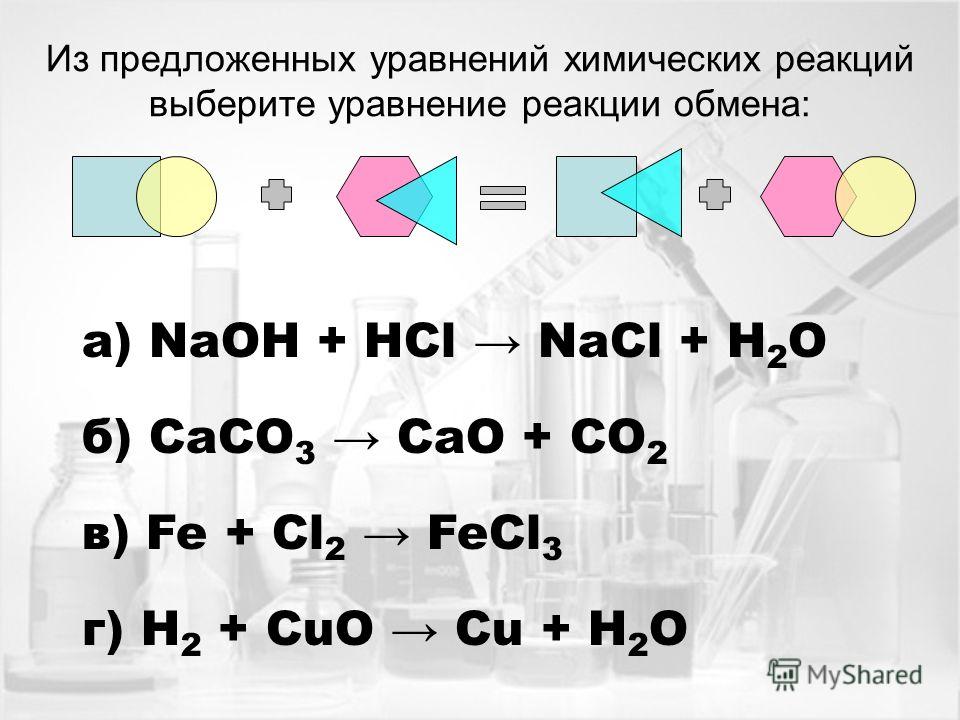 .. Читать далее
.. Читать далее
famast3г
5,2 K
Живу в сети. Не одинока. Люблю путешествовать, готовить, много читаю. А еще люблю делиться всем, что узнаю )
спрашиваетГабриэлла М. · 1 ответ
Сначала из хлорида алюминия и гидроксида натрия нужно получить гидроксид алюминия и в качестве «побочки» хлорид натрия (гидроксид алюминия — Al(OH)3 — и есть неизвестное х в этой цепочке)… Читать далее
TutorOnline3г
4,0 K
TutorOnline — одна из крупнейших онлайн-школ. Мы преподаем более 150 предметов. Наша цель — сделать качественное образование доступным.
спрашиваетDark Lord · 1 ответ
Пусть валентность неизвестного металла равна z m(Me2Oz) = 5 г m(h3O) = 2,7 г Уравнение реакции Me2Oz + zh3 = 2Ме + zh3O Пусть молярная масса эквивалента металла (масса моля… Читать далее
Первый
дами2г
1,9 K
девятиклассница
спрашиваетvadim s.
Невское Оборудование3г
3,3 K
Невское ОборудованиеОборудование для металлообработки
спрашиваетЮра Б. · 1 ответ
Во сколько раз возрастает скорость химической реакции при повышении температуры на 50 при температурном коэффициенте 2 Дано: t₁ = 0°C t₂ = 40°C γ = 3 Найти: v₁/v₂ -? Если предположить… Читать далее
Эдуард Чигиринец
4г
1,0 K
Молодой-исследовать в области химии и ядерной физики ускорителей частиц, г. Падуя, Италия.
Анонимный вопрос · 1 ответ
1)Cu+S = CuS↓
2) 2CuS↓ + h3 = Cu2S + h3S↑
3) 2h3S + 3O2 = 2SO2↑ + 2h3O
5 веб-сайтов для балансировки химических уравнений онлайн бесплатно
Рейтинги редактора:
Рейтинги пользователей:
[Всего: 0 Среднее значение: 0]
Сбалансировать химические уравнения не всегда легко. Существуют очень сложные химические уравнения, балансировка которых может занять значительное время. Наличие инструмента для автоматической балансировки химического уравнения может быть очень полезным в таком сценарии. Балансировщик химических уравнений может использоваться профессионалами, чтобы сэкономить время, и студентами, чтобы получить помощь в учебе.
Существуют очень сложные химические уравнения, балансировка которых может занять значительное время. Наличие инструмента для автоматической балансировки химического уравнения может быть очень полезным в таком сценарии. Балансировщик химических уравнений может использоваться профессионалами, чтобы сэкономить время, и студентами, чтобы получить помощь в учебе.
С помощью этих веб-сайтов вы можете легко сбалансировать химические уравнения за считанные секунды. Все, что вам нужно сделать, это ввести свое химическое уравнение на этих веб-сайтах, и они сбалансируют его для вас и подчеркнут изменения. Некоторые из этих веб-сайтов также предоставляют вам дополнительную информацию, такую как тип реакции , термодинамика реакции и т. д. . Вы также можете рассчитать стехиометрию реакции и ограничивающий реагент . Итак, давайте проверим эти сайты один за другим.
Также читайте: Бесплатное программное обеспечение Chemical Simulator для моделирования химических реакций
Вот 5 бесплатных веб-сайтов для балансировки химических реакций:
WolframAlpha.
 com
com WolframAlpha — это многофункциональный онлайн-инструмент для динамических вычислений, с помощью которого можно выполнять расчеты с различными типами данных. Здесь основное внимание уделяется образовательным данным и другим повседневным задачам, включая Математика , Наука и технологии , Общество и культура и Повседневная жизнь . С помощью инструмента для балансировки химических уравнений WolframAlpha вы можете быстро найти правильные коэффициенты для своей химической реакции.
Здесь вы можете ввести химическую реакцию тремя различными способами. Вы можете либо ввести формулы (символы) химических соединений, либо вместо этого ввести их полное название, либо смешать их оба. Таким образом, вы можете легко вводить такие соединения, как октан, глюкоза и т. д., без необходимости их формул. Когда вы анализируете свое химическое уравнение с помощью этого инструмента, он обнаруживает ваш ввод и показывает его интерпретацию.
Кроме того, WolframAlpha также вычисляет Термодинамику реакции и дает ее Энтальпию , Энтропию и E q постоянную среды . А если вы обновитесь до WolframAlpha Pro , вы сможете загрузить все эти результаты и разблокировать многие другие функции, такие как ввод изображений, ввод данных, загрузка файлов и т. д.
WebQC.org
WebQC.org — это химический онлайн-портал с Chemistry Tools , Unit Converters , Chemical Symmetry и многим другим. Под Chemistry Tools у него есть Chemical Equation Balancer , который вы можете использовать для балансировки своих химических реакций онлайн. Так же, как WolframAlpha , вы можете использовать имена, символы и/или формулы для ввода здесь вашего химического уравнения. В результате вы получите идеально сбалансированное химическое уравнение с новыми элементами, выделенными цветом. Кроме того, этот веб-сайт показывает вам таблицу химических соединений вашего уравнения с их Коэффициенты и Молярная масса . С помощью этой таблицы можно рассчитать стехиометрию реакции и ограничивающий реагент . Все, что вам нужно сделать, это ввести количество молей соединения, и таблица покажет вам его вес.
В результате вы получите идеально сбалансированное химическое уравнение с новыми элементами, выделенными цветом. Кроме того, этот веб-сайт показывает вам таблицу химических соединений вашего уравнения с их Коэффициенты и Молярная масса . С помощью этой таблицы можно рассчитать стехиометрию реакции и ограничивающий реагент . Все, что вам нужно сделать, это ввести количество молей соединения, и таблица покажет вам его вес.
Попробуйте онлайн-балансировщик химических уравнений здесь .
ChemicalAid.com
ChemicalAid — еще один бесплатный веб-сайт, предоставляющий информацию о химии и химических элементах. На этом сайте Chemical Equation Balancer , который уравновешивает химические уравнения, а также определяет их типы реакций. Вы можете напрямую ввести свое уравнение в этот инструмент, используя химические названия или формулы, или и то, и другое. Он также имеет периодическую таблицу, из которой вы можете использовать для выбора элементов для реакций.
Он также имеет периодическую таблицу, из которой вы можете использовать для выбора элементов для реакций.
В результатах этот инструмент уравновешивает химическую реакцию и выделяет изменения. Это также говорит вам, является ли реакция Горение , Синтез , Разложение , Одинарное смещение , Двойное смещение или Кислотно-основное тип . С помощью этого инструмента вы можете легко рассчитать стехиометрию реакции и ограничивающий реагент .
Здесь – ссылка, по которой можно попробовать онлайн-балансировщик химических уравнений .
TheodoreGrey.com
Следующий инструмент для балансировки химических уравнений в этом списке от TheodoreGrey.com . Это простой и понятный балансировщик химических уравнений, который вводит только химические символы. Чтобы сбалансировать уравнение, введите его здесь и нажмите кнопку «Рассчитать» . Этот инструмент дает сбалансированную реакцию на результаты. Это также дает вам сбалансированный вес реагентов. Вы можете ввести пользовательский вес для реагента, и он рассчитает вес других реагентов для реакции. Эта функция удобна для химических экспериментов, когда вам нужно провести реакцию на определенную сумму.
Этот инструмент дает сбалансированную реакцию на результаты. Это также дает вам сбалансированный вес реагентов. Вы можете ввести пользовательский вес для реагента, и он рассчитает вес других реагентов для реакции. Эта функция удобна для химических экспериментов, когда вам нужно провести реакцию на определенную сумму.
Этот инструмент также дает вам молекулярную массу каждого реагента вместе с их весовым процентным составом. Вы также можете рассчитать ограничивающие реагенты для реакции.
Вы можете попробовать онлайн-балансировщик химических уравнений здесь .
EndMemo.com
EndMemo — это бесплатный веб-сайт, на котором собрано множество образовательных инструментов и калькуляторов по математике , физике , Химия , Биология , Литература , Здоровье и другие. Он имеет простой балансировщик химических уравнений, который может помочь вам сбалансировать несбалансированное химическое уравнение.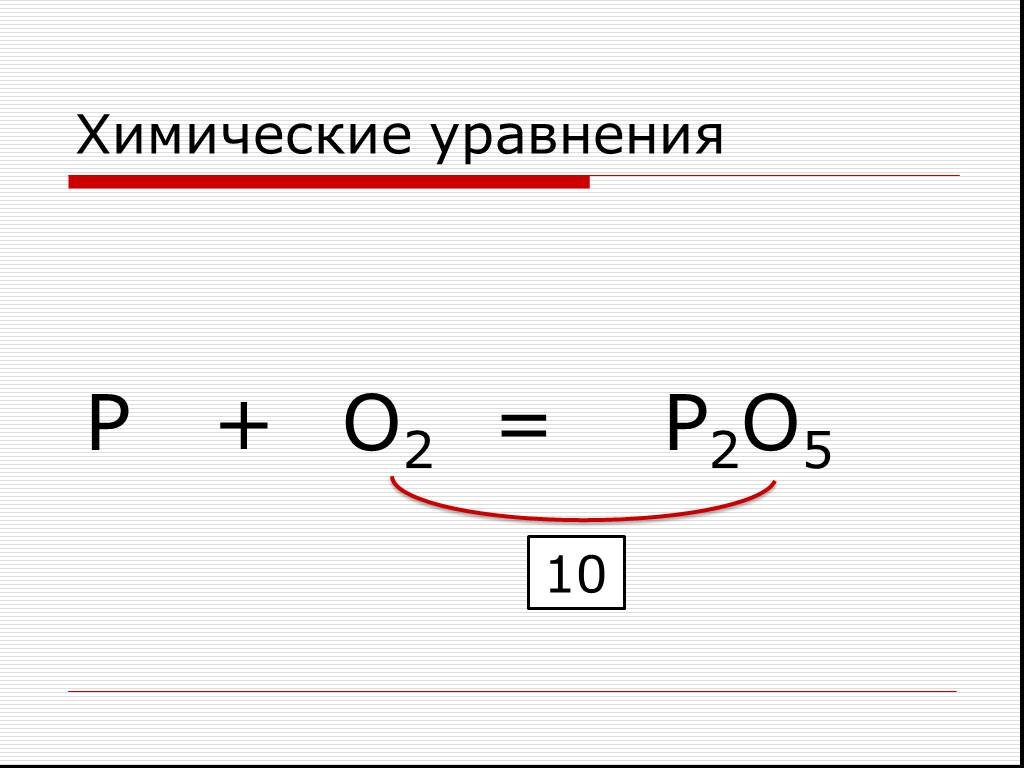 Для этого вы можете либо использовать периодическую таблицу для составления уравнения, либо напрямую ввести уравнение в данное текстовое поле, используя химические символы. После ввода уравнения можно проверить, сбалансировано оно уже или нет, с помощью кнопки «Проверить» . В случае несбалансированного уравнения нажмите кнопку «Баланс» кнопка для балансировки. Как только вы это сделаете, оно уравновесит уравнение и покажет вам результат под текстовым полем ввода. Он выделяет изменения, внесенные в уравнение, чтобы вы могли легко заметить, как оно сбалансировало уравнение.
Для этого вы можете либо использовать периодическую таблицу для составления уравнения, либо напрямую ввести уравнение в данное текстовое поле, используя химические символы. После ввода уравнения можно проверить, сбалансировано оно уже или нет, с помощью кнопки «Проверить» . В случае несбалансированного уравнения нажмите кнопку «Баланс» кнопка для балансировки. Как только вы это сделаете, оно уравновесит уравнение и покажет вам результат под текстовым полем ввода. Он выделяет изменения, внесенные в уравнение, чтобы вы могли легко заметить, как оно сбалансировало уравнение.
Попробуйте онлайн-балансировщик химических уравнений здесь .
Заключительные слова:
Это 5 бесплатных онлайн-сайтов для балансировки химических уравнений. Вы можете быстро сбалансировать химические уравнения, используя любой из этих веб-сайтов. Wolfram Alpha дает вам много другой информации, но для расчета всей этой информации требуется некоторое время. Итак, если вам просто нужно сбалансировать уравнение, я рекомендую вам использовать другие, но если вам нужны подробности, то вам подойдет Wolfram Alpha .
Итак, если вам просто нужно сбалансировать уравнение, я рекомендую вам использовать другие, но если вам нужны подробности, то вам подойдет Wolfram Alpha .
Chemical Equation Balancer — Калькулятор химического баланса
Chemical Equation Balancer
Многим людям трудно справиться с задачами по химии, особенно с балансировкой химических уравнений в неорганической химии. Балансировка уравнения может быть сложной задачей, потому что она связана со сложностью работы с атомами и молекулами. Студенты, как правило, плохо учатся в этой области химии, но вам не о чем беспокоиться, потому что мы предлагаем вам бесплатный балансировщик химических уравнений в вашем распоряжении.
Этот балансирующий химический калькулятор уравнений сэкономит вам много сил и времени при подготовке к экзаменам. Его можно использовать в качестве решателя химических уравнений для балансировки уравнений. Уравнения баланса не более сложны, потому что калькулятор уравнений баланса делает все сам. Вам нужно только поместить уравнения химического баланса в коробку, и она сделает волшебство.
Вам нужно только поместить уравнения химического баланса в коробку, и она сделает волшебство.
В этом содержании мы объясним, как сбалансировать химические уравнения, как Калькулятор уравнений баланса работает, и как вы можете использовать этот калькулятор уравнений баланса для своей академической работы.
Как пользоваться калькулятором сбалансированных уравнений?
Калькулятор уравнений баланса разработан, чтобы облегчить бремя студентов-химиков, которые сталкиваются с трудностями при балансировании химических уравнений в школе или колледже. Кроме того, требуется время, чтобы преобразовать несбалансированное уравнение в сбалансированное, что не способствует производительности. Этот инструмент является продуктивным образовательным инструментом для студентов, которые с нетерпением ждут техники решения для обучения.
Чтобы сделать этот инструмент более интерактивным, мы разместили периодическую таблицу. Эту таблицу можно использовать для ввода данных, щелкая элементы периодической таблицы. Существует также числовая вкладка для использования чисел для указания количества атомов или молекул в элементе. Это означает, что вам не нужно писать уравнение вручную, но вы можете написать его, если хотите.
Эту таблицу можно использовать для ввода данных, щелкая элементы периодической таблицы. Существует также числовая вкладка для использования чисел для указания количества атомов или молекул в элементе. Это означает, что вам не нужно писать уравнение вручную, но вы можете написать его, если хотите.
Чтобы использовать калькулятор химического баланса , , выполните следующие действия:
- Составьте химическое уравнение, нажимая на элементы периодической таблицы.
- Используйте числовую вкладку для ввода количества атомов.
- Используйте знаки + и = , чтобы составить полное уравнение.
- Вы также можете скопировать и вставить уравнение в данное поле ввода.
- Нажмите кнопку Рассчитать , чтобы получить уравнение баланса.
- Используйте кнопку Сброс для следующей операции.
Он выделяет только что добавленные атомы элемента синим цветом. Используя этот калькулятор, вы можете узнать, как сбалансировать химические уравнения, потренировавшись на этом инструменте. В химии очень важно число Авогадро. Вы можете в любое время воспользоваться нашим числовым калькулятором Авогадро, если он вам понадобится.
Используя этот калькулятор, вы можете узнать, как сбалансировать химические уравнения, потренировавшись на этом инструменте. В химии очень важно число Авогадро. Вы можете в любое время воспользоваться нашим числовым калькулятором Авогадро, если он вам понадобится.
Как сбалансировать химические уравнения?
Как упоминалось выше, химические уравнения нелегко сбалансировать вручную. Чтобы овладеть этим навыком, требуется много практики. Существуют различные способы сбалансировать химическое уравнение, но мы объясним эту тему самым простым. Вы можете легко понять основную концепцию и метод балансировки химических уравнений, изучив эту технику.
Начнем с простейшего уравнения водорода и серы. Вот неуравновешенное сбалансированное уравнение.
Пример – простое химическое уравнение
H + S 3 = H S 2
Итак, как мы можем сбалансировать это уравнение?
Как видите, в левой части уравнения три атома серы, а в левой только два атома серы. Атомы водорода уже уравновешены с обеих сторон, по одному атому с каждой стороны.
Атомы водорода уже уравновешены с обеих сторон, по одному атому с каждой стороны.
Решение:
- Чтобы выровнять атомы серы в этом уравнении, мы должны умножить правую часть на 3.
H + S 3 = 3 H S 2
H + 2 S 3 = 3 H S 2
- 44444444444444444444444444444444444444444. Sulf Ballf On Sails Sails Sails Sails Sails SALIDF SALIDF SALDF SULDFAR SULDFIRF ON SAINOMS SALIDF SALIDF SALDF SULDFIRF SALDF SULDFIRF SALDFIRF SALDFIRF ON SAI SALDF SALDF SULDFIRF SALDFAR. но, как вы можете видеть, водород слева состоит только из одного атома, а справа — из 3 атомов. Умножьте количество водорода в правой части на 3.
3 H + 2 S 3 = 3 H S 2
- Проверьте уравнение для каждого элемента и посчитайте количество атомов каждого элемента с обеих сторон. уравнения.
H = 3 и S = 6
Обе стороны имеют одинаковое количество атомов для каждого элемента.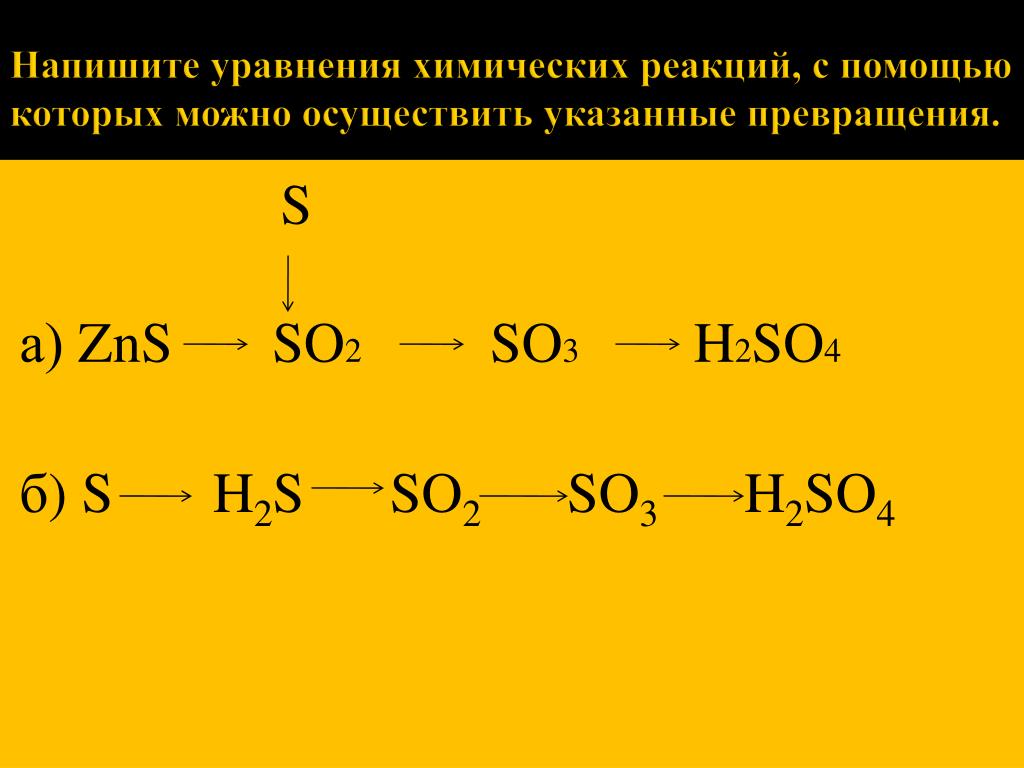
Теперь уравнение сбалансировано. С обеих сторон 3 атома водорода и 6 атомов серы. Вы можете использовать наш калькулятор уравнения балансировки выше, чтобы сделать это за несколько секунд.
Давайте сбалансируем сложное химическое уравнение на примере.
Пример – комплексное химическое уравнение
C 2 H 5 OH + O 2 = CO + H 2 O
Это сложное уравнение с углеродом, водородом и кислородом. Как видите, атомы каждого элемента в этом уравнении различаются.
- В правой части уравнения 2 атома углерода, 6 атомов водорода и 3 атома кислорода.
- С левой стороны 1 атом углерода, 2 атома водорода и 2 атома кислорода.
Итак, мы должны сбалансировать каждый элемент в отдельности.
Решение:
- В правой части уравнения поместите коэффициент 2 с CO , чтобы сбалансировать кислород с обеих сторон.

C 2 H 5 OH + O 2 = 2 C O + H 2 O
- Теперь, баланс The Hydrogen The Gydeficit O в правой части уравнения.
С 2 Н 5 OH + O 2 = 2 CO + 3 H 2 O
- В уравнении водорода и углерода уравновешены. Сбалансируйте атомы кислорода, умножив O 2 на 2 в левой части уравнения.
C 2 H 5 OH + 2 O 2 = 2 C O + 3 H 2 O
- Проверьте уравнение для каждого элемента и подсчитайте количество атомов каждого элемента в обеих частях уравнения.
C = 2, H = 6, O = 5
Обе стороны имеют одинаковое количество атомов для каждого элемента.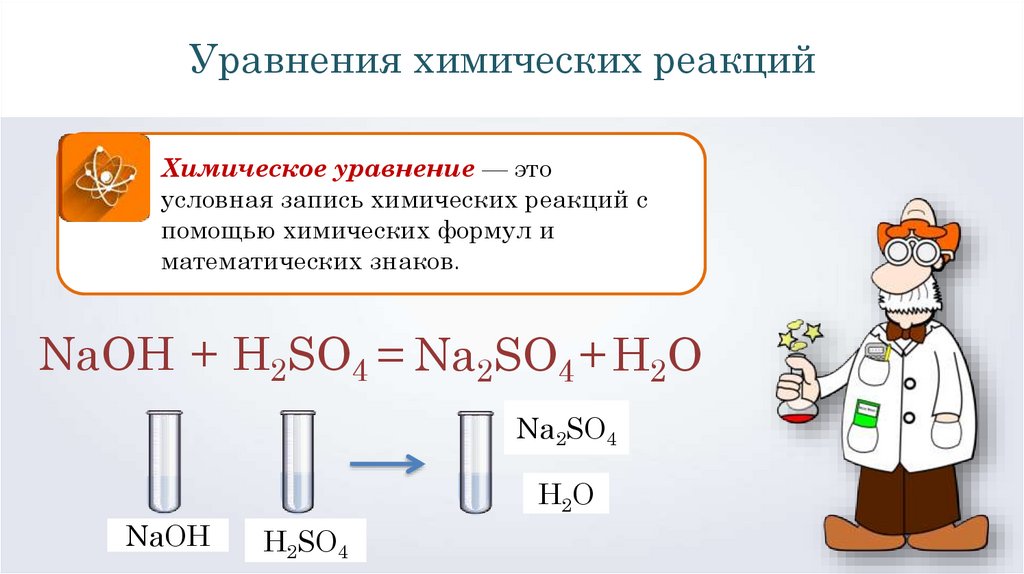
Теперь, когда вы знаете, как сбалансировать химические уравнения, вы можете использовать наш химический балансировщик , описанный выше, чтобы сэкономить много времени. Вы также можете рассчитать вес кислоты с помощью нашего калькулятора веса кислоты.
Часто задаваемые вопросы
Как сбалансировать химическое уравнение?
Химическое уравнение можно сбалансировать, используя следующий метод:
- Подсчитайте количество атомов реагентов и продуктов в обеих частях уравнения.
- Выровняйте количество атомов для каждого элемента, расставив коэффициенты с реагентами и соединениями.
- Повторяйте предыдущий шаг, пока каждый элемент с обеих сторон не будет иметь одинаковое количество атомов.
2 H 2 + O 2 → 2 H 2 O
Какие существуют 4 типа химических уравнений?
Четыре типа химических уравнений:
- Реакция соединения
- Реакция осаждения
- Реакция разложения
- Реакция горения
Что является примером химического уравнения?
H 2 + O 2 и 2 H 2 O является примером химического уравнения.

