Методом электронно-ионных уравнений составьте по…
Химия11 класс
У
Ученик
Методом электронно-ионных уравнений составьте полные уравнения реакций, учитывая, что либо окислитель, либо восстановитель являются также и средой. Обоснуйте на основании стандартных окислительно-восстановительных потенциалов возможность протекания данных реакций
Ангелина ЭдуардовнаПредметы: Литература, Литературное чтение, Русский язык
Так как в реакции участвует кислота, то среда кислая, соответственно, в полуреакциях можно использовать только ионы водорода.
Для обоснования возможности протекания данных реакций необходимо рассчитать изменение стандартного потенциала по формуле:
В таблице стандартных окислительно-восстановительных потенциалов полуреакций находим соответствующие потенциалы:
Следовательно, реакция возможна при стандартных условиях.
Здесь мы аналогично используем ионы водорода в полуреакциях, так как среда кислая. 2 − 6x
2 − 6x
Предметы: Математика, Геометрия, Алгебра, Окружающий мир, Начальные классы, Литературное чтение, Подготовка к ОГЭ, Русский язык
Алгебра7 класс
У
Ученик
Здравствуйте! Помогите, пожалуйста, с задачей, не понимаю как её решать. Три белки делили орехи. Сначала первая раздала половину своих орехов двум другим поровну. Потом вторая, а затем и третья белка поступили так же. В итоге у них стало 19, 14 и 8 орехов соответственно. Сколько было у каждой белки …
Ответ данНаталья ВасильевнаПредметы: Математика, Подготовка к школе, Окружающий мир, Начальные классы, Литературное чтение, Русский язык, Онлайн няня
Литература7 класс
У
Ученик
помогите пожалуйста, очень надо!!Самый запоминающийся эпизод в сказе «богиня в шинели» и о чём заставляет задуматься данное произведение? (И.М. Ермаков) буду очень благодарна!!
Ответ данНаталья ВасильевнаПредметы: Математика, Подготовка к школе, Окружающий мир, Начальные классы, Литературное чтение, Русский язык, Онлайн няня
Химия8 класс
У
Ученик
Здравствуйте! Помогите, пожалуйста, с решением задачи. 2 = 5,5𝑥 + 3 сначала графически, азатем с помощью формулы корней.
2 = 5,5𝑥 + 3 сначала графически, азатем с помощью формулы корней.
Предметы: Математика, Подготовка к школе, Окружающий мир, Начальные классы, Литературное чтение, Русский язык, Онлайн няня
Всеобщая история7 класс
М
Макар
Помогите пожалуйста. сравнение уровня социально экономического развития германских государств с развитием англии или франции и укажи на основе различия.
Ответ данНаталья ВасильевнаПредметы: Математика, Подготовка к школе, Окружающий мир, Начальные классы, Литературное чтение, Русский язык, Онлайн няня
Геометрия8 класс
М
Матвей
Из вершины 𝐵 треугольника 𝐴𝐵𝐶 проведеныбиссектриса 𝐵𝐸 и высота 𝐵𝐻, равная 12, причем высота делитсторону 𝐴𝐶 на отрезки 𝐴𝐻 и 𝐻𝐶, равные 9 и 16 соответственно.Найдите стороны треугольника и отрезки, на которые биссектриса делит сторону 𝐴𝐶.
Ответ данНаталья СергеевнаПредметы: Математика, Геометрия, Алгебра, Окружающий мир, Начальные классы, Литературное чтение, Подготовка к ОГЭ, Русский язык
Геометрия8 класс
М
Матвей
Периметр треугольника 𝐴𝐵𝐶 равен 60 см. На сторонах𝐴𝐵, 𝐵𝐶, 𝐴𝐶 лежат точки 𝐷, 𝐸, 𝐹 соответственно так, что 𝐷𝐵𝐸𝐹 −ромб. Найдите стороны 𝐴𝐵 и 𝐵𝐶 треугольника, если 𝐴𝐹 = 10,𝐹𝐶 = 15.
На сторонах𝐴𝐵, 𝐵𝐶, 𝐴𝐶 лежат точки 𝐷, 𝐸, 𝐹 соответственно так, что 𝐷𝐵𝐸𝐹 −ромб. Найдите стороны 𝐴𝐵 и 𝐵𝐶 треугольника, если 𝐴𝐹 = 10,𝐹𝐶 = 15.
Тепаева Мария
История России6 класс
И
Ирина
Не могу найти значимые события в 982 году ? по истории 6 класс
Ответ данИнна ИгоревнаПредметы: Математика, Подготовка к школе, История России, Окружающий мир, Подготовка к ЕГЭ, Обществознание, Всеобщая история, ИЗО, МХК, Литературное чтение, Русский язык
Русский язык8 класс
М
Матвей
Найдите предложения с несогласованным определением, запишите только номера предложений: 1. Солнце гуляло по мокрым от вчерашнего дождя жнивьям. 2. Я не мог забыть девушку с синими глазами. 3. Дальше по оврагу еще лежал снег в желтых, в синих пятнах. 4. После душной ночи потянул на рассвете свежий ве…
Ответ данНаталья ВасильевнаПредметы: Математика, Подготовка к школе, Окружающий мир, Начальные классы, Литературное чтение, Русский язык, Онлайн няня
Как уравнивать в химии.
 Как расставлять коэффициенты в химических уравнениях
Как расставлять коэффициенты в химических уравненияхЧасть I
1. Закон Ломоносова-Лавуазье – закон сохранения массы веществ:
2. Уравнения химической реакции – это условная запись химической реакции с помощью химических формул и математических знаков.
3. Химическое уравнение должно соответствовать закону сохранения массы веществ, что достигается расстановкой коэффициентов в уравнении реакции.
4. Что показывает химическое уравнение?
1) Какие вещества вступают в реакцию.
2) Какие вещества образуются в результате.
3) Количественные отношения веществ в реакции, т. е. количества реагирующих и образующихся веществ в реакции.
4) Тип химической реакции.
5. Правила расстановки коэффициентов в схеме химической реакции на примере взаимодействия гидроксида бария и фосфорной кислоты с образованием фосфата бария и воды.
а) Запишите схему реакции, т. е. формулы реагирующих и образующихся веществ:
б) начинайте уравнивать схему реакции с формулы соли (если она имеется).
в) водород уравняйте в предпоследнюю очередь:
г) кислород уравняйте последним – это индикатор верной расстановки коэффициентов.
Перед формулой простого вещества возможна запись дробного коэффициента, после чего уравнение необходимо переписать с удвоенными коэффициентами.
Часть II
1. Составьте уравнения реакций, схемы которых:
2. Напишите уравнения химических реакций:
3. Установите соответствие между схемой и суммой коэффициентов в химической реакции.
4. Установите соответствие между исходными веществами и продуктами реакции.
5. Что показывает уравнение следующей химической реакции:
1) Вступили в реакцию гидроксид меди и соляная кислота;
2) Образовались в результате реакции соль и вода;
3) Коэффициенты перед исходными веществами 1 и 2.
6. С помощью следующей схемы составьте уравнение химической реакции, используя удвоение дробного коэффициента:
7. Уравнение химической реакции:
4P+5O2=2P2O5
показывает количество вещества исходных веществ и продуктов, их массу или объём:
1) фосфора – 4 моль или 124 г;
2) оксида фосфора (V) – 2 моль, 284 г;
3) кислорода – 5 моль или 160 л.
Для того чтобы выяснить, как уравнять химическое уравнение, для начала следует узнать предназначение данной науки.
Определение
Химия изучает вещества, их свойства, а также превращения. В случае если не наблюдается изменения окраски, выпадения осадка, выделения газообразного вещества, то не происходит никакого химического взаимодействия.
Например, при обработке напильником железного гвоздя металл просто превращается в порошок. В этом случае никакой химической реакции не происходит.
Прокаливание перманганата калия сопровождается образованием оксида марганца (4), выделением кислорода, то есть наблюдается взаимодействие. При этом возникает вполне закономерный вопрос о том, как правильно уравнивать химические уравнения. Разберем все нюансы, связанные с подобной процедурой.
При этом возникает вполне закономерный вопрос о том, как правильно уравнивать химические уравнения. Разберем все нюансы, связанные с подобной процедурой.
Специфика химических превращений
Любые явления, которые сопровождаются изменением качественного и количественного состава веществ, относятся к химическим превращениям. В молекулярном виде процесс сгорания железа в атмосфере можно выразить с помощью знаков и символов.
Методика расстановки коэффициентов
Как уравнивать коэффициенты в химических уравнениях? В курсе химии средней школы разбирается метод электронного баланса. Рассмотрим процесс более подробно. Для начала в исходной реакции необходимо расставить степени окисления у каждого химического элемента.
Существуют определенные правила, по которым их можно определить у каждого элемента. В простых веществах степени окисления будут равны нулю. В бинарных соединениях у первого элемента она положительна, соответствует высшей валентности. У последнего данный параметр определяется путем вычитания номера группы из восьми и имеет знак «минус».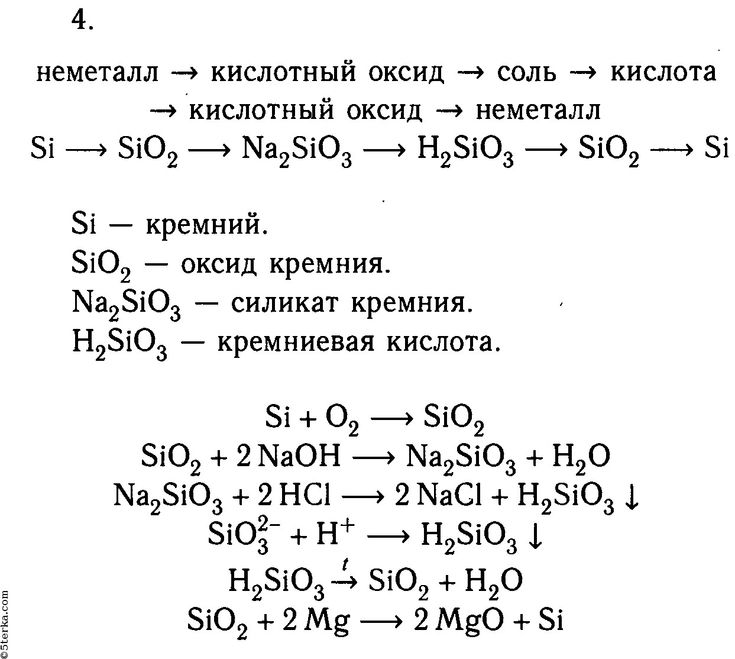 В формулах, состоящих их трех элементов, есть свои нюансы вычисления степеней окисления.
В формулах, состоящих их трех элементов, есть свои нюансы вычисления степеней окисления.
Для первого и последнего элемента порядок аналогичен определению в бинарных соединениях, а для вычисления центрального элемента составляется уравнение. Сумма всех показателей должна быть равна нулю, исходя из этого, вычисляется показатель для среднего элемента формулы.
Продолжим разговор о том, как уравнивать химические уравнения методом электронного баланса. После того как степени окисления будут поставлены, можно определять те ионы либо вещества, которые в ходе химического взаимодействия изменили их значение.
Знаками «плюс» и «минус» необходимо указать количество электронов, которые были приняты (отданы) в процессе химического взаимодействия. Между полученными цифрами находят наименьшее общее кратное.
При делении его на принятые и отданные электроны получают коэффициенты. Как уравнять химическое уравнение? Полученные в балансе цифры нужно поставить перед соответствующими формулами.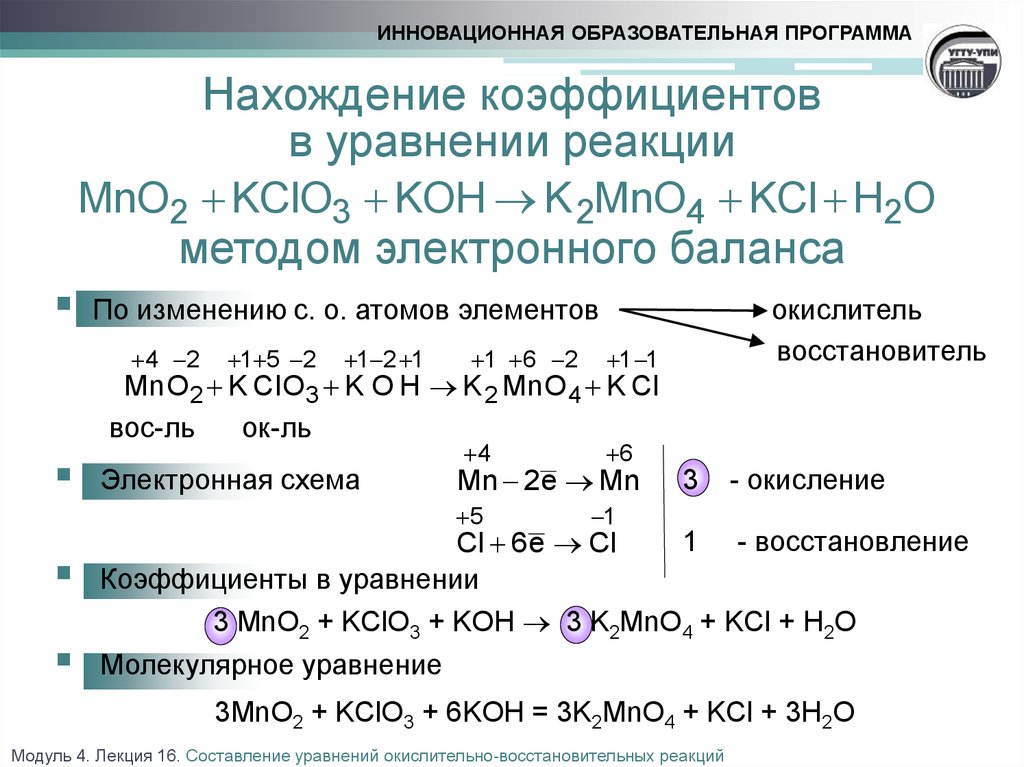 Обязательным условием является проверка количества каждого элемента в левой и правой части. Если коэффициенты расставлены правильно, их число должно быть одинаковым.
Обязательным условием является проверка количества каждого элемента в левой и правой части. Если коэффициенты расставлены правильно, их число должно быть одинаковым.
Закон сохранения массы веществ
Рассуждая над тем, как уравнять химическое уравнение, необходимо использовать именно этот закон. Учитывая, что масса тех веществ, которые вступили в химическую реакцию, равна массе образующихся продуктов, становится возможным постановка коэффициентов перед формулами. Например, как уравнять химическое уравнение, если вступают во взаимодействие простые вещества кальций и кислород, а после завершения процесса получается оксид?
Чтобы справиться с поставленной задачей, необходимо учитывать, что кислород является двухатомной молекулой с ковалентной неполярной связью, поэтому его формула записывается в следующем виде — О2. В правой части при составлении оксида кальция (СаО) учитывают валентности каждого элемента.
Сначала необходимо проверить количество кислорода в каждой части уравнения, так как оно отличается. По закону сохранения массы веществ перед формулой продукта нужно поставить коэффициент 2. Далее проводится проверка кальция. Для того чтобы он был уравнен, перед исходным веществом ставим коэффициент 2. В итоге получаем запись:
По закону сохранения массы веществ перед формулой продукта нужно поставить коэффициент 2. Далее проводится проверка кальция. Для того чтобы он был уравнен, перед исходным веществом ставим коэффициент 2. В итоге получаем запись:
- 2Са+О2=2СаО.
Разбор реакции методом электронного баланса
Как уравнивать химические уравнения? Примеры ОВР помогут ответить на данный вопрос. Допустим, что необходимо методом электронного баланса расставить коэффициенты в предложенной схеме:
- CuO + Н2=Cu + Н2О.
Для начала у каждого из элементов в исходных веществах и продуктах взаимодействия расставим значения степеней окисления. Получим следующий вид уравнения:
- Cu(+2)О(-2)+Н2(0)=Cu(0)+Н2(+)О(-2).
Показатели изменились у меди и водорода. Именно на их основе будем составлять электронный баланс:
- Cu(+2)+2е=Cu(0) 1 восстановитель, окисление;
- Н2(0)-2е=2Н(+) 1 окислитель, восстановление.
Исходя из коэффициентов, полученных в электронном балансе, получаем следующую запись предложенного химического уравнения:
- CuO+Н2=Cu+Н2О.

Возьмем еще один пример, который предполагает постановку коэффициентов:
- Н2+О2=Н2О.
Для того чтобы уравнять на основе закона сохранения веществ данную схему, необходимо начать с кислорода. Учитывая, что вступала в реакцию двухатомная молекула, перед формулой продукта взаимодействия необходимо поставить коэффициент 2.
- 2Н2+О2=2Н2О.
Заключение
На основании электронного баланса можно расставлять коэффициенты в любых химических уравнениях. Выпускникам девятых и одиннадцатых классов образовательных учреждений, выбирающим экзамен по химии, в одном из заданий итоговых тестов предлагают подобные задания.
Решение уравнений химический реакций вызывают затруднения у немалого количества учеников средней школы во-многом благодаря большому разнообразию участвующих в них элементов и неоднозначности их взаимодействия. Но так как основная часть курса общей химии в школе рассматривает именно взаимодействие веществ на основе их уравнений реакций, то ученикам необходимо обязательно ликвидировать пробелы в данной области и научиться решать химические уравнения, чтобы избежать проблем с предметом в дальнейшем.
Уравнением химической реакции называется символьная запись, отображающая взаимодействующие химические элементы, их количественное соотношение и получающиеся в результате взаимодействия вещества. Данные уравнения отражают сущность взаимодействия веществ с точки зрения атомно-молекулярного или электронного взаимодействия.
- В самом начале школьного курса химии учат решать уравнения на основе понятия валентности элементов периодической таблицы. На основе данного упрощения рассмотрим решение химического уравнения на примере окисления алюминия кислородом. Алюминий, взаимодействуя с кислородом, образует оксид алюминия. Обладая указанными исходными данными составим схему уравнения.Al + O 2 → AlO
В данном случае мы записали примерную схему химической реакции, которая лишь частично отражает ее сущность. В левой части схемы записываются вещества, вступающую в реакцию, а в правой результат их взаимодействия. Кроме того, кислород и другие типичные окислители, обычно записываются правее металлов и других восстановителей в обоих частях уравнения.
 Стрелка показывает направление реакции.
Стрелка показывает направление реакции. - Чтобы данная составленная схема реакции приобрела законченный вид и соответствовала закону сохранения массы веществ, необходимо:
- Проставить индексы в правой части уравнения у вещества, получившегося в результате взаимодействия.
- Уровнять количество участвующих в реакции элементов с количеством получившегося вещества в соответствии с законом сохранения массы веществ.
- Проставить индексы в правой части уравнения у вещества, получившегося в результате взаимодействия.
- Начнем с приостановки индексов в химической формуле готового вещества. Индексы устанавливаются в соответствии с валентностью химических элементов. Валентностью называют способность атомов образовывать соединения с другими атомами за счет соединения их неспаренных электронов, когда одни атомы отдают свои электроны, а другие присоединяют их себе на внешний энергетический уровень. Принято считать, что валентность химического элемента определяет его группой (колонкой) в периодической таблице Менделеева. Однако на практике взаимодействие химических элементов происходит гораздо сложнее и разнообразнее.
 Например, атом кислорода во всех реакциях имеет валентность Ⅱ, несмотря на то, что в периодической таблице находится в шестой группе.
Например, атом кислорода во всех реакциях имеет валентность Ⅱ, несмотря на то, что в периодической таблице находится в шестой группе. - Чтобы помочь вам сориентироваться в этом многообразии, предлагаем вам следующий небольшой справочный помощник, который поможет определить валентность химического элемента. Выберите интересующий вас элемент и вы увидите возможные значения его валентности. В скобках указаны редкие для выбранного элемента валентности.
- Вернемся к нашему примеру. Запишем в правой части схемы реакции сверху над каждым элементом его валентность.
Для алюминия Al валентность будет равна Ⅲ, а для молекулы кислорода O 2 валентность равна Ⅱ. Находим наименьшее общее кратное к этим числам. Оно будет равно шести. Делим наименьшее общее кратное на валентность каждого элемента и получаем индексы. Для алюминия шесть делим на валентность получаем индекс 2, для кислорода 6/2=3. Химическая формула оксида алюминия, полученного в результате реакции, примет вид Al 2 O 3 .
Al + O 2 → Al 2 O 3
- После получения правильной формулы готового вещества необходимо проверить и в большинстве случаев уравнять правые и левые части схемы согласно закона сохранения массы, так как продукты реакции образуются из тех же атомов, которые изначально входили в состав исходных веществ, участвующих в реакции.

- Закон сохранения массы гласит, что количество атомов вступивших в реакцию должно равняться количеству атомов получившихся в результате взаимодействия. В нашей схеме во взаимодействии участвуют один атом алюминия и два атома кислорода. В результате реакции получаем два атома алюминия и три кислорода. Очевидно, что схему необходимо уровнять, используя коэффициенты для элементов и вещества, чтобы соблюдался закон сохранения массы.
- Уравнивание выполняют также через нахождение наименьшего общего кратного, которое находится между элементами, обладающими наибольшими индексами. В нашем примере это будет кислород с индексом в правой части равным 3 и в левой части равным 2. Наименьшее общее кратное и в этом случае будет равно 6. Теперь разделим наименьшее общее кратное на значение наибольшего индекса в левой и правой частях уравнения и получим следующие индексы для кислорода.
- Теперь остается уравнять только алюминий в правой части.
 Для этого в левую часть поставим коэффициент 4.
Для этого в левую часть поставим коэффициент 4.4∙Al + 3∙O 2 = 2∙Al 2 O 3
- После расстановки коэффициентов уравнение химической реакции соответствует закону сохранения массы и между его левой и правой частями можно поставить знак равенства. Расставленные коэффициенты в уравнении обозначают число молекул веществ, участвующих в реакции и получающихся в результате нее, или соотношение данных веществ в молях.
После выработки навыков решения химических уравнений на основе валентностей взаимодействующих элементов, школьный курс химии знакомит с понятием степени окисления и теорией окислительно-восстановительных реакций. Данный тип реакций является наиболее распространенным и в дальнейшем химические уравнения чаще всего решают на основе степеней окисления взаимодействующих веществ. О том, рассказано в соответствующей статье на нашем сайте.
Для характеристики определенной химической реакции необходимо уметь составить запись, которая будет отображать условия протекания химической реакции, показывать какие вещества вступили в реакцию, а какие образовались. Для этого используют схемы химических реакций.
Для этого используют схемы химических реакций.
Схема химической реакции – условная запись, показывающая, какие вещества вступают в реакцию, какие продукты реакции образуются, а также условия протекания реакции
Рассмотрим в качестве примера реакцию взаимодействия угля и кислорода. Схема данной реакции записывается следующим образом:
С + О2 → СО2.
уголь взаимодействует с кислородом с образованием углекислого газа
Углерод и кислород – в данной реакции реагенты, а полученный углекислый газ – продукт реакции. Знак «→ » обозначает протекание реакции. Часто над стрелкой пишут условия, при которых происходит реакция
Например, знак « t° → » обозначает, что реакция протекает при нагревании. Знак « Р → » обозначает давление, а знак « hv → » – что реакция протекает под действием света. Также над стрелкой могут указывать дополнительные вещества, участвующие в реакции. Например, « О2 → ».
Если в результате химической реакции образуется газообразное вещество, то в схеме реакции, после формулы этого вещества записывают знак «→ ». Если при протекании реакции образуется осадок, его обозначают знаком «→ ».
Если при протекании реакции образуется осадок, его обозначают знаком «→ ».
Например, при нагревании порошка мела (он содержит вещество с химической формулой CaCO3), образуются два вещества: негашеная известь CaO и углекислый газ.
СaCO3 t° → CaO + CO2 .
В тех случаях, когда и реагенты и продукты реакции, например, являются газами, знак «» не ставят. Так, природный газ, в основном состоит из метана Ch5, при его нагревании до 1500°С он превращается в два других газа: водород Н2 и ацетилен С2Н2. Схема реакции записывается так:
Ch5 t° → C2h3 + h3.
Важно не только уметь составлять схемы химических реакций, но и понимать, что они обозначают. Рассмотрим, еще одну схему реакции:
h3O эл.ток → Н2 + О2
Данная схема означает, что под действием электрического тока, вода разлагается на два простых газообразных вещества: водород и кислород. Схема химической реакции является подтверждением закона сохранения массы и показывает, что химические элементы во время химической реакции не исчезают, а только перегруппировываются в новые химические соединения.
Уравнения химических реакций
Согласно закону сохранения массы исходная масса продуктов всегда равна массе полученных реагентов. Количество атомов элементов до и после реакции всегда одинаковое, атомы только перегруппировываются и образуют новые вещества.
Вернемся к схемам реакций, записанным ранее:
СaCO3 t° → CaO + CO2; С + О2 СО2.
В данных схемах реакций знак «→ » можно заменить на знак «=», так как видно, что количество атомов до и после реакций одинаковое. Записи будут иметь следующий вид:
СaCO3 = CaO + CO2; С + О2 = СО2.
Именно такие записи называют уравнениями химических реакций, то есть, это – записи схем реакций, в которых количество атомов до и после реакции одинаковое.
Уравнение химической реакции – условная запись химической реакции посредством химических формул, которая соответствует закону сохранения массы вещества
Если мы рассмотрим другие, приведенные ранее схемы уравнений, можно заметить, что на первый взгляд, закон сохранения массы в них не выполняется:
Ch5 t° → C2h3 + h3.
Видно, что в левой части схемы, атом углерода один, а в правой – их два. Атомов водорода поровну и в левой и правой частях их по четыре. Превратим данную схему в уравнение. Для этого необходимо уравнять количество атомов углерода. Уравнивают химические реакции при помощи коэффициентов, которые записывают перед формулами веществ.
Очевидно, чтобы количество атомов углерода стало одинаковым слева и справа, в левой части схемы, перед формулой метана, необходимо поставить коэффициент 2:
2Ch5 t° → C2h3 + h3
Видно, что атомов углерода слева и справа теперь поровну, по два. Но теперь неодинаково количество атомов водорода. В левой части уравнения их 2∙4 = 8. В правой части уравнения атомов водорода 4 (два из них в молекуле ацетилена, и еще два – в молекуле водорода). Если поставить коэффициент перед ацетиленом, нарушится равенство атомов углерода. Поставим перед молекулой водорода коэффициент 3:
2Ch5 = C2h3 + 3h3
Теперь количество атомов углерода и водорода в обеих частях уравнения одинаковое.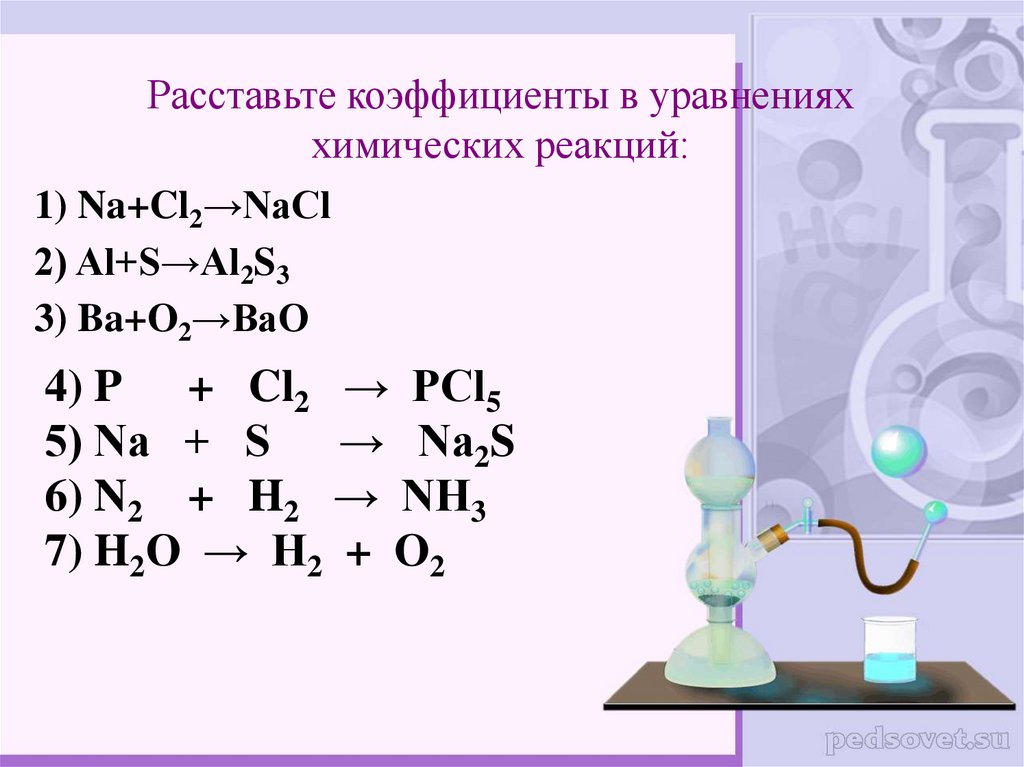 Закон сохранения массы выполняется!
Закон сохранения массы выполняется!
Рассмотрим другой пример. Схему реакции Na + h3O → NaOH + h3 необходимо превратить в уравнение.
В данной схеме различным является количество атомов водорода. В левой части два, а в правой – три атома. Поставим коэффициент 2 перед NaOH.
Na + h3O → 2NaOH + h3
Тогда атомов водорода в правой части станет четыре, следовательно, коэффициент 2 необходимо добавить и перед формулой воды:
Na + 2h3O → 2NaOH + h3
Уравняем и количество атомов натрия:
2Na + 2h3O = 2NaOH + h3
Теперь количество всех атомов до и после реакции одинаковое.
Таким образом, можно сделать вывод: чтобы превратить схему химической реакции в уравнение химической реакции, необходимо уравнять количество всех атомов, входящих в состав реагентов и продуктов реакции при помощи коэффициентов. Коэффициенты ставятся перед формулами веществ.
Подведем итоги об Уравнения химических реакций
- Схема химической реакции – условная запись, показывающая, какие вещества вступают в реакцию, какие продукты реакции образуются, а также условия протекания реакции
- В схемах реакций используют обозначения, указывающие на особенности их протекания
- Уравнение химической реакции – условная запись химической реакции посредством химических формул, которая соответствует закону сохранения массы вещества
- Схему химической реакции превращают в уравнение путем расстановки коэффициентов перед формулами веществ
Химическим уравнением можно назвать визуализацию химической реакции с помощью знаков математики и химических формул. Такое действие является отображением какой-либо реакции, в процессе которой появляются новые вещества.
Такое действие является отображением какой-либо реакции, в процессе которой появляются новые вещества.
Химические задания: виды
Химическое уравнение — это последовательность химических реакций. Они основываются на законе сохранения массы каких-либо веществ. Существует всего два вида реакций:
- Соединения — к ним относятся (происходит замена атомов сложных элементов атомами простых реагентов), обмена (замещение составными частями двух сложных веществ), нейтрализации (реакция кислот с основаниями, образование соли и воды).
- Разложения — образование двух и более сложных или простых веществ из одного сложного, но состав их более простой.
Химические реакции также можно разделить на типы: экзотермические (происходят с выделением теплоты) и эндотермические (поглощение теплоты).
Этот вопрос волнует многих учащихся. Мы предлегаем несколько простых советов, которые подскажут, как научиться решать химические уравнения:
- Желание понять и освоить.
 Нельзя отступать от своей цели.
Нельзя отступать от своей цели. - Теоретические знания. Без них невозможно составить даже элементарную формулу соединения.
- Правильность записи химической задачи — даже малейшая ошибка в условии сведет к нулю все ваши усилия в ее решении.
Желательно, чтобы сам процесс решения химических уравнений был для вас увлекательным. Тогда химические уравнения (как решать их и какие моменты нужно запомнить, мы разберем в этой статье) перестанут быть для вас проблемными.
Задачи, которые решаются с использованием уравнений химических реакций
К таким задачам относятся:
- Нахождение массы компонента по данной массе другого реагента.
- Задания по комбинации «масса-моль».
- Расчеты по комбинации «объем-моль».
- Примеры с применением термина «избыток».
- Расчеты с использованием реагентов, один из которых не лишен примесей.
- Задачи на распад результата реакции и на производственные потери.
- Задачи на поиск формулы.

- Задачи, в которых реагенты предоставлены в виде растворов.
- Задачи, содержащие смеси.
Каждый из этих видов задач включает в себя несколько подтипов, которые обычно подробно рассматриваются еще на первых школьных уроках химии.
Химические уравнения: как решать
Существует алгоритм, который помогает справиться с практически любым заданием из этой непростой науки. Чтобы понять, как правильно решать химические уравнения, нужно придерживаться определенной закономерности:
- При записи уравнения реакции не забывать расставлять коэффициенты.
- Определение способа, с помощью которого можно найти неизвестные данные.
- Правильность применения в выбранной формуле пропорций или использование понятия «количество вещества».
- Обратить внимание на единицы измерений.
В конце важно обязательно проверить задачу. В процессе решения вы могли допустить элементарную ошибку, которая повлияла на результат решения.
Основные правила составления химических уравнений
Если придерживаться правильной последовательности, то вопрос о том, что такое химические уравнения, как решать их, не будет вас волновать:
- Формулы веществ, которые вступают в реакцию (реагенты), записываются в левой части уравнения.

- Формулы веществ, которые образуются в результате реакции, записываются уже в правой части уравнения.
Составление уравнения реакции основывается на законе сохранения массы веществ. Следовательно, обе части уравнения должны быть равны, т. е. с одинаковым числом атомов. Достичь этого можно при условии правильной расстановки коэффициентов перед формулами веществ.
Расстановка коэффициентов в химическом уравнении
Алгоритм расстановки коэффициентов таков:
- Подсчет в левой и правой части уравнения атомов каждого элемента.
- Определение меняющегося количества атомов у элемента. Также нужно найти Н.О.К.
- Получение коэффициентов достигается путем деления Н.О.К. на индексы. Обязательно проставить данные цифры перед формулами.
- Следующим шагом является пересчет количества атомов. Иногда возникает необходимость в повторении действия.
Уравнивание частей химической реакции происходит с помощью коэффициентов. Расчет индексов производится через валентность.
Для успешного составления и решения химических уравнений необходимо учитывать физические свойства вещества, такие как объем, плотность, масса. Также нужно знать состояние реагирующей системы (концентрация, температура, давление), разбираться в единицах измерения данных величин.
Для понимания вопроса о том, что такое химические уравнения, как решать их, необходимо использование основных законов и понятий этой науки. Чтобы успешно вычислять подобные задачи, необходимо также вспомнить или освоить навыки математических операций, уметь совершать действия с числами. Надеемся, с нашими советами вам будет легче справляться с химическими уравнениями.
7 Крутые игры с балансировкой химических уравнений, в которые можно играть онлайн
Балансировка химических уравнений — это фундаментальное понятие в химии, которое помогает понять поведение различных химических веществ и то, как они реагируют друг с другом. Это важный шаг в прогнозировании исхода химической реакции и понимании стехиометрии реакции.
Однако понять и запомнить правила и методы балансировки химических уравнений может быть непросто. В этом случае онлайн-игры могут служить веселым и интерактивным способом помочь учащимся изучать и практиковать балансирование химических уравнений. Независимо от того, являетесь ли вы студентом, пытающимся сдать следующий тест, или любознательным учеником, стремящимся углубить свое понимание химии, веселые занятия и интерактивные онлайн-игры — идеальный способ сделать изучение химических реакций увлекательным и увлекательным.
Итак, приготовьтесь прокачать свои химические навыки с помощью этих эксклюзивных онлайн-игр, которые бросят вызов вашему разуму и помогут овладеть искусством балансировки химических уравнений. Берите лабораторный халат и защитные очки и окунитесь в мир химических реакций и онлайн-игр!
Облегчение понимания балансировки химических уравнений с помощью онлайн-игр Благодаря множеству онлайн-игр на химию дети могут также принять участие в нескольких играх с балансировкой химических уравнений, которые помогут им лучше понять эту концепцию. Итак, вот несколько игр, в которые можно играть в классе или даже дома!
Итак, вот несколько игр, в которые можно играть в классе или даже дома!
Это образовательная игра, которая моделирует химические реакции и знакомит игроков с элементами, соединениями и химическими реакциями. В игре обычно участвуют игроки, смешивающие различные элементы и соединения для создания новых соединений и наблюдения за получающимися химическими реакциями. Игра может включать несколько уровней или настроек сложности, а также может предоставлять информацию и пояснения об элементах и их свойствах.
Воспитательное значение этой игры заключается в том, что она помогает игрокам понять фундаментальные принципы химии и то, как различные элементы и соединения взаимодействуют друг с другом. Он также предоставляет учащимся интерактивный и визуальный опыт обучения, который может помочь им лучше понять и запомнить материал.
Ссылка на игру
2. Outer Space Molecule Chase Это игра, которая имитирует процесс создания молекул путем объединения атомов. В игре обычно участвуют игроки, которые перемещаются в пространстве, собирают различные атомы и используют их для создания молекул. Игра может включать несколько уровней или настроек сложности, а также может предоставлять информацию и пояснения об элементах и их свойствах.
В игре обычно участвуют игроки, которые перемещаются в пространстве, собирают различные атомы и используют их для создания молекул. Игра может включать несколько уровней или настроек сложности, а также может предоставлять информацию и пояснения об элементах и их свойствах.
Цель игры — помочь игрокам узнать о молекулах, их свойствах и способах их образования в увлекательной и увлекательной форме. Образовательное значение этой игры заключается в том, что она помогает учащимся узнать о концепции химических соединений и о том, как атомы объединяются в молекулы. Это также позволяет учащимся практиковаться в построении молекул, что может помочь им понять свойства и поведение различных соединений.
Ссылка на игру
3. Игра «Балансировка химических уравнений» 3. Игра «Балансировка химических уравнений» на TinyTap — это образовательная игра, предназначенная для того, чтобы помочь учащимся научиться составлять химические уравнения. Игра обычно представляет игроку несбалансированное химическое уравнение, и игрок должен использовать свои знания о химических реакциях и принципах сохранения массы, чтобы сбалансировать уравнение, регулируя коэффициенты реагентов и продуктов.
Затем игрок может проверить свою работу, представив уравнение, и игра сообщит, сбалансировано ли уравнение или нет. Образовательное использование этой игры должно помочь учащимся развить их понимание химических реакций и принципов сохранения массы.
Играя в игру, учащиеся могут практиковаться в балансировке уравнений и получать немедленную обратную связь о своей работе, которая может помочь им выявить и исправить любые ошибки, которые они могут совершать. Кроме того, игровой формат делает изучение химических уравнений более увлекательным и интерактивным, что может помочь повысить мотивацию учащихся и их вовлеченность в материал.
Ссылка на игру
4. PhET: балансировка химических уравнений Игра балансировки химических уравнений на PhET представляет собой интерактивную симуляцию, предназначенную для того, чтобы помочь учащимся научиться составлять химические уравнения. Игра обычно предоставляет игроку интерактивный интерфейс, который позволяет ему манипулировать реагентами и продуктами в химическом уравнении, регулируя количество атомов или молекул каждого элемента.
После этого игрок может проверить свою работу, нажав кнопку, чтобы сбалансировать уравнение, и игра сообщит, сбалансировано уравнение или нет. Эта игра предназначена для того, чтобы помочь учащимся развить свое понимание химических реакций и принципов сохранения массы путем визуального представления атомов и молекул, участвующих в реакции.
Кроме того, интерактивный характер моделирования позволяет учащимся экспериментировать с различными способами уравновешивания уравнений, что может помочь им более эффективно идентифицировать и понимать основные концепции.
Ссылка на игру
5. Химия: игра с балансирующими уравнениями – Из грязи в князи-2020i «Химия: игра с балансирующими уравнениями – Из грязи в князи-2020i» на Quia – это обучающая игра, предназначенная для помощи студенты узнают, как сбалансировать химические уравнения. Игра представляет собой формат множественного выбора, в котором учащимся предлагается химическое уравнение и четыре различных варианта его баланса.
Игрок должен использовать свои знания о химических реакциях и принципах сохранения массы, чтобы выбрать правильное сбалансированное уравнение из четырех вариантов. Игра также включает в себя систему начисления очков и функцию таблицы лидеров, которая может добавить элемент соревнования и мотивации для студентов.
Образовательное использование этой игры состоит в том, чтобы помочь учащимся лучше понять химические реакции и принципы сохранения массы, предоставляя учащимся возможность попрактиковаться в уравнениях баланса и получить немедленную обратную связь о своей работе.
Кроме того, формат множественного выбора позволяет учащимся проверить свое понимание уравнений баланса, что может помочь им выявить и исправить любые ошибки, которые они могут совершать. Формат игры с дополнительными функциями очков и таблицы лидеров делает изучение химических уравнений более увлекательным и интерактивным, что может помочь повысить мотивацию учащихся и их вовлеченность в материал.
Ссылка на игру
6. iwant2study: Балансировка химических уравнений«Балансировка химических уравнений» предназначена для того, чтобы помочь пользователям научиться балансировать химические уравнения. Моделирование представляет собой виртуальную среду, в которой пользователи могут взаимодействовать с атомами и молекулами, чтобы узнать, как сбалансировать химические уравнения. В игре пользователям предоставляется химическое уравнение, и им нужно настроить количество атомов каждого элемента в уравнении, чтобы сбалансировать его.
Моделирование позволяет пользователям добавлять или удалять атомы различных элементов, а также обеспечивает обратную связь о том, сбалансировано уравнение или нет. Эта интерактивная игра помогает учащимся понять концепцию балансировки химических уравнений, которая является важной частью химии. Игра позволяет игрокам проверить, является ли уравнение правильным представлением химической реакции, и помогает учащимся понять, как атомы трансформируются во время химической реакции.
Ученики могут поэкспериментировать с различными способами уравновешивания уравнений и сразу же узнать, верны они или нет. Это помогает им быстрее и эффективнее освоить процесс балансировки химических уравнений.
Ссылка на игру
7. Калькулятор балансировки химических уравненийЭто интересный способ научиться балансировать химические уравнения. Игра показывает вам изображение некоторых химических веществ и просит сбалансировать изображение. Думайте об этом как о сборке пазла — вам нужно убедиться, что все подходит правильно.
Вам нужно подсчитать количество каждого химического вещества, а затем сложить числа, чтобы картинка была сбалансированной. Например, если на одной стороне есть два атома кислорода, вам нужно убедиться, что на другой стороне также есть два атома кислорода. Вы вводите числа, которые, по вашему мнению, уравновесят изображение, а затем нажимаете кнопку, чтобы проверить, правы ли вы. Если да, то игра скажет вам, что вы хорошо поработали! Если нет, вы можете попробовать еще раз, пока не получите правильный результат.
Игра отслеживает, сколько картинок вы правильно сбалансировали, чтобы вы могли видеть, насколько хорошо у вас получается. Имейте в виду, что при вводе формулы нет необходимости добавлять пробел. В целом, это похоже на головоломку, которую нужно решить, и вы увидите, как многому вы научились по ходу дела!
Game Link
Овладение искусством балансировки химических уравнений: стратегии и советы для достижения успехаБалансировку химических уравнений можно упростить, следуя нескольким ключевым стратегиям:
- Начните с написания неуравновешенного уравнения с реагентами слева и продуктами справа.
- Подсчитайте количество атомов каждого элемента в обеих частях уравнения и составьте список этих чисел.
- Определите несбалансированные элементы и сначала выберите один из них для балансировки.
- Используйте коэффициенты (числа, расположенные перед химическими формулами), чтобы сбалансировать выбранный элемент в одной части уравнения.

- Отрегулируйте коэффициенты других элементов, чтобы сохранить баланс, и повторите процесс для всех оставшихся несбалансированных элементов.
- Наконец, убедитесь, что число атомов каждого элемента одинаково в обеих частях уравнения.
- Начните с самых сложных молекул или молекул с наибольшим количеством атомов.
- Используйте дроби, если необходимо сбалансировать уравнение. Например, вместо O можно использовать 1/2 O2, а вместо H можно использовать 2/3 h3.
- Помните, что балансировка уравнения требует корректировки как коэффициентов, так и нижних индексов химических формул.
- Еще раз проверьте свою работу, чтобы убедиться, что уравнение полностью сбалансировано, а коэффициенты представлены в простейшей форме.
Следуя этим стратегиям и советам, составление химических уравнений может стать веселой и интересной задачей, которая поможет углубить ваше понимание химии. В то же время химия также может быть облегчена для детей с нарушениями обучаемости, такими как дискалькулия.
В то же время химия также может быть облегчена для детей с нарушениями обучаемости, такими как дискалькулия.
В заключение, использование балансирующих онлайн-игр с уравнениями в качестве метода обучения для учащихся может быть эффективным и увлекательным способом помочь учащимся изучить химию и улучшить свое понимание предмета. Эти игры предоставляют учащимся интерактивный и визуальный опыт обучения, который может помочь привлечь их внимание и сделать процесс обучения более приятным.
С помощью множества доступных научных и математических игр учащиеся могут преодолеть неправильные представления и глубже понять концепции. Учителя могут использовать эти игры в качестве дополнения к традиционным занятиям в классе, а учащиеся могут использовать их для повторения и закрепления того, что они узнали.
Калькулятор уравнений баланса | Balance Chemical Equation
Удобный онлайн-калькулятор уравнений балансировки поможет вам легко сбалансировать химические уравнения. Просто введите свое химическое уравнение в поле ввода и нажмите кнопку расчета, чтобы проверить результат за считанные секунды с подробной работой.
Просто введите свое химическое уравнение в поле ввода и нажмите кнопку расчета, чтобы проверить результат за считанные секунды с подробной работой.
Введите реагенты
Введите продукты
Калькулятор уравнений балансировки: Free Balance Equations Tool — это замечательный инструмент, который поможет вам сбалансировать любое химическое уравнение. Кроме того, в нем описаны простые шаги для балансировки химического уравнения, а также определение уравнения балансировки. Баланс химического уравнения важен в некоторых ситуациях. Он добавит коэффициенты к реагентам и продуктам, чтобы сбалансировать уравнение. Выполняя этот процесс, мы можем сказать, что количество молекул с правой стороны равно количеству молекул с левой стороны.
Здесь мы даем 5 простых шагов, чтобы сбалансировать любое химическое уравнение. Следуйте этим рекомендациям и сбалансируйте свое уравнение легко и быстро.
- Подсчитайте количество атомов с каждой стороны уравнения
- Проверьте коэффициенты атомов и добавьте любое число n в качестве коэффициента для требуемых атомов, чтобы сбалансировать уравнение.

- Разрешается только ставить коэффициент перед реагентом или продуктом, но не разрешается изменять нижние индексы элементов.
- После добавления коэффициентов один раз проверьте, чтобы количество атомов в левой части было равно количеству атомов в правой части.
- Измените коэффициенты для необходимых атомов, чтобы сбалансировать уравнение.
- Когда вы имеете дело с многоатомными ионами, рассматривайте каждый многоатомный ион как один элемент.
- Добавьте коэффициенты к этим пунктам, чтобы получить сбалансированное уравнение.
- Иногда подсчитайте все атомы в химическом уравнении, даже если оно содержит многоатомные ионы, и добавьте к нему коэффициенты, чтобы получить сбалансированное уравнение.
Пример
Вопрос: Сбалансируйте это уравнение: CaCl 2 + AgNO 3 → Ca(NO 3 ) 2 + AgCl?
Решение:
. Данное несбалансированное уравнение составляет
CACL 2 + Agno 3 → CA (№ 3 ) 2 + Agcl
. Написать по номеру . Левая сторона имеет Ca=1, Cl= 2, Ag= 1, N= 1, O= 3
Написать по номеру . Левая сторона имеет Ca=1, Cl= 2, Ag= 1, N= 1, O= 3
В правой части Ca=1, Cl=1, Ag=1, N=2, O=6
Атомы азота, хлора и кислорода не сбалансированы.
Добавьте 2 слитка AgNO 3 и AgCl.
Левая сторона содержит Ca=1, Cl= 2, Ag= 1*2 = 2, N= 1*2 = 2, O= 3*2 = 6
Правая сторона содержит Ca= 1, Cl= 1 *2 = 2, Ag= 1*2 = 2, N= 2, O= 6
Наконец, уравнение сбалансировано.
CaCl 2 +2 AgNO 3 → Ca(NO 3 ) 2 + 2AgCl
Onlinecalculator.guru — лучшее место, где вы можете найти калькуляторы различных математических, физических и химических концепций. Взгляните на них и используйте, когда это необходимо, чтобы получить мгновенные результаты.
сообщите об этом объявлении
1. Каковы правила балансировки химического уравнения?
- Примените закон сохранения массы, чтобы получить одинаковое количество атомов с каждой стороны химического уравнения.

- Начните с балансировки элемента, доступного только в одном реагенте и продукте.
- После завершения балансировки одного элемента продолжайте, пока все элементы уравнения не будут сбалансированы.
- Сбалансируйте химическое уравнение, поставив перед ним коэффициенты. Вы не должны добавлять индексы, потому что это изменит реакцию.
2. Вы складываете или умножаете балансирующие уравнения?
Важный момент, который следует помнить при балансировке уравнения: никогда не меняйте его индексы, добавляйте к ним коэффициенты. Всегда умножайте коэффициенты атомов на его нижний индекс, чтобы определить количество элементов в реакции.
3. Как сбалансировать длинное химическое уравнение с помощью алгебраического метода?
- Сначала ко всем реагентам и продуктам добавляем переменные a,b,c,d и т.д.
- Обратите внимание на количество элементов справа и слева.
- Приравняйте любой элемент количеству молекул с обеих сторон.



 Стрелка показывает направление реакции.
Стрелка показывает направление реакции.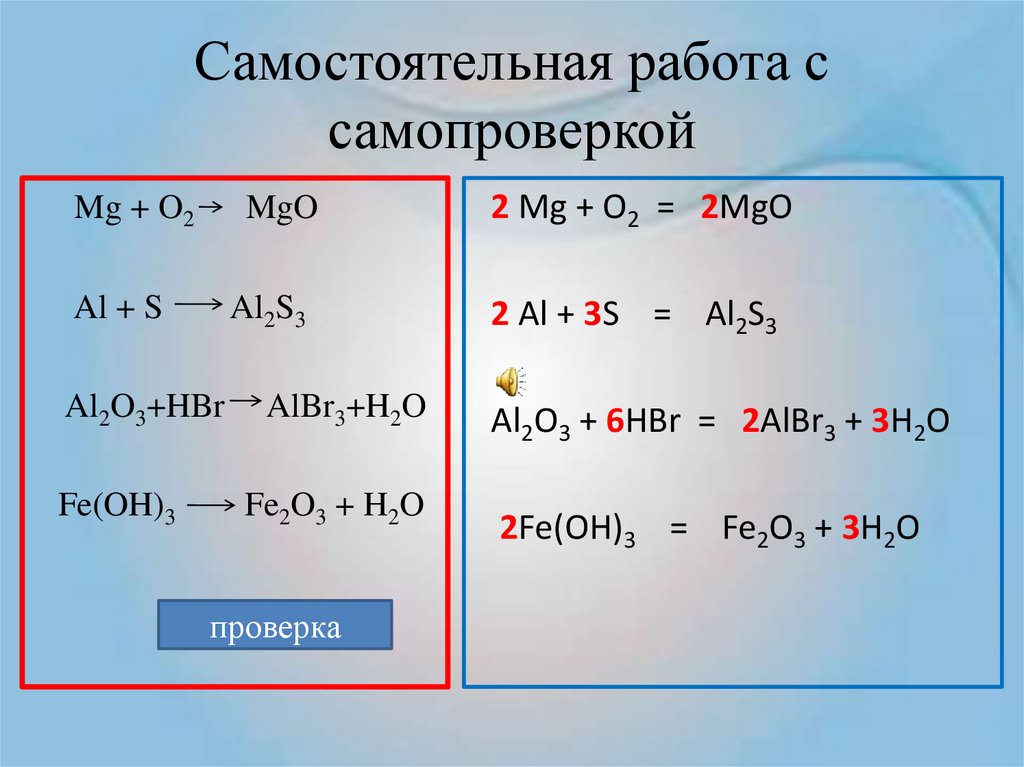 Например, атом кислорода во всех реакциях имеет валентность Ⅱ, несмотря на то, что в периодической таблице находится в шестой группе.
Например, атом кислорода во всех реакциях имеет валентность Ⅱ, несмотря на то, что в периодической таблице находится в шестой группе.
 Для этого в левую часть поставим коэффициент 4.
Для этого в левую часть поставим коэффициент 4. Нельзя отступать от своей цели.
Нельзя отступать от своей цели.
