Решение задач по химии. Расчет по уравнениям химических реакций. In-chemistry.ru
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.

- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении.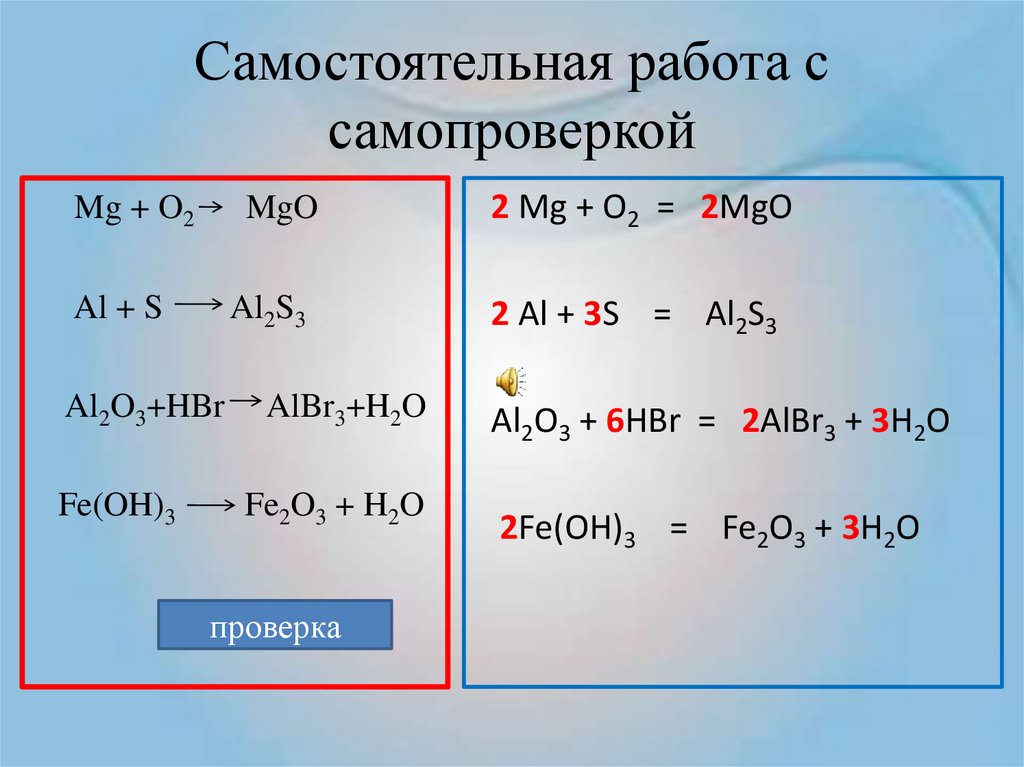 И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_{2}SO_{4} + NaOH → Na_{2}SO_{4} + H_{2}O
Расставим коэффициенты:
H_{2}SO_{4} + 2NaOH → Na_{2}SO_{4} + 2H_{2}O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅1023 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅1023 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅1023 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды.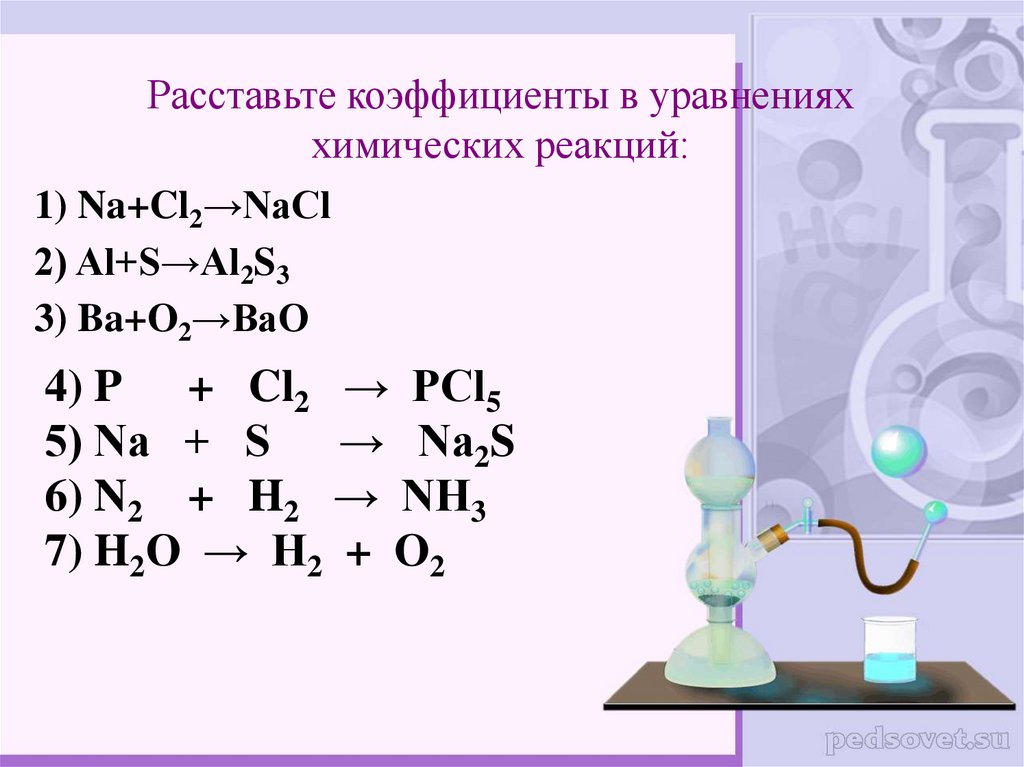 Давайте запишем эти данные под уравнением реакции для наглядности.
Давайте запишем эти данные под уравнением реакции для наглядности.
\begin{matrix}H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \\ 1 \: моль & & 2 \: моль & & 1 \: моль & & 2 \: моль \end{matrix}
Следом запишем молярные массы для этих веществ
\begin{matrix} H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \\ 1 \: моль & & 2 \: моль & & 1 \: моль & & 2 \: моль \\ 98 \: г& & 40 \: г & & 142 \: г & & 18 \: г \end{matrix}
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
\begin{matrix}49 \: г & & X \: г & & & & \\ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \\ 1 \: моль & & 2 \: моль & & 1 \: моль & & 2 \: моль \\ 98 \: г& & 40 \: г & & 142 \: г & & 18 \: г \end{matrix}
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
Для этого разделим известную массу вещества (49 грамм) на молярную массу:
49\98=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
\begin{matrix}49 \: г & & X \: г & & & & \\ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \\ 1 \: моль & & 2 \: моль & & 1 \: моль & & 2 \: моль \\ 98 \: г& & 40 \: г & & 142 \: г & & 18 \: г \\ 98 \: г & & 80 \: г & & 142 \: г & & 36 \: г \end{matrix}
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
Составим из этих данных пропорцию.
\frac{49}{98} = \frac{X}{80}
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
Химические уравнения — презентация онлайн
Похожие презентации:
Закон сохранения массы веществ. Уравнения химических реакций
Составление уравнений химических реакций
Расчеты по химическим уравнениям
Химические реакции
Химические уравнения. Типы химических реакций
Расчеты по химическим уравнениям
Закон сохранения массы веществ. Химические уравнения
Химические уравнения
Основные химические понятия
Лекция 3. Химическое равновесие
1. Химические уравнения
3. Атомно-молекулярная теория
Молекулы состоят из атомов.
Атомы при химических реакциях не
изменяются и не исчезают,
происходит лишь их
перегруппировка, т.е. образуются
новые вещества.
Следовательно, их общая масса
также не изменяется
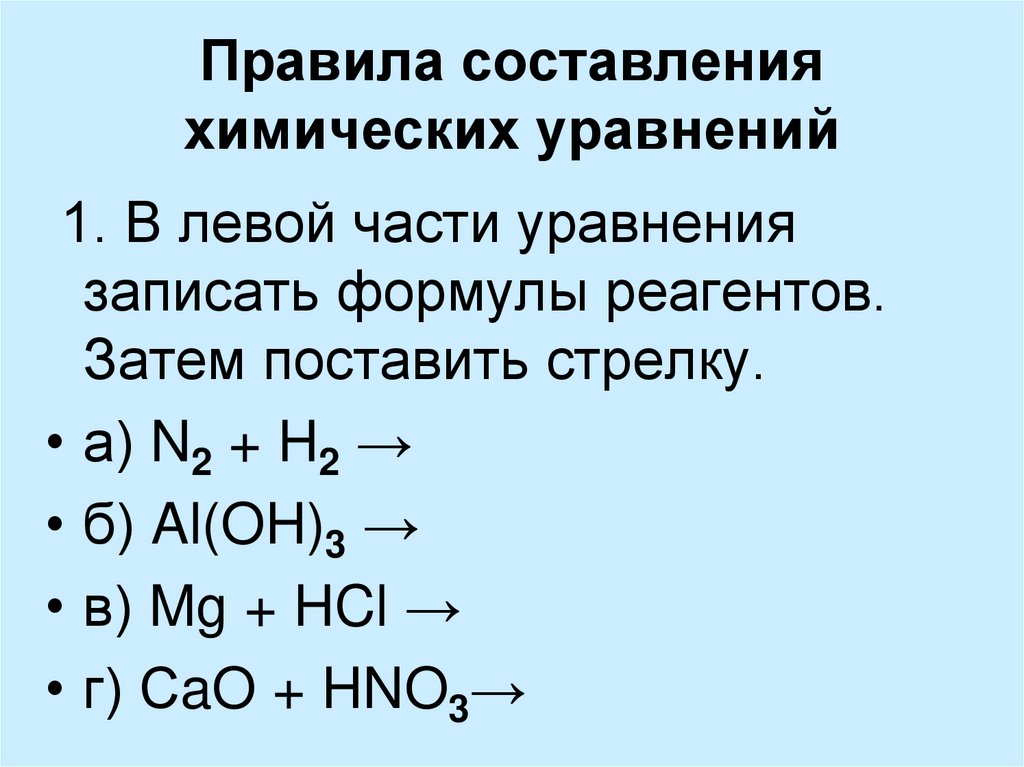
4. Основные правила составления химических уравнений:
1. В левой части уравнения пишутся формулы веществ,вступающих в реакцию – исходные вещества.
2. В правой части – формулы получившихся веществ –
продукты реакции.
3. Между исходными веществами и продуктами
реакции ставится стрелка.
4. На основании закона сохранения веществ
уравниваются атомы.
5.Число атомов каждого элемента в правой части равно
числу атомов этого же элемента в левой части.
6. Уравнивание атомов производится с помощью
подбора коэффициентов перед формулами веществ.
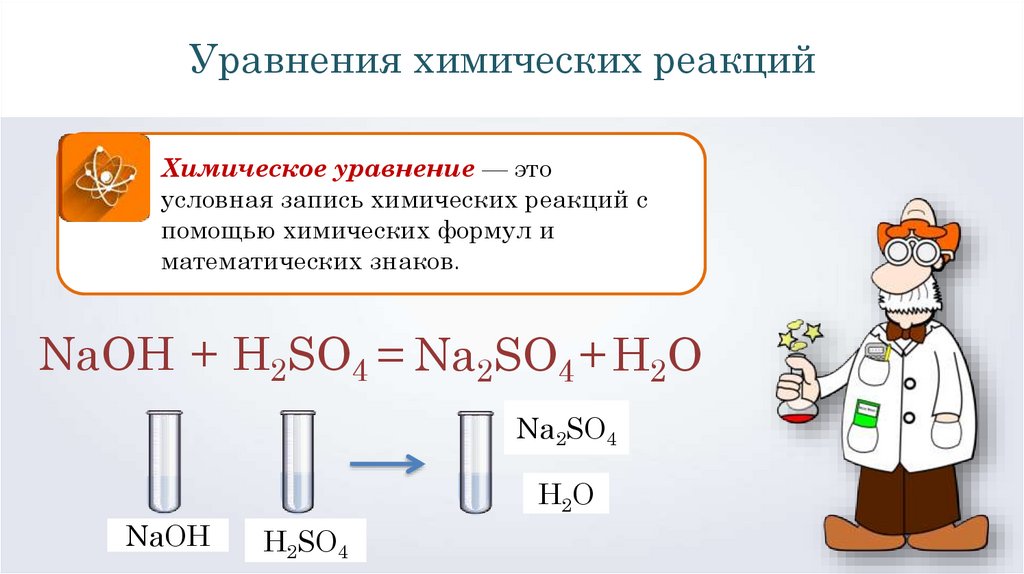
5. Химическим уравнением называют условную запись химической реакции с помощью химических формул и математических знаков.
6. При разложении воды образуются два газообразных вещества — Н2 и О2.
 h3O
h3Oh3 + O2
2h3O == 2h3 + O2
Уравнение химической реакции
7. Алгоритм составления уравнения химической реакции
1. Записать формулы исходныхвеществ.
2. Справа от формул исходных
веществ (после стрелки)
записать формулы продуктов
реакции.
3. Расставить коэффициенты.
8. Горение магния
Mg + O2MgO
2Mg + O2 = 2MgO
9. Работа у доски
1. Получение углекислого газа:С + О2
2. Разложение ртути:
HgO
3. Окисление натрия:
Na + O2
10. Соотношение количеств веществ, участвующих в реакции.
Коэффициенты показывают не толькочисло молекул каждого вещества, но и
соотношение количеств веществ,
которые участвуют в реакции.
Например: 2Н2 + О2 = 2Н2О
Для образования воды(2 моль)
необходимо столько же моль водорода(2
моль) и в 2 раза меньше кислорода (1
моль)
11. Задача: Определить количество вещества кислорода, образующегося в результате разложения 4 моль воды.
 Алгоритм решения задачи:
Алгоритм решения задачи:1. Составить уравнение реакции.
2. Составить пропорцию, определив
количества веществ по уравнению реакции и
по условию, неизвестное берем за Х.
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти Х.
12. Задача: Какое количество кислорода потребуется для полного сгорания 3 моль меди?
Ответ: n (О2) = 1,5 мольEnglish Русский Правила
Решатель задач по химии онлайн | Помощь с домашним заданием по химии
Лучшие помощники по домашнему заданию:
| Ранг | Веб-сайт | Уникальные особенности | Рейтинг | Дополнительная информация | ||
|---|---|---|---|---|---|---|
| 1 | Лучший по цене | 9,7/10 | Посетите сайт Получить 1 бесплатную страницу | |||
| 2 | Лучшее для срочных дел и задач | 9,4/10 | Посетите сайт -20% на задание STEAM | |||
| 3 | Лучший для написания реферата в колледже | 9. | Посетите сайт -10% на 1-й заказ | |||
| 4 | Лучшее решение для студентов с гибким бюджетом | 8,6/10 | Посетите сайт | |||
| 5 | Лучший выбор для студентов, изучающих финансы и право | 8,3/10 | Посетите сайт | |||
Каждому человеку, желающему досконально изучить химию и получить серьезные и полезные знания по этому предмету, время от времени необходим доступ к полезным веб-ресурсам. Ресурсы, которые помогут в качестве дорожной карты для их академической карьеры. Мы пройдемся по их списку в этом посте и рассмотрим преимущества этих сайтов.
3 ТОП-3 сайта помощи с домашними заданиями по химии, где вы можете сразу же решить свои проблемы:
- CheetahPapers.
 com
com - BookwormHub.com
- CheapWritingService.com
Если эти странные уравнения, которые учитель химии пишет на доске, сводят вас с ума, а не вызывают у вас любопытство, не нужно себя мучить. Благодаря цифровому и технологическому прогрессу вы можете найти решение химических задач для любого случая. Вот несколько альтернативных источников, которые вы можете использовать.
- Химия
- pH-калькулятор
- Уравновешивание химических уравнений
- Калькулятор кротов
- Калькулятор полураспада (реакция второго порядка)
- Номенклатура
- Калькулятор химических уравнений
- Калькулятор молярности Philip Harris
- Калькулятор химических реакций
- Уравнитель реакции
- Калькулятор коэффициента частоты
- Поиск элементов
- Generador de Estructuras de Lewis ITPA
- Калькулятор полураспада (реакция нулевого порядка)
- pH-калькулятор
- Виджет ВСЕПР
- Калькулятор электронной конфигурации
- Оксид
- Фазовая диаграмма
- Химическая формула
- Элементы периодической таблицы
- Калькулятор валентной оболочки
- Химическая структура
- Калькулятор температуры вспышки
- Найти и преобразовать формулу массы в граммах
- Этикетки NFPA для химических веществ
- Структура Льюиса
- Калькулятор полураспада (реакция первого порядка)
- Идентификатор соединения
- Трехмерный генератор химической структуры
- Закон идеального газа
- Создатель молекулярной структуры
- Ящик для химических составов
- Калькулятор растворов
- ДЖОУЛЕВ в eV
- Онлайн-решение проблем
- Степень
- Калькулятор молярной массы
- Свойства таблицы реагентов II
- Калькулятор плотности воды
- Молепреобразователь
- Калькулятор дефекта массы
- Определение константы скорости
- Структурный искатель Льюиса
- Калькулятор таблиц реагентов — настольный гаджет
- Поиск элементов
- Калькулятор pH для слабых кислот
10 лучших приложений-помощников по химии smallbox»]
[идентификатор магазина приложений = «962160097» style = «smallbox»]
[идентификатор магазина приложений = «940680956» стиль = «маленький ящик»]
[идентификатор магазина приложений = «422958981» стиль = «маленький ящик»]
[идентификатор магазина приложений = «493558583» стиль = «маленький ящик»]
[идентификатор магазина приложений = «1016291761» style=»smallbox»]
[идентификатор магазина приложений=»390821660″ style=»smallbox»]
[идентификатор магазина приложений=»463093687″ style=»smallbox»]
Title Best For Price StudyBlue Это приложение, которое можно использовать на устройства iOS и Android. Это учебное приложение, которое очень полезно для студентов, потому что это приложение, созданное студентами и управляемое студентами. Это помогает студентам учиться со 100% оригинальным содержанием, написанным студентами. Это очень интерактивное приложение, которым легко пользоваться.
Это учебное приложение, которое очень полезно для студентов, потому что это приложение, созданное студентами и управляемое студентами. Это помогает студентам учиться со 100% оригинальным содержанием, написанным студентами. Это очень интерактивное приложение, которым легко пользоваться.
Title Best For Price Quizlet Это очень интерактивное приложение, которое помогает учащимся готовиться к тестам. Он не только помогает учащимся готовиться к тестам, но также помогает им готовиться к викторинам, тестам и экзаменам, потому что он такой интерактивный. Это очень хорошо продуманное приложение, потому что оно помогает учащимся изучать множество предметов.
Title Лучшее по цене Khan Academy Это приложение очень полезно для студентов, которые работают над своей математикой. Это помогает учащимся понять математику и математические задачи, с которыми у них могут возникнуть проблемы. Он содержит более 3000 видеороликов, которые учащиеся могут посмотреть и помочь им понять математику. Он содержит более 1000 практических задач и упражнений для учащихся. Он очень интерактивен и прост в использовании.
Он содержит более 1000 практических задач и упражнений для учащихся. Он очень интерактивен и прост в использовании.
Title Лучшее по цене FlashCards+ Это приложение очень полезно для студентов, потому что оно помогает им готовиться к экзаменам в интерактивной и увлекательной форме. Это помогает учащимся готовиться к тестам, викторинам и экзаменам в веселой и интерактивной форме. Он имеет более 1000 наборов флэш-карт, которые можно использовать бесплатно. Он содержит более 100 000 карточек, которые учащиеся могут использовать для подготовки к экзаменам.
Название Best For Price eNotes Это приложение, которое можно использовать на устройствах iOS и Android. Это учебный инструмент, который помогает учащимся выполнять домашние задания, и это очень полезно. В нем есть учебное пособие, основанное на учебнике, и оно очень полезно для студентов. Он имеет словарь, который очень прост в использовании и навигации. Он также имеет глоссарий, который очень полезен для студентов.
Решатель задач по химии для всех студентов, изучающих химию
Когда вам нужно вычислить молярную массу или сбалансировать химическое уравнение, вы можете рассчитывать на помощь решателя задач по химии. Этот инструмент достаточно всеобъемлющий. Это полезно для любого студента, независимо от типа и уровня курса химии, который он или она изучает. Если вам трудно что-то понять, решатель задач поможет вам в процессе обучения. Если вы опытны и квалифицированы, это позволит вам сэкономить огромное количество времени при выполнении домашней работы. Инструмент довольно интуитивно понятен и очень прост в использовании.
Этот инструмент достаточно всеобъемлющий. Это полезно для любого студента, независимо от типа и уровня курса химии, который он или она изучает. Если вам трудно что-то понять, решатель задач поможет вам в процессе обучения. Если вы опытны и квалифицированы, это позволит вам сэкономить огромное количество времени при выполнении домашней работы. Инструмент довольно интуитивно понятен и очень прост в использовании.
Домашнее задание по химии Помощь в получении хороших оценок
Химия — это область науки, изучающая поведение и взаимодействие веществ друг с другом. Это очень интересный предмет, который расширяет знания учащихся об элементах и принципах, управляющих этими элементами. Но та же самая химия оказывается сложной для многих студентов, которые не могут запомнить формулы и уравнения, необходимые для понимания предмета. Это факт, что учащиеся должны запоминать множество формул и свойств веществ и газов, помимо того, что они должны помнить, как они реагируют с другими веществами и газами. Именно эти знания пригодятся при поиске ответов на домашние задания по химии, заданные учителями в школе. Для таких студентов, которые боятся химии, особенно формул этого предмета, становится необходимым организовать помощь в выполнении домашних заданий по химии, чтобы иметь возможность выполнять свои задания.
Именно эти знания пригодятся при поиске ответов на домашние задания по химии, заданные учителями в школе. Для таких студентов, которые боятся химии, особенно формул этого предмета, становится необходимым организовать помощь в выполнении домашних заданий по химии, чтобы иметь возможность выполнять свои задания.
Вам действительно нужна помощь, если вы не запомнили символы и значения
Если вы один из тысяч студентов, которые боятся химии из-за названий, символов и формул, которые вам нужно запомнить, чтобы решить проблемы, вам повезло. Теперь вы можете получить помощь с домашним заданием по химии, сидя дома, и это тоже всего за несколько кликов на вашем компьютере. Да, существует множество порталов, на которых можно найти ответы на домашние задания по химии для учащихся, которые не могут выполнить задания, данные им учителями в школе. Конечно, за такую услугу вы платите небольшие деньги, но представьте себе комфорт и удобство, связанные с такой услугой.
Держитесь подальше от бесплатных онлайн-ресурсов
Если вы заинтересованы в решении химических задач , но вам трудно запомнить символы, валентности, свойства и характеристики различных веществ, лучше всего зарегистрироваться самостоятельно. с веб-сайтом или онлайн-репетитором, который может решить ваши проблемы в короткие сроки. Хотя есть также репетиторы и веб-сайты, которые предоставляют помощь с домашними заданиями по химии бесплатно, вам лучше пользоваться веб-сайтами, которые взимают небольшую плату за свои услуги. Это связано с тем, что вы можете застрять в решающий момент и не получить ответа на проблему, размещенную вами в случае бесплатной услуги. Это может нарушить ваши расчеты и снизить оценки на выпускном экзамене. Чтобы избежать всего этого и получить быструю и эффективную помощь с домашним заданием по химии, выбирайте онлайн-помощь с умом.
с веб-сайтом или онлайн-репетитором, который может решить ваши проблемы в короткие сроки. Хотя есть также репетиторы и веб-сайты, которые предоставляют помощь с домашними заданиями по химии бесплатно, вам лучше пользоваться веб-сайтами, которые взимают небольшую плату за свои услуги. Это связано с тем, что вы можете застрять в решающий момент и не получить ответа на проблему, размещенную вами в случае бесплатной услуги. Это может нарушить ваши расчеты и снизить оценки на выпускном экзамене. Чтобы избежать всего этого и получить быструю и эффективную помощь с домашним заданием по химии, выбирайте онлайн-помощь с умом.
Некоторые веб-сайты пользуются услугами самых талантливых специалистов в области химии. Эти эксперты остаются в распоряжении веб-сайта и оперативно отвечают на вопросы зарегистрированных студентов. Вы должны убедиться из обзоров этих веб-сайтов в эффективности решателя домашних заданий по химии. Многие веб-сайты утверждают, что взломали вопросы из сотен учебников по химии.
Коллекция из 62 химических калькуляторов и утилит
В вашем веб-браузере отключен JavaScript.
Вам необходимо включить его, чтобы использовать наши калькуляторы на основе JavasSript.
Содержание
- Обзор
- Кислотно-основные реакции
- Буферы
- Катализ
- Химическое равновесие
- Эмпирические и молекулярные формулы
- Электрохимия
- Электролиз
- Электронные квантовые числа
- Газовые законы (идеальный закон Дальтона и Грэма)
- Ионные/ковалентные связи
- Ионы и молекулы
- Кинетика
- Масс-спектрометрия
- Ядерный распад
- Окислительно-восстановительные реакции
- Процентный состав
- Значимые цифры
- Концентрация раствора
- Стехиометрия раствора (моли, титрование и расчет молярности)
- Дополнительные инструменты
- Список общих уравнений
- Периодическая таблица
- Основные единицы измерения (метрические/СИ)
Обзор
Химия — это наука о материи: ее составе, ее свойствах, изменениях, которые приводят к ее образованию, и способах ее взаимодействия с другими материями в ее окружении. Мы начинаем со строительных блоков материи — электронов, нейтронов и протонов — и строим атомы и ионы, которые затем формируют молекулы и ионные соединения, которые могут реагировать, создавая материальный мир, который мы знаем. Тщательное исследование свойств и тенденций этих материальных образований способствует лучшему пониманию возможностей материального мира.
Мы начинаем со строительных блоков материи — электронов, нейтронов и протонов — и строим атомы и ионы, которые затем формируют молекулы и ионные соединения, которые могут реагировать, создавая материальный мир, который мы знаем. Тщательное исследование свойств и тенденций этих материальных образований способствует лучшему пониманию возможностей материального мира.
Этот сборник химических калькуляторов, разбитых на различные фундаментальные понятия, представляет собой хороший обзор вводной химии, но также содержит некоторые инструменты для более высокого уровня исследований в таких темах, как квантовые числа и продвинутая стехиометрия.
Кислотно-основные реакции
- WebQC pH-калькулятор — нужно знать pKa раствора? Или, может быть, даже просто рН? Посетите эту страницу, чтобы узнать обо всех ваших потребностях в кислотно-щелочной реакции.
- Реакция на нейтрализацию EasyCalculation. Есть два способа проверить свою работу: сдать ее и надеяться на лучшее или использовать этот сайт.
 Это так же просто, как нажать, подключить и проверить!
Это так же просто, как нажать, подключить и проверить! - Meracalculator Реакции нейтрализации — отлично подходит для работы с реакциями нейтрализации кислот и оснований, вернитесь к «нормальности» с помощью этого простого в использовании решения проблем.
Буферы
- Рецепты буферов PFG. Этот простой инструмент дает быстрые и точные ответы, а также позволяет распечатать результаты и рецепт буфера для дальнейшего использования.
- Wiley Buffers — Очень простой сайт без рекламы для расчета буфера.
- Общие реагенты и буферы Science Gateway. Нужно узнать массу или объем буферов? Как насчет объема буфера, необходимого для разбавления раствора? Щелкните здесь также, чтобы просмотреть список распространенных реагентов.
Катализ
- Энергия активации. Необходимо знать энергию активации реакции в Дж/моль вместо БТЕ/фунт-моль? Просто подключите и запустите здесь свои ответы об энергии активации для быстрых и удобных вычислений.

Chemical Equilibrium
- Onlinesciencetools Chemical Equilibrium — склоните чашу весов в правильном направлении с помощью этого простого в использовании баланса равновесия. Просто вставьте свои цифры в предоставленные места, и ваши формулы всегда будут ровными.
- Tutorvista Константа равновесия. Найдите константу равновесия для любого уравнения с помощью этого простого в использовании онлайн-уравнения. Просто введите свои значения равновесия и нажмите «Рассчитать константу равновесия».
- Colorado State Equilibria — более продвинутый и точный онлайн-источник для подсчета равновесий.
Эмпирические и молекулярные формулы
- Chemicalaid Empirical Formulas — идеально подходит, когда вам нужно знать эмпирическую формулу уравнения и нужна молекулярная формула, или наоборот.
- Химические формулы Easycalculation. Щелкните здесь для простых и эффективных расчетов процентного содержания каждого элемента в данном соединении.

- Решатель эмпирических и молекулярных формул. Хотите убедиться, что все ваши эмпирические и молекулярные утки выстроены в ряд? Просто следуйте простым инструкциям на mmsphyschem.com, и вы быстро освоите этот аспект химии.
- Калькулятор эмпирических формул Университета Сиднея. Введите здесь свои эмпирические формулы и получите обратно процент массы для каждого задействованного элемента.
Электрохимия
- Калькулятор электрической движущей силы. С помощью этого простого в использовании инструмента найдите движущую силу любой электрохимической реакции.
- Calctool.org Nernst Solver — Нужно знать фактический или стандартный обратимый потенциал уравнения Нернста? Введите свои данные в текстовые поля и начните получать ответы.
- TutorVista Уравнение Нернста. Найдите редукционный потенциал уравнения, используя это простое уравнение Нернста. Заполните отведенные текстовые поля своими цифрами и позвольте ему сделать все остальное.

Электролиз
- Преобразование кулонов в константы Фарадея — Проблемы с преобразованием кулонов в константы Фарадея? Начните свои преобразования сейчас.
Квантовые числа электронов
- Chem.purdue.edu Квантовые числа и конфигурация электронов — Хотите увидеть другое объяснение квантовых чисел электронов? Это отличное место, чтобы начать процесс понимания и освоения квантовых чисел.
- Angelo.edu Квантовые числа, атомные орбитали и конфигурации электронов. Не совсем уловили конфигурации электронов в классе? Здесь вы найдете множество примеров и объяснений квантовых чисел.
Газовые законы (идеальный закон, закон Дальтона и Грэма)
- AJ Design Формулы и уравнения закона идеального газа — независимо от того, решаете ли вы плотность, давление, температуру или объем, используя закон идеального газа,
- WebQC Закон об идеальных газах — идеальное место для любого химика, студента или любого другого лица, где можно быстро получить доступ к нескольким уравнениям и простым в использовании расчетам.

- EasyCalculation Закон идеального газа — Просто подставьте цифры, которые вы знаете из уравнений закона идеального газа, и пусть easycalculation.com сделает все остальное.
- Mera Calculator Закон Дальтона — Если вам нужно знать парциальные давления уравнения, то meracalculator.com подходит именно вам. Этот сайт использует закон Дальтона для расчета этих значений парциального давления для вас.
- 1728 Закон диффузии Грэма. Это отличное место для изучения уравнения диффузии Грэма. Удобный и точный результат.
Ионные/ковалентные связи
- Полярность химической связи – Идеально подходит для определения полярности связи между двумя элементами.
Ионы и молекулы
- Цифровое ионное уравнение — Знать название молекулы, но не знать, из чего она состоит? Просто введите название, и этот инструмент предоставит вам молярную массу и эмпирическую формулу молекулы.
- Шодор Многоатомный ион — Если вы знаете эмпирическую формулу иона или молекулы, то вы можете узнать и ее название.
 Отлично подходит, если вы новичок в ионах и молекулах или просто хотите перепроверить свою работу.
Отлично подходит, если вы новичок в ионах и молекулах или просто хотите перепроверить свою работу. - Mera Calculator Polyatomic Ion — простой, но эффективный, этот калькулятор позволяет вам вводить положительные и отрицательные ионы из эмпирической формулы, а затем выдает название молекулы.
Кинетика
- AJ Design Уравнения и формулы кинетической энергии — У вас есть уравнения кинетической энергии и числовые значения, но негде их вычислить? Получите значения кинетической энергии здесь.
- EngineersEdge Kinetic Energy Equations — краткий и простой способ найти кинетическую энергию объекта. Вставьте значения уравнений в текстовые поля, и ваши проблемы будут решены.
- EasyCalculation Kinetic Energy. Независимо от того, вычисляете ли вы кинетическую энергию или массу, просто введите свои данные, и вы получите ответы.
Масс-спектрометрия
- Собственная масс-спектрометрия – Взаимозаменяемые расчеты m/z, заряда, массы, теоретического состояния заряда.

- Плоттер для распределения изотопов и масс-спектрометрии — содержит оба уравнения, а также строит для вас диаграмму масс-спектрометрии.
Nuclear Decay
- AJ Design Уравнения и формулы для радиоактивных материалов. Здесь вы найдете подробные инструкции по реакциям ядерного распада и простые в использовании интерактивные уравнения.
- UWashington Radioactive Decay — Простые и полные уравнения ядерного распада, дающие точные ответы.
- Rad Pro Nuclear Calculations. Независимо от того, являетесь ли вы профессиональным химиком или впервые изучаете ядерный распад, это идеальное место для ввода ваших данных и получения дополнительной информации.
- Распад радиоактивных изотопов. Нужно место для быстрых и простых уравнений ядерного распада? Здесь вы найдете фантастический онлайн-решатель уравнений.
- Шодор Ядерный распад — Нужно знать ядерный распад нестабильных молекул? С простым вводом данных и ответами, а также кратким изложением самих уравнений ядерного распада.

Реакции окисления-восстановления
- Число окисления TutorVista. Введите нужную химическую формулу, и этот полезный онлайн-инструмент выдаст число окисления-восстановления за считанные секунды.
- Окислительно-восстановительные реакции Шодора. Чтобы более подробно изучить реакции окисления-восстановления, воспользуйтесь этим отличным решением проблем «включи и пей».
- Число окисления вольфрама — Просто введите химическую формулу, и в кратчайшие сроки вы получите числа реакций окисления-восстановления и структурную диаграмму.
Процентный состав
- TutorVista Процентный состав — Изучите процентный состав по массе каждого элемента в химической формуле.
- Chemhaven Процентный состав — Знайте процентный состав каждого элемента в любой химической формуле.
Значимые цифры
- Значимые цифры — не замедляйтесь из-за длинных рукописных уравнений. Вставьте сюда свои уравнения или числа для быстрого и надежного подсчета значащих цифр.

- Ostermiller Significant Figures — Значимые цифры сбивают вас с толку? Нажмите здесь и введите свои числа, чтобы получить правильное количество значащих цифр для любого числа, а также определить наименее значащий десятичный разряд.
- Счетчик значащих цифр для химиков. Хотите перепроверить количество значащих цифр? Просто введите свои числа для точных и точных значащих цифр.
- CalculatorSoup Significant Figures — этот инструмент, содержащий подробные сведения об определении значащих цифр, также помогает научить вас округлять числа (и может проверять вашу работу).
- TutorCircle Significant Figures — обширный список примеров и инструкций по значащим цифрам со счетчиком значащих цифр, чтобы вы могли даже проверить свою работу.
Концентрация раствора
- Концентрация раствора Calctool – преобразование между массой, объемом и молекулярным объемом для расчета молекулярной и/или массовой концентрации.
- Концентрации Advamacs — переключение между молекулярной массой и плотностью со встроенными растворами образцов, которые помогут вам в обучении.

- Easycalculation Разбавление растворов — определение объемов и концентраций раствора до и после разбавления.
Стехиометрия раствора (Моли, титрование и расчеты молярности)
- Endmemo Chemical Mole Grams — введите здесь химические формулы, чтобы определить количество молей или граммов в химической формуле.
- AJ Design Формулы и уравнения закона идеального газа — используйте эту онлайн-машину для решения уравнений и формул закона идеального газа, используя давление, объем и температуру.
- Lenntech Molecular Weights — расчет средней молекулярной массы (MW) по молекулярной формуле или по одному из двух списков распространенных органических соединений или элементов периодической таблицы.
- Инструмент стехиометрии. Введите свои сбалансированные химические уравнения (при необходимости используйте калькулятор химических уравнений!), чтобы получить стехиометрию каждого уравнения.
- OST Стехиометрия. Благодаря широкому диапазону входных параметров и опций для типа газа, а также выхода этот инструмент незаменим для расчетов стехиометрии.

- Стехиометрия реакции — укажите реакцию и выберите, хотите ли вы рассчитать реагент или продукт.
- Концентрация раствора с помощью титрования — онлайн-инструмент для титрования образцов с учетом концентрации стандарта и объема титранта, необходимого для титрования стандарта и образца.
- GraphPad Молярность – Масса, объем и концентрация: зная два, легко вычислите другое или разбавьте маточный раствор.
- Molaritycalculator.com — позволяет рассчитать массу, объем или концентрацию в зависимости от того, какие два из них известны, на этой странице также есть подробные объяснения различных способов выполнения этих расчетов вручную.
- Массовая молярность Sigma-Aldrich. Рассчитайте массу, необходимую для молярного раствора заданной концентрации и объема.
Дополнительные инструменты
Список общих уравнений
- Справочник по общим химическим уравнениям — Не хватает уравнения в ваших заметках или учебнике? Проверьте здесь список часто используемых уравнений в химии.



 1/10
1/10 com
com Это так же просто, как нажать, подключить и проверить!
Это так же просто, как нажать, подключить и проверить!


 Отлично подходит, если вы новичок в ионах и молекулах или просто хотите перепроверить свою работу.
Отлично подходит, если вы новичок в ионах и молекулах или просто хотите перепроверить свою работу.