что, как сбалансировать и часто задаваемые вопросы
Азотная кислота представляет собой неорганическое соединение с формулой HNO.3. Са (ОН)2 представляет собой бесцветный кристалл или белый порошок. Обсудим некоторые реакции и свойства HNO.3 и Са (ОН)2.
HNO3 используется как сильный окислитель. Его можно получить путем каталитического окисления аммиака. Гидроксид кальция, также называемый гашеной известью, Ca(OH)2, получается действием воды на оксид кальция.
В следующих частях этой статьи мы поговорим об энтальпии реакции HNO.3 + Ca (OH)2 с сопряженными парами, результирующим ионным уравнением, сопряженными парами, типом реакции и т.д.
Что является продуктом HNO
3 и Са (ОН)2 ?Са (NO3)2 и Н2O образуются как побочные продукты, когда HNO3 и Са (ОН)2 реагируют друг на друга.
2ХНО3(водн.) + Са(ОН)2 (водн.) → Ca (NO3)2(водн.) + 2H2О (я)
Какой тип реакции HNO?
3 + Ca (OH)2 является ?HNO3 + Ca (OH)2 реакции показывают двойное замещение типа реакции или нейтрализующий тип реакции.
Как сбалансировать HNO
3 + Ca (OH)2 ?Общее уравнение между HNO3 + Ca (OH)2 является :
HNO3 + Ca (OH)2 → Ca (НЕТ3)2 + H2O
Ниже приведены шаги, чтобы сбалансировать приведенное выше уравнение.
- Определите количество каждого элемента, участвующего в следующей реакции, как в реагенте, так и в продукте.
| элементы | реагент | Продукт |
|---|---|---|
| H | 3 | 2 |
| N | 1 | 2 |
| O | 5 | 7 |
| Ca | 1 | 1 |

- Мы находим, что количество молей кальция уравновешено, но количество молей водорода, азота и кислорода не уравновешено.
- Чтобы количество молей с обеих сторон было одинаковым, мы должны добавить 2 моля HNO.3 на стороне реагента и 2 моля H2O на стороне продукта.
| элементы | реагент | Продукт |
|---|---|---|
| H | 4 | 4 |
| N | 2 | 2 |
| O | 8 | 8 |
| Ca | 1 | 1 |

- Отсюда сбалансированное уравнение:
- 2ХНО3(водн.) + Са(ОН)2 (водн.) → Ca (NO3)2(л) + 2Н2О (водн.)
HNO
3 + Ca (OH)2 титрования?Кислотно-щелочное титрование между HNO3 и Са (ОН)2 может быть выполнено для оценки силы азотной кислоты. Процедура титрования следующая:
Аппараты
–Бюретка, держатель бюретки, пипетка, дистиллированная вода, коническая колба, мерная колба, промывная бутыль, мешалка и химический стакан.
Индикаторные
Здесь мы используем фенолфталеин индикатор. Это кислотно-щелочной индикатор, используемый для определения конечной точки титрования.
Процедура
.- 0.1 н. свежеприготовленного Ca(OH)2 берется в бюретку.
- 10 мл HNO3 пипеткой переносят в чистую коническую колбу.

- Добавьте 1-2 капли индикатора фенолфталеина.
- Добавить Са(ОН)2 по каплям из бюретки в коническую колбу при постоянном перемешивании до появления светло-розового окрашивания. Это конечная точка титрования.
- Обратите внимание на объем Ca(OH)2 требуется для нейтрализации раствора сернистой кислоты.
- Вышеупомянутая процедура повторяется для 3 последовательных показаний.
- Сила HNO3 рассчитывается по формуле NСа (ОН) 2× ВСа (ОН) 2 = NHNO3 × ВHNO3
HNO
3 + Ca (OH)2 чистое ионное уравнение?Чистое ионное уравнение между HNO3 + Ca (OH)2 :
2H+ + 2НО3– + Са+2 + 2ОН–→ Са+2 + 2НО3– + 2H+ + 2ОН–
Перечисленные ниже шаги используются для получения результирующего ионного уравнения:
- Напишите сбалансированное химическое уравнение:
- 2ХНО3 + Ca (OH)2 → Ca (НЕТ3)2 + 2H2O
- Напишите сбалансированное молекулярное уравнение вместе с физическим состоянием.

- 2ХНО3(водн.) + Са(ОН)2 (водн.) → Ca (NO3)2(л) + 2Н2О (водн.)
- Теперь напишите ионную форму каждого из веществ, находящихся в водной форме и способных к полной диссоциации в воде.
- 2H+ + 2НО3– + Са+2 + 2ОН–→ Са+2 + 2НО3– + 2H+ + 2ОН–
- Вычеркните ионы-спектаторы с обеих сторон полного ионного уравнения.
- 2H+ + 2ОН– = 2Н2O
- Запишите остальные вещества в виде результирующего ионного уравнения
- 2ХНО3(водн.) + Са(ОН)2 (водн.) → Ca (NO3)2(л) + 2Н2О (водн.)
HNO
3 + Ca (OH)2 сопряженные пары?сопряженное кислота и основание пара HNO3 и Са (ОН)2:
- Сопряженное основание HNO3 нет3– .

- Ca2+ представляет собой очень слабую сопряженную кислоту Ca (OH)2, следовательно, он не может реагировать ни с OH– ион или с ионами молекул воды.
HNO
3 и Са (ОН)2 межмолекулярные силы ?Компания межмолекулярные силы присутствует между HNO3 и Са (ОН)2 являются:
- В ХНО3Присутствуют водородная связь (диполь-дипольное притяжение) и лондонские силы. который связывает ион водорода и нитрит-ион с образованием молекулыs.
- В Са (ОН)2, сильные силы электростатического притяжения между Ca2+ и ОН– ионы, так как гидроксид кальция является ионным соединением.
HNO
3 + Ca (OH)2 энтальпия реакции?Энтальпия реакции HNO3 + Ca (OH)2 реакция составляет -58.0 кДж/моль.
HNO
3 + Ca (OH)2 буферный раствор?Реакция между HNO3 и Са (ОН)2 не буферный раствор. Потому что HNO3 является сильной кислотой, и Ca (OH)2 является сильной основой. Они не могут образовывать буферный раствор.
Потому что HNO3 является сильной кислотой, и Ca (OH)2 является сильной основой. Они не могут образовывать буферный раствор.
HNO
3 + Ca (OH)2 полная реакция?HNO3 + Ca (OH)2 является полной реакцией, так как продукты не будут реагировать дальше с образованием реагентов.
HNO
3 + Ca (OH)2 экзотермическая или эндотермическая реакция?Реакция между HNO3 + Ca (OH)2 экзотермический в природе, поскольку энтальпия реакции отрицательна, при этом выделяется энергия в виде тепла.
HNO
3 + Ca (OH)2 окислительно-восстановительная реакция?Реакция между HNO3 и Са (ОН)2 не является окислительно-восстановительной реакцией, потому что степень окисления не меняется в сторону продукта.
HNO
3 + Ca (OH)2 реакция осаждения?Реакция между HNO3 + Ca (OH)2 не является реакцией осаждения, поскольку нитрат кальция (Ca (NO3)2) образуется растворимый в воде, поэтому осадки не образуются.
HNO
3+ Ca (OH)2 обратимая или необратимая реакция?report this ad
Реакция между HNO3 и Са (ОН)2 это необратимая реакция потому что образуются соль и вода, которые не превращаются обратно в реагенты.
HNO
3 + Ca (OH)2 реакция смещения?HNO3 + Ca (OH)2 реакция представляет собой двойное смещение тип реакции. Потому что происходит обмен ионами.
Двойная реакция смещенияЗаключение —
HNO3 Использование включает производство нитратных солей, производство красителей и продуктов из каменноугольной смолы. Он также используется в основном для очистки драгоценных металлов, таких как платина, золото и серебро. Нитрат кальция используется в предварительной подготовке сточных вод для борьбы с запахами, а также в качестве компонента охлаждающих компрессов.
Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||
Другие ответы
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
Полное ионное уравнение fecl2+2naoh=fe(oh)2+2nacl
Решено
Молекулярное, полное ионное и сокращенное. ..
..
Пользуйтесь нашим приложением
What, How to Balance & FAQs – Lambda Geeks
Азотная кислота – это неорганическое соединение с формулой HNO 3 . Ca(OH) 2 представляет собой бесцветные кристаллы или белый порошок. Обсудим некоторые реакции и свойства HNO 3 и Ca(OH) 2 .
HNO 3 используется как сильный окислитель. Его можно получить путем каталитического окисления аммиака. Гидроксид кальция, также называемый гашеной известью, Ca(OH) 2 , получают действием воды на оксид кальция .
В следующих частях этой статьи мы поговорим об энтальпии реакции HNO 3 + Ca(OH) 2 с сопряженными парами, результирующим ионным уравнением, сопряженными парами, типом реакции и т. д.
Что является продуктом HNO
3 и Ca(OH) 2 ? Ca(NO 3 ) 2 и H 2 O образуются как побочные продукты, когда HNO 3 и Ca(OH) 2 реагируют друг с другом.
2HNO 3 (водн.) + Ca(OH) 2 (водн.) → Ca(NO 3 ) 2 (водн.) + 2H 2 O(I) 6 Какой тип реакции HNO 3 + Ca(OH) 2 ? HNO 3 + Ca(OH) 2 реакции показывают реакции двойного замещения или реакции нейтрализации. Общее уравнение между HNO 3 + CA (OH) 2 IS: HNO 3 + CA (OH) 2 → CA (№ 3 ) 2 + H 2 O . Ниже приведены шаги, чтобы сбалансировать приведенное выше уравнение. Кислотно-основное титрование между HNO 3 и Ca(OH) 2 можно использовать для оценки концентрации азотной кислоты. Процедура титрования следующая – Бюретка, держатель бюретки, пипетка, дистиллированная вода, коническая колба, мерная колба, промывная бутыль, мешалка и химические стаканы. Здесь мы используем индикатор фенолфталеин. Это кислотно-щелочной индикатор, используемый для определения конечной точки титрования. Чистое ионное уравнение между HNO 3 + CA (OH) 2 : 2H + + 2NO 3 — + CA +2 Как сбалансировать HNO
3 + Ca(OH) 2 ?
Количество молей каждого элемента как на стороне реагента, так и на стороне продукта до уравновешивания. Элементы Реагент Продукт H 3 2 N 1 2 O 5 7 Ca 1 1 
Количество молей каждого элемента как на стороне реагента, так и на стороне продукта после уравновешивания. Elements Reactant Product H 4 4 N 2 2 O 8 8 Ca 1 1 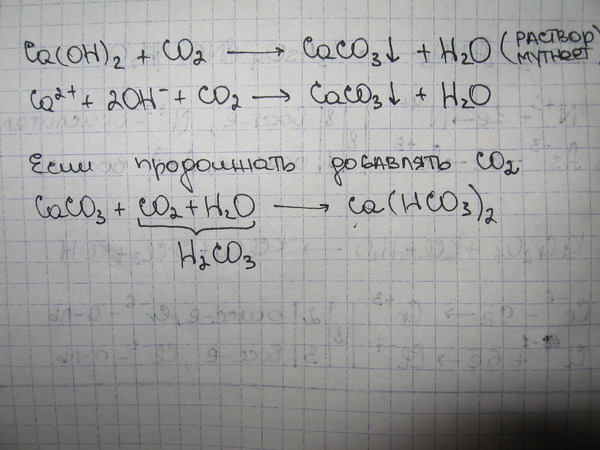
HNO
3 + Ca(OH) 2 титрования ? Аппарат
– Индикатор
Процедура
.
HNO
3 + Ca(OH) 2 результирующее ионное уравнение ? 4354435443544 3 4354 3 3 — 435443544 3 354354 3 354 3 — 354354 3 3 535353 3 3 — . CA +2 + 2NO 3 — + 2H + + 2OH —
4354435443544 3 4354 3 3 — 435443544 3 354354 3 354 3 — 354354 3 3 535353 3 3 — . CA +2 + 2NO 3 — + 2H + + 2OH —
. Списки. уравнение:
- 2HNO 3 + CA (OH) 2 → CA (№ 3 ) 2 + 2H 2 O
- Напишите сбалансированное молекулярное уравнение вместе с физическим состоянием вместе с физическим состоянием вместе с физическим состоянием на вместе с физическим состоянием на вместе с физическим состоянием на вместе с физическим состоянием на вместе с физическим состоянием. ..
- 2HNO 3 (AQ) + CA (OH) 2 (AQ) → CA (№ 3 ) 2 (L) + 2H 2 O (AQ)
- Теперь напишите ионную форму каждого из веществ, существующих в водной форме и способных к полной диссоциации в воде.

- 2H + + 2NO 3 — + CA +2 + 2OH — → CA +2 + 2N 29353 3 . . . 39353. 39353. 3 3 → CA +2 + 2N 2 9000 39354 → CA +2 + 2N 2 → CA +2 + 2NO 2 — . –
- Cross out the spectator ions on both sides of the complete ionic equation
- 2H + + 2OH – = 2H 2 O
- Write остальные вещества как результирующее ионное уравнение
- 2HNO 3 (AQ) + CA (OH) 2 (aq) → CA (№ 3 ) 2 (L) + 2H 2 O (AQ) 9
HNO
3 + Ca(OH) 2 сопряженные пары ?Пара сопряженных кислот и оснований HNO 3 и Ca(OH) 2 :
- Основание сопряжения HNO 3 9.
 0003 NO 9.0003 3
0003 NO 9.0003 3
- Са 2+ представляет собой очень слабую сопряженную кислоту Ca(OH) 2 , поэтому она не способна реагировать ни с ионами OH – , ни с ионами молекул воды.
HNO
3 и Ca(OH) 2 межмолекулярные силы ?Межмолекулярные силы между HNO 3 и Ca(OH) 2 :
- В HNO 3 присутствуют силы водородных связей (диполь-дипольное притяжение) и Лондона. который связывает ион водорода и нитрит-ион с образованием молекулы с.
- В Ca(OH) 2 сильные электростатические силы притяжения между ионами Ca 2+ и OH – , поскольку гидроксид кальция является ионным соединением.
HNO
3 + Ca(OH) 2 энтальпия реакции ? Энтальпия реакции HNO 3 + Ca(OH) 2 реакция составляет -58,0 кДж/моль.
Является ли HNO
3 + Ca(OH) 2 буферным раствором?Реакция между HNO 3 и Ca(OH) 2 не является буферным раствором. Потому что HNO 3 — сильная кислота, а Ca(OH) 2 — сильное основание . Не могут образовывать буферный раствор.
Является ли HNO
3 + Ca(OH) 2 полной реакцией?HNO 3 + Ca(OH) 2 является полной реакцией, так как продукты не будут вступать в дальнейшие реакции с образованием реагентов.
HNO
3 + Ca(OH) 2 экзотермическая или эндотермическая реакция ?Реакция между HNO 3 + Ca(OH) 2 является экзотермической по своей природе, поскольку энтальпия реакции отрицательна, что приводит к высвобождению энергии в виде тепла.
Является ли HNO
3 + Ca(OH) 2 окислительно-восстановительной реакцией? Реакция между HNO 3 и Ca(OH) 2 не относится к окислительно-восстановительным реакциям, так как степень окисления не меняется в сторону продукта .
Является ли HNO
3 + Ca(OH) 2 реакцией осаждения?Реакция между HNO 3 + Ca(OH) 2 не является реакцией осаждения, поскольку образуется нитрат кальция (Ca(NO 3 ) 2 ), который растворим в воде, поэтому осадки не образуются .
Является ли HNO
3 + Ca(OH) 2 обратимой или необратимой реакцией?Реакция между HNO 3 и Ca(OH) 2 является необратимой реакцией, поскольку образуются соль и вода, которые не превращаются обратно в реагенты.
Является ли HNO
3 + Ca(OH) 2 реакция замещения ?HNO 3 + Ca(OH) 2 реакция представляет собой реакцию двойного замещения. Потому что происходит обмен ионами.
Реакция двойного замещенияЗаключение –
HNO 3 Использование включает производство нитратных солей, производство красителей и продуктов из каменноугольной смолы. Он также используется в основном для очистки драгоценных металлов, таких как платина, золото и серебро. Нитрат кальция используется в предварительной подготовке сточных вод для борьбы с запахами, а также в качестве компонента охлаждающих компрессов.
Он также используется в основном для очистки драгоценных металлов, таких как платина, золото и серебро. Нитрат кальция используется в предварительной подготовке сточных вод для борьбы с запахами, а также в качестве компонента охлаждающих компрессов.
16.3: Кислотно-основные реакции и реакции выделения газа
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 118874
Цели обучения
- Определить, когда в результате реакции будет выделяться газ.
Реакции нейтрализации
Кислоты и основания химически реагируют друг с другом с образованием солей . Соль — это общий химический термин для любого ионного соединения, образованного кислотой и основанием. В реакциях, где кислота представляет собой соединение, содержащее ион водорода, а основание представляет собой соединение, содержащее ион гидроксида, вода также является продуктом. Общая реакция выглядит следующим образом:
В реакциях, где кислота представляет собой соединение, содержащее ион водорода, а основание представляет собой соединение, содержащее ион гидроксида, вода также является продуктом. Общая реакция выглядит следующим образом:
\[\text{кислота + основание} → \text{вода + соль} \nonumber \]
Реакция кислоты и основания с образованием воды и соли называется нейтрализация . Как и любое химическое уравнение, химическое уравнение нейтрализации должно быть правильно сбалансировано. Например, реакция нейтрализации между гидроксидом натрия и соляной кислотой выглядит следующим образом:
\[\ce{NaOH (водн.) + HCl (водн.) \rightarrow NaCl (водн.) + H_2O (л)} \label{Eq2} \ ]
с коэффициентами, которые все считаются равными единице. Реакция нейтрализации между гидроксидом натрия и серной кислотой выглядит следующим образом:
\[\ce{2NaOH (водн.) + H_2SO_4 (водн.) \rightarrow Na_2SO_4 (водн.) + 2H_2O (л)} \label{Eq3} \]
Пример \(\PageIndex{1}\): Нейтрализация азотной кислоты
Азотную кислоту (HNO 3 (водн. )) можно нейтрализовать гидроксидом кальция (Ca(OH) 2 (водн.)). Напишите сбалансированное химическое уравнение реакции между этими двумя соединениями и определите соль, которую она образует.
)) можно нейтрализовать гидроксидом кальция (Ca(OH) 2 (водн.)). Напишите сбалансированное химическое уравнение реакции между этими двумя соединениями и определите соль, которую она образует.
Решение
| Ступени | Пояснение | Уравнение |
|---|---|---|
| Напишите уравнение несбалансированности. | Это реакция двойного замещения, поэтому катионы и анионы меняются местами, образуя новые продукты. | Ca(OH) 2 (водн.) + HNO 3 (водн.) → Ca(NO 3 ) 2 (водн.) + H 2 O(ℓ) |
| Сбалансируйте уравнение. | Поскольку в формуле Ca(OH) 9 присутствуют два иона OH − 0003 2 , нам нужно два моля HNO 3 для получения ионов H + | CA (OH) 2 (AQ) + 2 HNO 3 (AQ) → CA (№ 3 ) 2 (AQ) + 2 H 2 416 2 H 2 4. ℓ) ℓ) |
| Дополнительный шаг: определение соли. | Образовавшаяся соль представляет собой нитрат кальция. |
Упражнение \(\PageIndex{1}\)
Синильная кислота (\(\ce{HCN(aq)}\)) может быть нейтрализована гидроксидом калия (\(\ce{KOH(aq)}\)). Напишите сбалансированное химическое уравнение реакции между этими двумя соединениями и определите соль, которую она образует.
Ответ
\[\ce{KOH (водн.) + HCN (водн.) → KCN (водн.) + h3O(ℓ)} \номер \]
Реакции выделения газа
Реакция выделения газа является химической процесс, который производит газ, такой как кислород или углекислый газ. В следующих примерах кислота реагирует с карбонатом с образованием соли, углекислого газа и воды соответственно. Например, азотная кислота реагирует с карбонатом натрия с образованием нитрата натрия, двуокиси углерода и воды (таблица \(\PageIndex{1}\)):
\[\ce{2HNO3(aq)+Na2CO3(aq)→2NaNO3(aq)+CO2(g)+h3O(l)} \nonumber \]
Серная кислота реагирует с карбонатом кальция с образованием сульфата кальция , диоксид углерода и вода:
\[\ce{h3SO4(aq) + CaCO3(aq) → CaSO4(aq) + CO2(g)+h3O(l)} \nonumber \]
Соляная кислота реагирует с карбонат кальция с образованием хлорида кальция, диоксида углерода и воды:
\[\ce{2HCl(водн. ) + CaCO3(водн.) → CaCl2(водн.) + CO2(г) + h3O(л)} \номер \]
) + CaCO3(водн.) → CaCl2(водн.) + CO2(г) + h3O(л)} \номер \]
Рисунок \(\PageIndex{1}\) демонстрирует этот тип реакции:
Рисунок \(\PageIndex{1}\): Взаимодействие кислот с карбонатами. В этой реакционной установке известковую воду (вода + гидроксид кальция) наливают в одну из пробирок и закрывают пробкой. В оставшуюся пробирку осторожно приливают небольшое количество соляной кислоты. К кислоте добавляют небольшое количество карбоната натрия и закрывают пробирку резиновой пробкой. Две трубки соединены. В результате кислотно-карбонатной реакции образуется углекислый газ и известковая вода мутнеет. В этой реакционной установке известковую воду, разбавленный раствор гидроксида кальция ( \(Ca(OH)_2\) ), наливают в одну из пробирок и закрывают пробкой. В оставшуюся пробирку осторожно приливают небольшое количество соляной кислоты. К кислоте добавляют небольшое количество карбоната натрия и закрывают пробирку резиновой пробкой. Две трубки соединены. В результате кислотно-карбонатной реакции образуется углекислый газ и известковая вода мутнеет.
| Тип реагента | Промежуточный продукт | Выделившийся газ | Пример |
|---|---|---|---|
| сульфид | нет | \(\ce{h3S}\) | \(\ce{2HCl(водн.) + K2S \rightarrow h3S (г) + 2KCl (водн.)}\) |
| карбонаты и бикарбонаты | \(\ce{h3CO3}\) | \(\ce{CO2}\) | \(\ce{2HCl(водн.) + K2CO2 \rightarrow h3O (л) + CO2(г) + 2KCl (водн. )}\) )}\) |
| сульфиты и бисульфиты | \(\ce{h3SO3}\) | \(\ce{SO2}\) | \(\ce{2HCl(водн.) + K2SO2 \rightarrow h3O (л) + SO2(г) + 2KCl (водн.)}\) |
| аммиак | \(\ce{Nh5OH}\) | \(\ce{Nh4}\) | \(\ce{Nh5Cl(водн.) + KOH \rightarrow h3O (ж) + Nh4(г) + 2KCl (водн.)}\) |
Эксперимент по газовыделению известковой воды показан в следующем видео: ). По мере протекания реакции известковая вода превращается из прозрачной в молочную; это происходит из-за того, что \(CO_2(g)\) реагирует с водным гидроксидом кальция с образованием карбоната кальция, который лишь немного растворим в воде.
Когда этот эксперимент повторяется с азотной или серной кислотой вместо \(HCl\), он дает те же результаты: прозрачная известковая вода становится молочной, что указывает на образование двуокиси углерода.




 .. — Учеба и наука
.. — Учеба и наука 06.18
06.18

 0003 NO 9.0003 3
0003 NO 9.0003 3