11 класс. Химия.ЕГЭ. Электролитическая диссоциация солей, кислот, щелочей. Реакции ионного обмена. Гидролиз солей — Электролитическая диссоциация солей, кислот, щелочей.
Электролитическая диссоциация солей, кислот, щелочей.
Электролитическая диссоциация (1)
Комментарии преподавателяЗадания с выбором ответов А1-А15
I. Выбор одного правильного варианта из 4 предложенных.
|
Вопрос |
Комментарий |
|
А1. Сильными электролитами являются: 1. CO2 2. h3S 3. O2 4. h3SO4 |
По определению, сильные электролиты – это вещества, которые в водном растворе полностью распадаются на ионы. Правильный ответ 4. |
|
А2. Вещесвами, которые диссоциируют только на ионы металла и гидроксид ионы, являются: 1. кислотами 2. щелочами 3. солями 4. амфотерными гидроксидами |
По определению, соединение, которое при диссоциации в водном растворе образует только гидроксид-анионы, называется основанием. Под данное определение подходит только щелочь и амфотерный гидроксид. Но в вопросе звучит, что соединение должно диссоциировать только на катионы металла и гидроксид-анионы. Амфотерный гидроксид диссоциирует ступенчато, и поэтому в растворе ионы гидроксометалла. Правильный ответ 2. |
|
А3. Реакция обмена происходит до конца с образованием нерастворимого в воде вещества между: 1. 2. NaCl и CuSO4 3. CaCO3 и HCl (р-р) 4. KOH и HNO3 |
Для ответа нужно написать эти уравнения и посмотреть в таблице растворимости, есть ли среди продуктов нерастворимые вещества. Это в первой реакции гидроксид магния Mg(OH)2
Правильный ответ 1. |
|
А4. Сумма всех коэффициентов в полном и сокращенном ионном виде в реакции между Fe(NO3)2 +2NaOH равна: 1. 10 и 3 2. 12 и 3 3. 10 и 4 4. 12 и 4 |
Fe(NO3)2 +2NaOH Fe(OH)2↓ +2Na NO3 молекулярное Fe2++2NO3- +2Na+2OH- Fe(OH)2↓ +2Na++2 NO3- полное ионное уравнение, сумма коэффициентов равна 12 Fe2+ + 2OH- Fe(OH)2↓ сокращенное ионное, сумма коэффициентов равна 4 Правильный ответ 4. |
|
А5. Сокращенное ионное уравнение реакции Н++ОН-→Н2О соответствует взаимодействию: 1. Н2 + О2 2. NaOH(Р-Р)+HNO3 3. Cu(OH)2+ HCl 4. CuO + h3SO4 |
Это сокращенное уравнение отражает взаимодействие между сильным основанием и сильной кислотой. Основание есть в 2 и 3 вариантах, но Cu(OH)2 – это нерастворимое основание
Правильный ответ 2. |
|
А6. Реакция ионного обмена протекает до конца при сливании растворов: 1. нитрата натрия и сульфата калия 2. сульфата калия и соляной кислоты 3. хлорида кальция и нитрата серебра 4. сульфата натрия и хлорида калия |
Напишем, как долны были бы проходить реакции ионного обмена между каждой парой веществ. NaNO3+K2SO4→Na2SO4 +KNO3 K2SO4 +HCl→h3SO4 +KCl CaCl2+2AgNO3 → 2AgCl↓ + Ca(NO3)2 Na2SO4+ KCl → K2SO4+ NaCl По таблице растворимости видим, что AgCl↓ Правильный ответ 3. |
|
А7. В водном растворе ступенчато диссоциирует: 1. K2SO4 2. K2S 3. h3S 4. Na2SO4 |
Ступенчатой диссоциации в водном растворе подвергаются многоосновные кислоты. Среди указанных веществ кислотой является только Н2S.
Правильный ответ 3. |
|
А8. Уравнению реакции СuCl2+2KOH→Cu(OH)2↓+2KCl соответствует сокращенное иооное уравнение: 1. 2. Сu2++KOH→Cu(OH)2↓+K+ 3. Cl-+K+→KCl 4. Сu2++2OH-→Cu(OH)2↓ |
Напишем полное ионное уравнение: Сu 2++2Cl-+2К++2OH-→ Cu(OH)2↓+2K+ +2Cl- Исключаем несвязанные ионы, получаем сокращенное ионное уравнение Сu2++2OH-→Cu(OH)2↓
Правильный ответ 4. |
|
А9. Практически до конца идет реакция: 1. Na2SO4+ KCl→ 2. Н2SO4+ ВаCl2→ 3. КNO3+NaOH→ 4. Na2SO4+ CuCl2→ |
Напишем предположительные реакции ионного обмена: Na2SO4+ KCl→ К2SO4+ Na Cl Н2SO4+ ВаCl2→ ВаSO4↓ + 2НCl КNO3+NaOH→ NaNO3 + KOH Na2SO4+ CuCl2→ CuSO4 + 2NaCl По таблице растворимости видим ВаSO4↓ Правильный ответ 2. |
|
А10. Нейтральную среду имеет раствор: 1. NaNO3 2. (Nh5)2SO4 3. FeSO4 4. Na2S |
Нейтральную среду имеют только водные растворы солей, образованных сильным основанием и сильной кислотой. NaNO3 – это соль, образованная сильным основанием NaOH и сильной кислотой HNO3. Правильный ответ 1. |
|
А11. Кислотность почвы можно увеличить введением раствора: 1. Nh5NO3 2. NaNO3 3. NaCl 4. Na2SO4 |
Нужно определить, какая соль будет давать кислую реакцию среды. Это должна быть соль, образованная сильной кислотой и слабым основанием. Это Nh5NO3.
Правильный ответ 1. |
|
А12. Гидролиз протекает при растворении в воде: 1. СaBr2 2. Ba(NO3)2 3. Na2SO4 4. AlCl3 |
Гидролизу не подвергаются только соли, образованные сильным основанием и сильной кислотой. Во всех приведенных солях содержатся анионы сильных кислот. Только AlCl3 содержит катион слабого основания. Правильный ответ 4. |
|
А 13. Гидролизу не подвергается: 1. уксусная кислота 2. этиловый эфир уксусной кислоты 3. крахмал 4. белок |
Гидролиз имеем большое значение в органической химии. Эфиры, крахмал и белок подвергаются гидролизу.
Правильный ответ 1. |
|
А14. Какой цифрой обозначен фрагмент молекулярного уравнения химической реакции, соответствующей кратному ионному уравнению Сu2++2OH—→Cu(OH)2↓? 1. Cu(OH)2+ HCl→ 2. CuCO3+ h3SO4→ 3. CuO + HNO3→ 4. CuSO4 +KOH→ |
По сокращенному уравнению следует, что нужно взять любое растворимое соединение, содержащее ион меди и гидроксид-ион. Из всех приведенных соединений меди только CuSO4 растворим, и только в водной реакции есть ОН-.
Правильный ответ 4. |
|
А15. При взаимодействии каких веществ выделится оксид серы: 1. 2. AgNO3и K2SO4 3. BaCO3и HNO3 4. Na2S и HCl
|
В первой реакции получается нестойкая кислота Н2SO3, которая распадается на воду и оксид серы (IV)
Правильный ответ 1. |
Задания с кратким ответом и на соответствие В1-В6
II. Задания с кратким ответом и на соответствие.
|
В1. Общая сумма всех коэффициентов в полном и сокращенном ионном уравнении реакции между нитратом серебра и гидроксидом натрия равна… |
Напишем уравнение реакции: 2AgNO3 +2NaOH→Ag2O↓+ 2NaNO3+h3O Полное ионное уравнение: 2Ag++2NO3- +2Na++2OH-→Ag2O↓+ 2Na++2NO3-+h3O Сокращенное ионное уравнение: 2Ag++2OH-→Ag2O↓+h3O Правильный ответ: 20 |
|
В2.
|
КOH + Al(OH)3↓→ K[Al(OH)4] Полное ионное уравнение: К++OH- + Al(OH)3↓ → K++[Al(OH)4]-
Правильный ответ: 4 иона. |
|
В3. Установите соответствие между названием соли и отношением её к гидролизу: А) ацетат аммония 1. не гидролизуется Б) сульфид бария 2. по катиону В)сульфид цинка 3. по аниону Г) карбонат натрия 4. по катиону и аниону |
Для ответа на вопрос нужно проанализировать, какими по силе основанием и кислотой образованы эти соли.
Правильный ответ А4 Б3 В4 Г3 |
|
В4. |
Напишем уравнение электролитической диссоциации сульфата натрия: Na2SО4↔ 2Na++SО42- Распалось на ионы 0,5 моль сульфата натрия. |
|
В5. Установите соответствие между реагентами и сокращенными ионными уравнениями: 1. Сa(OH)2+HCl → A)Nh5++OH-→Nh4↑+h3O 2. Nh5Cl+NaOH → Б) Al3+ + OH-→ Al(OH)3↓ 3. AlCl3+KOH → B) H++OH-→h3O 4. BaCl2 +Na2SO4 → Г) Ba2+ +SO42-→ BaSO4↓ Правильный ответ: В1 А2 Б3 Г4 |
|
|
В6. Составьте полное ионное уравнение, соответствующее сокращенному: СO32-+2H+ → CO2 ↑+H2O. |
Нужно взять любой растворимый карбонат и любую растворимую сильную кислоту. Молекулярное: Na2СO3+2HCl→ CO2 ↑+h3O +2NaCl; Полное ионное: 2Na++СO32-+2H++2Cl-→ CO2 ↑+h3O +2Na++2Cl-;
|
III.Задания с развернутым ответом
|
Вопрос |
Комментарий |
|
С1. Докажите, что процесс растворения сульфата меди – физико-химический. Приведите уравнения химических реакций. |
При химических реакциях происходит образование соединений. Сu2++n(h3O)→ [Сu (h3O) n]2+ Физическую составляющую процесса можно подтвердить тем, что в растворе данное соединение не имеет четкого состава. Из получившегося раствора, исходный сульфат меди можно получить при нагревании, т. е. нехимическим способом.
|
|
С2. Объясните, что общего в растворах соляной кислоты, хлорида натрия, хлорида кальция и хлорида алюминия. Какие процессы происходят в этих растворах при добавлении нитрата серебра? Ответы подтвердите записями сокращенных ионных уравнений реакций. |
Формулы этих соединений: HCl, NaCl, CaCl2, AlCl3. В состав каждого из этих соединений входит хлорид-ион, который при добавлении раствора нитрата серебра образует осадок нитрата серебра. Ag++Cl- → AgCl↓ |
Источники
источник презентации — http://ppt4web.ru/khimija/gidroliz-solejj-urok-khimii-klass.html
источник презентации — http://www.docme.ru/doc/470365/prezentaciya
источник презентации — http://ppt4web.ru/khimija/reakcii-ionnogo-obmena.html
http://www.youtube.com/watch?t=3&v=7maAR32ApYo
http://interneturok.ru/ru/school/chemistry/11-klass
http://www.youtube.com/watch?t=2&v=dpmltgnJxok
http://www.youtube.com/watch?t=2&v=8j2YyUxtIlE
Mg + h3SO4 = MgSO4 + h3 сокращенное ионное уравнение пж… -reshimne.ru
Новые вопросы
Ответы
Mg(0) + 2H(+) = Mg(2+) + h3(0)
То, что в скобках пишется сверху, как степень.
Похожие вопросы
Как относится соль(Fe2(SO4)3) к основанию(NaOH). Например соль относится к соли,как 1:1,соль относится к кислоте,как 1:2…
Fe + CuSO4 = FeSO4 + Cu ионные уравнения, полное и сокращеное пж…
Опоределить массу соли которая получится при действии разбавленной серной кислоты на цинк массой 30 г….
Какой объем водорода понадобится для восстановления 16 г оксида железа…
Какой объем водорода потребуется для восстановления 16 грамм оксида железа (|||)…
Какая масса серной кислоты понадобится для нейтрализации 400 грамм гидроксида натрия???. ..
..
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Как писать ионные уравнения — Мини-химия
- Железо имеет две степени окисления, то есть +2 и +3.
- Водный раствор иона железа(II) Fe 2+ светло-зеленого цвета. Водный раствор иона железа(III) Fe 3+ имеет коричневый цвет.
- Превращение иона железа(II) в ион железа(III) представляет собой процесс окисления. Это можно сделать, смешав окислитель.
Пример
Процедура:
- 2 см³ раствора сульфата железа (II) наливают в пробирку.
- Бромную воду добавляют по каплям в раствор до тех пор, пока не перестанут наблюдаться дальнейшие изменения.

- Затем смесь встряхивают и осторожно нагревают.
- Наблюдение записывается.
Наблюдение:
- Коричневый цвет бромной воды становится бесцветным.
- Цвет раствора изменяется от светло-зеленого до желтовато-коричневого.
Половины уравнения:
Fe 2+ → FE 3+ + E
BR 2 + 2E → 2BR —
ofation
—ofation
—.0174 2
→ 2FE 3+ + 2BR —Объяснение :
- Цвето -зеленый цвет (II) Sulphate Sulder Opense Offere, потому что IN (II) ионы Fe 2+ 2+ раствор Sulphate Opere Behip, потому что железное (II) Fe 2+ 2+ .
- превращается в ион железа (III), Fe 3+ .
- Ион железа (II), Fe 2+ подвергается окислению, высвобождая электрон, с образованием иона железа (III), Fe 3+ .
- Коричневый цвет бромной воды становится бесцветным, поскольку молекулы брома восстанавливаются до ионов брома.

- Молекулы брома принимают электроны и подвергаются восстановлению с образованием бромид-иона Br–.
Окислитель: Бромная вода
Восстановитель: Ионы железа (II) Fe 2+
В пробирку наливают 2 см³ раствора продукта.
Тест 1: Затем в пробирку добавляют разбавленный раствор гидроксида натрия (NaOH) до избытка.
Результат: образовался коричневый осадок. Осадок не растворяется в избытке раствора гидроксида натрия.
Тест 2: Затем в пробирку добавляют разбавленный раствор гидроксида аммония (NH 4 OH)/водный раствор аммиака (NH 3 ) до избытка
. Результат: Образуется коричневый осадок. Осадок не растворяется в избытке раствора гидроксида аммония/водного аммиака.
Тест 3: в пробирку добавляют 2 см³ тиоцианата калия.
Результат: Образовался раствор красной крови.
Прочие окислители, заменяющие бромную воду
- Хлорная вода
Половина уравненийCL 2 + 2E → 2CL —
- Кислотный калийский мангант (VII)
Половина уравненияMNO 4
242 Я011113,9. 2 —
2 —3,9. —
3,9. — ,9.
23,9
2 ,92. + + 4H 2 O - Potassium dichromate (VI)
Half EquationsCr 2 O 7 2- + 14H + + 6e → 2Cr 3+ + 7H 2 O
- Пероксид водорода
Половины уравненияH 2 o 2 + 2H + + 2E → 2H 2 O
4+ 2E → 2H 2 O4+ 2E → 2H 2 o 4. 2E → 2H 2 . — + 4H + + 3E → NO + 2H 2 O
Изменение ионов железа (III) на железо (II) Ион
- (II) ион является восстановительным процессом. Это можно сделать, смешав восстановитель.
Пример
Процедура :
- 2 см³ раствора сульфата железа (III) наливают в пробирку.

- Половина шпателя цинкового порошка добавляется в раствор.
- Затем смесь встряхивают и осторожно нагревают.
- Наблюдение записывается.
Наблюдение:
- Цинковый порошок растворяется.
- Коричневый раствор сульфата железа (III) становится светло-зеленым.
Половина уравнений:
Fe 3+ → Fe 2+ + E
Zn → Zn 2+ + 2E
Уравнение Ionic
2FE 3 3++ + + + + + + + + + + + + + +
+
++
+. Zn
2+
Объяснение :
- Коричневый цвет раствора сульфата железа (III) становится светло-зеленым показывает, что ионы железа (III), Fe 3+ восстанавливаются до железа (II)
- ион Fe 2+ .
- Ион железа (III), Fe 3+ подвергается восстановлению путем получения электрона с образованием иона железа (II), Fe 2+
- Добавленный цинковый порошок окисляется с образованием иона цинка, Zn 2+ .

. Zn
2+

 NaOH и MgCl2
NaOH и MgCl2
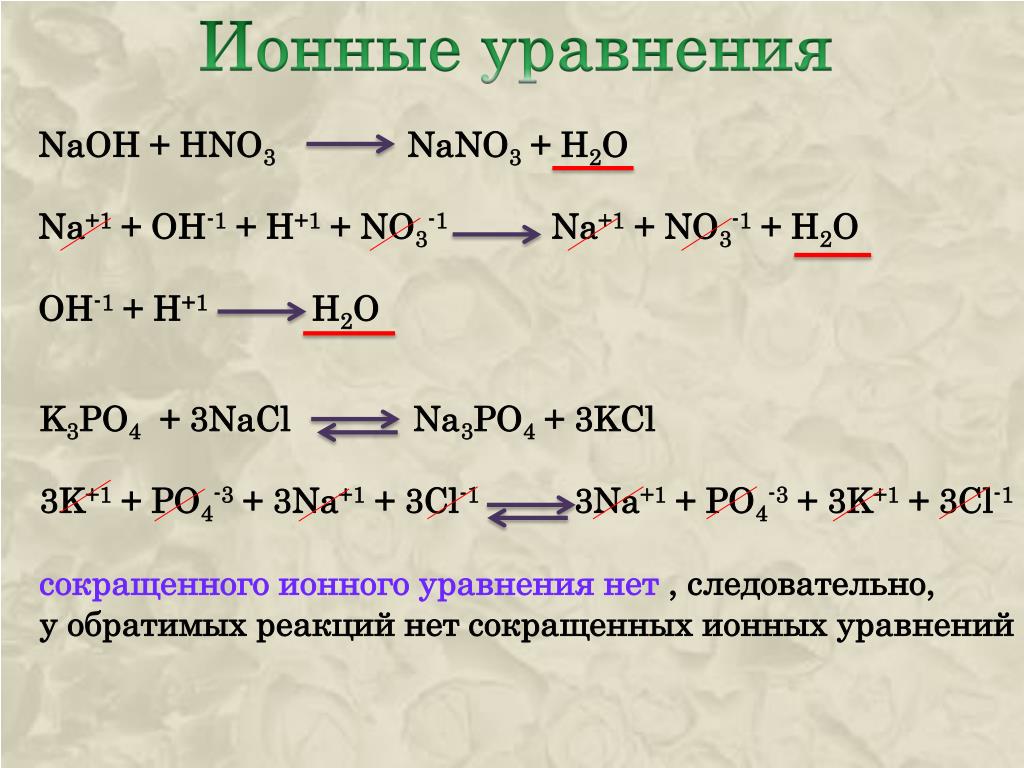
 СuCl2+2OH-→Cu2++2OH-+2Cl-
СuCl2+2OH-→Cu2++2OH-+2Cl-


 Na2SO3и HCl
Na2SO3и HCl Составьте краткое ионное уравнение взаимодействия 1 моль гидроксида калия с 1 моль гидроксида алюминия. Укажите число ионов в уравнении.
Составьте краткое ионное уравнение взаимодействия 1 моль гидроксида калия с 1 моль гидроксида алюминия. Укажите число ионов в уравнении. Раствор одного моль сульфата натрия содержит 6,02ионов натрия. Рассчитайте степень диссоциации соли.
Раствор одного моль сульфата натрия содержит 6,02ионов натрия. Рассчитайте степень диссоциации соли.