Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
структурная формула h4PO4 записывается так
Напишите уравнения реакции гидролиза( омыления) жира дипальмитостеарина
Решено
Помогите решить S—SO2—SO3—BaSO4
Решено
электронные и графические формулы элементов
Установите молекулярную формулу предельной карбоновой кислоты натриевой соли, которая содержит 37,5% углерода по массе
3.
 6.2 Вопросы методологии \ КонсультантПлюс
6.2 Вопросы методологии \ КонсультантПлюс3.6.2 Вопросы методологии
CO2 и CH4 от производства карбида кремния
Карбид кремния производится из кварцевого песка и нефтяного кокса, используемого в качестве источника углерода, по реакции:
SiO2 + 2C = Si + 2CO
Si + C = SiC.
Ниже дано суммарное уравнение реакции, но на практике процесс протекает не в такой стехиометрической пропорции:
SiO2 + 3C = SiC + 2CO (+ O2 -> 2CO2).
В процессе производства кварцевый песок и углерод смешивают в мольном отношении приблизительно 1:3. В процессе производства около 35% углерода нефтяного кокса переходит в карбид кремния, а остальная часть в избытке кислорода превращается в углекислый газ и выбрасывается в атмосферу. Нефтяной кокс, используемый в процессе, может содержать летучие соединения, которые превращаются в метан. Некоторое количество метана поступает в атмосферу, особенно в начале процесса.
CO2 от производства и потребления карбида кальция
Карбид кальция (CaC2) получают нагреванием карбоната кальция (известняка) с последующим восстановлением СаО с помощью углерода (например, углерода нефтяного кокса). В обеих стадиях выделяется CO2. Около 67% углерода из нефтяного кокса переходит в продукт.
Основные реакции получения карбида кальция:
CaCO3 = CaO + CO2
CaO + 3C = CaC2 + CO (+ 1/2O2 -> CO2).
Газ CO на большинстве заводов используют как источник энергии.
Самым важным применением карбида кальция является производство ацетилена (C2H2) по реакции CaC2 с водой. Значительное количество ацетилена используется для сварки. Ацетилен также применяется в химическом синтезе для получения ацетальдегида, уксусной кислоты, уксусного ангидрида и в качестве исходного сырья для производства «ацетиленовой сажи» (разновидность углеродной сажи). Часто ацетилен производится не на том заводе, где получают CaC2, и это следует иметь в виду при использовании методов оценки выбросов CO2 от использования CaC2 2 уровня.
Часто ацетилен производится не на том заводе, где получают CaC2, и это следует иметь в виду при использовании методов оценки выбросов CO2 от использования CaC2 2 уровня.
В результате использования ацетилена в химическом синтезе и производстве ацетиленовой сажи образуются продукты, содержащие углерод, что снижает общие выбросы CO2, связанные с использованием CaC2. Ацетилен может быть получен при частичном окислении природного газа, а также из CaC2. Метод учета ацетилена в этих видах использования описан в разделе 3.9.
Производство и использование ацетилена для сварки можно описать реакцией:
CaC2 + H2O = Ca(OH)2 + C2H2 (+ 2,5O2 -> 2CO2 + H2O).
Если ацетилен используется для сварки, то выбросы можно вывести исходя из количества CaC2, взятого для получения ацетилена, при допущении, что этот ацетилен будет использован в относительно короткий срок после его производства.
3.6.2.1 Выбор метода
Выбор метода в рамках эффективной практики зависит от национальных и региональных условий. В методе уровня 1 используются коэффициенты выбросов по умолчанию и данные региональной статистики. Уровень 2 основан на заводских данных по производству и использованию CaC2 для получения ацетилена для сварки. В методе уровня 3 используются заводские данные о расходе нефтяного кокса (включая коэффициент углеродного содержания (CCF) и коэффициент окисления углерода (COF), если они доступны; либо можно использовать национальные данные по сектору «Энергетика»), данные о расходе CaC2 для производства ацетилена сварки и данные о коэффициентах выбросов на уровне завода, где применимо.
CO2 и CH4 от производства карбида
Метод уровня 1
Выбросы от производства карбида можно рассчитывать на основании данных о потреблении нефтяного кокса или о производстве карбидов, а также данных о количестве карбида кальция, использованного для производства ацетилена сварки.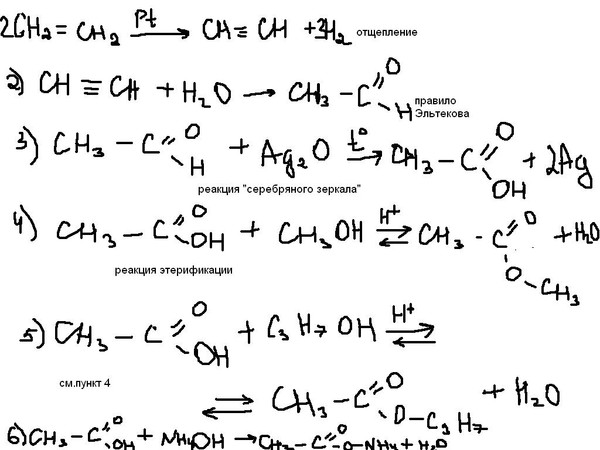 Для расчетов используются коэффициенты выбросов по умолчанию. Если используются данные о потреблении нефтяного кокса, то CCF и COF нефтяного кокса можно взять из главы 1 раздела «Энергетика», а результат умножить на 44/12, чтобы перевести C в CO2. Основное уравнение для расчета выбросов следующее:
Для расчетов используются коэффициенты выбросов по умолчанию. Если используются данные о потреблении нефтяного кокса, то CCF и COF нефтяного кокса можно взять из главы 1 раздела «Энергетика», а результат умножить на 44/12, чтобы перевести C в CO2. Основное уравнение для расчета выбросов следующее:
Уравнение 3.9
Выбросы от производства карбидов — уровень 1
,
где:
= региональные выбросы CO2, тонны;
AD = региональные данные о деятельности по потреблению нефтяного кокса или производству карбида, тонны израсходованного сырья или тонны продукции карбида;
EF = коэффициент выбросов CO2, тонны CO2/тонну сырья или продукции карбида.
Имеется два основных варианта:
Если в качестве данных о деятельности берут производство карбида, то EF должен быть равен среднему количеству выбросов CO2 на единицу продукции карбида, тонны CO2/тонну продукции карбида.
Если в качестве данных о деятельности берут потребление нефтяного кокса, то EF будет равен CCF (коэффициент углеродного содержания), помноженному на COF (коэффициент окисления углерода), помноженному на 44/12, с поправкой на содержание C в продукте, тонны CO2/тонну израсходованного сырья.
Поправочный коэффициент для SiC = 0,35 =
= Коэффициент выбросов = 0,65 · CCF · COF · 44/12;
Поправочный коэффициент для CaC2 = 0,67 =
= Коэффициент выбросов = 0,33 · CCF · COF · 44/12.
При этом могут быть использованы следующие национальные значения: CCF = 0,877 т С/т нефтяного кокса, COF = 0,99 (Российская, 2006 -…).
Уравнение 3.9 также можно использовать для оценки выбросов CH4, где EF — это соответствующий коэффициент выбросов для CH4.
В расчет выбросов от CaC2 необходимо включить выбросы CO2, которые косвенно относятся к CaC2, потребляемого при производстве ацетилена. Уравнение 3.9 можно применять, если AD — это количество потребленного CaC2, а EF — коэффициент выбросов, связанный с этим использованием. В методе уровня 1, в рамках эффективной практики, делают консервативное допущение о том, что весь CaC2, потребленный при производстве ацетилена, дает выбросы CO2 (Межправительственная, 2006).
Метод уровня 2
Для метода уровня 2 требуются данные на уровне предприятия о выпуске карбида и о содержании углерода в продукте. Для CaC2 также требуются данные об использовании в регионе CaC2 для производства ацетилена сварки. Выбросы от производства и использования можно рассчитать по уравнению 3.9 с помощью коэффициентов МГЭИК. Если ацетилен производится из CaC2 в другом субъекте РФ и количество потребленного для этой цели CaC2 неизвестно, то по правилам эффективной практики этот факт следует задокументировать. В этом случае учет выбросов от использования карбида кальция должен быть выполнен в том регионе, где CaC2 был использован для производства ацетилена сварки.
Метод уровня 3
Метод уровня 3 описан в Руководящих принципах МГЭИК (Межправительственная, 2006).
3.6.2.2 Выбор коэффициентов выбросов
Метод уровня 1
В методе уровня 1 используются значения по умолчанию CCF, COF и содержания C в продукте, там, где в расчете используется расход нефтяного кокса.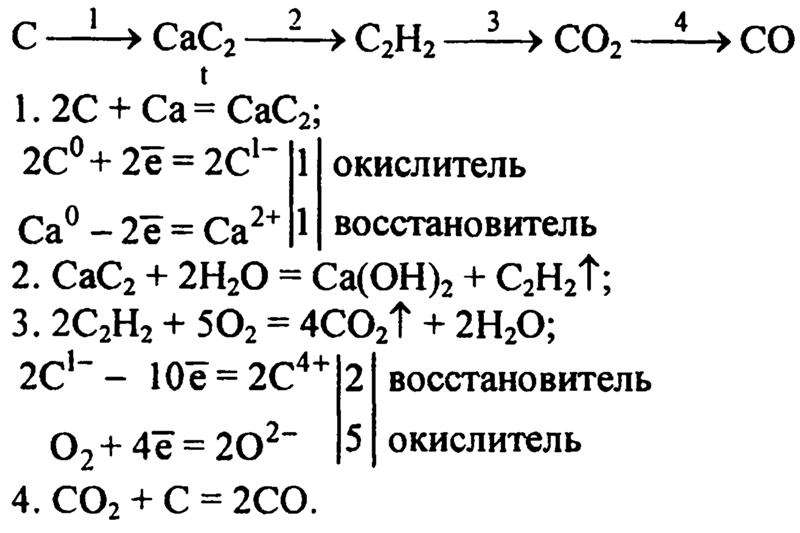 А если расчет основан на производстве карбида, то используются коэффициенты выбросов МГЭИК из таблицы 3.6 и 3.7. В обоих случаях применяется коэффициент выбросов МГЭИК для использования CaC2 (Межправительственная, 2006).
А если расчет основан на производстве карбида, то используются коэффициенты выбросов МГЭИК из таблицы 3.6 и 3.7. В обоих случаях применяется коэффициент выбросов МГЭИК для использования CaC2 (Межправительственная, 2006).
Таблица 3.6
КОЭФФИЦИЕНТЫ ВЫБРОСОВ МГЭИК ДЛЯ ОЦЕНКИ ВЫБРОСОВ CO2 И CH4
ОТ ПРОИЗВОДСТВА КАРБИДА КРЕМНИЯ
Таблица 3.7
КОЭФФИЦИЕНТЫ ВЫБРОСОВ МГЭИК ДЛЯ РАСЧЕТА ВЫБРОСОВ CO2
ОТ ПРОИЗВОДСТВА И ПОТРЕБЛЕНИЯ КАРБИДА КАЛЬЦИЯ
Метод уровня 2
Так же как для уровня 1, в методе уровня 2 используются значения коэффициентов выбросов по умолчанию, за исключением содержания C в продукте. Рекомедуется использовать данные предприятия.
3.6.2.3 Выбор данных о деятельности
Метод уровня 1
Для метода уровня 1 необходимы данные о потреблении нефтяного кокса или региональные данные о производстве карбида. Для этого рекомендуется использовать следующие источники данных:
— Территориальные органы государственной статистики РФ (Росстат).
— Предприятия или промышленные компании, осуществляющие производство или использование карбидов в регионе.
Метод уровня 2
Данные о деятельности, необходимые для метода уровня 2, включают данные на уровне предприятий о производстве карбида и о потреблении CaC2 для производства ацетилена для сварки.
3.6.2.4 Полнота
Заводы по производству карбида, как правило, хорошо известны. Данные о производстве карбида кальция и кремния учитываются органами Росстата. Данные о потреблении нефтяного кокса можно получить прямо от заводов по производству карбида. Сбор данных о деятельности и расчет выбросов осложняются тем, что ацетилен, образующийся из CaC2, не всегда производится на том же заводе, что и CaC2. Это следует иметь в виду при использовании методов высокого уровня, при этом выбросы от использования CaC2 должны учитываться по месту их образования. Например, в случае ацетилена для сварки, если ацетилен производится в другом месте (не там, где CaC2), то выбросы учитывают по месту производства ацетилена.
Химические характеристики карбида кальция и его реакция с водой
Похоже, вы зашли на наш сайт из
Выбрать другую страну
Почему так бодро?
[Депозитные фотографии]Карбид кальция представляет собой химическое соединение кальция и углерода и в чистом виде представляет собой белое кристаллическое вещество. Его получают по реакции
Ca + 2C → CaC₂
Карбид кальция [Викимедиа] Карбид кальция имеет большое практическое значение. Он также известен как ацетилид кальция.
Химические характеристики карбида кальция
Карбид кальция не летуч и не растворим ни в одном известном растворителе и реагирует с водой с образованием газообразного ацетилена и гидроксида кальция. Его плотность составляет 2,22 г/см³. Температура плавления 2160°С, температура кипения 2300°С. Поскольку ацетилен, образующийся при контакте с водой, легко воспламеняется, вещество отнесено к классу опасности 4.3.
Ацетилид кальция был впервые получен немецким химиком Фридрихом Вёлером в 1862 году при нагревании сплава цинка и кальция с углем. Ученый описал реакцию карбида кальция с водой. Карбид кальция энергично реагирует даже со следами Н₂O, выделяя большое количество тепла. При недостаточном количестве воды образующийся ацетилид самопроизвольно воспламеняется. Ацетилид кальция бурно реагирует с водными растворами щелочей и разбавленными неорганическими кислотами. Эти реакции высвобождают ацетилид. Благодаря своим сильным восстановительным свойствам CaC₂ восстанавливает все оксиды металлов до чистых металлов или превращает их в карбиды.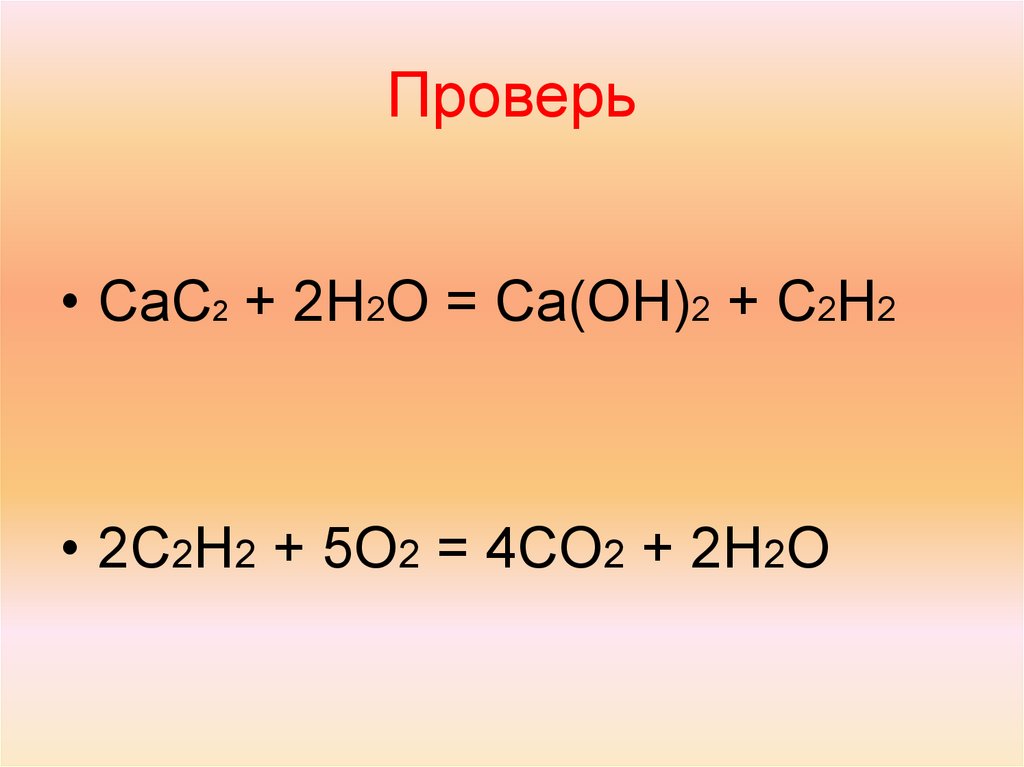
Легче получить карбид кальция из его оксида, чем из самого кальция, так как оксид восстанавливается при температуре выше 2000 °C. Соединение металла и углерода:
CaO + 3C → CO↑ + CaC₂
Реакция происходит в электродуговой печи, где нагревается смесь негашеной извести и кокса или антрацита. Технический продукт имеет серый цвет из-за наличия свободного углерода, оксида кальция, фосфида, сульфида и других химических соединений. CaC₂ составляет 80-85% продукта по массе.
Использование карбида кальция
В прошлом карбид кальция использовался в карбидных лампах, где он служил источником ацетиленового пламени. В настоящее время эти лампы все еще используются для питания маяков и маяков, а также при исследовании пещер. CaC₂ также служит сырьем для разработки химических технологий, прежде всего синтетического каучука. Карбид кальция также используется для производства винилхлорида, ацетиленовой сажи, акрилонитрила, уксусной кислоты, ацетона, этилена, стирола и синтетических смол.
В металлургии карбид кальция применяют для раскисления металлов и снижения содержания в них кислорода и серы (десульфурация). Карбид кальция используется для производства порошкообразного карбида, регулятора роста растений. Для получения одной тонны CaC₂ требуется 3000 кВт/ч электроэнергии. По этой причине производство вещества рентабельно только при низких затратах на электроэнергию. В то же время производство карбида кальция во всем мире постоянно увеличивается.
Карбид кальция – реакция с водой
При реакции карбида кальция с водой выделяется ацетилен:
2H₂O + CaC₂ → C₂H₂↑ + Ca(OH)₂
Ацетилен – промышленное вещество с неприятным запахом содержащимися в нем примесями (NH₃, H₂S, PH₃ и др.). В чистом виде ацетилен представляет собой бесцветный газ с характерным слабым запахом, растворяется в воде.
Чтобы продемонстрировать реакцию карбида кальция с водой, можно использовать простой опыт: налить воду в бутыль объемом 1,5 л, быстро добавить несколько кусочков карбида кальция и закрыть бутыль пробкой. В результате последующей реакции между карбидом кальция и водой ацетилен накапливается в бутылке по мере роста давления. Как только реакция прекратится, поместите в бутылку горящую бумажку – это должно вызвать взрыв, сопровождаемый огненным облаком. Поскольку в результате реакции стенки бутылки могут лопнуть, этот эксперимент опасен и должен проводиться только при строгом соблюдении техники безопасности.
Внимание! Не пытайтесь проводить эти эксперименты без профессионального присмотра! Посмотрите здесь эксперименты с пламенем, которые вы можете безопасно проводить дома
Чтобы продемонстрировать реакцию карбида кальция с водой, эксперимент можно повторить в модифицированном виде – с шестилитровой бутылью. При этом компоненты необходимо взвешивать с точностью, ведь чем больше радиус бутылки, тем меньше емкость выдерживает высокое давление (при условии одинакового материала и толщины стенок). Бутылка большой емкости имеет большой радиус, но стенки у нее примерно такие же — соответственно, она менее устойчива к давлению. Чтобы он не взорвался, необходимо заранее рассчитать количество карбида кальция. Молярная масса кальция составляет 40 г/моль, а углерода — 12 г/моль, поэтому молярная масса карбида кальция составляет около 64 г/моль. Соответственно, из 64 г карбида получится 22,4 л ацетилена. Объем баллона 6 л, а давление поднялось примерно на 4 атмосферы.
При этом компоненты необходимо взвешивать с точностью, ведь чем больше радиус бутылки, тем меньше емкость выдерживает высокое давление (при условии одинакового материала и толщины стенок). Бутылка большой емкости имеет большой радиус, но стенки у нее примерно такие же — соответственно, она менее устойчива к давлению. Чтобы он не взорвался, необходимо заранее рассчитать количество карбида кальция. Молярная масса кальция составляет 40 г/моль, а углерода — 12 г/моль, поэтому молярная масса карбида кальция составляет около 64 г/моль. Соответственно, из 64 г карбида получится 22,4 л ацетилена. Объем баллона 6 л, а давление поднялось примерно на 4 атмосферы.
Бутылка должна выдерживать пять атмосфер: для проведения эксперимента берем около 64 г карбида кальция и около 0,5 л воды. Поместите кусок карбида в небольшой пакет. Вставьте пакет в бутылку, затем быстро закройте бутылку пробкой. Реакция карбида кальция с водой продолжается несколько минут, бутылка вздувается и процесс сопровождается громкими хлопками, но бутылка должна это выдержать.
После завершения выпуска ацетилена положите горячую тряпку, смоченную гендеканом, на пробку бутылки, затем отойдите на максимально безопасное расстояние. Вскоре вы увидите яркую желтую вспышку, а из бутылки поднимется фонтан пламени высотой до 4 метров. Это сожжет пробку и деформирует бутылку, но бутылка должна остаться целой. Этот эксперимент необходимо проводить на открытом воздухе, вдали от легковоспламеняющихся и взрывоопасных предметов. Обязательно соблюдайте все соответствующие меры предосторожности.
У нас есть для вас еще статьи по химии:
- Эксперимент «Самодельный цемент» Как сделать цемент в домашних условиях
- Нитроцеллюлоза: огонь без ожогов Как заставить вату гореть за несколько секунд
Вы можете провести десятки химических опытов дома!
Почему такой синий?
Учить больше
Попробуй
Ключевые замечания по получению ацетилена из карбида кальция
Ацетилен, также известный как этин, является наиболее основным и хорошо известным членом ряда углеводородов, содержащих одну или несколько пар атомов углерода, связанных тройными связями, также известный как ацетиленовый ряд, или алкины. Это самый простой и наиболее известный член ряда углеводородов, содержащий одну или несколько пар атомов углерода, связанных тройными связями, также известный как алкины. Помимо использования в качестве топлива при кислородно-ацетиленовой сварке и резке металлов, он также используется в качестве сырья для синтеза многих органических соединений и полимеров. Его химическая формула C9.0077 2 H 2 , и это бесцветный горючий газ. ацетилен можно создать одним из трех способов: взаимодействием воды с карбидом кальция, пропусканием углеводорода через электрическую дугу или частичным сжиганием метана в присутствии воздуха или кислорода.
Это самый простой и наиболее известный член ряда углеводородов, содержащий одну или несколько пар атомов углерода, связанных тройными связями, также известный как алкины. Помимо использования в качестве топлива при кислородно-ацетиленовой сварке и резке металлов, он также используется в качестве сырья для синтеза многих органических соединений и полимеров. Его химическая формула C9.0077 2 H 2 , и это бесцветный горючий газ. ацетилен можно создать одним из трех способов: взаимодействием воды с карбидом кальция, пропусканием углеводорода через электрическую дугу или частичным сжиганием метана в присутствии воздуха или кислорода.
Ацетилен в чистом виде представляет собой бесцветный газ с приятным запахом; но когда он сделан из карбида кальция, он часто содержит остатки фосфина, который издает неприятный чесночный запах. С выделением тепла ацетилен может разлагаться на составные части. В зависимости от обстоятельств в результате процесса разложения может произойти взрыв, а может и не произойти. Чистый ацетилен, будь то в жидкой или твердой форме, взрывается с огромной силой, когда подвергается воздействию давления, превышающего около 15 фунтов на квадратный дюйм.
Чистый ацетилен, будь то в жидкой или твердой форме, взрывается с огромной силой, когда подвергается воздействию давления, превышающего около 15 фунтов на квадратный дюйм.
Смеси воздуха и ацетилена являются взрывоопасными в широком диапазоне концентраций, от примерно 2,5% воздуха в ацетилене до примерно 12,5% ацетилена в воздухе. Чистый белый свет получается при сжигании ацетилена с соответствующим количеством воздуха; в результате его когда-то использовали для освещения мест, где электричество было недоступно, таких как буи, шахтерские фонари и дорожные знаки. При горении ацетилена выделяется значительное количество тепла, а кислородно-ацетиленовое пламя, производимое правильно сконструированной горелкой, имеет самую высокую температуру пламени (около 6000°F или 3300°C) среди всех известных комбинаций горючих газов (примерно 6000°F, или 3300°С).
Атомы водорода ацетилена могут быть заменены металлическими элементами, что приводит к образованию ацетилидов, таких как ацетилиды серебра, меди и натрия. Ацетилиды серебра, меди, ртути и золота детонируют в результате высоких температур, трения и ударов. Помимо реакционноспособного атома водорода, тройная связь углерод-углерод способна легко принимать галогены, галогенокислоты, цианистый водород, спирты, амины и амиды в качестве партнеров по совместной реакции. Ацетилен также можно использовать в сочетании с другими соединениями, такими как альдегиды и кетоны. Многие из описанных здесь реакций используются в коммерческом производстве широкого спектра промышленных и потребительских товаров, включая ацетальдегид, синтетический каучук неопрен, краски на водной основе, виниловые ткани и напольные покрытия, растворители для химической чистки и аэрозольные инсектицидные спреи. , среди прочего. ацетилен можно создать одним из трех способов: взаимодействием воды с карбидом кальция, пропусканием углеводорода через электрическую дугу или частичным сжиганием метана в присутствии воздуха или кислорода.
Ацетилиды серебра, меди, ртути и золота детонируют в результате высоких температур, трения и ударов. Помимо реакционноспособного атома водорода, тройная связь углерод-углерод способна легко принимать галогены, галогенокислоты, цианистый водород, спирты, амины и амиды в качестве партнеров по совместной реакции. Ацетилен также можно использовать в сочетании с другими соединениями, такими как альдегиды и кетоны. Многие из описанных здесь реакций используются в коммерческом производстве широкого спектра промышленных и потребительских товаров, включая ацетальдегид, синтетический каучук неопрен, краски на водной основе, виниловые ткани и напольные покрытия, растворители для химической чистки и аэрозольные инсектицидные спреи. , среди прочего. ацетилен можно создать одним из трех способов: взаимодействием воды с карбидом кальция, пропусканием углеводорода через электрическую дугу или частичным сжиганием метана в присутствии воздуха или кислорода.
Ацетилен, часто известный как «этин», представляет собой химическое соединение, состоящее из двух атомов водорода и двух атомов углерода, которое имеет химическую формулу C 2 H 2 . Существует два процесса производства этого углеводорода: химическая реакция или термический крекинг, оба из которых используют различные типы сырья для достижения своих целей.
Существует два процесса производства этого углеводорода: химическая реакция или термический крекинг, оба из которых используют различные типы сырья для достижения своих целей.
Акрилонитрил производится из карбида кальция, который имеет химическую формулу CaC 2 . Это наиболее широко используемое сырье в производстве ацетилена. Карбид кальция обычно получают путем смешивания извести и кокса в доменной печи, а затем полученный карбид кальция используют в качестве топлива.
Когда карбид кальция обрабатывается водой, он имеет тенденцию к образованию газообразного ацетилена, что можно продемонстрировать с помощью приведенных ниже сбалансированных химических уравнений.
В производстве ацетилена из карбида кальция участвуют следующие стадии:
Получение негашеной извести (с химической формулой CaO) из карбоната кальция (т.е. CaCO 3 ) является простым процессом.
CaCO 3 →CaO + CO 2
– Получение карбида кальция из негашеной извести (CaO) в присутствии кокса (C) путем нагревания смеси: CaO + 3C → CaC 2 + CO
Ниже описана процедура получения ацетилена путем взаимодействия карбида кальция с водой (процесс, известный как гидролиз карбида кальция):
CaC 2 + 2H 2 O → C 2 H 2 + Ca(OH) 2
Ацетилен может быть получен из сбалансированного химического вещества с водой и карбидом кальция.

 12.12
12.12