Na NaOh Na2co3 NaCl NaNo3
Билет №1 (3)
Выведите молекулярную формулу вещества, если массовая доля углерода в нём составляет 82,75%, водорода 17,25%. Относительная плотность паров по воздуху равна 2.
Дано: | Решение: |
Dвозд(CxHy) = 2 ω(C) = 82,75% ω(H) = 17,25% | Mвозд = 29 г/моль M(CxHy) = 29 г/моль ∙ 2 = 58 г/моль Пусть ν(CxHy) = 1 моль, тогда m(CxHy) = 58 г m(C) = 0,8275 ∙ 58г = 47,995 ≈ 48г m(H) = 0,1725 ∙ 58г = 10,005 ≈ 10г ν(C) : ν(H)
= = 4 : 10 ⇒
С M(C4H10) = 48 + 10 = 58 г/моль |
CxHy– ? | Ответ: С4Н10 |
Билет №2 (3)
Осуществить превращения:
Натрий → гидроксид натрия → карбонат натрия → хлорид натрия → нитрат натрия
0 +1 -2 +1 -2 +1 0
2Na + 2H2O → 2NaOH + H2↑
в-ль ок-ль
Na0 – 1e— → Na+1 | 2
2H+1 + 2e— → H2 | 1
2NaOH + CO2 → Na2CO3 + H2O
2Na+ + 2OH– + CO2 → 2Na+ + CO32– + H 2O
2OH– + CO2 → CO32– + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
2Na+ + CO32– + 2H+ + 2Cl– → 2Na+ + 2Cl– + CO2↑ + H2O
CO32– + 2H+ → CO2↑ + H2O
NaCl + AgNO3 → NaNO3 + AgCl↓
Na+ + Cl– + Ag+ + NO3– → Na+ + NO3– + AgCl↓
Cl– + Ag+ → AgCl↓
Билет №3 (3)
Какой объём хлора прореагирует с
натрием массой 34,5г. Определить массу
хлорида натрия.
Определить массу
хлорида натрия.
Решение: | |
m(Na) = 34,5г | 34,5 г x л y л 2Na + Cl2 → 2NaCl 2 моль 1 моль 2 моль 46 г 22,4 л 117 г m = M ∙ ν V = Vm ∙ ν M(Na) = 23 г/моль M(NaCl) = 58,5 г/моль m(Na) = 23 г/моль ∙ 2 моль = 46 г m(NaCl) = 58,5 г/моль ∙ 2 моль = 117 г Vm = 22,4 л/моль V(Cl2) = 22,4 л/моль ∙ 1 моль = 22,4 л |
V(Cl2) – ? m(NaCl) – ? | Ответ: V(Cl 2) = 16,8 л; m(NaCl) = 87,8 г |
Билет №4 (3)
Осуществить превращения:
Магний → хлорид магния → гидроксид магния → оксид магния → сульфат магния
Mg MgCl2 Mg(oh)2 MgO MgSo4
0 +1 -1 +2 -1 0
Mg + 2HCl MgCl2 + H2↑
в-ль ок-ль
Mg0 – 2e— → Mg+2 | 1
2H+ + 2e— → H20 | 1
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
Mg2+ + 2Cl– + 2Na+ + 2OH– → Mg(OH)2↓ + 2Na+ + 2Cl–
Mg2+ + 2OH– → Mg(OH)2↓
Mg(OH)2 MgO + H2O
MgO + H
MgO + 2H+ + SO42–→ Mg2+ + SO42– + H2O
MgO + 2H+ → Mg2+ + H2O
Билет №5 (3)
Какой объём хлора прореагирует с железом массой 400г, если массовая доля примесей в нём 20%?
Дано: | Решение: |
mобр(Fe) = 400 г ωприм = 20% | 320 г x л 2Fe + 3Cl2 → 2FeCl3 2 моль 3 моль 112 г 67,2 л mприм = 0,2 ∙ 400 г = 80 г m(Fe) = m обр – mприм = 400 г – 80 г = 320 г M(Fe) = 56 г/моль; m(Fe) = 56 г/моль ∙ 2 моль = 112 г Vm = 22,4 л/моль V(Cl2) = Vm ∙ ν = 22,4 л/моль ∙ 3 моль = 67,2 л |
V(Cl2) – ? | Ответ: V(Cl2) = 192 л |
Билет №6 (3)
Осуществить превращения:
Медь → хлорид меди (II) → гидроксид меди (II) → оксид меди (II) → медь
Cu CuCl2 Cu(oh)2 CuO Cu
0 0 +2 –1
Cu + Cl2 → CuCl2
в—льок—ль
Cu0 – 2e— → Cu+2 | 1
Cl
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Cu2+ + 2Cl– + 2Na+ + 2OH– → Cu(OH)2↓ + 2Na+ + 2Cl–
Cu2+ + 2OH– → Cu(OH)2↓
Cu(OH)2 CuO + H2O
+2 –2 0 t 0 +1 –2
CuO + H2 Cu + H2O
ок—льв—ль
Cu+2 + 2e— → Cu0 | 1
H20 – 2e— → 2H+1 | 1
Билет №7 (3)
При прокаливании 300 г известняка,
содержащего 10% примесей, получено 75 г
негашеной извести. Найти массовую долю
выхода продукта реакции от теоретически
возможного.
Найти массовую долю
выхода продукта реакции от теоретически
возможного.
Дано: | Решение: |
mобр(CaCO3) = 300г ωприм = 10% mпракт(CaO) = 75г | 270 г x г CaCO3 CaO + CO2 1 моль 1 моль 100 г 56 г mприм = 300 г ∙ 0,1 = 30 г m(CaCO3) = 300 г – 30 г = 270 г = 151,2 г — m = 0,496 = = 49,6% |
η(CaO) – ? | Ответ: η(CaO) = 49,6 % |
Билет №8 (3)
Какова масса соли, получившейся в результате взаимодействия 100 г соляной кислоты с 14 г оксида кальция?
Дано: | Решение: |
m(HCl) = 100 г m(CaO) = 14 г | 0,25 моль х моль CaO + 2HCl → CaCl2 + H2O 1 моль 2 моль 1 моль m = M ∙ ν M(CaCl2) = 40 + 71 = 111 г/мольm(CaCl2) = 111 г/моль ∙ 0,25 моль = 27,75 г ≈ 27,8 г |
m(CaCl2) – ? | Ответ: m(CaCl2) = 27,8 г |
Билет №9 (3)
Какой объём ацетилена необходимо сжечь для получения 24 л оксида углерода (IV)?
Дано: | Решение: |
V(CO2) = 24 л | x л 24 л 2C2H2 + 5O2 → 4CO2 + 2H2O 2V 4V |
Ответ: V(C2H2) = 12 л |
Билет №10 (3)
Осуществить превращения:
Гидроксид меди (II) → сульфат меди (II) → медь →
→ оксид меди (II) → нитрат меди (II)
Получение из nahco3 na2co3
Питьевая сода — это гидрокарбонат натрия NaHCO3, двууглекислый натрий. Искусственная пищевая сода NaHCO3 — белый кристаллический порошок. Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Серлс в Калифорнии. В России из-за отсутствия крупных месторождений сода из минералов не добывается.
Искусственная пищевая сода NaHCO3 — белый кристаллический порошок. Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Серлс в Калифорнии. В России из-за отсутствия крупных месторождений сода из минералов не добывается.
Поиск данных по Вашему запросу:
Схемы, справочники, даташиты:
Прайс-листы, цены:
Обсуждения, статьи, мануалы:
Дождитесь окончания поиска во всех базах.
По завершению появится ссылка для доступа к найденным материалам.
Содержание:
- Аналитическая химия: Методические указания к выполнению лабораторных работ
- CO — CO2 — NaHCO3 — Na2CO3
- Читать онлайн «Большая Советская Энциклопедия (СО)» автора БСЭ — RuLit — Страница 131
- Вы точно человек?
- Реакция термического разложения гидрокарбоната натрия
- Na -> NaOH -> Na2CO3 -> NaCl -> Na осуществить цепочку превращений
- Значение слова СОДА в Большой советской энциклопедии, БСЭ
- Вы точно человек?
- Применение и реакции взаимодействия карбоната натрия
- Na-NaOH- Na2CO3-NaHCO3-Na2CO3
ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: Acid base titration sodium carbonate with HCl
youtube.com/embed/7sDJQJ-80FQ» frameborder=»0″ allowfullscreen=»»/>Аналитическая химия: Методические указания к выполнению лабораторных работ
Вплоть до начала 19 в. Водные растворы Na2CO3 имеют сильную щелочную реакцию вследствие гидролиза. Первый промышленный способ получения С. В во Франции было начато производство С. Он состоял из следующих стадий.
При этом происходили реакции:. Из охлажденного плава С. Раствор С. Сырую С. Процесс Леблана давал С. Поэтому полученную С. Побочными продуктами были HC1 его сперва выпускали на воздух, а затем стали поглощать водой, получая техническую соляную кислоту и CaS который образовывал огромные отвалы. От этих недостатков был свободен аммиачно-содовый процесс Э.
Сольве, запатентованный им в в в Бельгии был пущен первый завод, получавший С. Способ основан на реакциях, идущих в водных растворах:. Освобождающийся CO2 вновь поступает в производство. При этом карбонат и гидрокарбонат аммония разлагаются:.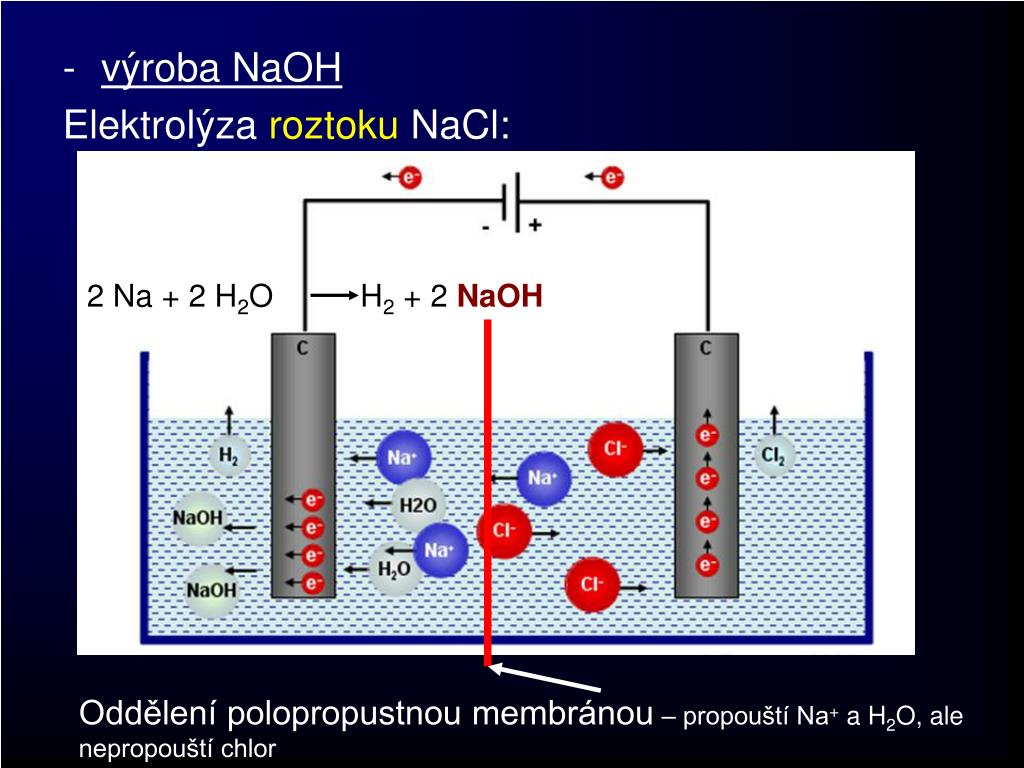 Аммиак возвращается в производство. Все реакции идут при невысоких температурах.
Аммиак возвращается в производство. Все реакции идут при невысоких температурах.
Единственным отбросом является раствор CaCl2, имеющий некоторое практическое применение см. Кальция хлорид. По этому способу получается очень чистая безводная С. Благодаря этим преимуществам способ Сольве вытеснил производство С.
В России первым предприятием. Водные растворы NaHCO3 имеют слабощелочную реакцию. Соль впервые описана в немецким аптекарем Б. В больших количествах её используют в стекольном, мыловаренном, бумажном и красильном производствах; она применяется также для умягчения воды паровых котлов.
NaHCO3 используют в производстве безалкогольных напитков, хлебобулочных и кондитерских изделий. В медицине гидрокарбонат натрия применяют внутрь в таблетках, порошках и растворах для нейтрализации избытка соляной кислоты в желудочном соке например, при гастритах , наружно — в виде растворов для полосканий горла, а также для промывания кожи при попадании на неё кислот.
При некоторых заболеваниях растворы NaHCO3 вводят внутривенно. Входит в состав многих лекарственных средств. Вольфковича, т.
Входит в состав многих лекарственных средств. Вольфковича, т.
В в СССР произведено 4,7 млн.
CO — CO2 — NaHCO3 — Na2CO3
Switch to English регистрация. Телефон или email. Чужой компьютер. Занимательная Химия. Занимательная Химия запись закреплена 26 янв
Реакция термического разложения гидрокарбоната натрия с образованием карбоната натрия оксида углерода(IV) и воды. Уравнение.
Читать онлайн «Большая Советская Энциклопедия (СО)» автора БСЭ — RuLit — Страница 131
Пронаблюдайте, что происходит в растворе. Объясните, почему произошли изменения. Смотри в. Объясните, почему это произошло. Cмотри г. Пронаблюдайте, что происходит в химическом стакане. Что можно предположить по этому поводу? Извлеките газоотводную трубку из стакана и потушите спиртовку.
Вы точно человек?
Различают С. Каустической С. Ещё древние египтяне применяли природную С. До 18 в.
Определение в их смеси может быть выполнено двумя методами. Метод 1.
Реакция термического разложения гидрокарбоната натрия
Кудрявцев А. Составление химических уравнений — Просвещение , Скачать прямая ссылка : sostavlenhimreakciy Составить уравнения реакций образования гидроокисей скйндия, иттрия и лантана. Как получить нитрат скандия и.
Составление химических уравнений — Просвещение , Скачать прямая ссылка : sostavlenhimreakciy Составить уравнения реакций образования гидроокисей скйндия, иттрия и лантана. Как получить нитрат скандия и.
Na -> NaOH -> Na2CO3 -> NaCl -> Na осуществить цепочку превращений
Чистый бикарбонат натрия может быть получен действием СО2 на раствор соды по реакции, обратной процессу его термического распада. В насыщенный при 30 — 40 С теплый раствор соды пропускают ток двуокиси углерода. Чистый бикарбонат натрия может быть получен действием ССь на раствор соды по реакции, обратной процессу его термического распада. Образующийся чистый бикарбонат натрия отфильтровывают, сушат, упаковывают в тару в сухих помещениях. В колбу вводят химически чистый бикарбонат натрия и умеренно нагревают его. U-образ-нук отводную трубку охлаждают льдом, в ней конденсируется основная часть ларов воды. Получают достаточно чистый газ. Для окончательной очистки применяют метод фракционированной возгонки, как описано ниже.
ce{Na2CO3}$ и $\ce{NaHCO3}$ имеют подобные реакции. Например, они могут взаимодействовать с кислотой для получения $\ce{CO2}$. Так что мой .
Значение слова СОДА в Большой советской энциклопедии, БСЭ
COM — образовательный портал Наш сайт это площадка для образовательных консультаций, вопросов и ответов для школьников и студентов. Вопросы ответы Задать вопрос О проекте Гость x Авторизация. Чужой компьютер.
Вы точно человек?
ВИДЕО ПО ТЕМЕ: How to Balance NaHCO3 + NaOH = Na2CO3 + h3O (Sodium bicarbonate + Sodium hydroxide)
Вам нужны консультации по Химии по Skype? Если да, подайте заявку. Стоимость договорная. Чтобы закрыть это окно, нажмите «Нет». Мы тут же подберём Вам репетитора.
Журнал неорганической химии.
Применение и реакции взаимодействия карбоната натрия
Содержание статьи Физические свойства Реакции взаимодействия карбоната натрия Применение кальцинированной соды Производители и стоимость. Карбонат натрия производиться в виде белого порошкообразного вещества. В простонародье это вещество называют кальцинированной содой, в международном производстве применяют название Sodium carbonate. Соду использовали еще в древних временах, первыми ее нашли египтяне. Они использовали ее для мытья посуды и для производства стекольных изделий.
Карбонат натрия производиться в виде белого порошкообразного вещества. В простонародье это вещество называют кальцинированной содой, в международном производстве применяют название Sodium carbonate. Соду использовали еще в древних временах, первыми ее нашли египтяне. Они использовали ее для мытья посуды и для производства стекольных изделий.
Na-NaOH- Na2CO3-NaHCO3-Na2CO3
Вплоть до начала 19 в. Водные растворы Na2CO3 имеют сильную щелочную реакцию вследствие гидролиза. Первый промышленный способ получения С. В во Франции было начато производство С.
Является ли Na2CO3 кислотой, основанием или солью? Strong or Weak
Главная > Химия > Является ли Na2CO3 кислотой, основанием или солью?
Карбонат натрия представляет собой неорганическое соединение, состоящее из соли натрия и карбонатной соли, имеющее химическую формулу Na 2 CO 3 . Она широко известна как стиральная сода или кальцинированная сода. Он выглядит как белое твердое вещество, растворимое в воде. В основном используется как очищающее средство в бытовых целях.
Он выглядит как белое твердое вещество, растворимое в воде. В основном используется как очищающее средство в бытовых целях.
В этой статье мы обсудим Карбонат натрия (Na 2 CO 3 ) кислота, основание или нейтральная соль?
Итак, Является ли Na 2 CO 3 кислотой или основанием? Na 2 CO 3 – основная соль. Он образуется при нейтрализации сильного основания, а именно гидроксида натрия (NaOH), и слабой кислоты, а именно угольной кислоты (H 2 CO 3 ). Значение pH водного раствора карбоната натрия выше 7.
Давайте более подробно рассмотрим, почему Na 2 CO 3 действует как основная соль?
| Name of Molecule | Sodium carbonate |
| Chemical formula | Na 2 CO 3 |
| Nature | Basic salt |
| Molar mass | 105. 9888 г/моль 9888 г/моль |
| pH | > 7 |
Вы когда-нибудь слышали, что означают эти термины «кислая соль», «основная соль», «нейтральная соль», «амфотерная соль»?
Кислотная соль: Кислая соль образуется при протекании реакции нейтрализации между сильной кислотой и слабым основанием. Этот тип соли образует кислый раствор после растворения в растворителе со значением pH менее 7. Примеры кислой соли – NH 4 Cl, NH 4 NO 3 , Nh5Br и т. д.
Читайте также: —
- Почему Nh5Cl является кислой солью?
- Почему Nh5NO3 является кислой солью?
- Почему Nh5Br является кислой солью?
Основная соль: Основная соль образуется при протекании реакции нейтрализации между сильным основанием и слабой кислотой. Этот тип соли образует основной раствор после растворения в растворителе со значением pH более 7. Примеры основных солей — NaCN, мыло, NaF и т. д.
Примеры основных солей — NaCN, мыло, NaF и т. д.
Читайте также: —
- основная соль?
- Почему NaCN является основной солью?
- Почему мыло является основной солью?
Нейтральная соль: Значение pH этой соли равно 7, что означает, что она не обладает ни кислотными, ни основными свойствами. Он образуется при протекании реакции нейтрализации между сильной кислотой и сильным основанием или слабой кислотой и слабым основанием. Примеры нейтральной соли – это NaCl, KCl, NaNO 3, и т. д.
Читайте также:-
- Почему NaCl является нейтральной солью,
- Почему KCl является нейтральной солью?
- Почему NaNO3 является нейтральной солью?
Амфотерная соль: Эта соль может действовать как кислая, так и основная соль. Или «Амфотерный означает, что соединение обладает способностью действовать как кислота с основанием и как основание с кислотой». Примеры амфотерных солей – NaHCO 3 , HCO 3 – , CH 3 OH и т. д.
д.
Читайте также: –
- Почему NaHCO3 действует не только как основание, но и как кислота?
- Почему HCO3- действует не только как основание, но и как кислота?
- Почему Ch4OH действует не только как основание, но и как кислота?
Хорошо, теперь перейдем к делу Почему Na 2 CO 3 действует как основная соль? Как мы знаем, карбонат натрия образуется, когда NaOH (сильное основание) реагирует с H 2 CO 3 (слабая кислота). Они реагируют друг с другом в молярном соотношении 2:1.
⇒ 2NaOH + H 2 CO 3 → Na 2 CO 3 + 2H 2 O
По представлениям сильных солей соединение со слабой кислотой приводит к образованию сильных солей основной соли.
Природа соли (кислая или основная) зависит от силы компонента в кислотно-щелочной реакции.
- Водный раствор более сильной кислоты и слабого основания приобретет больше свойства кислоты, чем основания.

- Водный раствор более сильного основания и слабой кислоты приобретет больше свойств основания, чем кислоты.
В случае Na 2 CO 3 более сильное основание (NaOH) реагирует с более слабой кислотой (h3CO3), поэтому его водный раствор приобретает скорее свойство основания, чем кислоты.
Следовательно, мы можем сказать, что Na 2 CO 3 является основной солью в природе.
Почему водный раствор Na2CO3 становится основным?Водный раствор, имеющий значение pH более 7, называется основным водным раствором.
При растворении карбоната натрия в воде он диссоциирует на два иона Na + и CO 3 2- .
⇒ Na 2 CO 3 → 2Na + + CO 3 2-
Na + представляет собой катион сильного основания (NaOH), поэтому он не подвергается гидролизу в воде и не влияет на рН раствора. Но CO 3 2- – это анион слабой кислоты , который подвергается гидролизу в воде с образованием ионов бикарбоната (HCO 3 – ), оставляя ионы OH – , которые делают раствор щелочным.
Но CO 3 2- – это анион слабой кислоты , который подвергается гидролизу в воде с образованием ионов бикарбоната (HCO 3 – ), оставляя ионы OH – , которые делают раствор щелочным.
⇒ CO 3 2- + H 2 O → HCO 3 – + OH –
Ион бикарбоната (HCO 3 – ) остается в основном неионизированным в растворе, следовательно, конечный раствор содержит больше 8 OH 9014 ион.
Следовательно, при наличии в водном растворе дополнительных ионов OH – раствор карбоната натрия (Na 2 CO 3 ) приобретает основной характер.
Примечание: Природа водного раствора зависит от H + и ионы ОН – . Когда в водном растворе присутствует больше ионов ОН – , то раствор становится основным, а когда в водном растворе присутствует больше ионов Н + , раствор становится кислым.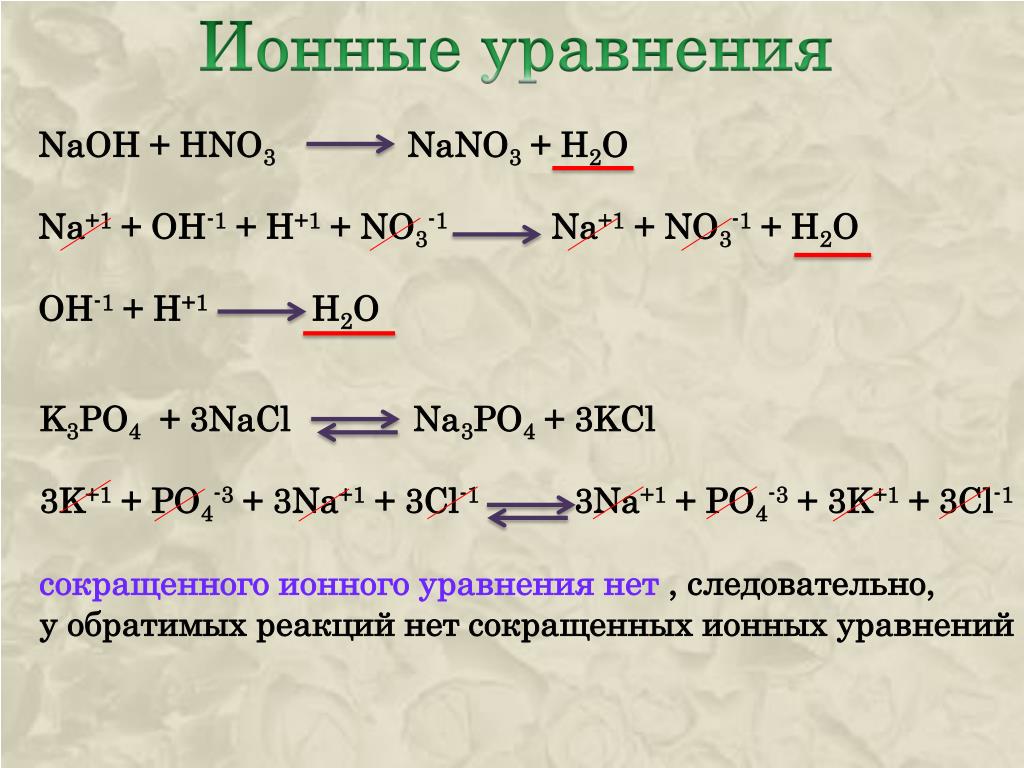
Также, когда количество ионов H + и OH – одинаково в водном растворе, то говорят, что раствор нейтрален.
Почему Na2CO3 не является кислой или нейтральной солью?Нейтральная соль означает, что при растворении в воде не проявляются кислотные или щелочные свойства, а кислая соль означает, что она обладает более сильными кислотными свойствами при растворении в водном растворе со значением pH менее 7,
Важная концепция кислотно-основной силы –
- Более сильное основание + более слабая кислота образуют основной водный раствор из-за присутствия большего количества ионов ОН – . (OH – > H + )
- Более сильная кислота + более слабое основание образует кислый водный раствор из-за присутствия большего количества ионов H + . (H + > OH – )
- Более сильная/более слабая кислота + Более сильное/более слабое основание образует нейтральный водный раствор из-за присутствия того же количества OH – и Н + в растворе.
 (H + = OH – )
(H + = OH – )
Итак, Почему карбонат натрия не является кислой или нейтральной солью в природе? Это связано с тем, что когда Na 2 CO 3 растворяется в водном растворе, он диссоциирует на катион 2Na + и анион CO 3 2-. Катион (Na + ) бесполезен, так как не вступает в химическую реакцию из-за своей очень слабой природы.
Тогда как анион (CO 3 2- ) реагирует с H + и образует соответствующую кислоту (HCO 3 – ), оставляя в растворе ионы OH – .
⇒ CO 3 2- + H + OH — → HCO 3 — + OH —
SO, Aqueous of NA —
. большое количество ионов ОН – за счет гидролиза СО 3 2- ионы.
Как показано на рисунке, водный раствор Na 2 CO 3 содержит большее количество ионов OH – , чем ионов H + , это приводит к увеличению рН раствора , в результате чего Na 2 CO 3 становится щелочным.
Следовательно, Na 2 CO 3 не является кислой или нейтральной солью из-за присутствия большего количества ионов OH – , что убедительно указывает на то, что она будет сохранять природу основания.
Примечание: Карбонат натрия (Na 2 CO 3 ) не является основанием, это основная соль, и ее водный раствор имеет щелочную природу.
Na2CO3 считается сильным или слабым (кислая или основная соль)?Читайте также: –
- Является ли NaBr кислой, основной или нейтральной солью?
- Является ли KBr кислой, основной или нейтральной солью?
- Является ли KNO3 кислой, основной или нейтральной солью?
Карбонат натрия не является ни кислотным, ни основным, это соль, состоящая из сильного основания и слабой кислоты. Сильные основания полностью диссоциируют в растворе и выделяют большое количество ионов OH –, но слабая кислота в основном остается недиссоциированной и выделяет меньше ионов H + .
Следовательно, при наличии в водном растворе Na 2 CO 3 большего количества ионов ОН – мы можем считать его сильноосновной солью.
Понятие кислой соли и основной соли:-
⇒ Сильное основание + Слабая кислота = Основная соль (∴ OH – ионов > H + ионов)
⇒ Более сильная кислота + Слабое основание = Кислая соль
Применение карбоната натрияТакже проверьте:
- Как определить, слабая это кислота или сильная?
- Как определить, является ли что-то кислой, щелочной или нейтральной солью?
- Карбонат натрия используется для изготовления стекла и бумаги.
- Используется для устранения постоянной и временной жесткости воды или, можно сказать, для смягчения воды.
- Применяется в домашнем хозяйстве как очищающее средство для стирки белья.

- Используется для регулирования кислотности и поддержания щелочных условий в различных химических процессах.
- Карбонат натрия также используется в медицине для лечения стригущего лишая, очищения кожи и лечения экземы.
- Используется в качестве пенообразователя в зубной пасте и в качестве смачивающего агента в кирпичной промышленности.
- Имеет октаэдрическую координатную геометрию.
- Температура кипения 1600 °C и температура плавления 851 °C.
- Он предпочтительнее гидроксида натрия из-за его неагрессивной природы.
- Растворим в воде и глицерине, но нерастворим в ацетоне, спирте и т. д.
- Значение кислотности (pKa) карбоната натрия составляет 10,33.
Карбонат натрия является одним из распространенных соединений, которые мы используем в нашем доме для таких целей, как стирка одежды, также известный как стиральная сода или кальцинированная сода. С ним безопаснее обращаться, поэтому его предпочитают гидроксиду натрия в различных химических процессах. Наконец, мы рассмотрим эту статью на тему «Является ли Na 2 CO 3 кислотой, основанием или нейтральной солью?»
С ним безопаснее обращаться, поэтому его предпочитают гидроксиду натрия в различных химических процессах. Наконец, мы рассмотрим эту статью на тему «Является ли Na 2 CO 3 кислотой, основанием или нейтральной солью?»
- Является ли карбонат натрия (Na 2 CO 3 ) кислой или основной солью? Na 2 CO 3 представляет собой основную соль со значением pH, близким к 11, полученную путем нейтрализации сильного основания (NaOH) слабой кислотой (H 2 CO 3 ).
- Водный раствор карбоната натрия (Na 2 CO 3 ) является основным по своей природе из-за большего количества гидроксид-ионов, образующихся в результате гидролиза карбонат-ионов (CO 3 2- + H
7 2
0 O → HCO 3 – + OH – )
. - Присутствие меньшего количества ионов водорода и большего количества ионов OH – повышает уровень pH раствора Na 2 CO 3 .

Вишал Гоял
Добро пожаловать в Topblogtenz, меня зовут Вишал Гоял. Я инженер, блоггер и основатель topblogtenz.com. Я фанат науки со страстью к наукам о жизни и химии. Будучи репетитором по химии, я знаю, как сложно учиться самостоятельно, поэтому я создала сайт, где вы можете найти помощь в первую очередь.
Поделись…
НАТРИЯ ГИДРОКСИД — wtinternational
Гидроксид натрия NaOH (также известный как едкий натр) — основное вещество, расплывающееся на воздухе, из которого он поглощает углекислый газ, превращаясь в NaHCO3 и Na2CO3. При температуре окружающей среды он не разъедает ни резину, ни синтетические смолы, но разъедает такие металлы, как алюминий, олово, цинк и свинец. Разрушает органические, животные и растительные ткани.
Подготовка.
Сода едкая получается двумя способами:
1) Реакцией карбоната натрия с гидроксидом кальция
2) Электролизом водных растворов хлорида натрия
Реакцией карбоната натрия с гидроксидом кальция.
Эта равновесная реакция называется карбонатным каузированием и выглядит следующим образом: при низкой концентрации карбоната натрия: с 10% растворами Na2CO3 выход 97%, а для 16%-ных растворов выход падает до 91%. Реакцию проводят, вводя раствор карбоната натрия и оксида кальция в котлы каскадной схемы, снабженные мешалкой и рубашкой для парового нагрева. Оксид кальция взаимодействует с водой по экзотермической реакции:
CaO + h3O = Ca(OH) 2
Раствор поступает в декантеры, где образующийся нерастворимый карбонат кальция отделяется декантацией, а затем фильтрованием. На этом этапе получается 10% раствор. Испарители используются для получения более высокой концентрации, так как часть воды испаряется, что приводит к концентрации до 50%. Для получения 98% едкого натра, концентрирование проводят в специальных чугунных котлах и при повышении температуры до 300°С удаляют расплав и стекают в формы, в которых он затвердевает. Однако полученный продукт является нечистым, и в случае, когда требуется продукт высокой чистоты, едкий натр растворяют в этиловом спирте, растворителе, в котором обычно содержатся примеси (карбонат натрия, оксиды железа, кремнезем и т. нерастворимы. Из раствора выпаривают спирт, остаток плавят и вливают в чистый едкий натр.
нерастворимы. Из раствора выпаривают спирт, остаток плавят и вливают в чистый едкий натр.
Электролиз водных растворов хлорида натрия.
В электролитическом процессе электрический ток проходит через раствор хлорида натрия в специальные электролизеры. Хлорид натрия, разлагающийся потоком, образует 10-12% раствор NaOH с выделением h3 на катоде из железа и Cl2 на графит-аноде по реакции:
2 NaCl + 2 h3O → h3 + Cl2 + 2 NaOH
Реакция 2 h3O → 2 OH– + h3 происходит на катоде
По мере увеличения концентрации ионов OH- вокруг катода они движутся к аноду, где реагируют с Cl2, образуя гипохлориты:
Cl2 + 2 OH– → ClO– + Cl– + h3O
Из-за потери хлора и каустической соды диффузию образующихся веществ избегают за счет использования пористых или колоколообразных цементных диафрагм, в которых разделение двух жидкостей достигается за счет разности плотностей самого плотного катодного раствора ( NaOH) и анодный раствор.


 (H + = OH – )
(H + = OH – )
