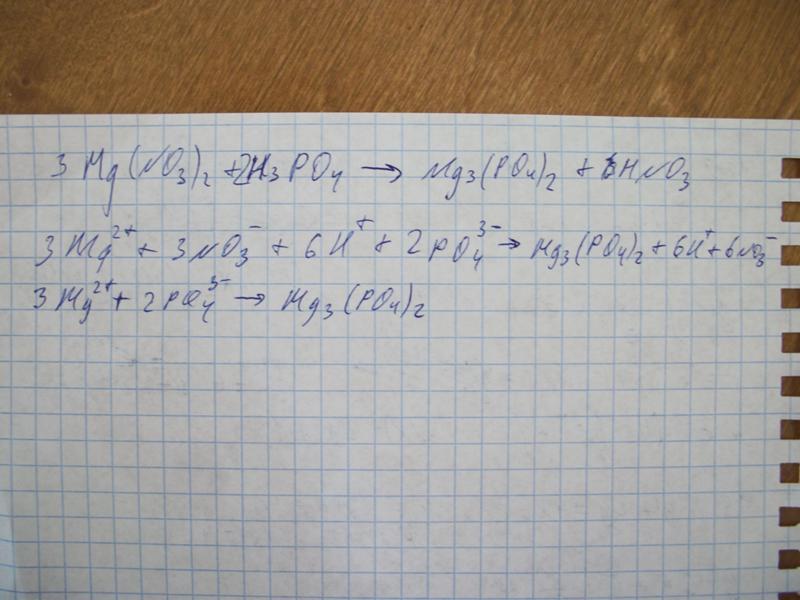= | Сбалансированное уравнение химической реакции
| Поиск |
Результаты поиска по химическому уравнению
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
121139000000-download. jpg» substance-weight=»18.01528 ± 0.00044″> H 2 O jpg» substance-weight=»18.01528 ± 0.00044″> H 2 O | + | 2KH 2 PO 4 | |||||||
| карбонат калия | Сонак; Фосфорная кислота; ортофосфорная кислота; Фосфорная кислота водород | вода | диоксид углерода | дигидрофосфат калия; Дигидрокалиевая соль фосфорной кислоты; ЭКС-Продувка; Нутрол; Дифосфат калия | |||||
| (dư) | |||||||||
| 1 | 2 | 1 | 1 | 2 | Hệ số | ||||
| Нгуен-Фантохой (г/моль) | |||||||||
| Số mol | |||||||||
| Khối lượng (g) |
Реклама
Дополнительная информация об уравнении K
2 CO 3 + 2H 3 PO 4 → H 2 O + CO 2 + 2KH 2 PO 4 2 PO 4 9 2 PO 40043 + 2KH 2 PO 40043 + 2KH 2 PO 40043 + 2KH 2 PO 40043 + 2KH 20018 Каковы условия реакции K2CO3 (карбонат калия) реагирует с h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)?Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель.
Как могут происходить реакции с образованием h3O (вода) и CO2 (двуокись углерода) и Kh3PO4 (дигидрофосфат калия; дигидрофосфат калия фосфорной кислоты; EKS-Purge; Nutrol; бифосфат калия)?
Явление после реакции K2CO3 (карбоната калия) с h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта Х3РО4 (Калия дигидрофосфат; Ортофосфорная кислота дигидрофосфат калий; ЭКС-Продувка; Нутрол; Бифосфат калия), появляющийся в конце реакции.
Или если какое-либо из следующих реагентов h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты), исчезающий
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
2 CO 3 + 2H 3 PO 4 → H 2 O + CO 2 + 2KH 2 PO 4
Каковы химические и физические характеристики K2CO3 (карбонат калия)? В каких химических реакциях используется K2CO3 (карбонат калия) в качестве реагента?
Вопросы, связанные с реагентом h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)
Каковы химические и физические характеристики h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)? Каковы химические реакции которые содержат h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты) в качестве реагента?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)? Каковы химические реакции, в результате которых образуется h3O (вода)?
Вопросы, связанные с продуктом CO2 (двуокись углерода)
Каковы химические и физические характеристики CO2 (Sonac, фосфорная кислота, ортофосфорная кислота, водород фосфорной кислоты)? Каковы химические реакции, в которых CO2 (углекислый газ) является продуктом ?
Вопросы, связанные с продуктом Х3РО4 (Дигидрофосфат калия; Дигидрофосфат калия фосфорной кислоты; ЭКС-Очистка; Нутрол; Бифосфат калия)
Каковы химические и физические характеристики Х3ПО4 (Сонак; Фосфорная кислота; Ортофосфорная кислота; Фосфорная кислота водород )?Каковы химические реакции, в которых продуктом является Kh3PO4 (дигидрофосфат калия; дигидрофосфат калия фосфорной кислоты; EKS-Purge; Nutrol; бифосфат калия)?
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1
Дополнительная информация о веществах, которые используют уравнение
Реакция K2CO3 (кали-каконат) реагирует с h4PO4 (аксит фосфорная) с образованием h3O (nước) и Kh3PO4 (кали дигидрофосфат)
Реакция с образованием вещества K2CO3 (кали какконат) (карбонат калия)
2NaOH + 2CH 3 COOK → 2C 2 H 4 + K 2 CO 3 + Na 2 CO 3 2KOH + CH 3 NH 3
Реакция с образованием вещества h4PO4 (аксит фосфорная) (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)
3H 2 O + P 2 O 5 → 2H 3 PO 4 3HCL + AG 3 PO 4 → 3AGCL + H 3 PO
4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 → 3AGCL + H 3 PO 4 . + P → H 2 O + 5NO 2 + H 3 PO 4
+ P → H 2 O + 5NO 2 + H 3 PO 4 Реакция с образованием вещества H3O (NướC) (вода)
2NH 3 + 3PBO → 3H 2 O + N 2 + 3PB 2H 2 S + 3O 2 → 2H 2 O + 2SO O + 2SO 2 2 → 2H 2 .0042 2 (6x-2y)HNO 3 + FexOy → (3x-y)H 2 O + 3x-2yNO 2 + xFe(NO 3 ) 3
3 Реакция, в результате которой образуется вещество CO2 (Cacbon Dioxit) (углекислый газ)
Fe 2 (CO 3 ) 3 + 3H 2 O → 3CO 2 + 2F + PdCl 2 → 2HCl + CO 2 + Pd C + O 2 → CO 2
Реакция с образованием вещества Kh3PO4 (Кали дигидрофосфат) (Дигидрофосфат калия; Дигидрофосфат калия фосфорной кислоты; ЭКС-Продувка; Нутрол; Бифосфат калия)
4H 2
Essentt — Подобранные вручную продукты
Подобранные вручную продукты незаменимы при работе из дома!
Сектор калийных химикатов, экспертиза технологических процессов K-Tech
Компания K-Tech разработала ряд технологий, связанных с производством калийных химикатов с использованием более экономичного сырья, чем те, которые обычно используются в «традиционных» перерабатывающих отраслях. Примеры включают следующее:
Примеры включают следующее:
Производство карбоната калия непосредственно из хлорида калия:
Компания K-Tech разработала технологию производства карбоната калия с использованием непрерывного процесса ионного обмена. Хлорид калия (в том числе «красный» калий сельскохозяйственного качества), известь и диоксид углерода используются в качестве основного сырья, поэтому высокая стоимость, связанная с текущими методами производства карбоната, основанными на использовании гидроксида калия, который производится электролитический процесс, значительно снижается.
В традиционном процессе производства карбоната калия гидроксид калия (КОН), который обычно получают с помощью дорогостоящего электролитического процесса, взаимодействует с диоксидом углерода (СО2) с образованием карбоната калия по следующей реакции:
2 КОН + СО2 → K2CO3 + h3O
Процесс прост; однако эта простота компенсируется необходимостью использования дорогого сырья, а именно КОН.
В процессе K-Tech, который первоначально был описан в патенте США 5449. ,506 Процесс получения карбоната калия, описан метод непрерывного ионного обмена, в котором хлорид калия обрабатывали в процессе ионного обмена с карбонатом аммония для обмена калия на ион аммония с получением раствора карбоната калия и побочного продукта — хлорида аммония. Общая реакция выглядит следующим образом:
,506 Процесс получения карбоната калия, описан метод непрерывного ионного обмена, в котором хлорид калия обрабатывали в процессе ионного обмена с карбонатом аммония для обмена калия на ион аммония с получением раствора карбоната калия и побочного продукта — хлорида аммония. Общая реакция выглядит следующим образом:
2 KCl + (Nh5)2CO3 → K2CO3 + 2 Nh5Cl
Продукт карбоната калия концентрируют до 45% насыщенного раствора, который можно использовать в качестве высокоаналитического, полностью растворимого в воде нерастворимого хлоридная форма поташа (0-0-62). Этот раствор также можно высушить в псевдоожиженном слое с образованием гранулированной твердой формы карбоната калия для различных промышленных применений.
В некоторых регионах хлорид аммония может иметь сельскохозяйственное или другое промышленное значение. Если это не так для конкретного места, то хлорид аммония обрабатывают гашеной известью, чтобы высвободить аммиак для извлечения и повторного использования, а также для получения побочного продукта хлорида кальция. Хлорид кальция можно перерабатывать для получения жидкости; хлопья; и продукты безводного хлорида, которые имеют ряд промышленных применений. Восстановление аммиака происходит следующим образом:
Хлорид кальция можно перерабатывать для получения жидкости; хлопья; и продукты безводного хлорида, которые имеют ряд промышленных применений. Восстановление аммиака происходит следующим образом:
2 Nh5Cl + Ca(OH)2 → 2 Nh5OH + CaCl2
Карбонат аммония производится на месте путем реакции аммиака с двуокисью углерода и водой. Гашеная известь производится путем взаимодействия негашеной извести с водой.
Непрерывное развитие K-Tech привело к дальнейшему совершенствованию технологии и улучшению экономики. По сравнению с традиционной методологией производства карбоната калия затраты, связанные с подходом K-Tech, значительно меньше, особенно если рассматривать использование гидроксида калия в качестве источника K для традиционной технологии.
Тиосульфат калия посредством ионного обмена с использованием соединений серы и промежуточных растворов калия, полученных из
хлорида калия:
Существует множество географических районов, где дефицит серы стал критическим, а также различные культуры, где сера (важное вторичное
питательное вещество для сельскохозяйственных культур) используется в качестве а также калий жизненно важны для оптимального роста. Тиосульфат калия является идеальным материалом для обеспечения высокого уровня серы на каждую единицу калия. Тиосульфат калия обеспечивает около 0,68 единиц растворимой серы на единицу K2O, что примерно вдвое превышает количество, обеспечиваемое сульфатом калия. Кроме того, тиосульфат калия имеет относительно низкий солевой индекс, что делает его привлекательным для культур с определенным уровнем непереносимости соли.
Тиосульфат калия является идеальным материалом для обеспечения высокого уровня серы на каждую единицу калия. Тиосульфат калия обеспечивает около 0,68 единиц растворимой серы на единицу K2O, что примерно вдвое превышает количество, обеспечиваемое сульфатом калия. Кроме того, тиосульфат калия имеет относительно низкий солевой индекс, что делает его привлекательным для культур с определенным уровнем непереносимости соли.
Тиосульфат калия обычно получают путем реакции калиевого материала, такого как гидроксид калия (КОН), с серосодержащими материалами в системе производства тиосульфата. В традиционном подходе KOH может реагировать в реакционной системе с тиосульфатом во многом так же, как аммиак реагирует с соединениями серы с образованием тиосульфата аммония. Технология тиосульфата аммония K-Tech также применима для производства тиосульфата калия с использованием КОН, однако, независимо от технологии производства, использование КОН в качестве исходного сырья является дорогостоящим.
С этой целью компания K-Tech разработала технологию производства тиосульфата калия путем первоначального производства промежуточного химического вещества калия непосредственно из хлорида калия сельскохозяйственного качества (KCl) с помощью запатентованной методики ионного обмена, а затем взаимодействия промежуточного соединения калия с серой и серой. диоксида с образованием тиосульфата калия.
Основным преимуществом технологического подхода K-Tech является то, что тиосульфат калия производится из более дешевого сырья, что обеспечивает более привлекательные экономические показатели для производителя удобрений.
Производство сульфата калия с помощью ионного обмена:
Сульфат калия (K2SO4) имеет множество применений в сельском хозяйстве и промышленности. В сельском хозяйстве это основная форма нехлоридного калия для сельскохозяйственных культур, а также обеспечивает вторичную питательную серу в растворимой форме. Около 95% сульфата калия во всем мире используется в сельском хозяйстве, а остальное используется на промышленных рынках с более высокой степенью чистоты. Его основное промышленное использование — производство гипсовых стеновых плит.
Его основное промышленное использование — производство гипсовых стеновых плит.
Один из современных процессов, используемых для производства сульфата калия, включает применение высокотемпературной реакционной системы, известной как процесс Мангейма, хотя аналогичные методы применялись. В этом процессе хлорид калия реагирует с серной кислотой в реакционной системе с более высокой температурой с образованием сульфата калия и побочного продукта — соляной кислоты (HCl). Эта технология использовалась в различных формах для производства сульфатного материала, и, хотя она работоспособна, она имеет ряд критических проблем, связанных с получением высококачественного материала. Общая реакция, связанная с этим подходом, выглядит следующим образом:
2 KCl + h3SO4 → K2SO4 + 2 HCl
Персонал K-Tech тесно сотрудничал с компаниями, производящими K2SO4, используя этот подход, а также разрабатывая методы очистки полученного HCl. Эксплуатация и контроль этих высокотемпературных реакционных систем могут быть дорогостоящими, и, как и ожидалось, существуют значительные проблемы с капиталом и техническим обслуживанием, связанные с методологией.
Компания K-Tech разработала передовой метод, устраняющий многие сложности, связанные с высокотемпературными системами. Компания K-Tech усовершенствовала технологию ионного обмена для производства сульфата калия с использованием дешевого сырья. В одном из вариантов подхода KCl сельскохозяйственного качества и источник сульфата (из солевых растворов или побочных продуктов) можно использовать для получения продукта сульфата калия промышленного качества с помощью следующей реакции с участием ионного обмена:
2 KCl + X-SO4 → K2SO4 + 2 X-Cl
Вспомогательное средство для ионного обмена (где X — катион соляного раствора)
Полученный раствор в результате реакции с вспомогательным ионным обменом подвергается дальнейшей обработке для извлечения сульфата калия промышленного качества в твердом виде. Побочный продукт X-Cl может быть восстановлен или утилизирован в зависимости от местоположения установки и периферийных технологических систем.
Соединения фосфата калия
Существует ряд соединений фосфата калия, которые находят применение в сельском хозяйстве и промышленности. Среди них монофосфат калия (MKP), дифосфат калия (DKP) и тетрапирофосфат калия (KTPP). Обычно эти соединения изготавливаются с использованием высококачественной фосфорной кислоты, то есть материалов технического или пищевого качества, и гидроксида калия (КОН).
Среди них монофосфат калия (MKP), дифосфат калия (DKP) и тетрапирофосфат калия (KTPP). Обычно эти соединения изготавливаются с использованием высококачественной фосфорной кислоты, то есть материалов технического или пищевого качества, и гидроксида калия (КОН).
Несмотря на то, что основные методы производства продуктов довольно просты, стоимость сырья приводит к высокой стоимости продукта.
Компания K-Tech разработала процесс, в котором можно использовать фосфорную кислоту сельскохозяйственного качества и промежуточный карбонат калия, который производится с использованием технологии K-Tech K2CO3.
Процесс основан на запатентованном подходе к предварительной кислотной обработке и последовательной нейтрализации, при котором загрязняющие вещества, обычно содержащиеся в фос-кислоте, осаждаются и удаляются из раствора в виде смеси удобрений. Полученный раствор фосфата калия дополнительно концентрируют для получения очищенных материалов фосфата калия. КТТП также может быть получен с использованием промежуточного продукта очистки путем дальнейшей термической обработки.