Список уравнений реакций (Страница 70)
Список уравнений реакций (Страница 70) — Химические Уравнения Онлайн! Обратно к введению уравнения- COh3 + K2Cr2O7 + h3SO4 = CO2 + K2SO4 + Cr2(SO4)3 + h3O
- Cu + O = CuO
- P2O5 + KOH = K3PO4 + h3O
- Cl2 + Br = BrCl
- C7h24 + O2 = CO2 + h3O
- Na2S + Cl2 + h3O = HCl + Na2SO4
- K2Cr2O7 + Ch4Ch3OH + h3SO4 = Ch4COH + Cr2(SO4)3 + K2SO4 + h3O
- h3[Hg(Cl)4] + SnCl2 = Hg2Cl2 + SnCl4 + HCl
- KMnO4 + h3SO4 = MnO2 + h3O2 + KSO4
- N2 + h3O + Cr2O3 = (Nh5)2Cr2O7
- Sb + O2 = Sb2O5
- PdCl2 + HNO3 = Pd(NO3)2 + HCl
- KCl + As4O6 + KMnO4 + h3O = K3AsO4 + MnCl2 + HCl
- P4 + h3O + I2 = h4PO4 + HI
- Ch4CHO + K2Cr2O7 + h3SO4 = Ch4COOH + Cr2(SO4)3 + K2SO4 + h3O
- I2 + Ba(OH)2 = BaI2 + Ba(IO3)2 + HI
- Na2Cr2O7 + FeSO4 + h3SO4 = Fe2(SO4)3 + Na2SO4 + h3O + Cr2(SO4)2
- Cl2 + AgNO3 + h3O = AgCl + AgClO3 + HNO3
- FeI2 + Mg = Fe + MgI2
- S2O3:2- + I3:- = S4O6:2- + I:-
- Fe + HNO3 = Fe(NO3)3 + NO + h3O + Nh5NO3
- KNO3 + S = K2SO4 + SO2 + N2
- Ch4CHO + [Ag(Nh4)2]OH = Ch4COOH + Ag + h3O + Nh4
- Al + KC2h4O2 = Al(C2h4O2)3 + K
- N2O + KClO + KOH = KCl + KNO2 + h3O
- MnO2 + Fe(NO3)2 + HNO3 = Fe(NO3)3 + Mn(NO3)2 + h3O
- CrCl3 + NaOH + h3O2 = Na2Cr2O7 + NaCl + h3O
- KNO3 + Fe = Fe2O3 + K2O + N2
- K2Cr2O7 + S8 = SO2 + Cr2O3 + K2O
- KMnO4 + MnO2 + h3SO4 = K2MnO4 + MnSO4 + h3O + K2SO4
- MgBr2 + Cl2 = MgCl2 + Br2
- Al + FeO = Fe + Al2O3
- C2h3O4 + O2 = CO2 + h3O
- NaBr + h4PO4 = Na3PO4 + HBr
- Co(OH)2 + HNO3 = h3O + Co(NO3)2
- CrCl3 + h3S = Cr2S3 + HCl
- Ph4 + N2O = P4h20 + N2 + h3O
- B + KNO3 + KOH = K3BO3 + Nh4 + h3O
- Fe2 + HCl = h3 + FeCl3
- V2(SO4)3 = V2 + (SO4)3
- h3SO4 = H + SO4
- Na2SO4 + Fe = Na + Fe2SO4
- KNO3 + C = K2CO3 + CO2 + N2
- MnCl2 + NaBiO3 = Mn(BiO3)2 + NaCl
- KNO2 + K2Cr2O7 + HCl = KCl + CrCl3 + KNO3 + Cl2 + h3O
- h3O2 + KMnO4 + HCl = KCl + MnCl2 + Cl2 + h3O + O2
- FeS + h3O + O2 = Fe(OH)3 + S
- HIO3 + h3SO3 = h3SO4 + I2 + h3O
- PbS + HNO3 = PbSO4 + NO2 + NO + h3O
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/vOuj6t2Zyeg» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/ElMEic2MJ-U» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
14HCl + K2Cr2O7 + 3SnCl2 = 7h3O + 2KCl + 2CrCl3 + 3SnCl4
| Поиск |
хлороводород + дихромат калия + хлорид двухвалентного олова = вода + хлорид калия + хлорид хрома (iii) + хлорид олова (iv) |
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Oxidation-reduction reaction
| 4609″> 14HCl | + | 063027000000-images.png» substance-weight=»294.1846″> K 2 Cr 2 O 7 | + | 022145000000-tai_xuong.png» substance-weight=»158.3551″> 2CRCL 3 | + | png» substance-weight=»260.5220″> 3SNCL 4 | ||||||||||||||||||
| 9.0082 хлористый водород | Дихромат калия; бихромат калия; Дихромическая кислота дипотассийная соль | Хлорид становота | Вода | 2 ХХОЛОРИЙС 9968 ХХОЛОРИЙС 9966966996696666666666666666666666666666666666666666669. 9008 ХХОЛОРИЙС 9 9000 ХХОЛОРИЙС | 6699669669966996699669968 ххлорид. | |||||||||||||||||||
| (навоз дух) | (Dung Dịch) | (RắN) | (LỏNG) | (RắN) | (Dung Dịch) | (RắN) | 11111111111111111111111111111111111111111111111111. )(da cam) | (trắng) | (không màu) | (trắng) | (tím đỏ) | |||||||||||||
| 14 | 1 | 3 | 7 | 2 | 2 | 3 | Hệ số | |||||||||||||||||
| Нгуен-Фантохой (г/моль) | ||||||||||||||||||||||||
| Số mol | ||||||||||||||||||||||||
| Khối lượng (g) |
Рекламное объявление
Дополнительная информация об уравнении 14HCl + K
2 Cr 2 O 7 + 3SnCl 2 → 7H 2 O + 2KCl + 2CrCl 3 + 3SnCl 4Условия реакции HCl (хлороводород) реагирует с K2Cr2O7 (дихромат калия; бихромат калия; дикалиевая соль nCl)2 хлорид олова) ?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель.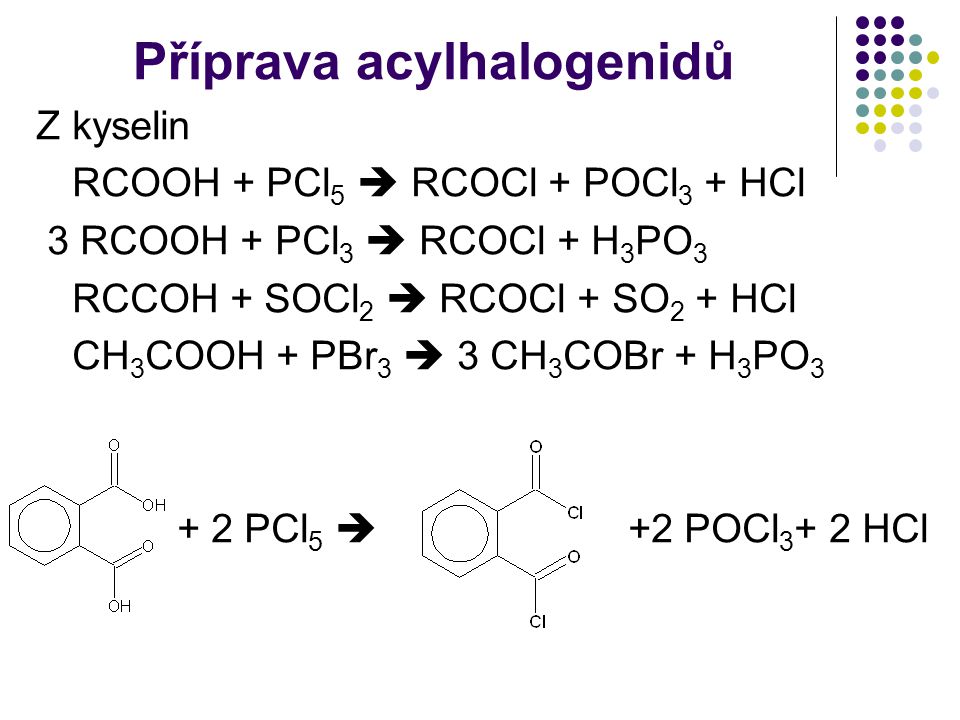 Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием h3O (вода) и KCl (хлорид калия) и CrCl3 (хлорид хрома(iii)) и SnCl4 (хлорид олова(iv)) ?
Олово(II) реагирует с бихроматом калия в кислой среде
В полном предложении вы также можете сказать, что HCl (хлористый водород) реагирует с K2Cr2O7 (дихромат калия; бихромат калия; дикалиевая соль дихромовой кислоты) реагирует с SnCl2 (хлоридом двухвалентного олова) с образованием h3O (воды) и KCl (хлорида калия) и CrCl3. (хлорид хрома(iii)) и SnCl4 (хлорид олова(iv))
Явление после взаимодействия HCl (хлороводород) с K2Cr2O7 (дихромат калия; бихромат калия; дикалиевая соль дихромовой кислоты) с SnCl2 (хлорид олова)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта SnCl4 (хлорид олова(iv)), появляющийся в конце реакции.
Или если какое-либо из следующих реагентов SnCl2 (хлорид олова), исчезающий
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Categories of equation
2 Cr 2 O 7 + 3SnCl 2 → 7H 2 O + 2KCl + 2CrCl 3 + 3SnCl 4
Вопросы, связанные с реагентом HCl (хлористый водород)
Каковы химические и физические характеристики HCl (хлороводород)? В каких химических реакциях используется HCl (хлороводород) в качестве реагента?
Вопросы, связанные с реагентом K2Cr2O7 (дихромат калия; бихромат калия; дикалиевая соль дихромовой кислоты)
Каковы химические и физические характеристики K2Cr2O7 (дихромат калия; бихромат калия; дикалиевая соль дихромовой кислоты)? K2Cr2O7 (дихромат калия; бихромат калия; дикалиевая соль дихромовой кислоты) в качестве реагента?
Вопросы, связанные с реагентом SnCl2 (хлоридом олова)
Каковы химические и физические характеристики SnCl2 (хлорида олова)? Какие химические реакции происходят с SnCl2 (хлоридом олова) в качестве реагента?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (хлорида двухвалентного олова)? Каковы химические реакции, в результате которых образуется h3O (вода)?
Вопросы, связанные с продуктом KCl (хлорид калия)
Каковы химические и физические характеристики KCl (хлорида двухвалентного олова)? В каких химических реакциях образуется KCl (хлорид калия)?
Вопросы, связанные с продуктом CrCl3 (хлорид хрома (iii))
Каковы химические и физические характеристики CrCl3 (хлорида двухвалентного олова)? В каких химических реакциях образуется CrCl3 (хлорид хрома (iii))?
Вопросы, связанные с продуктом SnCl4 (хлорид олова(iv))
Каковы химические и физические характеристики SnCl4 (хлорид олова)? Каковы химические реакции, в которых SnCl4 (хлорид олова(iv)) является продуктом?
Уравнения с HCl в качестве реагента
хлористый водород
2HCl + Zn → H 2 + ZnCl 2 Fe + 2HCl → FeCl 2 + H 2 HCl + NaOH → H 2 O + NaCl Просмотреть все уравнения с HCl в качестве реагента
Уравнения с K2Cr2O7 в качестве реагента
дихромат калия; бихромат калия; Дикалиевая соль дихромовой кислоты
C + 2K 2 Cr 2 O 7 → 2K 2 CO 3 + 2CR 2 O 3 + CO 2 K 2 CR 2 O 7 + S → CR 2 O 7 + S → CR 2 o 8 3 + S → CR 2 9 3 . 2 SO 4 5K 2 CR 2 O 7 + 6P → 5K 2 O + 3P 2 O 5 + 5CR 2 O 3 5 + 5CR 2 O 3 393939 + 5CR 2 O 3 393939393939393939393939393939.
Просмотреть все уравнения с K2Cr2O7 в качестве реагента
2 SO 4 5K 2 CR 2 O 7 + 6P → 5K 2 O + 3P 2 O 5 + 5CR 2 O 3 5 + 5CR 2 O 3 393939 + 5CR 2 O 3 393939393939393939393939393939.
Просмотреть все уравнения с K2Cr2O7 в качестве реагента
Уравнения с SnCl2 в качестве реагента
хлорид олова
14HCl + K 2 Cr 2 O 7 + 3SnCl 2 → 7H 2 O + 2KCl + 2CrCl 3 + 3SnCl 4 Na 2 S + SnCl 2 → 2NaCl + SnS Cl 2 + SnCl 2 → SnCl 4 Просмотреть все уравнения с SnCl2 в качестве реагента
Рекламное объявление
Уравнения с SnCl2 в качестве продукта
хлорид олова
SnCl 2 . 2H 2 O → 2H 2 O + SnCl 2 HCl + Sn → H 2 + SnCl 2 SnCl 4 + Sn → 2SnCl 93 2 Просмотреть все уравнения с SnCl2 в качестве продукта
2H 2 O → 2H 2 O + SnCl 2 HCl + Sn → H 2 + SnCl 2 SnCl 4 + Sn → 2SnCl 93 2 Просмотреть все уравнения с SnCl2 в качестве продукта
Уравнения с SnCl2 в качестве продукта
хлорид олова
SnCl 2 .2H 2 O → 2H 2 O + SnCl 2 HCl + Sn → H 2 + SnCl 2 SnCl 4 + Sn → 2SnCl 2 Просмотреть все уравнения с SnCl2 в качестве продукта
Уравнения с SnCl2 в качестве продукта
хлорид олова
SnCl 2 .2H 2 O → 2H 2 O + SnCl 2 HCl + Sn → H 2 + SnCl 2 SnCl 4 + Sn → 2SnCl 2 Просмотреть все уравнения с SnCl2 в качестве продукта
Уравнения с SnCl2 в качестве продукта
хлорид олова
SnCl 2 .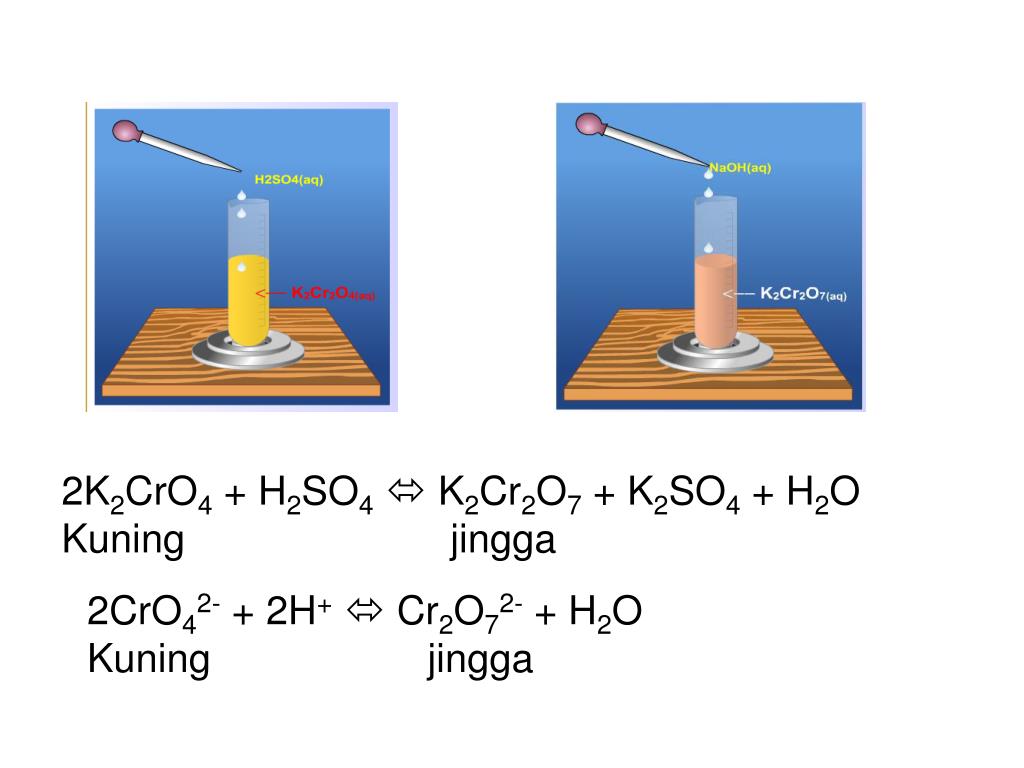 2H 2 O → 2H 2 O + SnCl 2 HCl + Sn → H 2 + SnCl 2 6HCl + 3Sn + C 6 H 5 NO 2 → C 6 H 5 NH 2 + 2H 2 О + 3SnCl 2 Просмотреть все уравнения с SnCl2 в качестве продукта
2H 2 O → 2H 2 O + SnCl 2 HCl + Sn → H 2 + SnCl 2 6HCl + 3Sn + C 6 H 5 NO 2 → C 6 H 5 NH 2 + 2H 2 О + 3SnCl 2 Просмотреть все уравнения с SnCl2 в качестве продукта
hcl+k2cr2o7+sncl2 → h3o+kcl+crcl3+sncl4Tất cả phương trình điều chế từ hcl+k2cr2o7+sncl2 ra h3o+kcl+crcl3+sncl4
9 Тим Ким Пхонг Трин Хоа Хок |
| Тим Ким | Нхом Хок Мьен Пхи Онлайн Facebook | |||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: h3 O2 | ||||
Tổng hợp đầy đủ và chi tiết nhất can bằng phương trình điều chế từ hcl+k2cr2o7+sncl2 ra h3o+kcl+crcl3+sncl4.
 Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học.
Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học. Đề Cương Ôn Thi & Bài Tập Trắc nghiệm
(версия 1.204.214, полная загрузка)
Những Điều Thú Vị Chỉ 5% Ngời Biet
Реклама

 2H 2 O → 2H 2 O + SnCl 2 HCl + Sn → H 2 + SnCl 2 SnCl 4 + Sn → 2SnCl 2
2H 2 O → 2H 2 O + SnCl 2 HCl + Sn → H 2 + SnCl 2 SnCl 4 + Sn → 2SnCl 2 