Ионные уравнения — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Ионные уравнения
Цели урока:
1)Познакомить учащихся с понятием
уравнения и ионные реакции;
ионные
2)рассмотреть случаи, при которых реакции ионного
обмена протекают до конца;
3)продолжить формирование умений составлять
уравнения химических реакций;
4)развивать
познавательный
выполнении теоретических
заданий.
интерес
при
и практических
Ионы
Большинство химических реакций протекает в
растворах. Растворы электролитов содержат
Растворы электролитов содержат
Ионы – это положительно или отрицательно
заряженные
частицы,
в
которые
превращаются атомы или группы атомов в
результате
отдачи
или
присоединения
электронов.
.
Ионные реакции – это реакции между ионами.
Ионные уравнения – это уравнения ионных реакций.
Например:
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ +2 Cl- + h3O + CO2
2K+ + CO32- + 2H+ + 2NO3- =2K+ + 2NO3- + h3O + CO2
.
Реакции ионного обмена записывают
тремя уравнениями:
молекулярное
полное ионное уравнение
сокращенное ионное уравнение
.
Реакции ионного обмена протекают до
конца в тех случаях, когда образуется
ОСАДОК
(МАЛОРАСТВОРИМОЕ
ВЕЩЕСТВО)
ГАЗ
МАЛОДИССОЦИИРУЮЩЕЕ
ВЕЩЕСТВО (ВОДА)
Реакции ионного обмена,
идущие с выделением осадка
Реакции ионного обмена,
идущие с выделением газа
.
Реакции
нейтрализации
–
реакция
взаимодействия сильной кислоты с щелочью.

Это частный случай реакции обмена.
Например: NaOH + HNO3 = NaNO3 + h3O
Na+ + OH- + H+ + NO3- = Na+ + NO3- + h3O
OH- + H+ = h3O
Домашнее задание:
§ 38, упр. 1,2.
14.04.2021.
Решение ионных
уравнений.
Если врезультате реакции выделяется
малодиссоциирующее (мд) вещество –
вода
1. KOH + HCl → KCl + h3O
2. CaO + HNO3 → Ca(NO3)2 + h3O
3. Mg(OH)2 + h3SO4 → MgSO4 + 2h3O
Если врезультате реакции
выделяется нерастворимое в воде
вещество
CuCl2 + KOH→KCl+ Cu(OH)2↓
Al2(SO4)3 + BaCl2 → BaSO4↓ + AlCl3
Если врезультате реакции выделяется
газообразное вещество
K2S + HCl → KCl + h3S↑
Na2CO3 + HNO3 →NaNO3 + h3O + CO2↑
Домашнее задание:
§38, упр.3;
подготовиться к проверочной
работе
Обобщение темы
Тест «Проверь себя»:
1) Ионные реакции – это реакции между:
а) нейтральными атомами б) ионами
г) протонами
2) Реакции нейтрализации – частный случай реакции:
а) обмена
б) замещения
в) соединения г) разложения
3) Какое из приведенных веществ выпадает в осадок:
а) MgS
б) KОН
в) HNO3
г) Na2SO4
.

4) Какое вещество надо добавить к соляной кислоте,
чтобы в результате реакции выделился газ:
а) KOH б) NaOH
в) Na2CO3 г) AgNO3
5) Какое вещество является малодиссоциирующим:
а) h4PO4 б) KOH
в) Na2SO4 г) h3O
Ответы:
1. б
2. а
3. а
4. в
5. г
Список источников
1) Габриелян О.С. Химия. 8 класс: учеб. для
общеобразоват. учрежд. / О.С. Габриелян. – 16
изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.:
ил.
Использованы фотографии:
http://900igr.net/datai/fizika/Tok-v-rastvorakh/0011-001-Skhema-elektroliticheskojdissotsiatsii.gif
ионы хлорид натрия
http://pochit.ru/matematika/71334/index.html
образование малорастворимого вещества
образование газообразного вещества
образование слабого электролита — воды
English Русский Правила
Вариант 1
Главная \ Подготовка к ОГЭ \ Химия \ Разбор вариантов 2017 года \ Вариант 1
Вариант 1
Задание №1.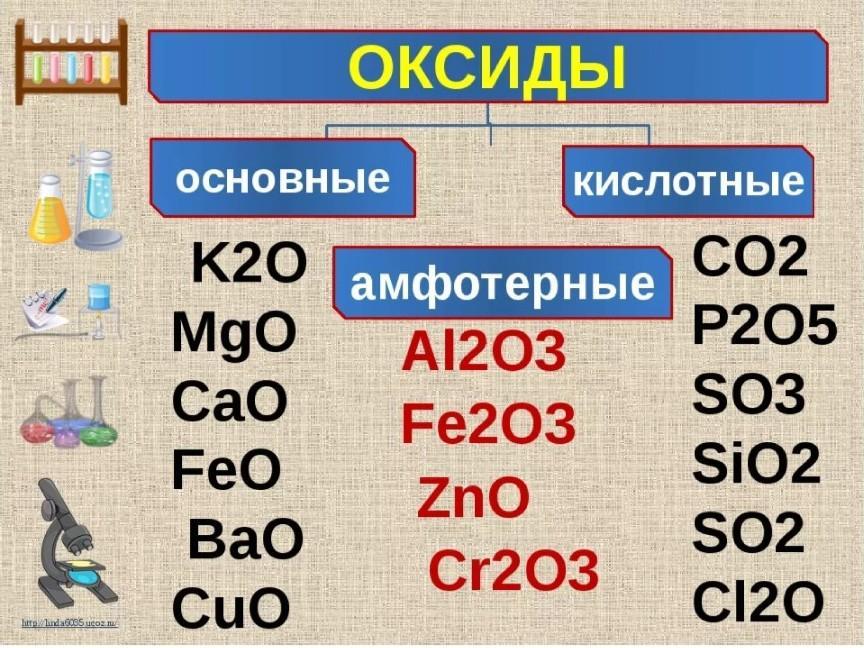
Распределение электронов по электронным слоям 2е, 8е, 8е, 1е соответствует химическому элементу, который в периодической системе находится:
1. В 3-м периоде, IIБ группе
2. Во 2-м периоде, IVБ группе
3. В 4-м периоде, IА группе
4. В 4-м периоде, IIА группе
Объяснение: химический элемент имеет 4 электронных слоя, то есть находится в 4-м периоде. На внешнем слое элемент имеет только один электрон, значит стоит в первой группе 4-го периода. Правильный ответ — 3.
Задание №2.
В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1. Натрий → магний → алюминий
2. Бериллий → магний → алюминий
3. Барий → стронций → кальций
4. Калий → натрий → литий
Объяснение: металлические свойства элементов усиливаются в группе сверху вниз и в периоде справа налево, то есть надо найти последовательность элементов, которые будут соответствовать этой закономерности.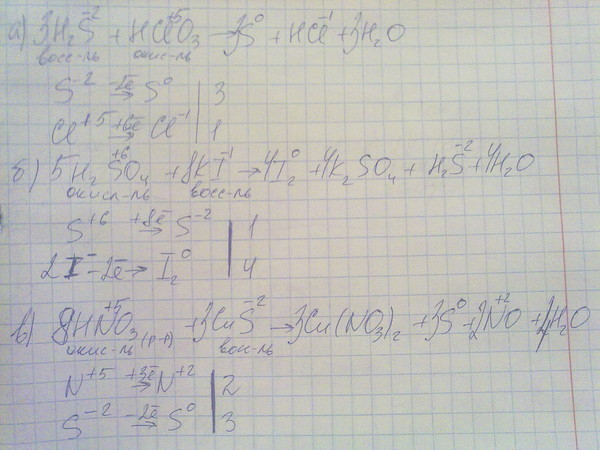 Это — вторая последовательность. Правильный ответ — 2.
Это — вторая последовательность. Правильный ответ — 2.
Задание №3.
Ковалентной полярной связью образовано каждое из веществ, формулы которых:
1. Cl2, N2, O3
2. O2, P4, Nh4
3. SO2, h3S, OF2
4. CO, Ch5, h3
Объяснение: ковалентная полярная связь образуется между двумя разными неметаллами. Рассмотрим вариант 3: сера, кислород, водород и фтор являются неметаллами. Все эти вещества образованы двумя разными неметаллами, что нам подходит. Правильный ответ — 3.
Задание №4.
Валентность неметаллов последовательно увеличивается в ряду водородных соединений, формулы которых:
1. HF → Ch5 → h3O → Nh4
2. Sih5 → Ash4 → h3S → HCl
3. HF → h3O → Nh4 → Ch5
4. Sih5 → h3S → Ash5 → HCl
Объяснение: определим степени окисления всех неметаллов во всех приведенных соединениях водорода.
1. HF(-1) → C(-4)h5 → h3O(-2) → N(-3)h4
2.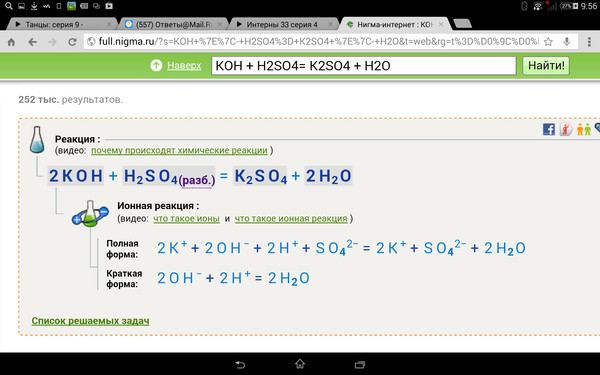 Si(+4)h5 → As(+3)h4 → h3S(-2) → HCl(-1)
Si(+4)h5 → As(+3)h4 → h3S(-2) → HCl(-1)
3. HF(-1) → h3O(-2) → N(-3)h4 → C(-4)h5
4. Si(+4)h5 → h3S(-2) → As(+3)h4 → HCl(-1)
Правильный ответ — 3.
Задание №5.
К солям относится каждое из двух веществ:
1. Fe2(SO4)3 и AlCl3
2. Ba(NO3)2 и h4PO4
3. Li2SO4 и Fe(OH)3
4. ZnS и CaO
Объяснение: соли состоят из катиона металла и аниона кислотного остатка. Соли получаются по реакции нейтрализации, например:
2NaOH + h3SO4 → Na2SO4 + h3O
Поэтому, нам подходит первый вариант ответа: сульфат железа (III) и хлорид алюминия. Правильный ответ — 1.
Задание №6.
К химическим явлениям не относится процесс:
1. Брожение сахара
2. Горение свечи
3. Перегонки воды
4. Горение спирта
Объяснение: химическое явление — такое явление, при котором происходит хотя бы одна химическая реакция. Так, химическая реакция идет при брожении сахара, горении свечи и спирта. Перегонка воды — это дистилляция (нагревание до 100С воды с последующей конденсацией паров). Правильный ответ — 3.
Перегонка воды — это дистилляция (нагревание до 100С воды с последующей конденсацией паров). Правильный ответ — 3.
Задание №7.
Только катионы калия и фосфат-анионы образуются при диссоциации вещества формулы которого?
1. K2HPO4
2. Ca3(PO4)2
3. Kh3PO4
4. K3PO4
Объяснение: образование только катионов калия фосфат-ионов возможно только если в состав молекулы входят эти ионы, то есть подходит только фосфат калия. Проверяем: К3РО4 → К+ + РО4³‾. Правильный ответ — 4.
Задание №8.
Уравнению реакции
Zn(OH)2 + h3SO4 → ZnSO4 + 2h3O
соответствует сокращенное ионное уравнение:
1. Н+ + ОН‾ → Н2О
2. Zn(OH)2 + 2Н+ → Zn²+ + 2h3O
3. Zn²+ + SO4²‾ → ZnSO4
4. Zn²+ + h3SO4 → Zn²+ + SO4²‾ + Н+
Объяснение: гидроксид цинка нерастворим, поэтому и диссоциировать в воде он не будет, поэтому нам подходит только второй вариант. Правильный ответ — 2.
Правильный ответ — 2.
Задание №9.
Верны ли следующие суждения о щелочных металлах?
А. При взаимодействии с галогенами щелочные металлы образуют соли.
Б. С водой щелочные металлы вступают в реакции замещения.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: верны оба суждения.
Докажем это реакциями:
2Na + Cl2 → 2NaCl
2K + 2h3O → 2KOH + h3↑
Правильный ответ — 3.
Задание №10.
Оксид углерода (IV) взаимодействует с каждым из двух веществ:
1. Вода и сернистая кислота
2. Оксид кальция и гидроксид кальция
3. Вода и медь
4. Кислород и оксид магния
Объяснение: СО2 — кислотный оксид, при взаимодействии с водой образует угольную кислоту, с кислотами не взаимодействует (так как в реакцию не вступают два вещества с одинаковыми свойствами), оксислиться кислородом не может, так как углерод находится в высшей степени окисления (+4). То есть СО2 вступает в реакцию с веществами, имеющими основные свойства, то есть оксид кальция и гидроксид калия. Правильный ответ — 2.
То есть СО2 вступает в реакцию с веществами, имеющими основные свойства, то есть оксид кальция и гидроксид калия. Правильный ответ — 2.
Задание №11.
Раствор серной кислоты взаимодействует с каждым из двух веществ:
1. Хлорид бария и оксид углерода (IV)
2. Железо и нитрат бария
3. Карбонат натрия и сероводород
4. Ртуть и гидроксид меди (II)
Объяснение: разбавленная серная кислота вступает в реакцию с металлами, стоящими в ряду напряжений металлов до водорода — это железо, но не ртуть. Кислоты не взаимодействуют с кислотными оксидами (СО2) и другими кислотами (сероводород), вступают в реакцию обмена с солями. если при этом выпадает осадок или выделяется газ. Учитывая все перечисленное выше, запишем химические реакции раствора серной кислоты с веществами из варианта 2:
h3SO4 + Fe → FeSO4 + h3↑
h3SO4 + Ba(NO3)2 → 2HNO3 + BaSO4↓
Правильный ответ — 2.
Задание №12.
Среди веществ: KCl, K2S, K2SO4 — в реакцию с раствором Zn(NO3)2 вступают
1. Только K2S
2. KCl и K2S
3. KCl и K2SO4
4. K2S и K2SO4
Объяснение: соли вступают в реакцию обмена только при образовании осадка или выделении газа.
Напишем соответствующие реакции:
Zn(NO3)2 + 2KCl ≠ 2KNO3 + ZnCl2 (реакция не идет так как оба продукта растворимы)
Zn(NO3)2 + K2S → 2KNO3 + ZnS↓
Zn(NO3)2 + K2SO4 → ZnSO4 + 2KNO3 (реакция не идет так как оба продукта растворимы)
Правильный ответ — 1.
Задание №13.
Верны ли следующие сужения об обращении с газами в процессе лабораторных опытов?
А. Прежде, чем поджечь водород, его необходимо проверить на чистоту.
Б. Полученный из бертолетовой соли хлор нельзя определять по запаху.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Оба суждения неверны
Объяснение: при реакции водорода с кислород получается вода, данная реакция идет со взрывом, перед поджиганием водород нужно проверить на чистоту, чтобы не допустить образование примесей. Ни хлор, ни любой другой газ нельзя определять по запаху. Правильный ответ — 3.
Задание №14.
Окислительные свойства водород проявляет в реакции, уравнение которой
1. CuO + h3 → Cu + h3O
2. h3 + Cl2 → 2HCl
3. Ca + h3 → Cah3
4. 2h3 + O2 → 2h3O
Объяснение: окислительные свойства водород проявляет только в гидридах, где имеет степень окисления -1. Среди продуктов представленных реакций есть один гидрид — гидрид кальция, в этой реакции водород и является окислителем. Правильный ответ — 3.
Задание №15.
Массовая доля натрия в сульфате натрия составляет:
1. 0,32
2. 0,64
3. 0,96
4. 0,48
Объяснение: для нахождения массовой доли натрия в сульфате натрия воспользуемся формулой:
ω = (n x Ar(Na))/Mr(Na2SO4)
n — количество атомов элемента в веществе
Здесь нужно не забыть, что в данной соли два натрия!
Находим:
ω(Na) = 2х23/142 = 0,324
Правильный ответ — 1.
Задание №16.
В ряду химических элементов Al → Si → P
1. Увеличивается заряд ядер атомов
2. Возрастают кислотные свойства образуемых ими гидроксидов
3. Увеличивается число электронных уровней
4. Уменьшается электроотрицательность
5. Возрастает атомный радиус
Объяснение: представленные элементы находятся в третьем периоде, стоят друг за другом и имеют порядковые номера — 13,14,15 соответственно. В периоде увеличивается электроотрицательность (а с ней и неметаллические свойства) и уменьшается радиус, но увеличивается заряд ядер атомов (равен порядковому номеру). Правильный ответ — 12.
Задание №17.
Для метана характерны следующие утверждения
1. В состав молекулы входят два атома углерода
2. Характерны реакции присоединения
3. Не растворяется в воде
4. Обесцвечивает бромную воду
5. Вступает с хлором в реакции замещения
Объяснение: формула метана — СН4, это алкан, то есть он не вступает в реакции присоединения (значит бромную воду не может обесцвечивать как этилен). Но вступает в реакцию замещения с хлором и не растворяется в воде. Правильный ответ — 35.
Но вступает в реакцию замещения с хлором и не растворяется в воде. Правильный ответ — 35.
Задание №18.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
Вещества Реактив
А) Fe и Ag 1. AgNO3(р-р)
Б) CaO и CaCO3 2. Фенолфталеин
В) Nh4(р-р) и Nh5Cl(р-р) 3. Na2SO4
4. HCl
Объяснение: железо и серебро будем различать соляной кислотой, так как с железом она будет реагировать, а с серебром — нет (растворы кислот реагируют с металлами до водорода), соляной кислотой отличим и оксид кальция от карбоната кальция: при реакции с карбонатом кальция выделится углекислый газ. Раствор аммиак имеет щелочную среду, а раствор хлорида аммиака — кислую, что нам покажет индикатор — фенолфталеин. Правильный ответ — 442.
Задание №19.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
Название вещества Реагенты
А) Фтор 1. ZnO, Mg
Б) Соляная кислота 2. Al, h3O
В) Хлорид натрия 3. SiO2, CuO
4. h3SO4(конц), AgNO3(р-р)
Объяснение: фтор реагирует с алюминием с образованием соли и с водой (с образованием фтороводорода и кислорода). Соляная кислота реагирует с оксидом цинка (реакция обмена) и магнием (реакция замещения водорода). Хлорид натрия реагирует с концентрированной серной кислотой и нитратом серебра (качественная реакция на хлорид-ионы). Правильный ответ — 214.
Задание №20.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
CuSO4 + KI → K2SO4 + CuI + I2
Определите окислитель и восстановитель.
Объяснение: CuSO4 + KI → K2SO4 + CuI + I2
В данной реакции меняют степени окисления йод и медь. Запишем электронно-ионный баланс.
Cu(+2) +1e→ Cu(+1) | 2 (окислитель)
2I‾ -2e→ I2° | 1 (восстановитель)
Ставим двойку перед йодидом калия (так как она есть в балансе) и перед медью. Двойку перед йодидом калия поменяем на 4, так как в правой части получилось 4 йода. Уравниваем калий справа и сульфат-ионы, получаем такой результат:
2CuSO4 + 4KI → 2K2SO4 + 2CuI + I2
Задание №21.
К раствору нитрата бария добавили 200 г раствора серной кислоты и получили 9,32 г соли. Какова массовая доля кислоты (в %) в исходном растворе?
Объяснение: запишем уравнение реакции, найдем количество вещества сульфата бария, такое же количество вещества и серной кислоты, найдем массу кислоты (вещества), затем найдем массовую долю.
Ba(NO3)2 + h3SO4 → BaSO4↓ + 2HNO3
n(BaSO4) = 9,32/235 = 0,04 моль
n(h3SO4) = n(BaSO4) = 0,04 моль
m(h3SO4 вещества) = 0,04 x 98 = 3,92 г
ω(h3SO4) = 3,92/200 x 100% = 1,96%
Ответ: массовая доля кислоты в исходном растворе равна 1,96%.
Задание №22.
Даны вещества: CuCl2, h3SO4(), Fe, Na2O, KOH, Na2SO4. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа (II). Опишите признаки проведения реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Объяснение: есть несколько способов получить нужное вещество. Приведем один из них.
Fe + CuCl2 → FeCl2 + Cu
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
= | Сбалансированное уравнение химической реакции
| Поиск |
Результаты поиска по химическому уравнению
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| + | |||||||
| 1 | 1 | 1 | 1 | Хо Со | |||
| Nguyên — Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g ) |
Реклама
Дополнительная информация об уравнении H
2 SO 4 + K 2 S → H 2 S + K 2 SO 4Каковы условия реакции H3SO4 (серная кислота) с K2S (сульфид калия)?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием h3S (сероводород) и K2SO4 (сульфат калия)?
Явление после реакции h3SO4 (серная кислота) с K2S (сульфид калия)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта K2SO4 (сульфат калия), появляющийся в конце реакции.
Или если какое-либо из следующих реагентов K2S (сульфид калия), исчезающий
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Другие вопросы, связанные с химическими реакциями H
2 SO 4 + K 2 S → H 2 S + K 2 SO 4Вопросы, связанные с реагентом h3SO4 (серная кислота)
Каковы химические и физические характеристики h3SO4 (серная кислота)? В каких химических реакциях используется h3SO4 (серная кислота) в качестве реагента?
Вопросы, связанные с реагентом K2S (сульфид калия)
Каковы химические и физические характеристики K2S (сульфид калия)? В каких химических реакциях используется K2S (сульфид калия) в качестве реагента?
Вопросы, связанные с продуктом h3S (сероводород)
Каковы химические и физические характеристики h3S (сульфида калия)? Каковы химические реакции, в результате которых образуется h3S (сероводород)?
Вопросы, связанные с продуктом K2SO4 (сульфат калия)
Каковы химические и физические характеристики K2SO4 (сульфид калия)? Какие химические реакции происходят с K2SO4 (сульфатом калия) в качестве продукта?
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1
Дополнительная информация о веществах, которые используют уравнение
Реакция h3SO4 (аксит серная) реакция с K2S (калий серная) с образованием h3S (гидро серная)
Реакция с образованием вещества h3SO4 (axit sulfuric) (sulfuric acid)
2H 2 O + 2KMnO 4 + 5SO 2 → 2H 2 SO 4 + 2MnSO 4 + K 2 SO 4 24HNO 3 + FeCuS 2 → Cu(NO 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 18NO 2 + Fe(NO 3 ) 3 2H 2 O + 2ZnSO 4 → 2H 2 SO 4 + O 2 + 2Zn
Реакция с образованием вещества K2S (сульфид калия) (сульфид калия)
3C + 2KNO 3 + S → K 2 S + N 2 + 3CO 2 3C + 2KNO 3 + S → K 2 S + N 2
 h3S (гидросульфуа) (сероводород)
h3S (гидросульфуа) (сероводород)H 2 + S → H 2 S FeS + 2HCl → FeCl 2 + H 2 S 2H 2 → 3 90 2 9043 OH + 5 + SO 2
Реакция с образованием вещества K2SO4 (солнечный жир калия) (сульфат калия)
2H 2 O + 2K + CUSO 4 → CU (OH) 2 + H 2 + K 2 SO 4 10FEO + 18H 2 SO 4 + 2K + 18H 2 SO 4 + 2K.
→ 5Fe 2 (SO 4 ) 3 + 18H 2 O + 2MnSO 4 + K 2 SO 4 2H 2 O + 2KMnO 4 + 5SO 2 → 2H 2 SO 4 + 2MnSO 4 + K 2 SO 4Essentt — Товары, подобранные вручную
Продукты, подобранные вручную, необходимые при работе из дома!
Potassium Sulfide Facts, Formula, Properties, Uses
- Potassium Sulfide Identification
- Composition and Synthesis
- Properties and Characteristics of Potassium Sulfide
- Prominent Reactions of K2S
- Potassium Sulfide Uses
- Is It Dangerous
Potassium сульфид, представленный химической формулой K 2 S представляет собой соединение калия и серы, умеренно растворимое в кислотах [1] . Он расплывается и может самовозгораться на воздухе. Это восстановитель и ионное соединение [4] .
Он расплывается и может самовозгораться на воздухе. Это восстановитель и ионное соединение [4] .
Сульфид калия
Идентификация сульфида калия | |
| Номер CAS | 1312-73-8 [1] |
| Идентификационный номер PubChem | 20072150 [3] |
| Идентификатор ChemSpider | 142491 [2] |
| Номер ЕС | 215-197-0 [1] |
Состав и синтез
Сульфид калия можно получить, сначала обрабатывая гидроксид калия до избытка сероводорода с образованием гидросульфида калия (KHS). Дальнейшая обработка KHS таким же количеством гидроксида калия приводит к образованию сульфида калия 9.0449 [9] .
KOH + H 2 S = KHS + H 2 O
KHS + KOH = K 2 S + H 2 O
Формула 3
.

Общие свойства
Физические свойства
Химические свойства
Атомные свойства
Структура сульфида калия
Точечная структура Льюиса для сульфида калия
Известные реакции K
2 S Сульфид калия реагирует с бромидом кобальта iii с образованием сульфида кобальта iii и бромида калия [10] .
3K 2 S + 2CoBr 3 = Co 2 S 3 + 6KBr
Сульфид калия реагирует с разбавленной соляной кислотой с образованием хлорида калия и сероводорода [4,94 90]
K 2 S + 2HCl = 2 KCl + H 2 S
Реагирует с концентрированной серной кислотой с образованием бисульфата калия, диоксида серы, серы и воды [13]
K 2 + 903H43 2 SO 4 = 2KHSO 4 + SO 2 + S + 2H 2 0
Соединение реагирует с нитратом серебра с образованием осадка водного нитрата калия и сульфида серебра 1904 [5,9].
К 2 S + 2AgNO 3 = 2KNO 3 + Ag 2 S
Калий сульфид Применение
- В пиротехнике [7] .
- В качестве реагента в аналитической химии [4] .
- Как средство для депиляции и лекарство [4] .
Is It Dangerous
Может вызвать пожар, поэтому необходимо принять меры предосторожности, чтобы не допустить его контакта с воздухом.
