Соли. Получение и свойства
Соли — это сложные вещества, которые диссоциируют, образуя катионы металла (или Nh5+) и анионы кислотного остатка. Кислые соли при диссоциации дают дополнительно ионы H+, а основные соли — ионы гидроксила OH-. Среди солей выделяют двойные, смешанные и комплексные.
Получение
1. Взаимодействием металлов и металло-неметаллов с неметаллами:
2Na + Cl2 = 2NaCl,
2Al + 3Cl2 = 2AlCl3.
2. Взаимодействием неметаллов с другими солями:
2KI + Br2 = 2KBr + I2Ї, 2KBrO3 + I2 = 2KIO3 + Br2.
3. Вытеснением более активным металлом более поссивного из его соли:
CuSO4 + Fe = FeSO4 + Cu.
4. Взаимодействием основных, амфотерных и кислотных оксидов:
Li2O + ZnO = Li2ZnO2,
CaO + SiO2 = CaSiO3,
Al2O3 + 3SO3 = Al2(SO4)3.
5. Взаимодействием основных, амфотерных и кислотных оксидов с основными, амфотерными и кислотными гидроксидами:
2LiOH + ZnO = Li2ZnO2 + 2h3O,
Ca(OH)2 + CO2 = CaCO3 + h3O,
Al2O3 + 3h3SO4 = Al2(SO4)3 + 3h3O.
6. Взаимодействием основных, амфотерных гидрооксидов с кислотами:
Al(OH)3 + KOH = K[Al(OH)4],
Cu(OH)2 + h3SO4 = CuSO4 + 2h3O,
Zn(OH)2 + 2HBr = ZnBr2 + 2h3O.
7. Путем обменных реакций основных, амфотерных гидрооксидов, кислот и солей с солями:
Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH,
Ca(OH)2 + Ca(HCO3)2 = 2CaCO3 + 2h3O,
KOH + AlCl3 = Al(OH)Cl2 + KCl,
h3SO4 + Ba(NO3)2 = BaSO4+ 2HNO3,
HCl + Mg(OH)Cl = MgCl2 + h3O,
Ca3(PO4)2 + 4h4PO4 = 3Ca(h3PO4)2,
FeCl3 + 3 KSCN = Fe(SCN)3 + 3KCl.
8. Термическим разложением солей:
2KClO3 = 2KCl + 3O2,
2NaNO3 = 2NaNO2 + O2.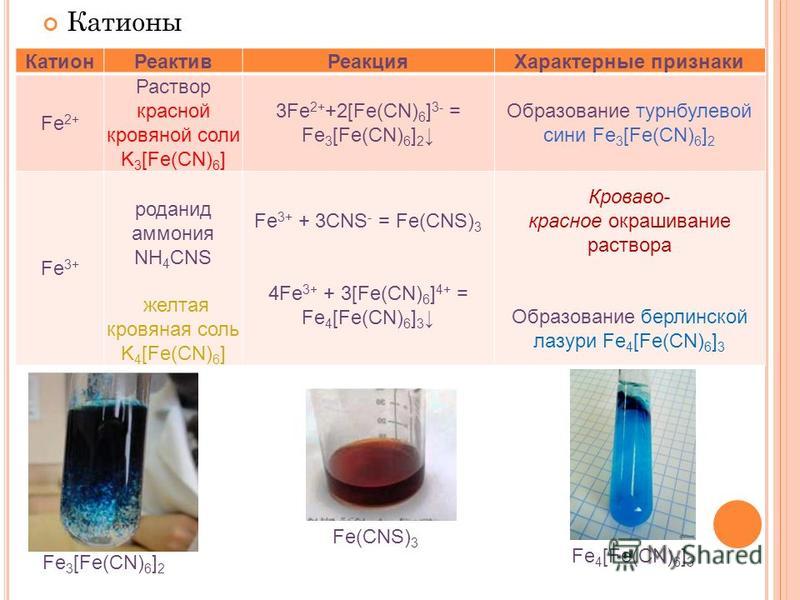
Свойства
1. Диссоциируют в растворах или расплавах:
2. Способны подвергаться гидролизу (кроме солей, образованных одновременно сильными одноосновными кислотами и щелочными металлами):
3. Могут взаимодействовать с основными и амфотерными гидроксидами, кислотами и солями, вступая в реакции обмена (смотри выше: пункт 7).
4. Способны вступать в многочисленные окислительно-восстановительные реакции, реакции диспропорционирования:
3KClO = KClO3 + 2KCl,
2FeCl3 + h3S = S + 2FeCl2 + 2HCl.
Как пример реакций получения комплексных солей рассмотрим образование и использование красной и желтой кровяной соли:
FeCl2 + 6KCN = 2KCl + K4[Fe(CN)6] ,
FeCl3 + 6KCN = 3KCl + K3[Fe(CN)6] ,
3 FeCl2 + 2 K3[Fe(CN)6] = 6KCl + Fe3[Fe(CN)6]2,
4 FeCl3 + 3 K4[Fe(CN)6] =
12KCl + Fe4[Fe(CN)6]3.
K4[Fe(CN)6] — гексоцианоферрат (II) калия или желтая кровяная соль,
K3[Fe(CN)6] — гексоцианоферрат (III) калия или красная кровяная соль,
Fe3[Fe(CN)6]2 — гексоцианоферрат (III) железа (II) или турнбулева синь,
Fe4[Fe(CN)6]3 — гексоцианоферрат (II) железа (III) или берлинская лазурь.
Примером двойной соли могут служить алюмокалиевые квасцы KAl(SO4)2 — здесь два разных катиона и один анион:
Примером смешанной соли является хлорная известь Ca(OCl)Cl. При ее диссоциации образуется один катион Ca2+ и два аниона Cl- и OCl-.
Гексацианоферрат(II) калия
[5].
Токсичность
Нейтральное вещество, поскольку анион (см. выше) не разлагается в воде и внутри человеческого организма. Летальная доза (LD50) для крыс при приёме перорально составляет 6400 мг/кг[6]. 4- -> Cu2[Fe(CN)6]v}}}
4- -> Cu2[Fe(CN)6]v}}}
Может использоваться для получения синильной кислоты:
- K4[Fe(CN)6]+2h3SO4⟶h5[Fe(CN)6]+2K2SO4{\displaystyle {\ce {K4[Fe(CN)6] + 2h3SO4 -> h5[Fe(CN)6] + 2K2SO4}}}
- 3h5[Fe(CN)6]⟶Fe3C+5C+3N2+12HCN{\displaystyle {\ce {3h5[Fe(CN)6] -> Fe3C + 5C + 3N2 + 12HCN}}}
Мнемоническое правило
Для того, чтобы запомнить формулу жёлтой кровяной соли K4[Fe(CN)6]{\displaystyle {\ce {K4[Fe(CN)6]}}}
и не спутать её с красной кровяной сольюK3[Fe(CN)6],{\displaystyle {\ce {K3[Fe(CN)6],}}}
существуют мнемонические правила:
- Число атомов калия соответствует числу букв в английских названиях солей: «gold» — 4 буквы, то есть 4 атома калия — жёлтая кровяная соль K4[Fe(CN)6]{\displaystyle {\ce {K4[Fe(CN)6]}}}
. «Red» — 3 буквы, то есть 3 атома калия — красная кровяная соль — K3[Fe(CN)6]{\displaystyle {\ce {K3[Fe(CN)6]}}}
.

- «Калий три — будет красный». Мнемоника построена на игре слов: «три» (число) и «три» (повелительное наклонение глагола «тереть»). Как известно при потирании, например, кожи, последняя краснеет.
- ↑ 1 2 Желтая или кровещелочная соль // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ 1 2 3 4 5 6 Некрасов Б.В. Основы общей химии. — М., 1973. — Т. 2. — С. 360.
- ↑ 1 2 3 Тананаев, 1971, с. 38-39.
- ↑ Тананаев, 1971, с. 5.
- ↑ Ф. Файгль, В.Ангер. Капельный анализ неорганических веществ. — 1976. — Т. 1. — С. 242.
- ↑ POTASSIUM FERROCYANIDE (неопр.
 ). hazard.com. Дата обращения: 16 января 2016.
). hazard.com. Дата обращения: 16 января 2016. - ↑ Аналитические методы определения цинка
- Тананаев И.В. и др. Химия ферроцианидов. — М., 1971.
Примечания
Литература
Гексацианоферрат, калия, Гексацианоферра, ка, лия, железистосинеро, дистый, ка, лий, ферроциани, ка, лия, гексацианоферроа, ка, лия, жёлтая, кровяная, соль, неорганическое, соединение, из, группы, гексацианоферратов, комплексная, соль, состава, displaystyle, с. Geksacianoferra t II ka liya zhelezistosinero distyj ka lij ferrociani d ka liya geksacianoferroa t ka liya zhyoltaya krovyanaya sol neorganicheskoe soedinenie iz gruppy geksacianoferratov kompleksnaya sol sostava K 4 Fe CN 6 displaystyle ce K4 Fe CN 6 soderzhashaya v anione dvuhvalentnoe zhelezo vydelyayushayasya iz vodnogo rastvora v vide kristallogidrata K 4 Fe CN 6 3 H 2 O displaystyle ce K4 Fe CN 6 3h3O Geksacianoferrat II kaliyaObshieSistematicheskoenaimenovanie Geksacianoferrat II kaliyaHim formula C6N6FeK4Rac formula K4 Fe CN 6 Fizicheskie svojstvaSostoyanie bezvodnyj bescvetnye kristally trigidrat bledno zhyoltye kristallyMolyarnaya massa 368 35 g molPlotnost trigidrata 1 85 g sm Termicheskie svojstvaTemperatura plavleniya 69 71 C razlozheniya 650 CKlassifikaciyaReg nomer CAS 13943 58 3PubChem 9605257Reg nomer EINECS 237 722 2SMILES C N C N C N C N C N C N K K K K Fe 2 C N C N C N C N C N C N Fe 4 K K K K InChI InChI 1S 6CN Fe 4K c6 1 2 q6 1 2 4 1 InChI 1S 6CN Fe 4K c6 1 2 q 4 4 1XOGGUFAVLNCTRS UHFFFAOYSA N OCPOWIWGGAATRP UHFFFAOYSA NKodeks Alimentarius E536ChEBI 30059ChemSpider 20162028BezopasnostKratkie harakter opasnosti H h512 EUH032Mery predostor P P273 P260NFPA 704 010Privedeny dannye dlya standartnyh uslovij 25 C 100 kPa esli ne ukazano inoe Mediafajly na Vikisklade Soderzhanie 1 Istoriya otkrytiya 2 Nazvaniya 3 Poluchenie 4 Fizicheskie i himicheskie svojstva 5 Toksichnost 6 Primenenie 7 Mnemonicheskoe pravilo 8 Primechaniya 9 LiteraturaIstoriya otkrytiya PravitV 1752 godu Maker en obnaruzhil chto pri kipyachenii berlinskoj lazuri s rastvorom shyolochi edkogo kali sinij cvet eyo ischezaet a v rastvor perehodit zheltoe veshestvo Issledovaniya Bertolle 1787 Gej Lyussaka i Berceliusa 1819 pokazali chto veshestvo eto soderzhit kalij zhelezo II i ostatok sinilnoj kisloty snachala ego prinimali za dvojnuyu sol Vposledstvii usiliyami Gmelina Gej Lyussaka i Libiha vyyasnilos chto eto kalievaya sol zhelezistosinerodistoj kisloty 1 Nazvaniya PravitPomimo zhyoltoj krovyanoj soli v ESBE otmecheny takzhe sleduyushie trivialnye nazvaniya 1 zhyoltoe sin kali zhyoltaya sol kroveshelochnaya sol Nazvanie zhyoltaya krovyanaya sol poyavilos iz za togo chto ranshe eyo poluchali prokalivaniem othodov boen soderzhashih krov s potashom i zheleznymi opilkami Eto a takzhe zhyoltyj cvet kristallov obuslovili nazvanie soedineniya 2 Poluchenie PravitV nastoyashee vremya v promyshlennosti poluchayut iz otrabotannoj massy posle ochistki gazov na gazovyh zavodah soderzhit cianistye soedineniya etu massu obrabatyvayut suspenziej Ca OH 2 filtrat soderzhashij Ca2 Fe CN 6 pererabatyvayut putyom posledovatelnogo dobavleniya snachala KCl a zatem K2CO3 On takzhe mozhet byt poluchen putyom vzaimodejstviya suspenzii FeS s vodnym rastvorom KCN Reakciyu mozhno predstavit sleduyushej shemoj 1 cianid kaliya perevodit Fe 2 displaystyle ce Fe 2 v belyj osadok geksacianoferrata II zheleza II 3 Fe 2 6 CN Fe 2 Fe CN 6 displaystyle ce 3Fe 2 6CN gt Fe2 Fe CN 6 v a ne v cianid zheleza II kak schitalos ranee chto vytekaet iz vzaimodejstviya etogo osadka so shyolochyu Fe 2 Fe CN 6 4 KOH 2 Fe OH 2 K 4 Fe CN 6 displaystyle ce Fe2 Fe CN 6 4KOH gt 2Fe OH 2v K4 Fe CN 6 2 2 zatem osadok rastvoryaetsya v izbytke KCN s obrazovaniem zhyoltoj krovyanoj soli Fe 2 Fe CN 6 4 KCN K 4 Fe CN 6 2 Fe CN 2 displaystyle ce Fe2 Fe CN 6 4KCN gt K4 Fe CN 6 2Fe CN 2 Fizicheskie i himicheskie svojstva PravitSvetlo zhyoltye kristally s tetragonalnoj sushestvuyut takzhe rombicheskaya i monoklinnaya modifikacii reshyotkoj sushestvuyushie v vide trigidrata K 4 Fe CN 6 3 H 2 O displaystyle ce K4 Fe CN 6 3h3O 3 Plotnost 1 853 g sm pri 17 C Rastvorimost v vode 35 8 g 100 g pri 25 C ona umenshaetsya v prisutstvii ammiaka ili drugih solej kaliya V absolyutnom spirte nerastvorim no rastvoryaetsya v smesyah spirta s vodoj Malo rastvorim v metanole 0 024 mol l prakticheski ne rastvoryaetsya v efire piridine aniline etilacetate zhidkih hlore i ammiake 3 Geksacianoferrat II kaliya diamagniten pri nizkih temperaturah yavlyaetsya segnetoelektrikom 3 Vyshe 120 C po drugim dannym vyshe 87 3 C istochnik prevrashaetsya v bezvodnuyu sol s plotnostyu 1 935 g sm Vyshe 650 C razlagaetsya 2 3 K 4 Fe CN 6 t Fe 3 C 5 C 3 N 2 12 KCN displaystyle ce 3K4 Fe CN 6 gt t Fe3C 5C 3N2 12KCN V reakcii s koncentrirovannoj solyanoj kislotoj vydelyaetsya belyj osadok zhelezistosinerodistoj kisloty H 4 Fe CN 6 displaystyle ce h5 Fe CN 6 2 S koncentrirovannoj sernoj kislotoj reagiruet po uravneniyu K 4 Fe CN 6 6 H 2 SO 4 6 H 2 O t 2 K 2 SO 4 FeSO 4 3 NH 4 2 SO 4 6 CO displaystyle ce K4 Fe CN 6 6h3SO4 6h3O gt t 2K2SO4 FeSO4 3 Nh5 2SO4 6CO Etim sposobom mozhno polzovatsya v laboratorii dlya polucheniya monooksida ugleroda S solyami metallov v stepeni okisleniya 2 i 3 obrazuet malorastvorimye soedineniya geksacianoferratov II V vodnyh rastvorah okislyaetsya hlorom i drugimi okislitelyami takimi kak peroksid vodoroda do geksacianoferrata III kaliya 2 K 4 Fe CN 6 H 2 O 2 2 HCl 2 K 3 Fe CN 6 2 KCl 2 H 2 O displaystyle ce 2K4 Fe CN 6 h3O2 2HCl gt 2K3 Fe CN 6 2KCl 2h3O Anion Fe CN 6 4 displaystyle ce Fe CN 6 4 ochen prochen ego konstanta nestojkosti po raznym dannym 2 4 ot 4 10 36 do 1 10 35 ne razlagaetsya ni shelochami ni kislotami ustojchiv po otnosheniyu k vozduhu poetomu s tradicionnymi reagentami rastvory geksacianoferratov II ne dayut reakcij ni na Fe 2 displaystyle ce Fe 2 ni na CN displaystyle ce CN 2 Odnako dissociativno razrushit etot kompleks i obnaruzhit v nyom nalichie dvuhvalentnogo zheleza vsyo taki udayotsya odnovremenno svyazav i zhelezo i cianid v otdelnye prochnye kompleksy naprimer obrabotav rastvor geksacianoferrata II smesyu a a dipiridila i hlorida rtuti Pri etom poyavlyaetsya krasnoe okrashivanie vsledstvie obrazovaniya kompleksa Fe 2 displaystyle ce Fe 2 s a a dipiridilom pri odnovremennom svyazyvanii cianida v vide Hg CN 2 displaystyle ce Hg CN 2 5 Toksichnost PravitNejtralnoe veshestvo poskolku anion sm vyshe ne razlagaetsya v vode i vnutri chelovecheskogo organizma Letalnaya doza LD50 dlya krys pri priyome peroralno sostavlyaet 6400 mg kg 6 Primenenie PravitPrimenyayut pri izgotovlenii pigmentov krashenii shyolka v proizvodstve cianistyh soedinenij ferritov cvetnoj bumagi kak komponent ingibiruyushih pokrytij i pri cianirovanii stalej dlya vydeleniya i utilizacii radioaktivnogo ceziya V pishevoj promyshlennosti ferrocianid kaliya zaregistrirovan v kachestve pishevoj dobavki E536 prepyatstvuyushej slyozhivaniyu i komkovaniyu Primenyaetsya kak dobavka k povarennoj soli V Rossijskoj Federacii shiroko primenyayut pri proizvodstve produktov pitaniya soli tvorozhnyh produktov v vinodelii i prochem istochnik ne ukazan 530 dnej Geksacianoferrat II kaliya primenyaetsya v analiticheskoj himii kak reaktiv dlya obnaruzheniya nekotoryh kationov 1 Fe 3 displaystyle ce Fe 3 obrazuetsya malorastvorimyj sinij osadok berlinskoj lazuri Fe III Cl 3 K 4 Fe II CN 6 KFe III Fe II CN 6 3 KCl displaystyle ce Fe III Cl3 K4 Fe II CN 6 gt KFe III Fe II CN 6 3KCl ili v ionnoj forme Fe 3 Fe CN 6 4 Fe Fe CN 6 displaystyle ce Fe 3 Fe CN 6 4 gt Fe Fe CN 6 Poluchayushijsya geksacianoferrat II kaliya zheleza III slabo rastvorim s obrazovaniem kolloidnogo rastvora poetomu nosit nazvanie rastvorimaya berlinskaya lazur 2 Zn 2 displaystyle ce Zn 2 obrazuetsya belyj osadok geksacianoferrata II cinka kaliya 7 3 ZnCl 2 2 K 4 Fe II CN 6 K 2 Zn 3 Fe CN 6 2 6 KCl displaystyle ce 3ZnCl2 2K4 Fe II CN 6 gt K2Zn3 Fe CN 6 2v 6KCl ili v ionnoj forme 3 Zn 2 2 K 2 Fe CN 6 4 K 2 Zn 3 Fe CN 6 2 displaystyle ce 3Zn 2 2K 2 Fe CN 6 4 gt K2Zn3 Fe CN 6 2v 3 Cu 2 displaystyle ce Cu 2 iz nejtralnyh ili slabokislyh rastvorov vypadaet krasno buryj osadok geksacianoferrata II medi II 2 CuCl 2 K 4 Fe II CN 6 Cu 2 Fe CN 6 4 KCl displaystyle ce 2CuCl2 K4 Fe II CN 6 gt Cu2 Fe CN 6 v 4KCl ili v ionnoj forme 2 Cu 2 Fe CN 6 4 Cu 2 Fe CN 6 displaystyle ce 2Cu 2 Fe CN 6 4 gt Cu2 Fe CN 6 v Mozhet ispolzovatsya dlya polucheniya sinilnoj kisloty K 4 Fe CN 6 2 H 2 SO 4 H 4 Fe CN 6 2 K 2 SO 4 displaystyle ce K4 Fe CN 6 2h3SO4 gt h5 Fe CN 6 2K2SO4 3 H 4 Fe CN 6 Fe 3 C 5 C 3 N 2 12 HCN displaystyle ce 3h5 Fe CN 6 gt Fe3C 5C 3N2 12HCN Mnemonicheskoe pravilo PravitDlya togo chtoby zapomnit formulu zhyoltoj krovyanoj soli K 4 Fe CN 6 displaystyle ce K4 Fe CN 6 i ne sputat eyo s krasnoj krovyanoj solyu K 3 Fe CN 6 displaystyle ce K3 Fe CN 6 sushestvuyut mnemonicheskie pravila Chislo atomov kaliya sootvetstvuet chislu bukv v anglijskih nazvaniyah solej gold 4 bukvy to est 4 atoma kaliya zhyoltaya krovyanaya sol K 4 Fe CN 6 displaystyle ce K4 Fe CN 6 Red 3 bukvy to est 3 atoma kaliya krasnaya krovyanaya sol K 3 Fe CN 6 displaystyle ce K3 Fe CN 6 Kalij tri budet krasnyj Mnemonika postroena na igre slov tri chislo i tri povelitelnoe naklonenie glagola teret Kak izvestno pri potiranii naprimer kozhi poslednyaya krasneet Primechaniya Pravit 1 2 Zheltaya ili kroveshelochnaya sol Enciklopedicheskij slovar Brokgauza i Efrona v 86 t 82 t i 4 dop SPb 1890 1907 1 2 3 4 5 6 Nekrasov B V Osnovy obshej himii M 1973 T 2 S 360 1 2 3 Tananaev 1971 s 38 39 Tananaev 1971 s 5 F Fajgl V Anger Kapelnyj analiz neorganicheskih veshestv 1976 T 1 S 242 POTASSIUM FERROCYANIDE neopr hazard com Data obrasheniya 16 yanvarya 2016 Analiticheskie metody opredeleniya cinkaLiteratura PravitTananaev I V i dr Himiya ferrocianidov M 1971 Istochnik https ru wikipedia org w index php title Geksacianoferrat II kaliya amp oldid 113169845, Википедия, чтение, книга, библиотека, поиск, нажмите,
истории
, книги, статьи, wikipedia, учить, информация, история, секс, порно, скачать, скачать, sex, seks, porn, porno, скачать, бесплатно, скачать бесплатно, mp3, видео, mp4, 3gp, jpg, jpeg, gif, png, картинка, музыка, песня, фильм, игра, игры - 3h5[Fe(CN)6]⟶Fe3C+5C+3N2+12HCN{\displaystyle {\ce {3h5[Fe(CN)6] -> Fe3C + 5C + 3N2 + 12HCN}}}
Сбалансируйте химическое уравнение: K4Fe(CN)6 + h3SO4 + h3O = K2SO4 + FeSO4 + (Nh5)2SO4 + CO.

Выберите область веб-сайта для поиска
ХимияВсеУчебные пособияПомощь по выполнению домашних заданийПланы уроков
Искать на этом сайте
Цитата страницы Начать эссе значок-вопрос Задайте вопросНачать бесплатную пробную версию
Скачать PDF PDF Цитата страницы Цитировать Поделиться ссылкой ДелитьсяСсылайтесь на эту страницу следующим образом:
«Сбалансируйте химическое уравнение: K4Fe(CN)6 + h3SO4 + h3O = K2SO4 + FeSO4 + (Nh5)2SO4 + CO». eNotes Editorial , 10 апреля 2011 г., https://www.enotes.com/homework-help/balance-chemical-equation-k4fe-cn-6-h3so4-h3o-253381. По состоянию на 29 апреля 2023 г.
Ответы экспертов
Химическое уравнение, которое необходимо сбалансировать: K4Fe(CN)6 + h3SO4 + h3O = K2SO4 + FeSO4 + (Nh5)2SO4 + CO
Сделайте это следующим образом:
Рассмотрим первое соединение K4Fe(CN)6, K присутствует только в одном из соединений слева. Таким образом, вы можете записать коэффициент K2SO4 как 2. Точно так же, учитывая Fe и N, мы получаем коэффициенты FeSO4 как 1 и (Nh5)2SO4 как 3.
Таким образом, вы можете записать коэффициент K2SO4 как 2. Точно так же, учитывая Fe и N, мы получаем коэффициенты FeSO4 как 1 и (Nh5)2SO4 как 3.
Так как K2SO4, FeSO4 и (Nh5)2SO4 имеют SO4, и мы получаем Всего 6 SO4, мы можем сделать коэффициент h3SO4 равным 6. (Nh5)2SO4 имеет 8 атомов H, а их 3, это дает 24 атома H. Из 6 h3SO4 мы получаем 12 атомов H, остальные или еще 12 приходятся на h30, поэтому h3O можно присвоить коэффициент 6. Наконец, в K4Fe(CN)6 имеется 6 атомов C, чтобы учесть это, присвойте CO коэффициент из 6. В итоге получаем:
K4Fe(CN)6 + 6 h3SO4 + 6 h3O = 2 K2SO4 + FeSO4 + 3 (Nh5)2SO4 + 6 CO
См. eNotes Ad-Free
Начните 48-часовую бесплатную пробную версию , чтобы получить доступ к более чем 30 000 дополнительных руководств и более чем 350 000 вопросов помощи при выполнении домашних заданий, на которые наши эксперты ответили.
Получите 48 часов бесплатного доступа Уже зарегистрированы? Войдите здесь.
Утверждено редакцией eNotes
Задайте вопрос
Похожие вопросы
Просмотреть всеХимия
Последний ответ опубликован 21 июня 2012 г. в 16:50:16.
Сколько молей h3SO4 вступит в реакцию с 18 моль Al в химической реакции с их участием.
4 Ответы воспитателя
Химия
Последний ответ опубликован 21 июня 2012 г. в 12:56:39.ВЕЧЕРА
Алюминий реагирует с кислородом в следующей химической реакции: Al + O2 → Al2O3. Сколько молей Al2O3 образуется при взаимодействии 6,38 моль O2 и 9,15 моль Al?
2 Ответы воспитателя
Химия
Последний ответ опубликован 02 июня 2013 г. в 20:16:05.
в 20:16:05.
Что удерживает атомы вместе в ионных связях?
2 Ответы воспитателя
Химия
Последний ответ опубликован 19 ноября 2012 г. в 17:41:47.
Оксид ванадия (V) используется в качестве катализатора в приведенной ниже реакции.2 SO2 (г) + O2 (г) —> 2 SO3 (г)Объясните, как оксид ванадия (V) способен снижать энергию активации и повышать скорость…
1 Ответ воспитателя
Химия
Последний ответ опубликован 23 сентября 2012 г. в 3:35:39.
Является ли CO2 + h3O ->h3CO3 окислительно-восстановительной реакцией?
1 Ответ воспитателя
Ферроцианид калия – определение, структура, свойства, использование и применение
Ферроцианид калия K 4 (Fe(CN) 6 ) используется в пищевой и фармацевтической промышленности для окрашивания. Ферроцианид калия используется в качестве красителя в сахаре, в пищевых продуктах, таких как выпечка, макаронные изделия, фрукты, желе и начинки для пирогов, молочные продукты, мясные и рыбные продукты, кофе и жевательная резинка; и в качестве компонента в лекарствах и фармацевтических препаратах, таких как вакцины, витамины и антибиотики. Он обычно используется в производстве продуктов, не содержащих сухих веществ, и пищевых красителей, но все чаще используются продукты, содержащие небольшое количество добавленного ферроцианида калия. Этот краситель не является пищевой добавкой и не влияет на безопасность пищевых продуктов. Ферроцианид калия обычно добавляют в сахар для улучшения цвета пищевого продукта. Он одобрен для использования в качестве красителя в пищевых продуктах и в качестве компонента лекарственных средств и пищевых продуктов для контроля цвета.
Ферроцианид калия используется в качестве красителя в сахаре, в пищевых продуктах, таких как выпечка, макаронные изделия, фрукты, желе и начинки для пирогов, молочные продукты, мясные и рыбные продукты, кофе и жевательная резинка; и в качестве компонента в лекарствах и фармацевтических препаратах, таких как вакцины, витамины и антибиотики. Он обычно используется в производстве продуктов, не содержащих сухих веществ, и пищевых красителей, но все чаще используются продукты, содержащие небольшое количество добавленного ферроцианида калия. Этот краситель не является пищевой добавкой и не влияет на безопасность пищевых продуктов. Ферроцианид калия обычно добавляют в сахар для улучшения цвета пищевого продукта. Он одобрен для использования в качестве красителя в пищевых продуктах и в качестве компонента лекарственных средств и пищевых продуктов для контроля цвета.
Преимущества
Ферроцианид калия не влияет на безопасность пищевых продуктов.

Ферроцианид калия водорастворим, устойчив к гидролизу и не образует токсичных веществ.
Высокая стабильность.
Не окрашивает рот, губы, зубы или пальцы.
Пятна можно смыть холодной водой.
Простота в обращении.
Высокая стабильность и низкая температура плавления.
Цвет является постоянным и не будет работать.
Насыщенность цвета можно варьировать, регулируя уровень pH и количество ингредиентов.
Красители с этим свойством помогают производить яркую и привлекательную выпечку.

Хорошо впитывает влагу из сахара.
Не является канцерогеном.
Не окисляется быстро и может использоваться в больших количествах.
Безопасен для детей, беременных женщин, пожилых людей и больных.
Не воспламеняется.
Низкая стоимость.
Не вступает в реакцию с большинством других пищевых продуктов.
Не изменяет вкус пищи, в которую добавляется.
Ферроцианид калия не наносит вреда окружающей среде.

Области применения
Ферроцианид калия используется в качестве красителя в пищевых продуктах и напитках, таких как варенье, желе, мармелад и разрыхлитель. Его также можно использовать в некоторых лекарствах и препаратах, содержащих кальций или железо. Он также входит в состав некоторых лечебных продуктов. Ферроцианид калия также можно использовать для окрашивания некоторых медицинских продуктов для определенных групп пациентов, например, с проблемами почек или сердца.
История
Соли ферроцианидов были впервые получены в 1840-х годах. Ферроцианид калия был произведен в 1891 году Томасом Грэмом и Альфредом Роузом из Английского фармацевтического общества. Это было первое успешное коммерческое производство ферроцианида калия.
Ферроцианид калия был впервые использован в качестве красителя в пищевой промышленности в 1890-х годах. Затем его использовали для окрашивания желатина в пищевых продуктах, таких как варенье и мармелад, чтобы отличить их от более дешевых продуктов синтетического цвета. Было получено множество патентов для защиты нового красителя.
Было получено множество патентов для защиты нового красителя.
Использование ферроцианида в качестве пищевого красителя было разрешено в 1930-х годах. Он был одобрен для использования в желе, джеме, мармеладе, конфетах и разрыхлителе.
Есть некоторые споры по поводу названия ферроцианид калия. Ее также называют «зеленой солью».
Преимущества:
Хороший краситель, так как придает продукту ярко-зеленый цвет. Он не теряет цвет при нагревании или воздействии солнечных лучей.
Имеет меньше недостатков, чем синтетический краситель.
Безопасен для использования в пищевых продуктах.
Может использоваться в широком ассортименте пищевых продуктов.
Он не летучий, поэтому нет риска обжечь рот.

Не вызывает рак.
Недорого.
О калиях ферроцианид -K
4 (Fe (CN) 6 )Ферроцианид калия -K 4 (Fe (CN)) 6 представляет собой феррицианидную соль или калиевую соль. Это бесцветный или желтоватый твердый материал. Как соль, это соль сильной кислоты. Растворим в воде, эфире и других растворителях.
Ферроцианид калия -K 4 (Fe(CN) 6 ) используется в качестве катализатора в фотографической, биохимической и аналитической химии. Он в основном используется в качестве калиевой соли для получения ферроцианида калия — K 4 (Fe(CN)) 6 . Ферроцианид калия -K 4 (Fe(CN) 6 ) также называется феррицианид калия -K 4 (Fe(CN)) 6 , феррицианид калия -K 4 (Fe(CN) 2 ), феррицианид калия — K 4 (Fe(CN) 2 ), феррицианид калия -K 4 (Fe(CN) 2 ) и феррицианид калия -K 4 (Fe(CN) 3 ). Ферроцианид калия -K 4 (Fe(CN) 6 ) также называют дихроматом калия -K 4 Cr 2 О 7 ).
Ферроцианид калия -K 4 (Fe(CN) 6 ) также называют дихроматом калия -K 4 Cr 2 О 7 ).
Ферроцианид калия — K 4 (Fe(CN) 6 ) используется во многих процессах в аналитической лаборатории для обнаружения и определения металлов. Он используется в аналитической химии для определения следовых количеств меди и железа, для определения железа в стали и для анализа меди и железа. Он используется для обнаружения присутствия меди в железной руде, определения железа и меди в алюминии атомно-абсорбционным методом, а также для идентификации и определения меди в растворе. Применяется в аналитической химии для определения мышьяка, кадмия, свинца и цинка, при определении мышьяка и свинца в руде, свинца в стали и стали всех марок.
Широко известно использование ферроцианида калия — K 4 (Fe(CN) 6 ) в качестве индикатора в методике титриметрического осаждения. Реакцию проводят при низких значениях рН в присутствии различных оснований, избыток основания определяют титрованием кислотой. Также проводят осаждение ферроцианидом калия — К 4 (Fe(CN) 6 ) в присутствии различных металлов. Осаждение железа (II) ферроцианидом калия — К 4 (Fe(CN) 6 ) используется для идентификации и определения железа в железной руде, определения железа в стали и для идентификации меди в алюминиевом сплаве. Осаждение алюминия в присутствии ферроцианида калия -К 4 (Fe(CN) 6 ) может быть использовано для идентификации и определения алюминия в алюминиевом сплаве.
Реакцию проводят при низких значениях рН в присутствии различных оснований, избыток основания определяют титрованием кислотой. Также проводят осаждение ферроцианидом калия — К 4 (Fe(CN) 6 ) в присутствии различных металлов. Осаждение железа (II) ферроцианидом калия — К 4 (Fe(CN) 6 ) используется для идентификации и определения железа в железной руде, определения железа в стали и для идентификации меди в алюминиевом сплаве. Осаждение алюминия в присутствии ферроцианида калия -К 4 (Fe(CN) 6 ) может быть использовано для идентификации и определения алюминия в алюминиевом сплаве.
Простая процедура экстракции для определения алюминия в диапазоне 5-70 мкг/г с использованием 2-(п-толуолсульфокислоты)-3,6-диамино-9-этилкарбазол — описан DAEC. Результаты, полученные методом экстракции и хелатирования, согласуются с результатами, полученными методом электротермической атомно-абсорбционной спектрометрии.
Ферроцианид калия определяется как неорганическое соединение, имеющее химическую формулу K 4 (Fe(CN) 6 ) (формула ферроцианида калия). Ферроцианид калия иначе называют желтым пруссатом калия, который представляет собой желтый кристалл. Он был сделан из роговых или шерстяных обрезков, перемешивающих горячий карбонат калия с помощью железного стержня. Соединение ферроцианида калия можно использовать в некоторых процессах получения железа в качестве проявителя и в качестве добавки для щелочных пиропроявителей.
Гексацианоферрат калия (II), желтая пруссия калия — другие названия ферроцианида калия.
Структура ферроцианида калия –K
4 (Fe(CN) 6 )Структуру ферроцианида калия можно представить следующим образом:
(Изображение будет добавлено позже)
в важные свойства ферроцианида калия
Свойства ферроцианида калия
Название IUPAC | Ферроцианид калия |
Химическая формула | K 4 (Fe(CN) 6 ) |
Молекулярный вес или молярная масса | 368,35 г/моль |
Плотность | 1,85 г/см³ | Температура плавления | 300 °C |
Температура кипения | 400 °C |
Физические свойства ферроцианида калия – K 9008 9 4
(Fe(CN) 6 )Внешний вид | Светло-желтые кристаллические гранулы |
Запах | Без запаха | Акцептор водородных связей | 12 |
Ковалентно-связанный блок | 10 |
Растворимость | Нерастворим в эфире, этаноле |
Сложность | 127 9033 4 |
Химические свойства ферроцианида калия – K
4 (Fe(CN) 6 )Ферроцианид калия дополнительно реагирует с серной кислотой в водной форме сульфата железа ели, сульфат калия, окись углерода и сульфат аммония.
 Химическую реакцию можно представить следующим образом:
Химическую реакцию можно представить следующим образом:
\[ K_{4}(Fe(CN)_{6}) + 6H_{2}SO_{4} + 6h3O \rightarrow 2K_{2}SO_{4} + FeSO_{4} + 3(NH_ {4})_{2}SO_{4} + 6CO \]
\[ K_{4}(Fe(CN)_{6}) + FeCl_{3} \rightarrow KFe[Fe(CN)_{6 }] + 3 KCIC \]
Использование ферроцианида калия – K
4 (Fe(CN) 6 )Ферроцианид калия можно использовать в процессах отпуска стали и гравировки. Он также используется в производстве пигментов и в качестве химического реагента.
Небольшое количество гидрохинона и пиропроявителей способствует уменьшению запотевания и увеличению плотности.
Он также используется в производстве цианида калия, который может широко использоваться в добыче золота.
Кроме того, Ferro Cyanogen производит большинство соединений металлов, нерастворимых в воде, некоторые из которых имеют очень характерные цвета.
 Он служит тестом для соединений железа и меди.
Он служит тестом для соединений железа и меди.
Применение ферроцианида калия
Важные области применения ферроцианида калия можно перечислить следующим образом:
Ферроцианид калия находит несколько нишевых применений в промышленности. Родственная натриевая соль широко используется в качестве противослеживающего агента как для поваренной соли, так и для дорожной соли. Ферроцианиды натрия и калия также могут быть использованы при выделении меди из молибденовых руд и очистке олова. Соединение ферроцианида калия используется в производстве лимонной кислоты и вина.
Также используется в кормлении животных.
Ферроцианид калия используется для определения концентрации перманганата калия в лаборатории, соединения, часто используемого при титровании по окислительно-восстановительным реакциям.
 Соединение ферроцианида калия используют в смеси с фосфатно-буферным раствором и феррицианидом калия для получения буфера для бета-галактозидазы. Его можно использовать для расщепления X-Gal, создавая ярко-синюю визуализацию, где антитело (иначе другая молекула), конъюгированное с Beta-gal, связано со своей мишенью. Кроме того, при реакции с Fe (3) он дает берлинскую лазурь. Поэтому его можно использовать в качестве реагента для идентификации железа в лабораториях.
Соединение ферроцианида калия используют в смеси с фосфатно-буферным раствором и феррицианидом калия для получения буфера для бета-галактозидазы. Его можно использовать для расщепления X-Gal, создавая ярко-синюю визуализацию, где антитело (иначе другая молекула), конъюгированное с Beta-gal, связано со своей мишенью. Кроме того, при реакции с Fe (3) он дает берлинскую лазурь. Поэтому его можно использовать в качестве реагента для идентификации железа в лабораториях.Соединение ферроцианида калия используется в качестве удобрения для растений.
До 1900 г. н.э., до изобретения процесса Кастнера, соединение ферроцианида калия было важным источником цианидов щелочных металлов. Цианид калия был получен путем разложения ферроцианида калия в этом историческом процессе. Химическая реакция может быть представлена следующим образом:
\[ K_{4}(Fe(CN)_{6}) \rightarrow 4 KCN + FeC_{2} + N_{2} \]
Токсичность ферроцианида калия для соли
Острая пероральная токсичность ферроцианида калия указана как 5000 мг/кг. Это означает 350 г для человека весом 70 кг. Хотя молекулы состоят из ионов цианида, они более прочно связаны с атомом железа и остаются с железом на протяжении всей пищеварительной системы человека.
Это означает 350 г для человека весом 70 кг. Хотя молекулы состоят из ионов цианида, они более прочно связаны с атомом железа и остаются с железом на протяжении всей пищеварительной системы человека.
Количество, добавляемое в поваренную соль для предотвращения слеживания, составляет порядка 20 мг/кг хлорида натрия, а это означает, что нам придется съесть целый грузовик поваренной соли, чтобы достичь уровня токсичности ферроцианида калия. Конечно, соль убьет нас задолго до ферроцианида калия.
Наличие на рынке ферроцианида калия
Соединения ферроцианида калия существуют в виде светло-желтых кристаллов без запаха, растворимых в воде, но нерастворимых в спиртах. Это соединение также называют либо желтым пруссатом гексацианоферрата (II) калия, либо калием. Ферроцианид калия производится из гидроксида калия и ферроцианида водорода. Это соединение не считается токсичным, но оно опасно при смешивании с другими химическими веществами или при нагревании с ними.


 ). hazard.com. Дата обращения: 16 января 2016.
). hazard.com. Дата обращения: 16 января 2016.
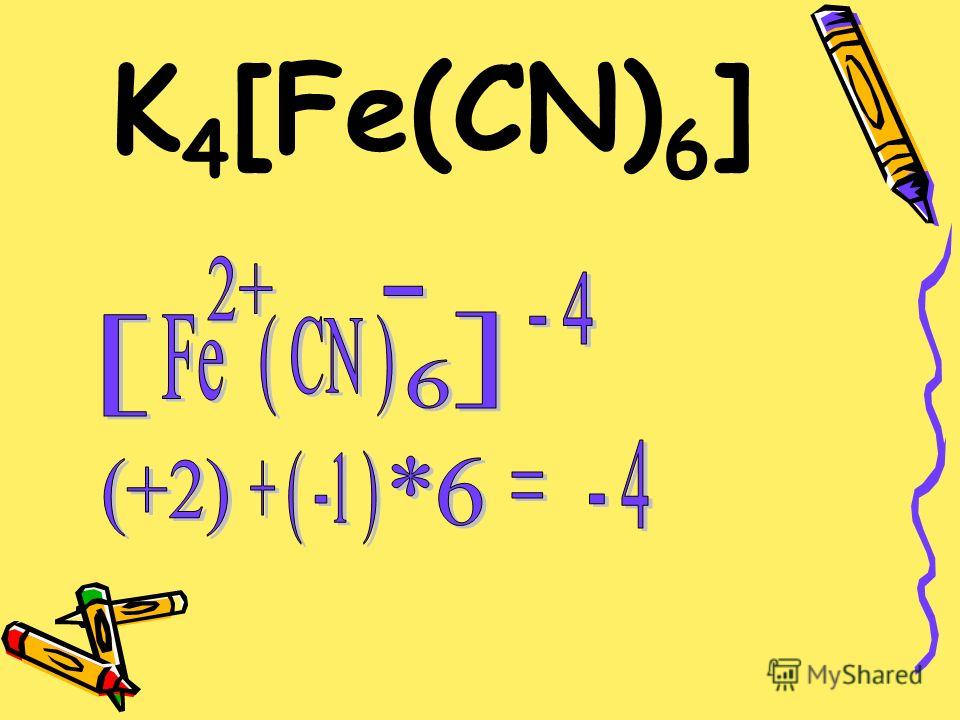

 Химическую реакцию можно представить следующим образом:
Химическую реакцию можно представить следующим образом: Он служит тестом для соединений железа и меди.
Он служит тестом для соединений железа и меди. Соединение ферроцианида калия используют в смеси с фосфатно-буферным раствором и феррицианидом калия для получения буфера для бета-галактозидазы. Его можно использовать для расщепления X-Gal, создавая ярко-синюю визуализацию, где антитело (иначе другая молекула), конъюгированное с Beta-gal, связано со своей мишенью. Кроме того, при реакции с Fe (3) он дает берлинскую лазурь. Поэтому его можно использовать в качестве реагента для идентификации железа в лабораториях.
Соединение ферроцианида калия используют в смеси с фосфатно-буферным раствором и феррицианидом калия для получения буфера для бета-галактозидазы. Его можно использовать для расщепления X-Gal, создавая ярко-синюю визуализацию, где антитело (иначе другая молекула), конъюгированное с Beta-gal, связано со своей мишенью. Кроме того, при реакции с Fe (3) он дает берлинскую лазурь. Поэтому его можно использовать в качестве реагента для идентификации железа в лабораториях.