Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
| Похожие вопросы |
тело находится в равновесии под действием трех сил.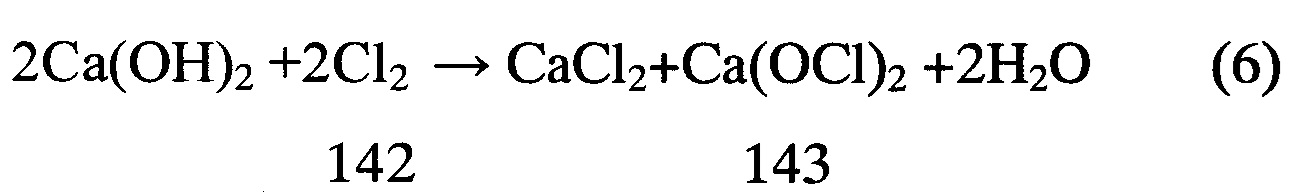 2-2x-3 Найдите: а) наименьшее значение функции; б) значения х, при которых значение функции равно 5; в) значения х, при которых функция принимает положительные
2-2x-3 Найдите: а) наименьшее значение функции; б) значения х, при которых значение функции равно 5; в) значения х, при которых функция принимает положительные
Решите уравнение (5x+2)(-x-4)=0 если уравнение имеет более одного корня в ответ запишите больший из корней напишите решение плииз
Решено
Радиус вписанной в квадрат окружности равен 4√2 найти радиус окружности описанной около этого квадрата
Можно ли силу 8 Н разложить на две по 5 Н каждая? Можно ли ту же силу разложить на две по 9 Н?
Пользуйтесь нашим приложением
Объемное восстановление расплава FeCl2–CaCl2 кальцием, растворенным в хлориде кальция | Поляков
1. Лыков П.А. Разработка гидропневмоагрегатов машин по производству микропорошков из жидких металлов: Автореф. дис. … Кандидат технических наук. Челябинск: ЮУрГУ, 2014. http://tekhnosfera. com/view/ 447915/a?#?page=1.
com/view/ 447915/a?#?page=1.
2. Анциферов В.Н., Бобров Г.В., Дружинин Л.К., Кипарисов С.С., Костиков В.И., Крупин А.В., Кудинов В.В., Либенсон Г.А., Митин Б.С., Роман О.В. Порошковая металлургия и напыленные покрытия. М.: Металлургия, 1987.
3. Кипарисов С.С., Либенсон Г.А. Порошковая металлургия. М.: Металлургия, 1972.
4. Ramakrishnan P. Iron powder from iron scrap // Conservat. Recycl. 1983. Vol. 6. No. 1. P. 49—54. DOI: dx.doi.org/10.1016/0361-3658(83)90016-4.
5. Hoeges S., Zwiren A., Schade C. Additive manufacturing using water atomized steel powders // Metal Powder Rep. 2017. Vol 72. No. 2. P. 111—117. DOI: dx.doi.org/10.1016/j.mprp.2017.01.004.
6. Зленко М.А., Нагайцев М.В., Довбыш В.М. Аддитиивные технологии в машиностроении: Пособие для инженеров. М.: НАМИ, 2015. С. 160—171.
7. Tsantrizos P.G., Allaire F., Entezarian M. Method of production of metal and ceramic powders by plasma atomization: Pat. 5707419 (USA). 1998. https://www.google.com/patents/US5707419.
8. Boulos M. Plasma power can make better powders // Metal Powder Rep. 2004. Vol. 59. No. 5. P. 16—21. DOI: dx.doi.org/10.1016/S0026-0657(04)00153-5.
9. Александров В.Влияние «теплого прессования» и степени легирования на структуру и свойства изделий из металлических порошков: Автореф. дис. … Кандидат технических наук. Пермь: ПНИПУ, 2005. http://pstu.ru/files/file/adm/dissertacii/aleksandrov/aftoreferat_aleksandrov_vg.pdf.
10. Ye Q., Zhu H., Zhang L., Ma J., Zhou L., Liu P., Chen J., Chen G., Peng J. Preparation of reduced iron powder using combined distribution of wood-charcoal by microwave heating // J. Alloys and Compd. 2014. Vol. 613. P. 102—106. DOI: dx.doi.org/10.1016/j.jallcom. 2014.06.016.
11. Martin M.I., Lopez F.A., Torralba J.M. Production of sponge iron powder by reduction of rolling mill scale // Ironmaking and Steelmaking. 2012. Vol 39. No. 3. P. 155—162.
12. Squires A.M., Johnson C.A. The h-iron process // J. Metals. 1957. P. 586—590.
13. Brooks J. Production of ferrous chloride and metallic iron powder: Pat. 2762700 A (US). 1956.
Brooks J. Production of ferrous chloride and metallic iron powder: Pat. 2762700 A (US). 1956.
14. Gaballah N., Zikry A., Khalifa M., Farag A., El-Hussiny N., Shalabi M. Production of iron from mill scale industrial waste via hydrogen // Open J. Inorg. Non-metal. Mater. 2013. Vol. 3 No. 3. P. 23—28. DOI: dx.doi.org/10.4236/ojinm.2013.33005.
15. Bloemacher D. Carbonyl iron powders: Its production and new developments // Metal Powder Rep. 1990. Vol. 45. No. 2. P. 117—119. DOI: dx.doi.org/10.1016/S0026-0657(10)80122-5.
16. Benchiheub O., Mechachti S., Serrai S., Khalifa M.G. Elaboration of iron powder from mill scale // J. Mater. Envir. Sci. 2010. Vol. 1. No. 4. P. 267—276.
17. Despeisse M., Ford S. The role of additive manufacturing in improving resource efficiency and sustainability // Proc. Int. Conf. APMS 2015. United Kingdom: Institute for Manufacturing, University of Cambridge, 2015. http://www.apms-conference.org.
18. Petrick I., Simpson T. 3D Printing disrupts manufacturing // Res. Technol. Management. 2013. Vol. 56. No. 6. DOI: dx.doi.org/10.5437/08956308X5606193.
Technol. Management. 2013. Vol. 56. No. 6. DOI: dx.doi.org/10.5437/08956308X5606193.
19. Berman B. 3-D Printing: The new industrial revolution // Business Horizons. 2012. Vol. 55. P. 155—162. DOI: dx.doi.org/10.1016/j.bushor.2011.11.003.
20. Petrovic V., Gonzalez J., Ferrando O., Gordillo J., Puchades J., Griñan L. Additive layered manufacturing: Sectors of industrial application shown through case studies // Int. J. Production Res. 2011. Vol. 49. No. 4. P. 1061—1079. DOI: dx.doi.org/10.1080/00207540903479786.
21. Gibson I. Additive manufacturing technologies: 3D printing, rapid prototyping, and direct digital manufacturing. N.Y.: Springer-Verlag, 2015. DOI: dx.doi.org/10.1007/978-1-4939-2113-3.
22. Баймаков Ю.В., Ветюков М.М. Электролиз расплавленных солей. М.: Металлургия, 1966.
23. Родякин В.В. Металлургия кальция. М.: Металлургия, 1957.
24. Лаптев Д.А., Поляков В.В., Бабин А.В., Лебедев В.А. Восстановительная способность растворов кальция в его расплавленном хлориде // Матер. 3-й научный-техн. конф. «Металлургия легких и тугоплавких металлов» (10—11 окт. 2014). Екатеринбург: УрФУ, 2014. С. 169—172.
3-й научный-техн. конф. «Металлургия легких и тугоплавких металлов» (10—11 окт. 2014). Екатеринбург: УрФУ, 2014. С. 169—172.
Сколько CaCl2 нужно добавить, чтобы изменить концентрацию Ca со 100 мг/л до 200 мг/л?
Наука Химия Стехиометрия Химия Химия Преобразование Молярность
Мадлен С.
спросил 26.07.16Вопрос: У меня есть 275 галлонов воды. Концентрация Ca составляет 100 мг/л. Сколько CaCl2 нужно добавить, чтобы Ca стало 200 мг/л?
Я понимаю, что вам следует преобразовать мг в граммы, и это будет 0,1 г/л и 0,2 г/л.
Я также понимаю, что концентрация измеряется в молярности (моль/литры) и что, поскольку это соотношение 1:1, количество молей CaCl2, вероятно, должно быть удвоено.
Как мне это настроить?
Подписаться І 3
Подробнее
Отчет
2 ответа от опытных наставников
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Майкл В. ответил 16.06.17
ответил 16.06.17
Репетитор
Новое в Византе
Химик со стажем
Смотрите таких репетиторов
Смотрите таких репетиторов
Поскольку они просят вас указать мг/мл кальция, можно подумать об этом так: если бы у вас был один литр с концентрацией 100 мг/мл, сколько CaCl2 вам нужно было бы добавить? Я бы узнал, сколько Ca содержится в CaCl2 (вес. %), и тогда вы можете использовать этот % в будущем. Не забудьте перейти от 1 л к конечному объему!
Голосовать за 0 голос против
Подробнее
Отчет
Джули С. ответил 30.07.16
Репетитор
5,0 (473)
Химия может быть веселой! Более 25 лет обучения Gen Chem и Orgo Chem
Смотрите таких репетиторов
Посмотреть таких репетиторов
Это довольно длинный вопрос, чтобы ответить на него, мне потребовалось бы 30 минут, чтобы напечатать полный пошаговый ответ на него.
Я дам вам несколько подсказок/подсказок. Самая распространенная ошибка/проблема заключается в том, что исходная концентрация Ca указана в мг на литр. НО вас спрашивают, сколько CaCl 2 прибавить.Формула веса на кальций в г/моль не совпадает с формулой веса хлорида кальция .
Переведи галлоны —> литры, найди там мг кальция. Преобразовать в г, а затем преобразовать в моли. Вам нужно удвоить это, поэтому вам нужно добавить к нему такое же количество молей кальция.
Один моль CaCl2 содержит один моль Ca. Вот сколько молей CaCl2 нужно добавить. Найдите это количество в г, и вы получите ответ! Надеюсь, это поможет.
Голосовать за 0 голос против
Подробнее
Отчет
Все еще ищете помощь? Получите правильный ответ, быстро.

Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн. Никаких пакетов или подписок, платите только за то время, которое вам нужно.
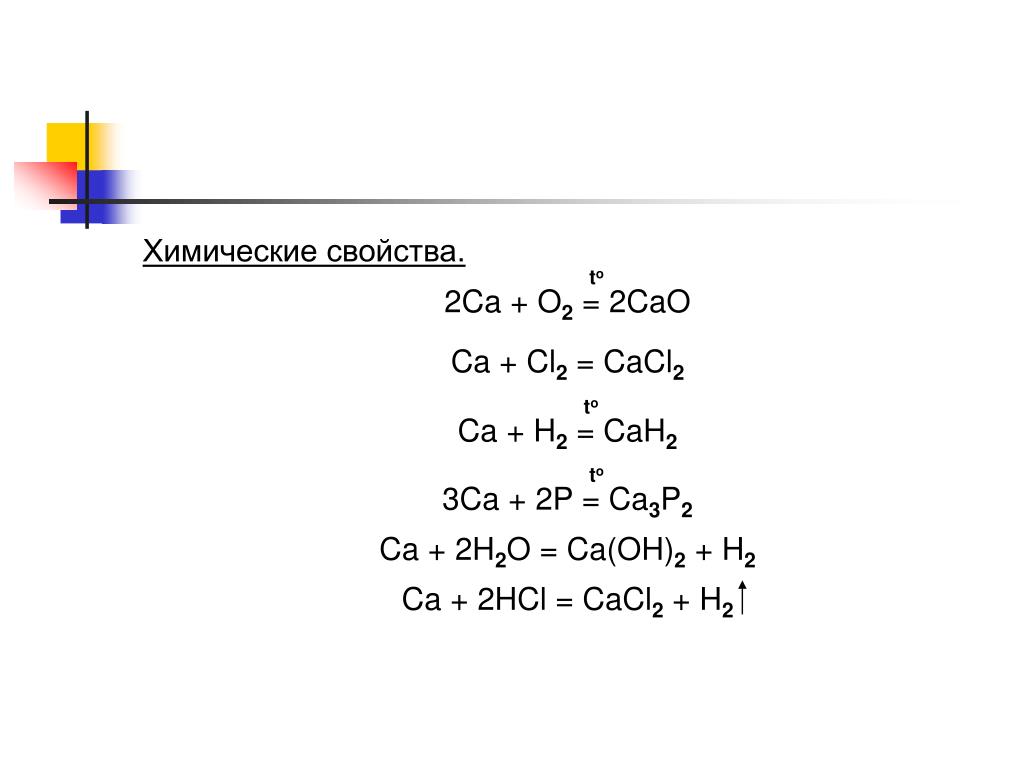
Свойства хлорида кальция (CaCl2) (25 фактов, которые вы должны знать) Определим ниже свойства хлорида кальция.
Свойства хлорида кальция относятся к химическим и физическим свойствам соединения хлорида кальция.
Внутренние характеристики, образующиеся после соединения кальция и хлора, проявляются через свойства хлорида кальция. В этой статье будут описаны такие свойства, как молярная масса, температура плавления, температура кипения, вязкость и другие.
Хлорид кальция Название IUPAC
Название IUPAC хлорида кальция такое же, как «дихлорид кальция» или «хлорид кальция 9».0074».
Химическая формула хлорида кальция
Химическая формула хлорида кальция Cacl 2 , где Ca — это символ кальция, а Cl — это символ хлора.
Хлорид кальция Номер CAS
Регистрационный номер CAS хлорида кальция 7440-70-2.
Хлорид кальция ChemSpider ID
В базе данных ChemSpider хлориду кальция присвоен номер 23237. Это идентификационный номер для получения свободного доступа к данным о соединении.
Химическая классификация хлорида кальция
- Хлорид кальция химически классифицируется по его неорганической природе.
- Хлорид кальция — неорганическая соль кальция.
- Хлорид кальция хорошо растворим в воде.
- Хлорид кальция считается типичным растворимым галогенидом.

Молярная масса хлорида кальция
Молярная масса хлорида кальция может быть получена как 110,98 г/моль.
Цвет хлорида кальция
Хлорид кальция в природе имеет приличный белый цвет.
Вязкость хлорида кальция
Величина вязкости хлорида кальция составляет почти 6 моль кг -1 . Уровни вязкости соединения в бинарном водном растворе составляют 0,10, 0,33, 0,65, 0,97, 1,40 и 2,00.
Молярная плотность хлорида кальция
Кальций безводный имеет молярную плотность 2,15 г/см 3 .
Температура плавления хлорида кальция
Температура плавления твердого хлорида кальция 772 °C.
Температура кипения хлорида кальция
Расчетная температура кипения жидкого хлорида кальция составляет 1935 °C.
Состояние хлорида кальция при комнатной температуре
При комнатной температуре хлорид кальция, соль может находиться в твердом состоянии.
Ионная связь хлорида кальция
Хлорид кальция образуется из ионных связей между кальцием и двумя атомами хлора. Здесь атом кальция передает свои два валентных электрона, чтобы сделать связь с хлором прочной, вместо того, чтобы частично делиться электронами.
Cacl 2 структураИонный радиус хлорида кальция
Ионный радиус всего соединения Хлорид кальция не определен, так как этот коэффициент применим для отдельных элементов. Ионный радиус иона кальция (Ca 2+ ) составляет 114 пм, а каждый ион хлора (Cl – ) составляет 167 пм в CaCl 2 .
Электронные конфигурации хлорида кальция
Электронная конфигурация относится к типу расположения электронов на атомных орбиталях. Идентифицируем электронную конфигурацию атомов Ca и Cl в CaCl 2 .
Электронная конфигурация Ca 2+ : 1s 2 2s 2 2p 6 3s 2 3p 6 и каждый ион Cl – составляют 1s 2 2s 2 2p 6 в соответствии с принципом .
Степень окисления хлорида кальция
Степень окисления CaCl 2 равна 0. Расчет степени окисления приведен ниже:
- Степень окисления кальция +2 в CaCl
6 9
7 Степень окисления каждого иона хлора в CaCl 2 равно -1 - Степень окисления двух ионов хлора (2*(-1)) = -2
- Степень окисления CaCl 2 равно (+2-2) = 0
Хлорид кальция Кислотность/щелочность
Хлорид кальция не является ни кислотным, ни щелочным. Это нейтральная соль. В воде эта твердая соль образует нейтральный раствор.
Хлористый кальций не имеет запаха?
Хлорид кальция не имеет запаха как в твердом, так и в жидком состоянии.
Является ли хлорид кальция парамагнитным?
Парамагнетизм — это магнитный эффект, создаваемый периодическим элементом и соединением, когда они обладают неспаренными электронами. Выясним, является ли CaCl 2 парамагнитным или нет.
Выясним, является ли CaCl 2 парамагнитным или нет.
Хлорид кальция не является парамагнитным, скорее, магнитный эффект CaCl 2 не может быть определен, поскольку соединение является нейтральным по своей природе и со всеми спаренными электронами.
Гидраты хлорида кальция
Можно получить 5 типов гидратов хлорида кальция, которые перечислены ниже:
- Агрид хлорида кальция (CACL 2 )
- Calcium Monohydrate (CACL 70077 7. 777777 7. 7777. )
- Calcium chloride dihydrate (CaCl 2 . 2H 2 O)
- Calcium Chloride tetrahydrate (CaCl 2 . 4H 2 O)
- Calcium chloride hexahydrate (CaCl 2 . 4H 2 O)
Кристаллическая структура хлорида кальция
Хлорид кальция встречается в виде кристаллической твердой соли.
Полярность и электропроводность хлорида кальция
- Хлорид кальция не является ни полярным, ни неполярным, поскольку соединение классифицируется как ионное соединение, состоящее из одного металла и одного неметаллического элемента.
- Проводимость хлорида кальция очень высокая, 64300 количеств при температуре 18 0 C.
Реакция хлорида кальция с кислотой
Хлорид кальция реагирует в присутствии различных кислот. Реакции перечислены ниже:
- В реакции с разбавленной серной кислотой хлорид кальция дает белый осадок соединения сульфата кальция.
- При взаимодействии с соляной кислотой соединение растворяется в растворе и нейтрализует соляную кислоту. CaCl 2 + HCl = H Cl 2 + Ca
- Хлорид кальция не может вступать в реакцию с азотной кислотой.

Реакция хлорида кальция с основанием
Можно заметить, что хлорид кальция реагирует с сильным основанием Гидроксид натрия (NaOH). Когда соединение смешивается с NaOH, кальций соединяется с ионом гидроксида и легко образует гидроксид кальция.
CaCl 2 (водн.)+NaOH(водн.)→Ca(OH) 2 (тв.)+NaCl(водн.) .
Реакция хлорида кальция с оксидом
Хлорид кальция не реагирует в присутствии кислорода и при контакте с любыми оксидами. Однако было получено, что соединение выделяет сульфат кальция в реакции с оксидом серы очень медленно.
SO 2 + CaCl 2 = CaSO 2 + Cl .
Реакция хлорида кальция с металлом
Хлорид кальция вызывает сильную коррозию при контакте с голыми металлами из-за своей гигроскопичности.

 10.17
10.17