Способы получения FeCl2
ок-е вос-е
вос-ль ок-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
вос-е ок-е
ок-ль вос-ль
ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль
ок-е вос-е
вос-ль ок-ль
вос-е
ок-ль
ок-е
вос-ль
вос-е ок-е
ок-ль вос-ль
Номенклатура соединений железа
[Fe(CO)5] | пентакарбанилжелезо |
[Fe(NH3)4Cl2] | дихлоротетраамминжелезо |
[Fe(C5H5)2] | бис(циклопентадиенил)железо, ферроцен |
FeO | оксид железа (II) |
Fe(OH)2 | гидроксид железа (II) |
FeS | сульфид железа (II) |
FeS2 | дисульфид железа (II), пирит, серный колчедан, железный колчедан |
Fe(CN)2 | цианид железа (II) |
Fe(NCS)2 | тиоцианат железа (II) |
FeCl2 | хлорид железа (II) |
FeCl2. | тетрагидрат хлорида железа (II) |
FeI2 | йодид железа (II) |
| FeSO4.7H2O | гептагидрат сульфата железа (II) |
FeSO3.3H2O | тригидрат сульфита железа (II) |
Fe(NO3)2.6H2O | гексагидрат нитрата железа (II) |
Fe3(PO4)2.8H2O | октагидрат ортофосфата железа (II) |
FeHPO4.2H2O | дигидрат гидроортофосфата железа (II) |
Fe(H2PO4)2. | дигидрат дигидроортофосфата железа (II) |
FeCO3 | карбонат железа (II), сидерит |
Fe(HCO3)2 | гидрокарбонат железа (II) |
(CH3COO)2Fe.4H2O | тетрагидрат ацетата железа (II) |
(HCOO)2Fe.2H2O | дигидрат формиата железа (II) |
FeSiO3 | силикат железа (II) |
Fe2SiO4 | ортосиликат железа (II) |
FeC2O4. | пентагидрат оксалата железа (II) |
Fe(ClO4)2.6H2O | гексагидрат перхлората железа (II) |
FeSO4.(NH4)2SO4.6H2O | гексагидрат сульфата диаммония-железа (II), соль Мора |
K4[Fe(CN)6] | гексацианоферрат (II) калия, «желтая кровяная соль» |
[Fe(H2O)6]SO4 | сульфат гексаакважелеза (II) |
Na2[Fe(NO+)(CN)5] | пентацианонитрозилийферрат (II) натрия, нитропруссид натрия |
(FeFe2)O4 | оксид дижелеза (III) – железа (II), железная окалина, магнитный железняк, магнетит |
(FeFe2)I8 | йодид дижелеза (III) – железа (II) |
Fe2O3 | оксид железа (III), красный железняк, гематит |
Fe(OH)3 | гидроксид железа (III) |
FeO(OH) | метагидроксид железа (III) |
FeBr3. | гексагидрат бромида железа (III) |
Fe2(SO4)3.9H2O | нонагидрат сульфата железа (III) |
Fe(OH)SO4 | сульфат гидроксожелеза (III) |
(Fe(OH)2)2SO4 | сульфат дигидроксожелеза (III) |
Fe2(SeO3)3.3H2O | тригидрат селенита железа (III) |
Fe(NO3)3.9H2O | нонагидрат нитрата железа (III) |
FePO4 | фосфат железа (III) |
Fe(H2PO4)3 | дигидроортофосфат железа (III) |
Fe2(C2O4)3 | оксалат железа (III) |
Fe(CN)3 | цианид железа (III) |
Fe(NCS)3 | тиоцианат железа (III) |
KFeO2 | феррат (III) калия |
NH4Fe(SO4)2. | железоаммонийные квасцы |
Fe(ClO4)3.10H2O | декагидрат перхлората железа (III) |
K3[Fe(CN)6] | гексацианоферрат (III) калия, «красная кровяная соль» |
K3[Fe(NCS)6] | гексатиоцианатоферрат (III) калия |
K[Fe(OH)4] | тетрагидроксоферрат (III) калия |
K3[Fe(C2O4)3] | триаксалатоферрат (III) калия |
[Fe(C2H5)2]NO3 | нитрат бис(циклопентадиенил)железа (III) |
K2FeO4 | феррат (VI) калия |
BaFeO4 | феррат (VI) бария |
FeO4 | оксид железа феррат (VIII) калия |
Fe3C | карбид железа, цементит |
(Cr2Fe)O4 | оксид дихрома (II) – железа (III) |
Fe(CrO2) | хромистый железняк |
Fe2(CrO4)3 | хромат железа (III) |
Fe2(Cr2O7)3 | дихромат железа (III) |
KFe+3[Fe+2(CN)6] | гексацианоферрат (II) железа (III) – калия, берлинская лазурь, турнбулева синь |
KFe+2[Fe+3(CN)6] | гексацианоферрат (III) железа (II) – калия, берлинская лазурь, турнбулева синь |
Fe+34[Fe+2(CN)6]3 | гексацианоферрат (II) железа (III) |
Fe+23[Fe+3(CN)6]2 | гексацианоферрат (III) железа (II) |
9 фактов, которые вы должны знать
В этой статье мы должны обсудить структуру Льюиса FeCl2. Давайте поговорим о структуре Льюиса FeCl2 и 9 различных характеристиках.
Давайте поговорим о структуре Льюиса FeCl2 и 9 различных характеристиках.
FeCl2 часто называют хлоридом железа. Железистый термин подходит для Fe в степени окисления +2. В FeCl2 Fe находится в степени окисления +2. Электронная конфигурация Fe(II) d6. Поскольку FeCl2 является координационным соединением, Cl является здесь не только противоионом, но и лигандом. Геометрия структуры Льюиса FeCl2 представляет собой изогнутую форму, хотя в кристаллической форме она принимает октаэдрическую форму.
Поскольку Cl является лигандом с мягким полем, электронная пара не образуется на d-орбитали. Итак, Fe(II) – это объявление6 система высокого вращения здесь. Только одно подмножество спарено из-за шести электронов, присутствующих в пяти подмножествах. FeCl2 структура льюиса могут ионизироваться до ионов двухвалентного железа и хлорида.
Некоторые важные факты о FeCl2FeCl2 представляет собой твердую кристаллическую молекулу белого цвета. Это парамагнитное твердое тело из-за наличия четырех неспаренных электронов на d-орбитали. Цвет его тетрагидратной формы зеленоватый из-за его октаэдрической формы и перехода Лапорта. Но в безводной форме имеет белый цвет.
Это парамагнитное твердое тело из-за наличия четырех неспаренных электронов на d-орбитали. Цвет его тетрагидратной формы зеленоватый из-за его октаэдрической формы и перехода Лапорта. Но в безводной форме имеет белый цвет.
Ангидратную форму можно получить реакцией стальных отходов с соляной кислотой.
Fe + 2 HCl → FeCl2 + H2
Температура плавления и кипения FeCl2 составляют 950 К и 1296 К соответственно.
1. Как нарисовать структуру Льюиса FeCl2?Рисование FeCl2 структура льюиса это непростая задача. Поскольку FeCl2 является координационным соединением, а не ковалентной молекулой. Таким образом, здесь d-электроны будут участвовать в формировании связи, и управлять d-электронами для рисования структуры Льюиса непросто, потому что d-электроны следуют правилу 18 электронов, а не правилу октета. Итак, мы попытаемся легко нарисовать структуру Льюиса FeCl2 следующими способами.
Шаг 1– Во-первых, мы должны посчитать валентные электроны для Fe, а также для Cl. Валентные электроны Fe представляют собой d-электроны и p-электроны для атомов Cl и суммируются. В FeCl32 структура льюиса, валентные электроны для Fe равны 6, так как он находится в степени окисления +2, и все электроны принадлежат только его d-орбитали, для трех атомов Cl 7 * 2 = 14. Таким образом, общее количество валентных электронов составляет 6 + 14 = 20.
Валентные электроны Fe представляют собой d-электроны и p-электроны для атомов Cl и суммируются. В FeCl32 структура льюиса, валентные электроны для Fe равны 6, так как он находится в степени окисления +2, и все электроны принадлежат только его d-орбитали, для трех атомов Cl 7 * 2 = 14. Таким образом, общее количество валентных электронов составляет 6 + 14 = 20.
Шаг 2 — Fecl2 будет следовать правилу 18 электронов, потому что это координационное соединение. Это похоже на правило октета координационной молекулы. Электроны, которые понадобятся для FeCl2 структура льюиса будет 8 + (2 * 8) = 24, потому что правило октета требовало 8 электронов в валентной оболочке для каждого атома. Мы получаем, что доступные валентные электроны равны 20 из предыдущего расчета для FeCl2. Теперь необходимые электроны будут (24-20) = 4 электронов и минимальное количество связей, необходимых для того, чтобы все три атома были соединены в этой молекуле 4/2 = 2 связи.
Шаг 3. Пришло время определиться с центральным атомом в FeCl2. структура льюиса. Fe здесь является центральным атомом, так как он электроположителен, потому что это переходный металл., тогда как Cl относится к семейству галогенов и является более электроотрицательным атомом.
Шаг 4 – Соединить два атома Cl с центральным Fe через минимально необходимое количество одинарных связей, т.е. две. Так, Fe образует две одинарные связи с двумя атомами Cl со своей d-орбитали. электроны в FeCl2 структура льюиса.
Шаг -5 После образования связи мы должны проверить количество неподеленных пар, доступных в молекуле. Итак, проверяем, какие атомы в составе FeCl2 структура льюиса содержит неподеленные пары. В структуре Льюиса FeCl2 Fe имеет степень окисления +2, поэтому это объявление6 системе и не имеет неподеленных пар на своей d-орбитали.. Итак, мы проверяем неподеленные пары над атомами Cl.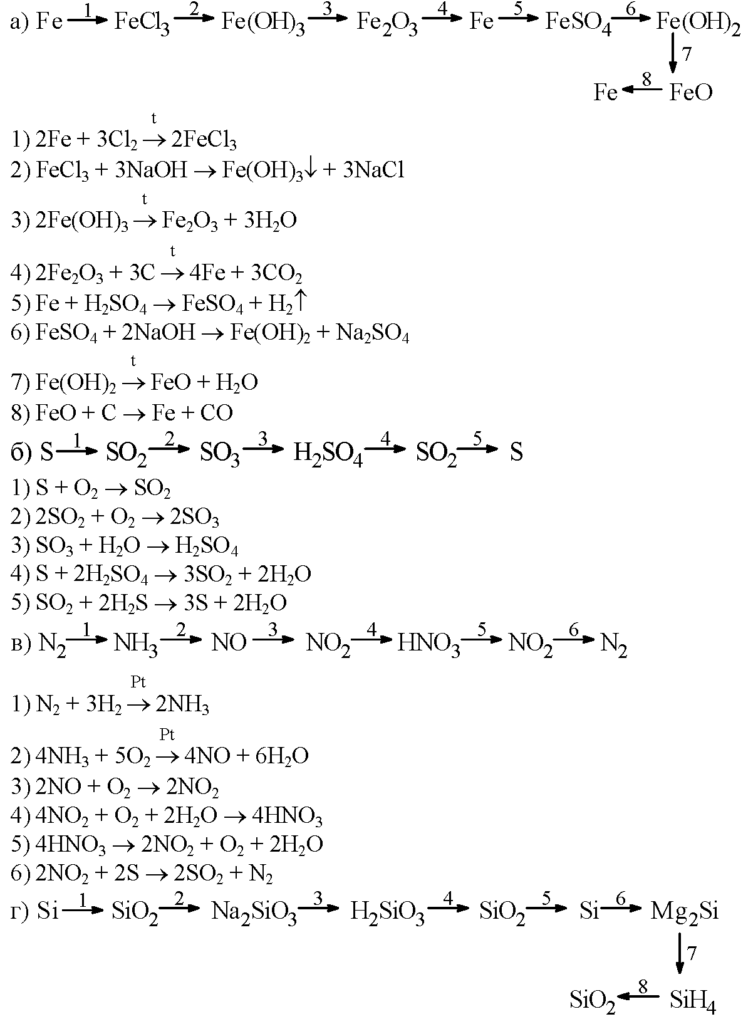 Cl группа 17th элемент и из семейства галогенов. Итак, после образования связи у него есть три пары неподеленных пар. Таким образом, неподеленные пары отнесены только к атомам Cl.
Cl группа 17th элемент и из семейства галогенов. Итак, после образования связи у него есть три пары неподеленных пар. Таким образом, неподеленные пары отнесены только к атомам Cl.
Весь октет завершен после образования связи и назначения неподеленных пар, поэтому нет необходимости добавлять какие-либо кратные связи в структуру Льюиса FeCl2.
2. Гибридизация FeCl2Метод связывания координационного соединения или металлического соединения отличается. Они не следуют правилу теории валентных связей (VBT). Они будут следовать CFT, т.е. теории кристаллического поля. Гибридизация является следствием VBT. Таким образом, сложно определить гибридизацию структуры Льюиса FeCl2.
Итак, мы прогнозируем гибридизация структуры FeCl2 по форме Льюиса. Форма изогнута, присутствуют два окружающих атома и не участвуют неподеленные пары, поэтому в гибридизации будут участвовать две орбитали, и гибридизация будет sp.
В гибридизации FeCl2 не участвуют его d-электроны, потому что они не являются его самой внешней орбиталью, и из-за присутствия лиганда слабого поля Cl вклад будет вносить только внешняя орбиталь, они являются 3s- и 4p-орбиталями. Итак, это еще один пример внешнего орбитального комплекса, такого как FeCl3.
Если использовать типичную формулу для расчета гибридизации, Н = 0.5 (В+М-С+А),
H = ½ (2 + 2 + 0 + 0) = 2 (sp), Fe имеет два электрона, кроме шести электронов на его d-орбитали, и присутствуют два атома Cl. Из теории VSEPR, если количество орбиталей, смешанных при гибридизации, равно 2, то центральный атом — это sp2 гибридизированный.
Давайте нарисовать и понять гибридизацию структуры Льюиса FeCl2.
Гибридизация FeCl2По ящичной диаграмме Fe(II) можно сказать, что в образовании связи участвуют только 4s- и 4p-орбитали. FeCl2 низкая структура. Итак, гибридизация sp. 4s- и 4p-орбитали являются внешними орбиталями для Fe, поэтому это внешний орбитальный комплекс. Когда он образует тетрагидраты, четыре молекулы воды связываются с четырьмя неспаренными электронами на d-орбитали и образуют октаэдрический комплекс.
Когда он образует тетрагидраты, четыре молекулы воды связываются с четырьмя неспаренными электронами на d-орбитали и образуют октаэдрический комплекс.
Координационное соединение является несколько ковалентным. Но в FeCl2 структура льюиса, два иона Fe и Cl могут быть разделены из-за больших ионных различий и также проявляют ионный характер. В водном растворе он легко ионизируется, а Fe(II) легко поляризует хлорид-анионы. Таким образом, FeCl2 помимо ковалентного характера имеет ионный характер.
2. Растворяется ли FeCl2 в воде?Любая полярная молекула будет растворяться в полярном растворителе (подобное растворяется подобно). Вода является полярным протонным растворителем и также может образовывать Н-связь. FeCl2 является полярной молекулой, потому что разница зарядов между Fe и Cl настолько велика, а из-за изогнутой формы молекула делает ее полярной. Так что, естественно, FeCl2 растворим в воде.
Так что, естественно, FeCl2 растворим в воде.
После растворения в воде любой молекулы эта форма называется водной формой этой конкретной молекулы. Как обсуждалось ранее, FeCl2 структура льюиса растворим в воде, поэтому после растворимости весь раствор называется водным раствором FeCl2. Таким образом, FeCl2 может легко превращаться в водный раствор после растворения в воде.
В водном растворе FeCl2 можно легко ионизировать для разделения двух ионных форм.
FeCl2(водн.) = Fe2+ (водн.) + 2Cl–(Водно)
4. FeCl2 это соль?Реакция между кислотой и основанием всегда дает нам соль и воду. Итак, если молекула образуется в результате реакции между кислотой и основной молекулой, она называется солью. Соль представляет собой комбинацию встречного катиона основной молекулы и встречного аниона кислых молекул.
Если бы мы реагировали гидроксидом железа с соляной кислотой, мы должны были бы получить FeCl2 в виде соли вместе с водой в качестве побочного продукта.
Fe (OH)2 + 2HCl = FeCl2 + 2H2O
Таким образом, в основном соль является частью нейтрализации кислоты и основания после реакции, и соль не обладает ни кислотными, ни основными свойствами. Итак, FeCl2 — это соль.
5. Является ли FeCl2 сильным электролитом?Вещество, которое растворяется в воде или другом полярном растворителе с образованием ионов и раствором, проводящим электричество, называется электролиты. В водном растворе FeCl2 мы уже видим, что FeCl2 полностью ионизируется в этом растворе с образованием ионов двухвалентного железа и хлорида. Эти ионы являются очень хорошими проводниками электричества. Так вот, если мы пропускали ток в водном растворе FeCl2, то он может очень хорошо проводить ток. Таким образом, FeCl2 является сильным электролитом.
Если соединение нерастворимо в воде, его можно осадить в реакционном сосуде. Но FeCl2 растворим в воде, поэтому FeCl2 не может существовать в виде осадка. Осадок также может образовываться за счет реакции двух соединений и в водном растворе продукт будет нерастворим в воде.
7. Реагирует ли FeCl2 с HCl?Когда мы реагировали Fe с HCl, вместо FeCl2 образуется FeCl3. Потому что FeCl2 является термодинамически более стабильным продуктом. Это реакция замещения, и металл может легко вытеснить H2 из HCl, поэтому вместо FeCl2 образуется FeCl3.
ЗаключениеFeCl2 также является координационным соединением и может образовывать тетрагидраты с октаэдрической геометрией. Cl является лигандом со слабым полем, поэтому система является слабоспиновой, а Fe имеет степень окисления +2. Итак, электронная конфигурация будет d6 высокий спин. FeCl2 растворим в воде и является сильным электролитом.
Итак, электронная конфигурация будет d6 высокий спин. FeCl2 растворим в воде и является сильным электролитом.
Разница между хлоридом железа II и хлоридом железа III
Ключевое различие между хлоридом железа II и хлоридом железа III заключается в том, что атом Fe в химическом соединении хлорида железа (II) имеет степень окисления +2, тогда как атом Fe в Соединение хлорида железа (III) имеет степень окисления +3 .
Хлорид железа (II) и хлорид железа (III) являются важными неорганическими соединениями химического элемента железа (Fe). Хлорид железа II также называют хлоридом железа, а хлорид железа III называют хлоридом железа.
СОДЕРЖАНИЕ
1. Обзор и основные различия
2. Что такое хлорид железа II
3. Что такое хлорид железа III
4. Прямые сравнения — хлорид железа II и хлорид железа III в табличной форме
5. Резюме
Что такое хлорид железа II?
Хлорид железа(II) представляет собой FeCl2, где атом Fe находится в степени окисления +2. Его также называют хлоридом железа. Это соединение является парамагнитным, потому что оно имеет неспаренные электроны, которые позволяют этому соединению притягиваться к внешнему магнитному полю. Это твердое вещество желтовато-коричневого цвета с высокой температурой плавления. Существует две формы хлорида железа (II): безводная форма и форма тетрагидрата. Форма тетрагидрата имеет бледно-зеленый цвет. Однако существует и менее распространенная форма дигидрата.
Его также называют хлоридом железа. Это соединение является парамагнитным, потому что оно имеет неспаренные электроны, которые позволяют этому соединению притягиваться к внешнему магнитному полю. Это твердое вещество желтовато-коричневого цвета с высокой температурой плавления. Существует две формы хлорида железа (II): безводная форма и форма тетрагидрата. Форма тетрагидрата имеет бледно-зеленый цвет. Однако существует и менее распространенная форма дигидрата.
Твердый хлорид железа(II) может кристаллизоваться из воды в виде зеленоватого тетрагидрата. Это вещество хорошо растворяется в воде и при растворении в воде дает бледно-зеленый раствор. Мы можем производить гидратированные формы хлорида железа (II) путем обработки отходов производства стали кислотой HCl. Этот тип растворов можно назвать отработанной кислотой или травильным раствором. Кроме того, безводная форма этого соединения может быть получена добавлением порошка железа к раствору кислоты HCl в метаноле.
Рисунок 01: Ангидрат хлорида железа (II)
Существуют различные области применения хлорида железа (II), включая производство хлорида железа (III), регенерацию соляной кислоты в процессе ее приготовления, коагуляцию и флокуляцию. агент для очистки сточных вод, полезный для контроля запаха при очистке сточных вод и т. д.
агент для очистки сточных вод, полезный для контроля запаха при очистке сточных вод и т. д.
Что такое хлорид железа III?
Хлорид железа(III) представляет собой FeCl3, где атом Fe находится в степени окисления +3. Его также называют хлоридом железа. Это обычное соединение химического элемента железа. Это кристаллическое твердое вещество различных цветов; цвет зависит от угла обзора, т.е. кристаллы имеют темно-зеленый цвет в отраженном свете, тогда как кристаллы появляются в пурпурно-красном цвете в проходящем свете.
Рисунок 02: Хлорид железа III в проходящем свете
Существуют три основные гидратированные формы соединения хлорида железа(III). Это FeCl3.6h3O, FeCl3.2.5h3O, FeCl3.2h3O и FeCl3.3.5h3O. Характерно, что водные растворы хлорного железа окрашены в желтый цвет.
Безводная форма хлорида железа (III) может быть получена с помощью комбинации элементов, где Fe взаимодействует с газообразным Cl2. Однако растворы хлорида железа можно приготовить из железа, и этот процесс включает растворение железной руды в соляной кислоте с последующим окислением хлорида железа (II) хлором или окислением хлорида железа (II) газообразным кислородом.
В чем разница между хлоридом железа II и хлоридом железа III?
Хлорид железа (II) и хлорид железа (III) представляют собой неорганические соединения, содержащие анионы железа (Fe) и хлорида, связанные друг с другом посредством ионной связи. Ключевое различие между хлоридом железа II и хлоридом железа III заключается в том, что атом Fe в химическом соединении хлорида железа (II) имеет степень окисления +2, тогда как атом Fe в соединении хлорида железа (III) имеет степень окисления +3. Хлорид железа (II) имеет две основные формы: дигидратную форму и тетрагидратную форму. Хлорид железа (III) имеет четыре основные формы: FeCl3,6h3O, FeCl3,2,5h3O, FeCl3,2h3O и FeCl3,3,5h3O.
Ниже инфографика показывает больше различий между хлоридом железа II и хлоридом железа III в табличной форме.
Резюме – Хлорид железа II в сравнении с хлоридом железа III
Хлорид железа(II) и хлорид железа(III) представляют собой неорганические соединения, содержащие анионы железа (Fe) и хлорида, связанные друг с другом за счет ионной связи. Ключевое различие между хлоридом железа II и хлоридом железа III заключается в том, что атом Fe в химическом соединении хлорида железа (II) имеет степень окисления +2, тогда как атом Fe в соединении хлорида железа (III) имеет степень окисления +3.
Ключевое различие между хлоридом железа II и хлоридом железа III заключается в том, что атом Fe в химическом соединении хлорида железа (II) имеет степень окисления +2, тогда как атом Fe в соединении хлорида железа (III) имеет степень окисления +3.
Ссылка:
1. «Хлорное железо». Pubchem, доступно здесь.
Изображение предоставлено:
1. «Ангидрат хлорида железа (II)» Лейем — собственная работа (CC BY-SA 4.0) через Commons Wikimedia
2. «Ангидрат хлорида железа (III)» Лейем — собственная работа (CC BY-SA 4.0) через Commons Wikimedia
неорганическая химия — образование хлорида железа или хлорида железа
спросил
Изменено 4 года, 11 месяцев назад
Просмотрено 5к раз
$\begingroup$
Вопрос
При взаимодействии $\ce{HCl}$ с тонкоизмельченным железом образуется хлорид железа, а не хлорид железа.

 H2O
H2O 2H2O
2H2O
 6H2O
6H2O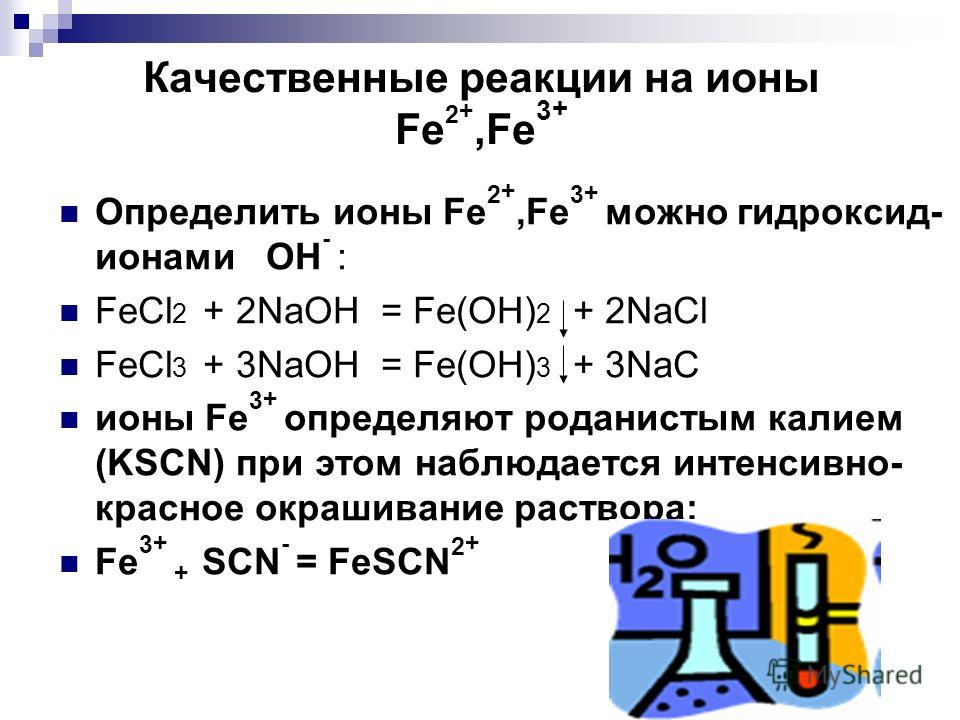 12H2O
12H2O