что, как сбалансировать и часто задаваемые вопросы
By Сурья Сатья
H2SO4 является сильной кислотой, поэтому она может реагировать с нейтральным основанием K2SO4 . Давайте посмотрим на факты, связанные с этой реакцией.
H2SO4 очень гигроскопичен и недоступен в природе на Земле из-за его высокой способности превращаться в пар, а его молярная масса составляет 98.079 г / моль К.2SO4 представляет собой бесцветное неорганическое соединение, его молярная масса составляет 174.259 г/моль·К.2SO4 является окислителем, так что он может окислять H2SO4 уменьшая себя.
В этой статье мы обсудим некоторые характеристики H2SO4 + К2SO4 реакция, как и ее продукты, действующие силы и тип смещения.
Что является произведением H
2SO4 и K2SO4Гидросульфат калия образуется в ходе реакции H2SO4+K2SO4.
H2SO4(Водно) +K2SO4 (водно) = 2ХСО4 (водно)
Какой тип реакции Н
2SO4 + К2SO4H2SO4+K2SO4 считается кислотно-щелочной реакцией.
Как сбалансировать H
2SO4 + К2SO4Реакция Н2SO4 + К2SO4 балансируется с помощью следующих шагов.
H2SO4(Водно) +K2SO4 (водно) = 2ХСО4 (водно)
- Подсчитайте количество атомов как на стороне реагентов, так и на стороне продуктов..
- Следующая таблица дает нам подробную информацию о количестве атомов, присутствующих как на стороне реагентов, так и на стороне продуктов.
| атомы | Сторона реагентов | Сторона продуктов |
|---|---|---|
| H | 2 | 1 |
| S | 2 | 1 |
| O | 8 | 4 |
| K | 2 | 1 |
- Поместите требуемые стехиометрические значения перед несбалансированными атомами.
 чтобы получить сбалансированное химическое уравнение.
чтобы получить сбалансированное химическое уравнение.
- Реакция уравновешивается, если поставить 2 в качестве коэффициента KHSO.4.
- Таким образом, сбалансированное химическое уравнение имеет вид;
- H2SO4(Водно) +K2SO4 (водно) = 2ХСО4 (водно)
H
2SO4 + К2SO4 титрованиеH2SO4 + К2SO4 титрование невозможно, поскольку K2SO4 является нейтральной солью, поэтому не может подвергаться титрованию.
H
2SO4 + К2SO4 чистое ионное уравнениеЧистое ионное уравнение для H2SO4 + К2SO4 реакция
2H+(aq) + ТАК42-(aq) + ТАК42-(вода) =2HSO4–(aq)
Следующие шаги используются для получения чистого ионного уравнения.
- Напишите сбалансированное химическое уравнение.
- Сбалансированное химическое уравнение для H2SO4 + К2SO4 реакция
- H2SO4(Водно) +K2SO4 (водно) = 2ХСО4 (водно)
- Разделить сильные электролиты на ионную форму.
- В этой реакции все являются сильными электролитами, поэтому полное ионное уравнение имеет вид
- 2H+(aq) + ТАК42-(aq) + 2 К+(aq) + ТАК42-(aq) = 2К+(aq) + 2HSO4–(aq)
- Отмена ионов-спектаторов для получения общего ионного уравнения.

- После исключения ионов-спектаторов с обеих сторон результирующее ионное уравнение для вышеуказанной реакции имеет вид
- 2H+(aq) + ТАК42-(aq) + ТАК42-(вода) =2HSO4–(aq)
H
2SO4 + К2SO4 сопряженные пары- H2SO4 и Н2SO4– это сопряженные кислотно-основные пары образован в H2SO4 + К2SO4 реакция.
- K2SO4 не имеет сопряженных пар из-за своей нейтральной природы.
H
2SO4 и K2SO4 межмолекулярные силы- Водородная связь, диполь-дипольное взаимодействие и Силы Вандер-Вааля межмолекулярные силы, присутствующие в H2SO4 где водородная связь наиболее прочная.

- Чернила2SO4 ион-ионные взаимодействия находится между атомами молекулы.
H
2SO4 + К2SO4 энтальпия реакцииH2SO4 + К2SO4 энтальпия реакции еще не найдена в базе данных исследований из-за сильного окислительного характера K2SO4.
Н
2SO4 + К2SO4 буферный растворH2SO4 + К2SO4 не буферный раствор потому что К2SO4 представляет собой нейтральную основную соль, а H2SO4 является сильной кислотой, поэтому оба не подходят для образования буферного раствора..
Н
2SO4 + К2SO4 полная реакцияH2SO4 + К2SO4 является полной реакцией, потому что KHSO4 стабилен, поэтому не вступает в дальнейшие реакции.
Н
2SO4 + К2SO4 экзотермическая или эндотермическая реакцияОтсутствует литературный отчет по экзотермический or эндотермический природа H2SO4 + К2SO4 реакция.
Н
2SO4 + К2SO4 окислительно-восстановительная реакцияH2SO4 + К2SO4 не окислительно-восстановительная реакция так как не наблюдается изменения степени окисления реагентов.
Н
2SO4 + К2SO4 реакция осажденияH2SO4 + К2SO4 не реакция осаждения так как не образуется осадок.
Н
2SO4 + К2SO4 обратимая или необратимая реакцияH2SO4 + К2SO4 не является обратимой реакцией, так как KHSO4 произведенный требует большого количества энергии для прохождения обратной реакции, что невозможно в этом случае.
Н
2SO4 + К2SO4 реакция смещенияH2SO4 + К2SO4 не является реакцией замещения, так как смещения атомов не наблюдается.
Как сбалансировать H
2SO4+K2SO4 + MnO2 = H2О + КМnО4 + MnSO4Реакция уравновешивается с помощью следующей стадииs.
2H2SO4 + К2SO4 + 5MnO2 = 2Н2О + 2KMnO4 + 3MnSO4
- Подсчитайте количество атомов на сторонах реагентов и продуктов.
- В следующей таблице указано количество атомов с обеих сторон.
| атомы | Сторона реагентов | Сторона продуктов |
|---|---|---|
| H | 2 | 2 |
| S | 2 | 1 |
| O | 10 | 9 |
| K | 2 | 1 |
| Mn | 1 | 1 |
- Поместите стехиометрические коэффициенты перед несбалансированными атомами.
 .
.
- Наша первая попытка была реализована, поставив 2 как коэффициент KMnO4 и 4 как коэффициент MnO2, а 2 как коэффициент MnSO4, но реакция еще не уравновешена.
- H2SO4 + К2SO4 + 4MnO2 = H2О + 2KMnO4 + 2MnSO4
- Поместите необходимые стехиометрические коэффициенты, чтобы получить сбалансированное уравнение.
- Реакция уравновешивается, если поставить 2 в качестве коэффициента H2SO4 и 5 как коэффициент MnO2, а 2,2,3 как коэффициент H2О, КМnО4 и MnSO4.
- Следовательно, сбалансированное химическое уравнение для H2SO4 + K2SO4 + MnO2 реакция
- 2H2SO4 + K2SO4 + 5MnO2 = 2Н2О + 2KMnO4 + 3MnSO4
Заключение
ХСО4, образующийся во время этой реакции, представляет собой бесцветный гигроскопичный кристалл, известный как кислый сульфат калия. Его температура кипения составляет 300°С. ХСО4 действует как химический разрыхлитель и сильный окислитель. В основном используется в виноделии для приготовления тартрата калия.
Его температура кипения составляет 300°С. ХСО4 действует как химический разрыхлитель и сильный окислитель. В основном используется в виноделии для приготовления тартрата калия.
Закон эквивалентов | Химик.ПРО – решение задач по химии бесплатно
Закон эквивалентов — массы реагирующих веществ прямопропорциональны молярным массам эквивалента этих веществ.
Масса сульфита натрия
Какая масса сульфита натрия (Na2SO3) потребуется для восстановления 0,05 литра 0,1 нормального перманганата калия (KMnO4) в присутствии серной кислоты?
Категории: Закон эквивалентов , Основные законы химии и стехиометрические расчеты , Расчеты по химическим уравнениям
Комментировать
Молярная масса эквивалента хромата калия
Вычислите молярную массу эквивалента хромата калия (K2CrO4) как окислителя, если хромат калия (K2CrO4) восстанавливается до хромита калия (KCrO2).
Категории: Закон эквивалентов , Основные законы химии и стехиометрические расчеты
Комментировать
Эквивалентная масса металла
При растворении в кислоте металла массой 11,9 грамм выделился водород объемом 2,24 литра (нормальные условия). Чему равна эквивалентная масса металла ( Мэкв) и фактор эквивалентности металла (fэкв).
Чему равна эквивалентная масса металла ( Мэкв) и фактор эквивалентности металла (fэкв).
Категории: Закон эквивалентов , Основные законы химии и стехиометрические расчеты
Комментировать
Соляная кислота вода
К какому объёму воды следует добавить 1 миллилитр соляной кислоты (HCl) с молярной концентрацией 0,1 моль/л, чтобы получить раствор с рОН 11?
Категории: Закон эквивалентов , Основные законы химии и стехиометрические расчеты , Разбавление и приготовление более концентрированных растворов , Растворы
Комментировать
Молярная масса эквивалента вещества
Вычислить молярные массы эквивалента вещества: хлорида цинка (ZnCl2), карбоната натрия (Na2CO3), гидроксида алюминия (Al(OH)3).
Категории: Закон эквивалентов , Основные законы химии и стехиометрические расчеты
Комментировать
Вычислить молярные массы эквивалентов (тригидроксид железа)
Определите эквиваленты и вычислить молярные массы эквивалентов тригидроксида железа (Fe(OH)3) в реакциях: Fe(OH)3 + 3 HCl = FeCl3 +3h3O; Fe(OH)3 + 2 HCl = FeOHCl2 +2h3O; Fe(OH)3 + HCl = Fe(OH)2Cl + h3O.
Категории: Закон эквивалентов , Основные законы химии и стехиометрические расчеты
4 комментария
Определить эквивалентную массу
Вычислить фактор эквивалентности и определить эквивалентную массу ортофосфорной кислоты (h4PO4) в реакциях образования гидрофосфата, дигидрофосфата и ортофосфата.
Категории: Закон эквивалентов , Основные законы химии и стехиометрические расчеты
Комментировать
Эквивалентная масса серы
Какова эквивалентная масса серы (S), если 4 грамма ее окисляются 2,8 литрами кислорода (O) (нормальные условия)?
Категории: Закон эквивалентов , Основные законы химии и стехиометрические расчеты
Комментировать
Молярная масса эквивалента (серная кислота)
При взаимодействии серной кислоты (h3SO4) со щелочью образуются соли гидросульфат калия (KHSO4) и сульфат калия (K2SO4). Вычислить эквивалент и молярные массы эквивалентов кислоты для каждого случая. Написать соответствующие уравнения реакций.
Категории: Закон эквивалентов , Основные законы химии и стехиометрические расчеты
Комментировать
Масса эквивалента
Найдите массу эквивалента металла, если 3 грамма его реагируют с 2 граммами кислорода (O2).
Категории: Закон эквивалентов , Основные законы химии и стехиометрические расчеты
Комментировать
Что, как сбалансировать и часто задаваемые вопросы
By Surya Satya
H 2 SO 4 является сильной кислотой, поэтому она может реагировать с нейтральным основанием K 2 SO 4 . Давайте посмотрим на факты, связанные с этой реакцией.
H 2 SO 4 обладает высокой гигроскопичностью и недоступен в природе на Земле из-за высокого сродства к испарению, а его молярная масса составляет 98,079 г/моль.K 2 SO 4 — бесцветное неорганическое соединение с молярной массой 174,259.г/моль.K 2 SO 4 является окислителем, так что он может окислять H 2 SO 4 путем своего восстановления.
В этой статье обсуждаются некоторые характеристики реакции H 2 SO 4 + K 2 SO 4 , такие как ее продукты, действующие силы и тип смещения.
Что является продуктом H
2 SO 4 и K 2 SO 4Гидросульфат калия образуется в ходе реакции H 2 SO 4 +K 2 SO 4 .
H 2 SO 4 (AQ) +K 2 SO 4 (AQ) = 2KHSO 4 (AQ)
Какой тип реакции — H
2 SO. 4
+ K 2 SO 4H 2 SO 4 +K 2 SO 4 считается кислотно-щелочной реакцией.
Как сбалансировать H
2 SO 4 + K 2 SO 4 Реакция H 2 SO 4 + K 2 SO 4 уравновешивается с использованием следующих шагов 9.
H 2 SO 4 (AQ) +K 2 SO 4 (AQ) = 2KHSO 4 (aq)
- Подсчет Количество оба на атсомы на оба на Ат -Атомы и на Атом на Атом на Атом на Атом оба иапта. сторона продуктов .
- Следующая таблица дает нам подробную информацию о количестве атомов, присутствующих как на стороне реагентов, так и на стороне продуктов.
| Atoms | Reactants side | Products side |
|---|---|---|
| H | 2 | 1 |
| S | 2 | 1 |
| O | 8 | 4 |
| K | 2 | 1 |
- Реакция уравновешивается путем подстановки 2 в качестве коэффициента KHSO 4 .

- Таким образом, сбалансированное химическое уравнение ;
- H 2 SO 4 (aq) +K 2 SO 4(aq) = 2KHSO 4(aq)
H
2 SO 4 + K 2 SO 4 титрованиеH 2 SO 4 + K 2 SO 4 титрование невозможно, т.к.
H
2 SO 4 + K 2 SO 4 Чистое ионное уравнениеЧистое ионное уравнение для H 2 SO 4 + K 2 SO 4 .
2H + ( aq ) + SO 4 2- ( aq ) + SO 4 2- ( aq) =2HSO 4 – ( aq )
Следующие шаги используются для получения результирующего ионного уравнения .
- Напишите сбалансированное химическое уравнение .
- Сбалансированное химическое уравнение для H 2 SO 4 + K 2 SO 4 Реакция составляет
- H 2 SO 4 (AQ) +K 2 SO 4 (AQ) = 2KHS.O 46 466 (AQ) 466 466 (AQ).
- Разделить сильные электролиты на ионную форму .
- В этой реакции все являются сильными электролитами, поэтому полное ионное уравнение имеет вид0294) + SO 4 2- ( AQ ) + 2K + ( AQ ) + SO 4 2-) + SO 4 2- ( 4 2-). + ( AQ ) + 2HSO 4 — ( AQ )
- .

- После исключения ионов-спектаторов с обеих сторон, итоговое ионное уравнение для вышеуказанной реакции равно
- 2H + ( aq ) + SO 4 2- ( aq ) + SO 4 2- ( aq) = 2HSO 4 — ( AQ )
H
2 SO 4 + K 2 SO 4 СОЗДА. H 2 SO 4 – – сопряженные кислотно-основные пары, образующиеся в реакции H 2 SO 4 + K 2 SO 4 .H
2 SO 4 и K 2 SO 4 БОЛЬШОЙ ДЛЯ ДЕЙСТВИЯ- .
 межмолекулярные силы, присутствующие в H 2 SO 4 где водородная связь наиболее прочная.
межмолекулярные силы, присутствующие в H 2 SO 4 где водородная связь наиболее прочная.
- In K 2 SO 4 Между атомами молекулы присутствует ион-ионное взаимодействие.
H
2 SO 4 + K 2 SO 4 Этальпия реакцииH 2 .0006 SO 4 + K 2 SO 4 энтальпия реакции еще не найдена в базе данных исследований из-за сильного окислительного характера K 2 SO 4 .
IS H
2 SO 4 + K 2 SO 4 A Buffer Solution H 2 Таким образом, 4 + K 2 SO 4 не является буферным раствором, потому что k 2 2 SO 4 представляет собой нейтральную основную соль и H 2 SO 4 является сильной кислотой, поэтому оба не подходят для образования буферного раствора .
IS H
2 SO 4 + K 2 SO 4 Полная реакцияH 2 SO 4 + K 2 SO 4 — это полная реакция, потому что KHSO + K . 4 стабилен, поэтому не вступает в дальнейшую реакцию .
Is H
2 SO 4 + K 2 SO 4 экзотермическая или эндотермическая реакцияВ литературе нет сведений об экзотермической или эндотермической природе реакции H 2 SO 4 + K 2 SO 4 .
IS H
2 SO 4 + K 2 SO 4 Окислительно -восстановительная реакция H 2 , поэтому 4 + K 2 SO 4 не является реакцией RODOX, так как NO no k 2 не является реакцией RODOX, не является реакцией RODOX. наблюдается изменение степени окисления реагентов .
Н
2 SO 4 + K 2 SO 4 Реакция осадковH 2 Таким образом, 4 + K 2 , так что 4 не является реакцией осаждения, так как не является предотвращением. сформировался.
IS H
2 SO 4 + K 2 SO 4 Обратимая или необратимая реакцияH 2 SO 4 + K 2 SO 4 2 — не A A — не A A AT AS AIS AIS AIS AIS A IS A A AT AS AIS AS AIS AS AIS A IS AS AIS AS AIS A IS A A AT AS AIS AIS A IS AS AIS AIS AS AIS A IS A A AT AS AIS AIS AIS A IS AS ARAI обратимая реакция с KHSO 4 произведено требует большого количества энергии для прохождения обратной реакции, что невозможно в данном случае .
IS H
2 SO 4 + K 2 SO 4 Реакция смещения H 2 SO 4 + K 2 SO 4 не является линейной реакцией с тех пор. смещения атомов не наблюдается .
смещения атомов не наблюдается .
Как сбалансировать H
2 SO 4 +K 2 SO 4 +MnO 2 = H 2 O + KMnO 4 + MnSO 4
2H 2 SO 4 + K 2 SO 4 + 5MNO 2 = 2H 2 O + 2KMNO 4 + 3MNSO 4 91492
- 9003
- 9003 9003
- 9003 9003 9000 3
- 9003 9003 9000 3
- 9000 3 9000 9000 3 9000 3 . атомов со стороны реагентов и продуктов.
- В следующей таблице указано количество атомов с обеих сторон.
| Atoms | Reactants Side | Products side |
|---|---|---|
| H | 2 | 2 |
| S | 2 | 1 |
| О | 10 | 9 |
| К | 2 | 1 |
| Mn | 1 | 1 |
- Поместите стехиометрические коэффициенты перед неуравновешенными атомами .

- Наша первая попытка была осуществлена путем размещения 2 в качестве коэффициента KMnO 4 и 4 в качестве коэффициента MnO 2 , и 2 в качестве коэффициента MnSO 4 , но реакция все равно не уравновешивалась. .
- H 2 SO 4 + K 2 SO 4 + 4MNO 2 = H 2 O + 2KMNO 4 + 2MNSO 4
- 40006
- Реакция уравновешивается путем подстановки 2 в качестве коэффициента H 2 SO 4 и 5 в качестве коэффициента MnO 2 , и 2,2,3 в качестве коэффициента H 2 O, KMnO 4 и MnSO 4 .

- Таким образом, сбалансированное химическое уравнение для ч 2 SO 4 + K 2 SO 4 + MNO 2 + MNO 2 . 2 H 2 SO 4 + K 2 SO 4 + 5 MNO2 = 2H 2 0006 O + 2KMnO 4 + 3MnSO 4
Заключение
KHSO 4 , образующийся в ходе этой реакции, представляет собой бесцветный гигроскопичный кристалл, известный как сульфат калия. Его температура кипения составляет 300 °C. KHSO 4 действует как химический разрыхлитель и сильный окислитель. В основном используется в виноделии для приготовления тартрата калия.
h3C2O4 + K2Cr2O7 + h3SO4 = Cr2(SO4)3 + K2SO4 + CO2 + h3O
30 сентября 2022 г. Тубус для обучения
Химическая реакция, без категорий
0
Тубус для обучения
Химическая реакция, без категорий
0
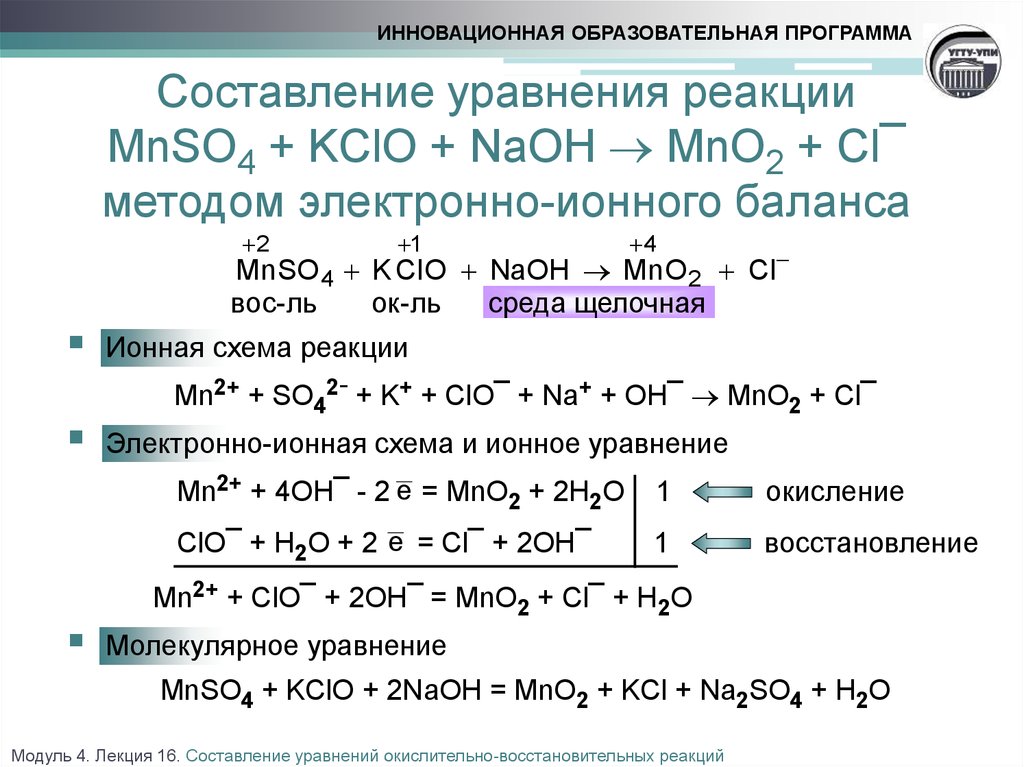
Щавелевая кислота, дихромат калия и серная кислота (h3C2O4 K2Cr2O7 h3SO4) реагируют друг с другом. В этой реакции щавелевая кислота (h3C2O4) взаимодействует с дихроматом калия (K2Cr2O7). Серная кислота создает кислую среду, чтобы помочь этой реакции, которая является реакцией окисления-восстановления. Как известно, окислительно-восстановительные реакции называются окислительно-восстановительными. Поскольку приведенная выше реакция является окислительно-восстановительной, мы можем сбалансировать это химическое уравнение ионно-электронным методом.
Реакция щавелевой кислоты, серной кислоты и бихромата калия (h3C2O4 h3SO4 K2Cr2O7)
Эти известные химические вещества реагируют друг с другом и выделяют углекислый газ. Этот газ будет выходить из реакционной смеси. Когда происходит эта окислительно-восстановительная реакция, мы наблюдаем умопомрачительную игру изменения цвета. Химическое уравнение этой реакции приведено ниже.
3h3C2O4 + K2Cr2O7 + 4h3SO4 = Cr2(SO4)3 + K2SO4 + 6CO2 + 7h3O
В этой окислительно-восстановительной реакции h3C2O4, представляющий собой кислоту, не будет действовать как кислота. Потому что это не такая сильная кислота по сравнению с серной кислотой. Он будет действовать как восстановитель. С другой стороны, K2Cr2O7 будет действовать как окислитель.
Редоссудочный агент: H 2 C 2 O 4 или , C 2 O 4 -2 , и -окислительный агент: 15 2 6666 2 2 66 2 2 2 2 2 2 2 2 2 2 2 2 2 и . O 7 or, Cr 2 O 7 -2
Fig: Oxalic acid Reduction Half Reaction The K 2 Cr 2 O 7 или, Cr 2 O 7 -2 является сильным окислителем, поэтому в этой реакции он будет вести себя как окислитель. В кислых условиях дихромат калия будет принимать в общей сложности 6 электронов, так что степень окисления хрома, которая была +6 на стороне реагента, станет +3 в продукте. Таким образом, в соответствии с этим полуреакция восстановления будет иметь следующий вид:0291 + 14H + = 2Cr 3+ + 7H 2 O … … … (1)
В кислых условиях дихромат калия будет принимать в общей сложности 6 электронов, так что степень окисления хрома, которая была +6 на стороне реагента, станет +3 в продукте. Таким образом, в соответствии с этим полуреакция восстановления будет иметь следующий вид:0291 + 14H + = 2Cr 3+ + 7H 2 O … … … (1)
The oxalic acid H 2 C 2 O 4 — очень слабая кислота и органическая кислота. В химической реакции, упомянутой выше, он будет действовать как восстановитель. Всего он освободит два электрона и станет углекислым газом. Следовательно, степень окисления углерода в щавелевой кислоте равна +3 и станет +4 после высвобождения двух электронов (по одному электрону на каждый). В соответствии с этим условием полуреакция окисления принимает следующий вид:
C 2 O 4 -2 – 2e = 2CO 2 … … … (2)
Уравновешивание реакции
полуреакции восстановления. Теперь мы можем просто добавить эти две полуреакции, чтобы получить сбалансированную конечную реакцию. В любой окислительно-восстановительной реакции количество электронов, отдаваемых восстановителем, и количество электронов, принимаемых окислителем, должно быть одинаковым. Потому что другого способа обмена электронами в реакционной системе нет. Следовательно, полуреакция восстановления умножится в 1 раз, а уравнение полуреакции окисления умножится в 3 раза, чтобы сделать число электронов равным. Затем мы добавляем эти уравнения, чтобы найти сбалансированную конечную реакцию окисления-восстановления.
Теперь мы можем просто добавить эти две полуреакции, чтобы получить сбалансированную конечную реакцию. В любой окислительно-восстановительной реакции количество электронов, отдаваемых восстановителем, и количество электронов, принимаемых окислителем, должно быть одинаковым. Потому что другого способа обмена электронами в реакционной системе нет. Следовательно, полуреакция восстановления умножится в 1 раз, а уравнение полуреакции окисления умножится в 3 раза, чтобы сделать число электронов равным. Затем мы добавляем эти уравнения, чтобы найти сбалансированную конечную реакцию окисления-восстановления.
Cr 2 O 7 2- + 6e – + 14H + = 2Cr 3+ + 7H 2 O
3C 2 O 4 -2 – 6e = 6CO 2
Cr 2 O 7 2- + 14H + + 3C 2 O 4 -2 = 2Cr 3+ + 7H 2 O + 6CO 2
Теперь нужно добавить необходимые ионы и радикалы, получаем итоговую реакцию.

 чтобы получить сбалансированное химическое уравнение.
чтобы получить сбалансированное химическое уравнение.

 .
.

 межмолекулярные силы, присутствующие в H 2 SO 4 где водородная связь наиболее прочная.
межмолекулярные силы, присутствующие в H 2 SO 4 где водородная связь наиболее прочная. 
