Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.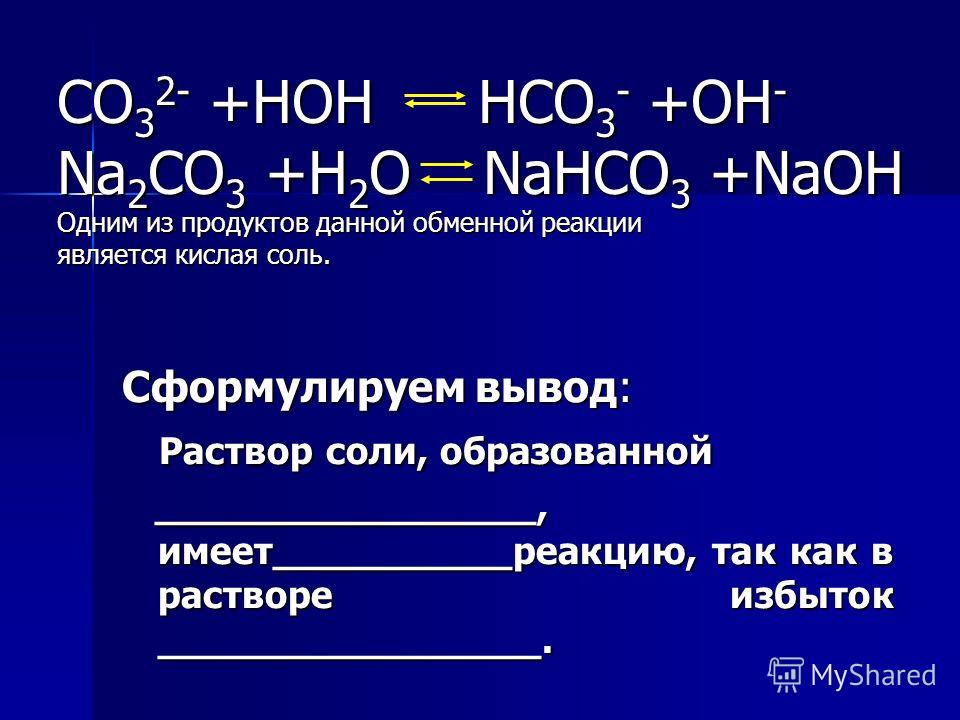
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
h3o o2 zno — здійсніть перетворення…. -reshimne.ru
Новые вопросы
Ответы
2h3O → 2h3+O2
O2+2Zn → 2ZnO
2h3O -> 2h3↑ + O2↑
2Zn + O2 -> 2ZnO
Похожие вопросы
h4C-CH-CH-Ch3-COOH
Ch4 Ch4…
Помогите, пожалуйста, даю 30 баллов
Рассчитать массу раствора h3SO4 с массовой долей растворённого вещества 10% надо взять для реакции с CaCO3, чтобы получить 200 мл CO2. 7,NaCl,Cal²,Al²S³…
7,NaCl,Cal²,Al²S³…
К раствору серной кислоты массой 50г с массовой долей 7% добавили избыток раствора naoh.найдите массу образовавшейся соли…
Какой объем углекислого газа выделиться при взаимодействии 126г азотной кислоты и 280г карбоната кальция
…
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Немецкий язык
МХК
ОБЖ
Психология
Найдите операторов сотовой связи и международных поставщиков услуг, которые предлагают обслуживание по eSIM
eSIM — это цифровая SIM-карта, которая позволяет активировать тарифный план мобильной связи вашего оператора без необходимости использовать физическую карту nano-SIM. Узнайте, какие операторы беспроводной связи в вашей стране или регионе предлагают сотовые тарифы для eSIM, активируемые путем активации eSIM оператором, быстрого переноса eSIM или другими способами активации. Международные поставщики услуг также предлагают тарифные планы с картами eSIM в более чем 190 странах и регионах для использования дома или во время путешествий. Если ваш iPhone не привязан к оператору, можно также использовать тарифные планы с картами eSIM, предлагаемые другими операторами.
Узнайте, какие операторы беспроводной связи в вашей стране или регионе предлагают сотовые тарифы для eSIM, активируемые путем активации eSIM оператором, быстрого переноса eSIM или другими способами активации. Международные поставщики услуг также предлагают тарифные планы с картами eSIM в более чем 190 странах и регионах для использования дома или во время путешествий. Если ваш iPhone не привязан к оператору, можно также использовать тарифные планы с картами eSIM, предлагаемые другими операторами.
Операторы сотовой связи, поддерживающие активацию eSIM оператором
Благодаря возможности активации eSIM оператором карта eSIM может быть назначена вашему устройству iPhone цифровым способом в момент его покупки. Вы также можете обратиться к своему оператору для получения eSIM после настройки устройства.
Австралия
Vodafone
Австрия
Magenta
Чешская Республика
Vodafone
Германия
Telekom
Vodafone
Венгрия
Magyar Telekom
Индия
Reliance Jio
Япония
au
Польша
T-Mobile
Румыния
Vodafone
Испания
Vodafone
Швейцария
Sunrise
Swisscom
Соединенное Королевство
EE
США
AT&T
Boost Mobile
Cellcom
Credo Mobile
C Spire
FirstNet
h3O Wireless
Spectrum Mobile
Straight Talk
Strata
T-Mobile USA
Tracfone
US Cellular
Verizon Wireless
Xfinity Mobile
Операторы сотовой связи, поддерживающие быстрый перенос eSIM
С помощью быстрого переноса eSIM вы можете перенести свой номер телефона с предыдущего устройства iPhone на новое без необходимости обращаться к оператору. Кроме того, вы можете преобразовать свою физическую SIM-карту в eSIM.
Кроме того, вы можете преобразовать свою физическую SIM-карту в eSIM.
Австралия
Vodafone
Бахрейн
Batelco
Финляндия
Telia
Германия
Telekom
Япония
au
Rakuten Mobile
Норвегия
OneCall
Telia
Швейцария
Sunrise
Swisscom
Таиланд
AIS
dtac
ОАЭ
Etisalat
Соединенное Королевство
EE
США
AT&T
C Spire
T-Mobile USA
US Cellular
Verizon Wireless
Операторы сотовой связи, поддерживающие другие способы активации eSIM
В дополнение к возможностям активации eSIM оператором и быстрому переносу eSIM эти операторы поддерживают другие способы активации eSIM на устройстве iPhone, такие как сканирование QR-кода или использование приложения оператора.
Албания
Vodafone
Аргентина
Claro
Movistar
Personal
Армения
Ucom
Австралия
Optus
Telstra
Truphone
Vodafone
Австрия
A1
Drei
Magenta
Багамские острова
Aliv
Бахрейн
Batelco
stc
Zain
Беларусь
A1
МТС
Бельгия
Orange
Ubigi
Бразилия
Claro
TIM
Vivo
Болгария
A1
Vivacom
Yettel
Буркина-Фасо
Orange
Камбоджа
Smart Axiata
Камерун
Orange
Канада
Bell
Fido
Freedom
Koodo
Lucky Mobile
Rogers
Shaw
Telus
Virgin
Чили
Entel
Movistar
Колумбия
Movistar
Хорватия
A1
Hrvatski Telekom
Чешская Республика
O2
T-Mobile
Vodafone
Дания
3
Telenor
Telia
Yousee
Эквадор
Movistar
Эстония
Tele2
Telia
Финляндия
DNA
Elisa
Telia
Франция
Bouygues Telecom
Free
Orange
SFR
Truphone
Ubigi
Французские Антильские острова
Orange
Германия
1&1
O2
Telekom
Truphone
Vodafone
Греция
Cosmote
Vodafone
Гуам
IT&E
Гонконг
1O1O
3
csl
China Mobile Hong Kong
SmarTone
Truphone
Венгрия
Magyar Telekom
Vodafone
Yettel
Исландия
Siminn
Индия
Airtel
Reliance Jio
Vi
Ирландия
Vodafone
Италия
TIM
Vodafone
Wind Tre
Япония
au
NTT Docomo
Rakuten Mobile
Softbank
Иордания
Orange
Umniah
Zain
Казахстан
Kcell
Кувейт
Ooredoo
stc
Zain
Латвия
LMT
Ливан
Alfa
Литва
Telia
Люксембург
MTX Connect
Orange
POST
Tango Mobile
Ubigi
Макао
CTM
Малайзия
Celcom
Digi
Maxis
U Mobile
Мальдивы
Dhiraagu
Ooredoo
Мальта
GO
Мексика
AT&T
Movistar
Молдова
Moldcell
Черногория
Crnogorski Telekom
One
Марокко
Maroc Telecom
Orange
Нидерланды
KPN
Simyo
T-Mobile
Truphone
Ubigi
Vodafone
Новая Зеландия
2degrees
Spark
Северная Македония
Македонски Телеком
Норвегия
OneCall
Telenor
Telia
Оман
Omantel
Ooredoo
Пакистан
Ufone
Палестина
Jawwal
Филиппины
Globe
Smart
Польша
Orange
Plus
Truphone
T-Mobile
Португалия
MEO
NOS
Vodafone
Катар
Ooredoo
Vodafone
Румыния
Orange
Vodafone
Саудовская Аравия
Mobily
stc
Zain
Сенегал
Orange
Сербия
A1
Сингапур
M1
Словакия
Orange
O2
Slovak Telekom
Словения
A1 Slovenija
ЮАР
MTN
Vodacom
Южная Корея
KT
LG U+
SK Telecom
Испания
Movistar
Orange
Pepephone
Truphone
Vodafone
Yoigo
Шри-Ланка
Dialog
Mobitel
Швеция
3
Comviq
Tele2
Telenor
Telia
Швейцария
Salt
Sunrise
Swisscom
Ubigi
Тайвань
APT
Chunghwa Telecom
Far EasTone
Taiwan Mobile
Taiwan Star
Таджикистан
ZET-Mobile
Таиланд
AIS
dtac
TrueMove H
Тунис
Ooredoo
Orange
Турция
Turkcell
Turk Telekom
Vodafone
Украина
Kyivstar
Lifecell
Vodafone
ОАЭ
du
Etisalat
Virgin Mobile
Соединенное Королевство
EE
O2
Truphone
Ubigi
Vodafone
США
Appalachian Wireless
AT&T
Boost Mobile
Carolina West Wireless
Cellcom
Chat Mobility
Consumer Cellular
Copper Valley Telecom
Credo Mobile
Cricket
C Spire
FirstNet
GCI
h3O Wireless
Metro by T-Mobile
Mint Mobile
Nemont
Nex-Tech Wireless
NorthwestCell
Optimum Mobile
Pioneer Wireless
PTCI
PureTalk
Red Pocket
Republic
Spectrum Mobile
Straight Talk
Strata
Thumb Cellular
T-Mobile USA
Tracfone
Truphone
Ubigi
Union Wireless
United Wireless
US Cellular
Verizon Wireless
Visible
West Central Wireless
Xfinity Mobile
Вьетнам
Viettel
Mobifone
Vinaphone
Международные поставщики услуг
Международные поставщики услуг позволяют вам оставаться на связи благодаря предоплаченным тарифным планам, которые вы можете использовать дома или во время путешествий в более чем 190 странах и регионах. Вы также можете приобрести план перед поездкой, чтобы оставаться на связи было еще проще.
Вы также можете приобрести план перед поездкой, чтобы оставаться на связи было еще проще.
airalo
AirSim
aloSIM
BNESIM
DENT Wireless
Flexiroam
GigSky
MTX Connect
Redtea Mobile
Soracom Mobile
Truphone
UPeSIM
Ubigi
USIMS
Webbing
Информация о продуктах, произведенных не компанией Apple, или о независимых веб-сайтах, неподконтрольных и не тестируемых компанией Apple, не носит рекомендательного или одобрительного характера. Компания Apple не несет никакой ответственности за выбор, функциональность и использование веб-сайтов или продукции сторонних производителей. Компания Apple также не несет ответственности за точность или достоверность данных, размещенных на веб-сайтах сторонних производителей. Обратитесь к поставщику за дополнительной информацией.
Дата публикации:
Метод изготовления кислорода из воды в нулевой гравитации повышает надежду на расстояние космических путешествий
Share на Facebook
.
 Поделиться по электронной почте
Поделиться по электронной почтеВерсия для печати
Следующее эссе перепечатано с разрешения The Conversation, интернет-издания, посвященного последним исследованиям.
Космические агентства и частные компании уже разработали планы по отправке людей на Марс в ближайшие несколько лет и, в конечном счете, его колонизации. А с растущим числом открытий похожих на Землю планет вокруг ближайших звезд дальние космические путешествия никогда не казались более захватывающими.
Однако людям нелегко выживать в космосе в течение продолжительных периодов времени. Одной из главных проблем дальних космических полетов является транспортировка достаточного количества кислорода для дыхания астронавтов и достаточного количества топлива для питания сложной электроники. К сожалению, в космосе мало кислорода, а большие расстояния затрудняют быстрое восполнение запасов.
Но теперь новое исследование, опубликованное в Nature Communications, показывает, что можно производить водород (для топлива) и кислород (для жизни) только из воды, используя полупроводниковый материал и солнечный свет (или звездный свет) в условиях невесомости, что делает устойчивые космические путешествия — реальная возможность.
Использование неограниченных ресурсов солнца для обеспечения энергией нашей повседневной жизни является одной из самых больших проблем на Земле. Поскольку мы медленно уходим от нефти к возобновляемым источникам энергии, исследователей интересует возможность использования водорода в качестве топлива. Лучший способ сделать это — разделить воду (h3O) на составляющие: водород и кислород. Это возможно с помощью процесса, известного как электролиз, который включает пропускание тока через образец воды, содержащий некоторое количество растворимого электролита. Это расщепляет воду на кислород и водород, которые выделяются отдельно на двух электродах.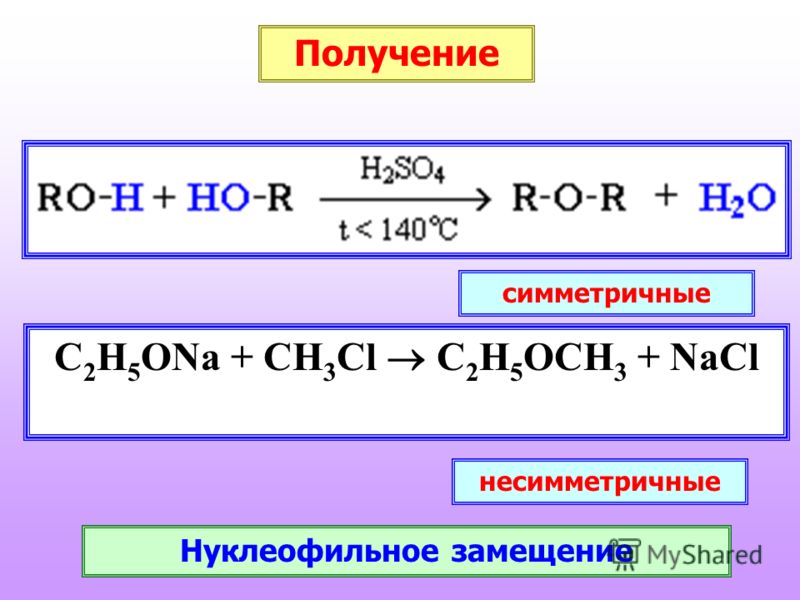
Хотя этот метод технически возможен, он еще не стал доступным на Земле, поскольку нам нужно больше инфраструктуры, связанной с водородом, такой как станции заправки водородом, чтобы масштабировать его.
Солнечная энергия
Водород и кислород, полученные таким образом из воды , также могут использоваться в качестве топлива на космических кораблях. Запуск ракеты с водой на самом деле был бы намного безопаснее, чем запуск с дополнительным ракетным топливом и кислородом на борту, которые могут быть взрывоопасными. Оказавшись в космосе, специальная технология сможет расщепить воду на водород и кислород, которые, в свою очередь, можно будет использовать для поддержания жизни или для питания электроники с помощью топливных элементов.
Это можно сделать двумя способами. Один из них включает электролиз, как мы делаем на Земле, с использованием электролитов и солнечных элементов , чтобы улавливать солнечный свет и преобразовывать его в ток.
Альтернативой является использование «фотокатализаторов», которые работают, поглощая частицы света — фотоны — полупроводниковым материалом, помещенным в воду. Энергия фотона поглощается электроном в материале, который затем прыгает, оставляя после себя дыру. Свободный электрон может реагировать с протонами (которые вместе с нейтронами составляют атомное ядро) в воде с образованием водорода. Между тем, дырка может поглощать электроны из воды с образованием протонов и кислорода.
Энергия фотона поглощается электроном в материале, который затем прыгает, оставляя после себя дыру. Свободный электрон может реагировать с протонами (которые вместе с нейтронами составляют атомное ядро) в воде с образованием водорода. Между тем, дырка может поглощать электроны из воды с образованием протонов и кислорода.
Процесс также можно отменить. Водород и кислород можно объединить или «рекомбинировать» с помощью топливного элемента, возвращая солнечную энергию, полученную в результате «фотокатализа» — энергию, которую можно использовать для питания электроники. В результате рекомбинации в качестве продукта образуется только вода, а это означает, что вода также может быть использована повторно. Это ключ к дальним космическим путешествиям.
Процесс с использованием фотокатализаторов – лучший вариант для космических путешествий, так как вес оборудования намного меньше, чем для электролиза. По идее должно работать легко. Отчасти это связано с тем, что интенсивность солнечного света намного выше, а атмосфера Земли не поглощает его в больших количествах на пути к поверхности.
Управление пузырьками
В новом исследовании исследователи сбросили полную экспериментальную установку для фотокатализа в 120-метровую вышку, создав среду, подобную микрогравитации. По мере того, как объекты ускоряются к Земле в свободном падении, эффект гравитации уменьшается, поскольку силы, действующие под действием гравитации, уравновешиваются равными и противоположными силами из-за ускорения. Это противоположно перегрузкам, которые испытывают космонавты и летчики-истребители, когда они разгоняются в своих самолетах.
Исследователям удалось показать, что в этой среде действительно возможно разделить воду. Однако, когда вода расщепляется с образованием газа, образуются пузырьки. Избавление от пузырьков из когда-то образовавшегося материала катализатора важно, так как пузырьки мешают процессу образования газа. На Земле гравитация заставляет пузырьки автоматически всплывать на поверхность (вода у поверхности плотнее, чем пузырьки, что делает их гибкими), освобождая место на катализаторе для образования следующего пузыря.
В условиях невесомости это невозможно, и пузырек останется на катализаторе или рядом с ним. Однако ученые скорректировали форму наночастиц в катализаторе, создав пирамидальные зоны, в которых пузырек мог легко отделиться от кончика и уплыть в среду.
Но остается одна проблема. В отсутствие гравитации пузырьки останутся в жидкости, даже если они были вытеснены из самого катализатора. Гравитация позволяет газам легко выходить из жидкости, что очень важно для использования чистого водорода и кислорода. Без гравитации никакие пузырьки газа не всплывают на поверхность и не отделяются от смеси — вместо этого весь газ остается для создания пены.
Это резко снижает эффективность процесса из-за блокировки катализаторов или электродов. Инженерные решения этой проблемы будут иметь ключевое значение для успешного внедрения технологий в космосе. Одна из возможностей — использование центробежных сил от вращения космического корабля для отделения газов от раствора.
Тем не менее, благодаря этому новому исследованию мы стали на шаг ближе к длительному космическому полету человека.
Первоначально эта статья была опубликована на The Conversation. Прочитайте оригинальную статью.
ОБ АВТОРАХ
Старший преподаватель энергетики Университета Суонси.
Читать дальше
Ученые открыли новый способ получения воды
Университет Иллинойса Урбана-Шампейн
Фото Л. Брайана ШтауффераШАМПЕЙН, Иллинойс — В знакомой школьной демонстрации химии преподаватель сначала использует электричество, чтобы разделить жидкую воду на составляющие ее газы, водород и кислород. Затем, объединив два газа и воспламенив их искрой, инструктор превращает газы обратно в воду с громким хлопком.
Ученые из Университета Иллинойса открыли новый способ приготовления воды, причем без шипучки. Мало того, что они могут производить воду из необычных исходных материалов, таких как спирты, их работа также может привести к созданию лучших катализаторов и менее дорогих топливных элементов.
«Мы обнаружили, что нетрадиционные гидриды металлов можно использовать для химического процесса, называемого восстановлением кислорода, который является неотъемлемой частью процесса производства воды», — сказал Захария Хейден, докторант и ведущий автор статьи, принятой к публикации в в журнале Американского химического общества и размещены на его веб-сайте.
Молекула воды (ранее известная как монооксид дигидрогена) состоит из двух атомов водорода и одного атома кислорода. Но вы не можете просто взять два атома водорода и приклеить их к атому кислорода. Реальная реакция образования воды немного сложнее: 2ч3 + О2 = 2ч3О + Энергия.
Уравнение на английском языке гласит: Чтобы получить две молекулы воды (h3O), две молекулы двухатомного водорода (h3) должны быть соединены с одной молекулой двухатомного кислорода (O2). Энергия будет высвобождаться в процессе.
«Эта реакция (2h3 + O2 = 2h3O + энергия) известна уже два века, но до сих пор никто не заставил ее работать в гомогенном растворе», — сказал Томас Раухфус, профессор химии и соответствующий автор статьи.
Хорошо известная реакция также описывает то, что происходит внутри водородного топливного элемента.
В типичном топливном элементе двухатомный водород поступает с одной стороны элемента, двухатомный кислород – с другой. Молекулы водорода теряют свои электроны и становятся положительно заряженными в результате процесса, называемого окислением, в то время как молекулы кислорода получают четыре электрона и становятся отрицательно заряженными в результате процесса, называемого восстановлением. Отрицательно заряженные ионы кислорода объединяются с положительно заряженными ионами водорода, образуя воду и высвобождая электрическую энергию.
Отрицательно заряженные ионы кислорода объединяются с положительно заряженными ионами водорода, образуя воду и высвобождая электрическую энергию.
«Трудной стороной» топливного элемента является реакция восстановления кислорода, а не реакция окисления водорода, сказал Раухфусс. «Однако мы обнаружили, что новые катализаторы для восстановления кислорода могут также привести к новым химическим средствам для окисления водорода».
Rauchfuss и Heiden недавно исследовали относительно новое поколение катализаторов гидрогенизации с переносом для использования в качестве нетрадиционных гидридов металлов для восстановления кислорода.
В своей статье JACS исследователи сосредоточились исключительно на окислительной реакционной способности катализаторов гидрирования переноса на основе иридия в гомогенном неводном растворе. Они обнаружили, что комплекс иридия влияет как на окисление спиртов, так и на восстановление кислорода.
«Большинство соединений реагируют либо с водородом, либо с кислородом, но этот катализатор реагирует и с тем, и с другим, — сказал Хайден. «Он реагирует с водородом, образуя гидрид, а затем реагирует с кислородом, образуя воду; и делает это в гомогенном неводном растворителе».
«Он реагирует с водородом, образуя гидрид, а затем реагирует с кислородом, образуя воду; и делает это в гомогенном неводном растворителе».
Новые катализаторы могут привести к разработке более эффективных водородных топливных элементов, что существенно снизит их стоимость, сказал Хайден.
Работа финансировалась Министерством энергетики США.
Чтобы связаться с Томасом Раухфусом, позвоните по телефону 217-333-7355; электронная почта: [email protected]
Чтобы связаться с Zachariah Heiden, позвоните по номеру 217-352-1559; электронная почта: [email protected]
Связанные лица
Похожие темы
- Факультет
- Неорганическая химия
Каталог
scheelinАлександр
Scheeline
bjmccallБенджамин
МакКолл
r-gennisРоберт
Геннис
j-gerltДжон
Герлт
sgranickСтив
Граник
мгрюбельМартин
Грубель
hergenroPaul
Хергенротер
ХуанВорон
Хуан
mlkraftMary
Крафт
ЛекбандДебора
Лекбанд
йи-луйи
Лу
мартиниСьюзан
Мартини
snairSatish
Наир
ЭолдфилдЭрик
Олдфилд
cmsCharles
Шредер
zanZaida
Лютей-Шультен
СелвинПол
Селвин
sksScott
Сильверман
s-sligarStephen
Слигар
тайхорсЭмад
Тайхоршид
zhao5Huimin
Чжао
pbraunPaul
Браун
mdburkeМартин
Берк
ДжеффчанДжефферсон
Чан
sdenmarkScott
Дания
dlottДана
Длотт
foutЭлисон
Fout
возраст Эндрю
Гевирт
ggirolamGregory
Джиролами
СохиратаСо
Хирата
джайнПрашант
Джайн
jkatzeneJohn
Katzenellenbogen
нмакриНанси
Макри
ДугласДуглас
Митчелл
ДжсмурДжеффри
Мур
murphycjКэтрин
Мерфи
р-нуццоРальф
Нуццо
dimerPhilip
Phillips
rauchfusThomas
Rauchfuss
ХоакинХоакин
Родригес-Лопес
СарлахДэвид
Сарлах
kschweizKenneth
Schweizer
джсвидлДжонатан
Свидлер
vddonkWilfred
ван дер Донк
renskeRenske
Ван дер Вин
вуравейс Джош
Вура-Вайс
Макуайт7М.
Белый
sczimmerСтивен
Циммерман
клювПитер
Клюв
wklemperWalter
Клемперер
jdmcdonaJ.
Макдональдс
погорелоТарас
Погорелов
mshen233Мей
Шен
ДевунДэвид
Вун
wboulangWilliam
Буланже
rxbRohit
Бхаргава
qchen20Qian
Чен
jianjuncJianjun
Ченг
hy66Hong
Ян
АндиномаХосе
Андино Мартинес
decosteDonald
DeCoste
thhuangTina
Хуанг
tjhummelThomas
Хаммель
dkellДэвид
Келл
докторкМайкл
Кернер
МарвильКелли
Марвиль
crrayКристиан
Рэй
tlbrownТеодор
Браун
rmcoatesRobert
Коутс
thdjrThom
Даннинг
Дайкстра Клиффорд
Дайкстра
j-jonasДжири
Йонас
j-lisyJames
Лизи
ШеплиДжон
Шепли
pshaplePatricia
Шепли
zumdahl2Steven
Zumdahl
ksuslickКеннет
Суслик
jcoxДженни
Кокс
sqdSean
Драммонд
ШилиСара
Шили
jsmaddenДжозеф
Мэдден
cknight4Connie
Рыцарь
ШульцеХезер
Шульце
КбаумгарКина
Финни
adkssnБеатрис
Адкиссон
trabari1Katie
Трабарис
МеткалфКара
Меткалф
ljohnso2Lori
Джонсон
ЛченовеЛесли
Ченовет
вдедоВолали
Дедо
spinnerDavid
Spinner
плблумПатриция
Симпсон
Стивенс2Чад
Стивенс
лсагекарлори
Сейдж-Карлсон
БертольдДебора
Бертольд
кекарлсоКэтрин
Карлсон
sdesmondSerenity
Десмонд
axelson2Jordan
Аксельсон
scbakerStephanie
Бейкер
pflotschPriscila
Фалаган Лотч
dgrayDanielle
Серый
thennes2Tom
Хеннесси
ХолдаНэнси
Холда
aibarrАлехандро
Ибарра
Кимш Сунг Хун
Ким
kocherg2Николай
Кочергинский
philipk2Philip
Кочерил
legare2Stephanie
Legare
алевандоАгнешка
Левандовска
смккомбиСтюарт
Маккомби
jdm5Джастин
МакГлаухлен
egmooreEdwin
Мур
МайерскоуКэтлин
Майерскоу
snalla2Siva
Налла
Романова Елена
Романова
рубахиСтанислав
Рубахин
shvedalxАлександр
Швед
Асуда Александр
Судаков
xywangXiying
Ван
kwilhelKaren
Wilhelmsen
Уилки Рэнди
Уилки
силонгSilong
Чжан
schlembaMary
Шлембах
триммеллЭшли
Триммелл
emccarr2Elise
Маккаррен
cmersierChristen
Мерсье
атимпермАарон
Тимперман
niesShuming
Nie
hshanHee-Sun
Хань
ммгМутха
Гунасекера
kknightsКатриена
Рыцари
lisawЛиза
Уильямсон
КейнкКэти
Айнк
коленоf1Кейт
Ниф
txiang4Tiange
Сян
j-hummelJohn
Hummel
i-PaulLain
Пол
МунджанджаЛлойд
Мунджанджа
glnGayle
Нельсен
agerardАнна
Джерард
ПауэрсКимберли
Пауэрс
lolshansЛиза
Ольшанский
МирикаЛивиу
Мирика
qingcao2Qing
Цао
lisa3Лиза
Джонсон
тиналамбТина
Баранина
баронpБарон
Петерс
bransle2Sarah
Брэнсли
dylanmh3Дилан
Гамильтон
raegansRaegan
Смит
apm8Ангад
Мехта
ЛевериттДжон
Леверитт
синвсин
Ван
эмиллрева
Миллер
jmill24Жаклин
Миллер
jlbass2Юлия
Басс
ramonarРамона
Рудзинский
tlcraneTracy
Кран
cejohnstCelia
Джонстон
адлАмбер
Лабау
cnsolomoCandice
Соломон-Струтц
mikaelbMikael
Баклунд
ДжексонНик
Джексон
Подробнее новости департамента
2022-23 Malar Medalist: профессор Грегори Х.
 Робинсон
Робинсон Фонд UGA, выдающийся профессор химии в Университете Джорджии, Грегори Х. Робинсон и его исследование группы сделали новаторские открытия, изучая проблемы, связанные со структурой и связью в металлоорганических соединениях, в частности, с синтезом, стабилизацией и…
Читать полностью
Ученые разрабатывают новый процесс вторичной переработки пластмасс и сокращения выбросов парниковых газов
Дэмиен Гиронне, профессор химической и биомолекулярной инженерии и химии в Иллинойсе, и Сюзанна Скотт, профессор устойчивой каталитической обработки в Калифорнийском университете в Санта-Барбаре, совместно Ведущие авторы нового исследования, подробно описывающего процесс превращения полиэтилена в пропилен, который затем может быть…
Читать полностью
Дания, Макри выбрал победителей Национальной премии ACS
Американское химическое общество объявило лауреатов Национальной премии 2023 года, в том числе профессоров химии Скотта Дании и Нэнси Макри.
 Среди получателей также есть выпускник химии из Иллинойса Марк В. Гринстафф (доктор философии, ’92).
Среди получателей также есть выпускник химии из Иллинойса Марк В. Гринстафф (доктор философии, ’92).Читать полностью
Кислород (O) и вода
- Дом
- Периодическая таблица
- Элементы и вода
- Кислород в воде (O2 + h3O)
| Кислород является самым распространенным элементом на Земле. Кислород существует в виде O 2 и O 3 (озон) и присутствует в ряде соединений, включая молекулы воды. Его можно найти растворенным в воде в виде молекул O 2 . Следовательно, содержание кислорода в морской воде составляет 85,7%. Газообразный кислород не реагирует с водой. Он растворим в воде и действует как окислитель: O 2 + 2 H 2 O + 4 e — -> 4 OH — Кислород может окислять органические вещества. Это в основном биологический процесс. Fe 2+ + 0,25 O 2 -> Fe(OH) 3 + 2,5 H + Эти механизмы показывают, что аммоний и метан используют большие количества кислорода, и в результате реакций окисления образуется большее или меньшее количество кислоты. При нормальных условиях кислота в воде реагирует с HCO 3 — с образованием CO 2 . Растворимость кислорода в воде при 25 o C и давлении = 1 бар при 40 мг/л воды. В воздухе нормального состава парциальное давление кислорода равно 0,2 атм. Это приводит к растворению 40 . 0,2 = 8 мг O 2 /л в воде, контактирующей с воздухом. Как было сказано ранее, кислород естественным образом растворяется при контакте воды с воздухом. Кислород окисляет другие вещества. Это происходит, например, во время пожаров, а также внутри организмов, при разрушении бактерий и при конверсии металлов. Общая концентрация кислорода в организме человека составляет около 60% от общей массы тела. Это значение может сильно варьироваться, так как в основном оно присутствует в молекулах воды. Одна из причин, по которой может понадобиться удалить кислород из воды, заключается в том, что это может вызвать коррозию водопроводных труб. Эту проблему могут решить различные физические и химические процессы, например ионообменные смолы. Основным принципом этого метода является реакция между водородом и кислородом: 2H 2 + O 2 -> 2H 2 O. Эта реакция может быть декатализирована различными соединениями, что приводит к ее самопроизвольному завершению. Ионные смолы, содержащие палладий, могут снижать концентрацию кислорода в воде при наличии достаточного количества водорода. Гидразин — еще одно возможное восстановительное соединение, которое можно использовать вместо водорода: O 2 + N 2 H 4 -> N 2 + 2 H 2 O. |

 Поделиться по электронной почте
Поделиться по электронной почте Робинсон
Робинсон  Среди получателей также есть выпускник химии из Иллинойса Марк В. Гринстафф (доктор философии, ’92).
Среди получателей также есть выпускник химии из Иллинойса Марк В. Гринстафф (доктор философии, ’92). Каждое отдельное соединение имеет механизм реакции, который можно описать с помощью электронного баланса. Примеры приведены ниже (H 2 O исключен):
Каждое отдельное соединение имеет механизм реакции, который можно описать с помощью электронного баланса. Примеры приведены ниже (H 2 O исключен): Есть также большое количество соединений, которые реагируют с водой.
Есть также большое количество соединений, которые реагируют с водой. Кислород также применяется в коммерческих целях. Для промышленных целей элемент ежегодно извлекается из воздуха около 100 млн т. Из общего количества 55 % применяется в производстве стали, 25 % — в химической промышленности, а остальное — в больницах, для запуска ракет и резки металла. В химической промышленности применяют реакцию кислорода и этилена, а полученный оксид этилена применяют в качестве антифриза и полиэфира. Кислород обладает высокой реакционной способностью и поэтому может применяться для разрушения опасных веществ. Его также можно применять в качестве отбеливателя. Кислород в озоновых соединениях применяют для обеззараживания питьевой воды. Воды не загрязняются кислородом при его промышленном применении.
Кислород также применяется в коммерческих целях. Для промышленных целей элемент ежегодно извлекается из воздуха около 100 млн т. Из общего количества 55 % применяется в производстве стали, 25 % — в химической промышленности, а остальное — в больницах, для запуска ракет и резки металла. В химической промышленности применяют реакцию кислорода и этилена, а полученный оксид этилена применяют в качестве антифриза и полиэфира. Кислород обладает высокой реакционной способностью и поэтому может применяться для разрушения опасных веществ. Его также можно применять в качестве отбеливателя. Кислород в озоновых соединениях применяют для обеззараживания питьевой воды. Воды не загрязняются кислородом при его промышленном применении. Кислород очень важен, потому что он является частью ДНК и практически всех других биологически значимых соединений. В легких кислород связан с атомами железа; центральные элементы гемоглобина. Всего 200 см 3 кислорода может растворяться в крови по этому механизму, количество, которое явно превышает водорастворимое количество. Вместе с запасами энергии кислород вызывает мышечную активность и теплопродукцию. Этот процесс высвобождает углекислый газ, который выделяется и впоследствии поглощается растениями. Растения производят дополнительный кислород в процессе фотосинтеза. Растения содержат от 4,1 до 4,4% кислорода (сухая масса).
Кислород очень важен, потому что он является частью ДНК и практически всех других биологически значимых соединений. В легких кислород связан с атомами железа; центральные элементы гемоглобина. Всего 200 см 3 кислорода может растворяться в крови по этому механизму, количество, которое явно превышает водорастворимое количество. Вместе с запасами энергии кислород вызывает мышечную активность и теплопродукцию. Этот процесс высвобождает углекислый газ, который выделяется и впоследствии поглощается растениями. Растения производят дополнительный кислород в процессе фотосинтеза. Растения содержат от 4,1 до 4,4% кислорода (сухая масса).  Термическое загрязнение вызывает ту же проблему, потому что растворимость кислорода ниже в более теплой воде. Это может быть следствием сброса охлаждающей воды в поверхностные воды.
Термическое загрязнение вызывает ту же проблему, потому что растворимость кислорода ниже в более теплой воде. Это может быть следствием сброса охлаждающей воды в поверхностные воды.  Однако органические вещества часто оседают и остаются на дне водоема в виде осадка. Это может вызвать дефицит кислорода в результате разложения. Когда в озерах установится экологическое равновесие, эти проблемы могут быть решены. Однако при сбросе, чрезмерном удобрении и т. д. добавляются питательные вещества, которые должны быть разложены, и увеличивается цветение водорослей, концентрация кислорода может снизиться до уровня, при котором не выживает ни один организм. Это явление широко известно как эвтрофикация (эвтрофная = богатая питательными веществами, олиготрофная = бедная питательными веществами). Критическая концентрация кислорода для рыб достигается при 4 мг О 2 / л воды.
Однако органические вещества часто оседают и остаются на дне водоема в виде осадка. Это может вызвать дефицит кислорода в результате разложения. Когда в озерах установится экологическое равновесие, эти проблемы могут быть решены. Однако при сбросе, чрезмерном удобрении и т. д. добавляются питательные вещества, которые должны быть разложены, и увеличивается цветение водорослей, концентрация кислорода может снизиться до уровня, при котором не выживает ни один организм. Это явление широко известно как эвтрофикация (эвтрофная = богатая питательными веществами, олиготрофная = бедная питательными веществами). Критическая концентрация кислорода для рыб достигается при 4 мг О 2 / л воды.  Токсическими соединениями являются, например, гипероксиды и пероксиды. Некоторые вещества токсичны в условиях пониженного содержания кислорода в воде, так как дыхание организмов усиливается и, следовательно, вещества усваиваются быстрее. Для облигатных анаэробных организмов высокие концентрации кислорода токсичны.
Токсическими соединениями являются, например, гипероксиды и пероксиды. Некоторые вещества токсичны в условиях пониженного содержания кислорода в воде, так как дыхание организмов усиливается и, следовательно, вещества усваиваются быстрее. Для облигатных анаэробных организмов высокие концентрации кислорода токсичны. 



