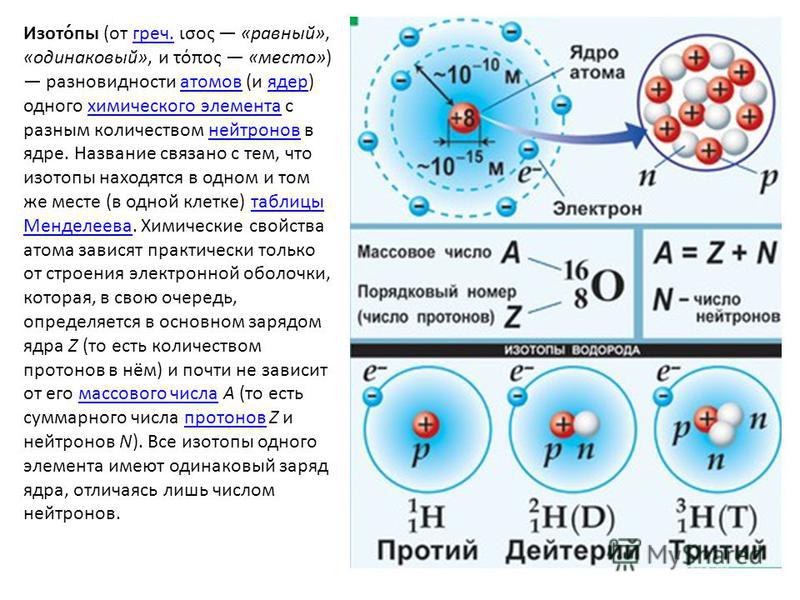
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Закон сохранения электрического заряда — формулы, определение
Электрический заряд
Электрический заряд — это физическая величина, которая определяет способность тел создавать электромагнитное поле и принимать участие в электромагнитном взаимодействии.
Мы состоим из клеток, клетки состоят из молекул, молекулы в свою очередь состоят из атомов, а атомы — из ядра и электронов. Ядро состоит из протонов и нейтронов.
Протон — это частица, которая заряжена положительно, нейтрон — нейтрально, а электрон — отрицательно. Электроны вращаются по орбитам, которые во много раз больше, чем размер электрона.
Размер электрона с размером орбиты можно сравнить так: представьте футбольный мяч и футбольное поле. Во сколько раз поле больше мяча, во столько же раз орбита больше, чем электрон.
Как мы уже выяснили, электрические заряды бывают положительными и отрицательными. Одноименные заряды отталкиваются, разноименные притягиваются:
А вот измерять Электрический заряд мы будем в Кулонах [Кл]. Нет, не тех, что болтаются на цепочке. Шарль Кулон — это физик, который изучал электромагнитные явления.
Шарль Кулон — это физик, который изучал электромагнитные явления.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Электризация
Чтобы разобраться с тем, как тело приобретает электрический заряд и сохраняет его, нам для начала нужно поближе познакомиться с протоном и электроном. Протон — ленивый и неповоротливый — он точно не будет никуда перемещаться, если мы не переместим атом целиком.
А вот электрон — парень подвижный, и ему перебежать с одного атома на другой — ничего не стоит.
Мы поговорим о двух типах электризации: электризация соприкосновением и электризация трением.
- Электризация соприкосновением — это процесс, при котором мы берем два проводящих тела: отрицательно заряженное и нейтральное.

Свободные электроны переходят с незаряженного тела на нейтральное. А если мы возьмем положительно заряженное тело вместо отрицательного, то свободные электроны перейдут с нейтрального тела, чтобы уравновесить заряды.
- Электризации трением — это когда мы берем два незаряженных тела и трем их друг о друга.
Электроны переходят от одного тела к другому и в отличии от электризации соприкосновением заряжаются противоположными по знаку и равными по модулю зарядами.
То есть при соприкосновении заряд раздают одного знака и поровну. Как если бы ты поделился с другом конфетами, которых у тебя с избытком.
При трении наоборот — заряды у тел будут разных знаков, но также в одинаковом количестве. Например, у вас есть равное количество денег в рублях и долларах, и у меня аналогичная ситуация с той же суммой. Вы решили лететь в США, а мне как раз доллары не нужны. Чтобы не ходить в банк, мы можем просто поменяться. Тогда у вас будут только доллары, а у меня — только рубли. Главное, договориться про курс 🙂
Чтобы не ходить в банк, мы можем просто поменяться. Тогда у вас будут только доллары, а у меня — только рубли. Главное, договориться про курс 🙂
Давайте решим пару задач по этой теме.
Задачка один
Из какого материала может быть сделан стержень, соединяющий электрометры, изображённые на рисунке?
А. СтеклоБ. Эбонит
Решение:
Он может быть сделан либо из проводника, либо из диэлектрика. Проводник пропускает через себя заряды, а диэлектрик — нет. Если мы посмотрим на показания электрометров, то увидим, что они отличаются.
Как мы помним, при соприкосновении заряды уравниваются по величине (один электрометр делится конфетами с другим). В данном случае никто ни с кем не делился, это значит, что стержень не пропускает — он диэлектрик. И стекло, и эбонит являются диэлектриками. Значит подходят оба варианта!
Ответ: стержень может быть сделан как из стекла, так и из эбонита.
Задачка два
В процессе трения о шёлк стеклянная линейка приобрела положительный заряд. Как при этом изменилось количество заряженных частиц на линейке и шёлке при условии, что обмен при трении не происходил?
А) количество протонов на стеклянной линейке
Б) количество электронов на шёлке
Решение:
Вспомните, как мы охарактеризовали протон: он ленивый и неподвижный! Значит количество протонов ни на стеклянной линейке, ни на шелке измениться просто не может. Мы же не отламываем кусок линейки вместе с атомами, из которых она состоит. А вот электроны охотно перемещаются. Нам известно, что линейка приобрела положительный заряд. Получается, электроны сбежали от нее к шелку. Следовательно, количество электронов на шелке увеличилось.
Ответ: количество протонов на стеклянной линейке не изменилось, а количество электронов на шелке увеличилось.
Классический курс физики для 10 класса поможет разобраться в законе сохранения заряда и других непростых темах.
Электростатическая индукция
Кажется, с электризацией разобрались. Теперь разберемся, что произойдет, если мы поднесем одно тело к другому, но не вплотную. Произойдет такое явление, как электростатическая индукция — явление перераспределения зарядов в нейтрально заряженных телах.
Давай разбираться на примере задачи:
На нити подвешен незаряженный металлический шарик. К нему снизу поднесли положительно заряженную палочку. Как изменится при этом сила натяжения нити?
Решение:
Здесь важно подчеркнуть, что незаряженный — значит заряжен нейтрально. То есть в теле равное количество положительных и отрицательных зарядов.
Электроны металлического шарика будут перемещаться вниз и притягиваться к поднесенной положительной палочке. В результате шарик притягивается к палочке, следовательно, сила натяжения нити увеличивается.
В результате шарик притягивается к палочке, следовательно, сила натяжения нити увеличивается.
Ответ: сила натяжения нити увеличивается
Поляризация диэлектрика
Давайте возьмем два, на первый взгляд, одинаковых задания из ЕГЭ.
Задание 1
Если к незаряженному металлическому шару поднести, не касаясь, точечный положительный заряд, то на стороне шара, ближайшей к заряду, появится отрицательный заряд. Как называется это явление?
Мы только что это разобрали: это электростатическая индукция.
Задание 2
Если к незаряженному диэлектрическому шару поднести, не касаясь, точечный положительный заряд, то на стороне шара, ближайшей к заряду, появится отрицательный заряд. Как называется это явление?
Кажется, что очень похоже на электростатическую индукцию, но это явление будет называться поляризация. В чем разница:
В чем разница:
В первом случае — это проводник, а во втором — диэлектрик. Если не вдаваться в подробности, то поляризация диэлектрика — процесс, очень похожий по природе своей на электростатическую индукцию, только происходит в непроводящих материалах.
Закон сохранения электрического заряда
И последнее, о чем мы сегодня поговорим — этот закон сохранения заряда
Звучит он так:
Алгебраическая сумма зарядов электрически замкнутой системы сохраняется.
Закон сохранения заряда q1 + q2 + q3 + … + qn = const q1, q2, q3, …, qn — заряды электрически замкнутой системы [Кл] |
Задачка раз
У нас есть два металлических шарика. Один имеет положительный заряд 2q, а другой — отрицательный −3q. Шарики соприкасаются, после чего их разъединяют. Каков конечный заряд каждого шарика?
Один имеет положительный заряд 2q, а другой — отрицательный −3q. Шарики соприкасаются, после чего их разъединяют. Каков конечный заряд каждого шарика?
Решение:
Для решения этой задачи нам нужно найти алгебраическую сумму зарядов.
2q − 3q = −1q.
Это суммарный заряд шариков и до, и после и во время взаимодействия.
Так как суммарный заряд сохраняется, но шарики соприкоснулись, суммарный заряд разделится между всеми шариками поровну. То есть нам нужно суммарный заряд просто поделить на количество шариков — на 2.
−1/2 = −0,5q.
И это ответ к нашей задаче.
Ответ: конечный заряд каждого шарика будет равен −0,5 Кл.
Задачка два
Металлическая пластина, имевшая положительный заряд, по модулю равный 10е, при освещении потеряла шесть электронов. Каким стал заряд пластины?
Каким стал заряд пластины?
Решение:
У положительно заряженной пластины 10e забрали 6 электронов. Заряд одного электрона равен −е. Спасемся математикой и посчитаем:
q = q₀ − 6(−e) = 10e + 6e = 16e
Красный знак «минус» образуется из-за того, что мы «отнимаем» электроны, а зеленый — из-за того, что электрон отрицательный. «Минус на минус» дает плюс, поэтому мы получаем 10e + 6e = 16е.
Ответ: 16е
Задачка три
Имеются два одинаковых проводящих шарика. Одному из них сообщили электрический заряд +8q, другому −4q. Затем шарики привели в соприкосновение и развели на прежнее расстояние. Какими стали заряды у шариков после соприкосновения?
Решение:
По закону сохранения заряда сумма зарядов в замкнутой системе остается постоянной.
+8q − 4q = + 4q
Два шарика привели в соприкосновение и развели, значит их суммарный заряд разделится между шариками поровну.
+4q/2 = +2q
Ответ: заряд каждого шарика равен 2q.
Закон Кулона и связь с гравитацией
Мы уже упоминали Шарля Кулона. В честь него названа единица измерения заряда — Кулон. Он придумал закон о взаимодействии зарядов.
Закон Кулона k — коэффициент пропорциональности (Н · м2)/Кл2 (Н · м2)/Кл2 — электрическая постоянная — диэлектрическая проницаемость среды — показывает во сколько раз сила электростатического взаимодействия в вакууме больше силы в среде (в вакууме равна 1) q1 — заряд первого тела [Кл] q2 — заряд второго тела [Кл] r — расстояние между телами [м] F — сила электростатического взаимодействия (кулоновская) [Н] |
Мы уже знаем, что заряды бывают положительными и отрицательными. Одноименные заряды отталкиваются, а разноименные — притягиваются. Это значит, что сила направлена туда же, куда заряд будет стремиться двигаться.
Одноименные заряды отталкиваются, а разноименные — притягиваются. Это значит, что сила направлена туда же, куда заряд будет стремиться двигаться.
Например, у положительного заряда сила будет направлена в сторону отрицательного, если он есть где-то поблизости, и от положительного, так как одноименные заряды отталкиваются.
Согласно третьему закону Ньютона, силы одной природы возникают попарно, равны по величине, противоположны по направлению. Если взаимодействуют два неодинаковых заряда, сила, с которой больший заряд действует на меньший (В на А) равна силе, с которой меньший действует на больший (А на В).
Интересно, что у различных законов физики есть некоторые общие черты. Вспомним закон тяготения. Сила гравитации также обратно пропорциональны квадрату расстояния, но уже между массами. И невольно возникает мысль, что в этой закономерности таится глубокий смысл. До сих пор никому не удалось представить тяготение и электричество, как два разных проявления одной и той же сущности.
Сила и тут изменяется обратно пропорционально квадрату расстояния, но разница в величине электрических сил и сил тяготения поразительна. Пытаясь установить общую природу тяготения и электричества, мы обнаруживаем такое превосходство электрических сил над силами тяготения, что трудно поверить, будто у тех и у других один и тот же источник. Нельзя говорить, что одно действует сильнее другого, ведь все зависит от того, какова масса и каков заряд.
Рассуждая о том, насколько сильно действует тяготение, мы не вправе говорить: «Возьмем массу такой-то величины», потому что мы выбираем ее сами. Но если мы возьмем то, что предлагает нам сама Природа: ее собственные числа и меры, которые не имеют ничего общего с нашими дюймами, годами — с любыми нашими мерами, вот тогда мы можем сравнивать.
Мы возьмем элементарную заряженную частицу, например, электрон. Две элементарные частицы, два электрона, за счет электрического заряда отталкивают друг друга с силой, обратно пропорциональной квадрату расстояния между ними, а за счет гравитации притягиваются друг к другу опять-таки с силой, обратно пропорциональной квадрату расстояния.
Закон всемирного тяготения F — сила тяготения [Н] M — масса первого тела (часто планеты) [кг] m — масса второго тела [кг] R — расстояние между телами [м] G — гравитационная постоянная G = 6,67 · 10−11м3 · кг−1 · с−2 |
Тяготение относится к электрическому отталкиванию, как единица к числу с 42 нулями. Да, это огромное число! Исследователи перебирали все большие числа, чтобы понять — откуда это взялось. Одно из таких больших чисел — это отношение диаметра Вселенной к диаметру протона — как ни удивительно, это тоже число с 42 нулями. Нормально так перебрали.
Да, это огромное число! Исследователи перебирали все большие числа, чтобы понять — откуда это взялось. Одно из таких больших чисел — это отношение диаметра Вселенной к диаметру протона — как ни удивительно, это тоже число с 42 нулями. Нормально так перебрали.
Если вы смотрели Рика и Морти, то знаете о теории параллельных вселенных и о том, что эти вселенные расширяются. Из-за расширения вселенной постоянная сила тяготения меняется. Хотя эта гипотеза еще не опровергнута, у нас нет никаких свидетельств в ее пользу. Наоборот, некоторые данные говорят о том, что постоянная сила тяготения не менялась таким образом. Это громадное число по сей день остается загадкой.
От расширяющихся вселенных и мультиков перейдем к чему-то более приземленному — к задачам.
Задачка раз
Расстояние между двумя точечными электрическими зарядами уменьшили в 3 раза, каждый из зарядов увеличили в 3 раза. Во сколько раз увеличился модуль сил электростатического взаимодействия между ними?
Решение:
Возьмем закон Кулона.
Если расстояние уменьшилось в 3 раза, то знаменатель уменьшился в 9 раз. Каждый из зарядов увеличился в три раза, значит числитель увеличился в 9 раз. Уменьшаем знаменатель в 9 раз, тем самым увеличивая всю дробь в 9 раз, увеличиваем числитель в 9 раз, получаем, что вся дробь увеличилась в 81 раз. И это ответ.
Ответ: модуль сил электростатического взаимодействия увеличится в 81 раз.
Задачка два (последняя!)
Два одинаковых маленьких отрицательно заряженных металлических шарика находятся в вакууме на достаточно большом расстоянии друг от друга. Модуль силы их кулоновского взаимодействия равен F1. Модули зарядов шариков отличаются в 5 раз.
Если эти шарики привести в соприкосновение, а затем расположить на прежнем расстоянии друг от друга, то модуль силы их кулоновского взаимодействия станет равным F2. Определите отношение F2 к F1.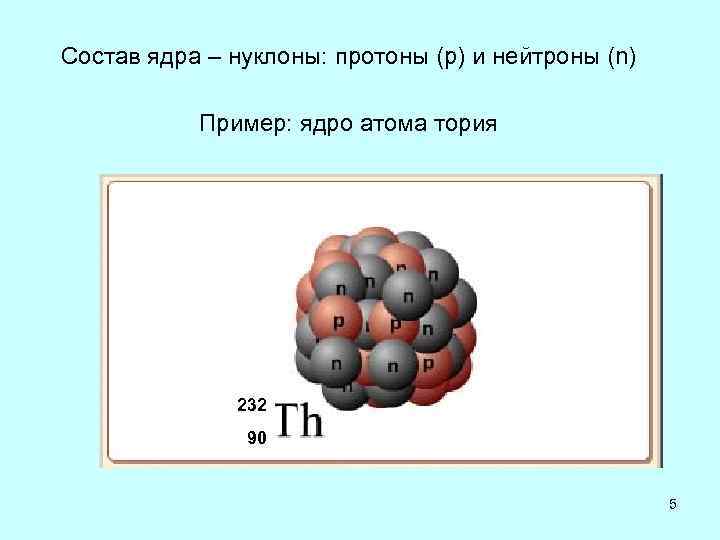
Решение:
Для начала найдем заряд шариков после соприкосновения.
По закону Кулона найдем силу F1:
Теперь по закону Кулона найдем силу F2:
И находим отношение сил
Ответ: отношение сил равно 1,8.
Количество протонов в учебнике по атомной химии
Количество протонов в учебнике по атомной химииКлючевые понятия
- Протоны находятся в ядре атома.
- Количество протонов в ядре атома равно его порядковому номеру.
- Атомный номер элемента обозначается символом Z.
- В Периодической таблице элементы перечислены в порядке возрастания атомного номера (Z).
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Определение количества протонов в атоме с помощью периодической таблицы
Современная Периодическая таблица состоит из ряда прямоугольников.
Каждый прямоугольник предоставляет нам четыре важных элемента информации об элементе:
| (а) Атомный номер элемента Z (всегда целое число). (b) Символ элемента (1 или 2 буквы, первая буква всегда заглавная). (c) Имя элемента 1 . (d) Атомный вес элемента 2 (обычно не целое число). |
Например, прямоугольник для элемента водорода в Периодической таблице выглядит так, как показано ниже:
| (а) атомный номер водорода равен 1 (Z = 1) (b) символ водорода — H (c) название элемента — водород (d) атомный вес водорода 1,008 |
Атомный номер (Z) элемента говорит нам, сколько протонов содержится в ядре атома этого элемента.
атомный номер = Z = количество протонов в ядре атома
Например, водород имеет атомный номер 1 (Z = 1), поэтому в ядре атома водорода находится 1 протон.
Если мы знаем
Атомный номер первых двадцати элементов периодической таблицы
Ниже приведена выдержка из Периодической таблицы, показывающая атомные номера (Z), символы и названия первых двадцати элементов:
| Группа 1 | Группа 2 | Группы 3 — 12 | Группа 13 | Группа 14 | Группа 15 | Группа 16 | Группа 17 | Группа 18 | |
| Период 1 | 1 H водород | 2 He гелий | |||||||
| Период 2 | 3 литиевый литиевый | 4 Be бериллий | 5 В бор | 6 C уголь | 7 Н азот | 8 O кислород | 9 F фтор | 10 Ne неон | |
| Период 3 | 11 Na натрий | 12 мг магний | 13 Алюминий | 14 кремний кремний | 15 P фосфор | 16 S сера | 17 Cl хлор | 18 Ar аргон | |
| Период 4 | 19 К калий | 20 Ca кальций | |||||||
Поскольку атомный номер (Z) элемента говорит нам, сколько протонов находится в ядре атома этого элемента, мы можем составить таблицу, чтобы показать название, символ, атомный номер (Z) и количество протонов в ядре атома этого элемента. ядро атома, как показано ниже:
ядро атома, как показано ниже:
| Наименование элемента | Символ элемента | Атомный номер элемента (Z) | Число протонов в ядре атома (= Z) |
|---|---|---|---|
| водород | Х | 1 | 1 |
| гелий | Он | 2 | 2 |
| литий | Ли | 3 | 3 |
| бериллий | Быть | 4 | 4 |
| бор | Б | 5 | 5 |
| уголь | С | 6 | 6 |
| азот | № | 7 | 7 |
| кислород | О | 8 | 8 |
| фтор | Ф | 9 | 9 |
| неон | Не | 10 | 10 |
| натрий | Нет | 11 | 11 |
| магний | Мг | 12 | 12 |
| алюминий | Ал | 13 | 13 |
| кремний | Си | 14 | 14 |
| фосфор | Р | 15 | 15 |
| сера | С | 16 | 16 |
| хлор | Кл | 17 | 17 |
| аргон | Ар | 18 | 18 |
| калий | К | 19 | 19 |
| кальций | Са | 20 | 20 |
Примеры работы: количество протонов в ядре атома
Вопрос 1: Сколько протонов содержится в ядре атома элемента с атомным номером 54?
Решение:
(На основе подхода StoPGoPS к решению проблем. )
)
- Какой вопрос просит вас сделать?
Определить количество протонов в ядре атома
- Какие данные (информация) были указаны в вопросе?
Извлечь данные из вопроса:
Z = атомный номер = 54
- Какая связь между тем, что вы знаете, и тем, что вам нужно узнать?
Z = атомный номер = количество протонов в ядре атома
- Определить количество протонов в ядре атома
количество протонов в ядре атома = Z = 54
- Ваш ответ правдоподобен?
(а) Количество протонов должно быть целым числом, целым числом. 54 — целое число, поэтому наш ответ правдоподобен.
(b) Атомный номер и, следовательно, количество протонов не может быть больше, чем количество известных элементов (в настоящее время 116). 54 меньше, чем количество известных элементов, так что наш ответ правдоподобен. - Укажите свой вариант решения задачи «число протонов в ядре атома»:
Количество протонов = 54
Вопрос 2: Определите число протонов в ядре атома бора.
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Что за вопрос?
Найдите число протонов в атоме бора
- Какие данные (информация) были указаны в вопросе?
Извлечь данные из вопроса:
Название элемента: бор
- Какая связь между тем, что вы знаете, и тем, что вам нужно узнать?
количество протонов = атомный номер элемента = Z
Используйте периодическую таблицу, чтобы найти атомный номер бора:
Z(бор) = 5 - Определить число протонов в атоме бора
Z = атомный номер = количество протонов = 5
- Ваш ответ правдоподобен?
(а) Количество протонов должно быть целым числом, целым числом. 5 — целое число, поэтому наш ответ правдоподобен.
(b) Атомный номер и, следовательно, количество протонов не может быть больше, чем количество известных элементов (в настоящее время 116). 5 меньше, чем количество известных элементов, поэтому наш ответ правдоподобен.
5 меньше, чем количество известных элементов, поэтому наш ответ правдоподобен. - Укажите свой вариант решения задачи «число протонов в ядре атома»:
Количество протонов = 5
Вопрос 3: Элемент имеет символ Cl. Вычислите количество протонов в ядре атома этого элемента.
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Какой вопрос просит вас сделать?
Рассчитайте количество протонов в атоме элемента с символом Cl
- Какие данные (информация) были указаны в вопросе?
Извлечь данные из вопроса:
Символ элемента: Cl
- Какая связь между тем, что вы знаете, и тем, что вам нужно узнать?
количество протонов = атомный номер элемента = Z
Используйте периодическую таблицу, чтобы найти символ Cl и, следовательно, его атомный номер (Z):
Z(Cl) = 17 - Рассчитайте количество протонов в атоме Cl
Z = атомный номер = количество протонов = 17
- Ваш ответ правдоподобен?
(а) Количество протонов должно быть целым числом, целым числом.
 17 — целое число, поэтому наш ответ правдоподобен.
17 — целое число, поэтому наш ответ правдоподобен.
(b) Атомный номер и, следовательно, количество протонов не может быть больше, чем количество известных элементов (в настоящее время 116). 17 меньше, чем количество известных элементов, поэтому наш ответ правдоподобен. - Укажите свой вариант решения задачи «число протонов в ядре атома»:
Количество протонов = 17
1. IUPAC признает обычно используемые альтернативные варианты написания двух элементов:
Элемент с атомным номером 13 и символом Al может быть записан как алюминий или как алюминий.
Элемент с атомным номером 55 и символом Cs может быть записан как цезий или как цезий.
НО следует отметить, что эти элементы присутствуют в периодической таблице ИЮПАК как цезий и алюминий.
2. В периодической таблице ИЮПАК используются стандартные атомные веса и приводятся нижняя и верхняя границы стандартного атомного веса для некоторых элементов. До сих пор ведутся споры о том, следует ли использовать термин атомная масса, атомный вес, относительная атомная масса, относительный атомный вес или стандартный атомный вес. Не беспокойтесь об этом, в старших классах вы можете рассматривать все эти термины как означающие одно и то же.
До сих пор ведутся споры о том, следует ли использовать термин атомная масса, атомный вес, относительная атомная масса, относительный атомный вес или стандартный атомный вес. Не беспокойтесь об этом, в старших классах вы можете рассматривать все эти термины как означающие одно и то же.
www.ausetute.com.au
Как найти количество электронов, протонов и нейтронов?
Главная > Химия > Как рассчитать количество протонов, электронов и нейтронов?
Все в мире имеет значение. Точно так же, как материя состоит из крошечных неделимых частиц, называемых атомами, эти атомы также состоят из большого числа субатомных частиц. Электроны, протоны и нейтроны являются наиболее важными субатомными частицами, присутствующими в атоме.
Эти три управляют физическими и химическими свойствами атомарных элементов. В этой статье вы узнаете все, что нужно знать об этих субатомных частицах.
В частности, как найти протоны, нейтроны и электроны, присутствующие в конкретном атоме или элементе.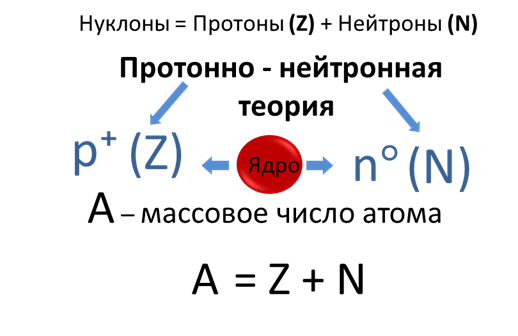 Итак, приступим к чтению!
Итак, приступим к чтению!
- Протоны — это положительно заряженные частицы, находящиеся внутри ядра атома.
- Нейтроны — это нейтральные частицы, находящиеся внутри атомного ядра.
- Электроны представляют собой отрицательно заряженные частицы, вращающиеся вокруг ядра атома.
Основная атомная структура состоит из плотного положительно заряженного ядра, находящегося в центре. Положительный заряд исходит от положительно заряженных протонов. Ядро окружено отрицательно заряженными электронами, удерживаемыми на определенных энергетических уровнях, называемых оболочками. Противоположно заряженные субатомные частицы притягиваются друг к другу силой, известной как ядерная сила притяжения.
Нейтральный атом состоит из равного количества протонов (р) и электронов (е). Таким образом, общий положительный заряд нейтрализуется полным отрицательным зарядом, что приводит к общему нулевому заряду атома, и он остается стабильным.
Масса протона равна массе нейтрона, а электроны обладают пренебрежимо малой массой, т. е. в 1/1836 th умноженной на массу протона или нейтрона.
Субатомная частица | Symbol | Charge | Relative mass (amu) | Actual mass (kg) |
Proton | p + | +1 | 1 | 1.67 x 10 -27 |
Neutron | n | 0 | 1 | 1.67 x 10 -27 |
Electron | e – | -1 | 1/1836 | 9,11 x 10 -31 |
Аббревиатура а.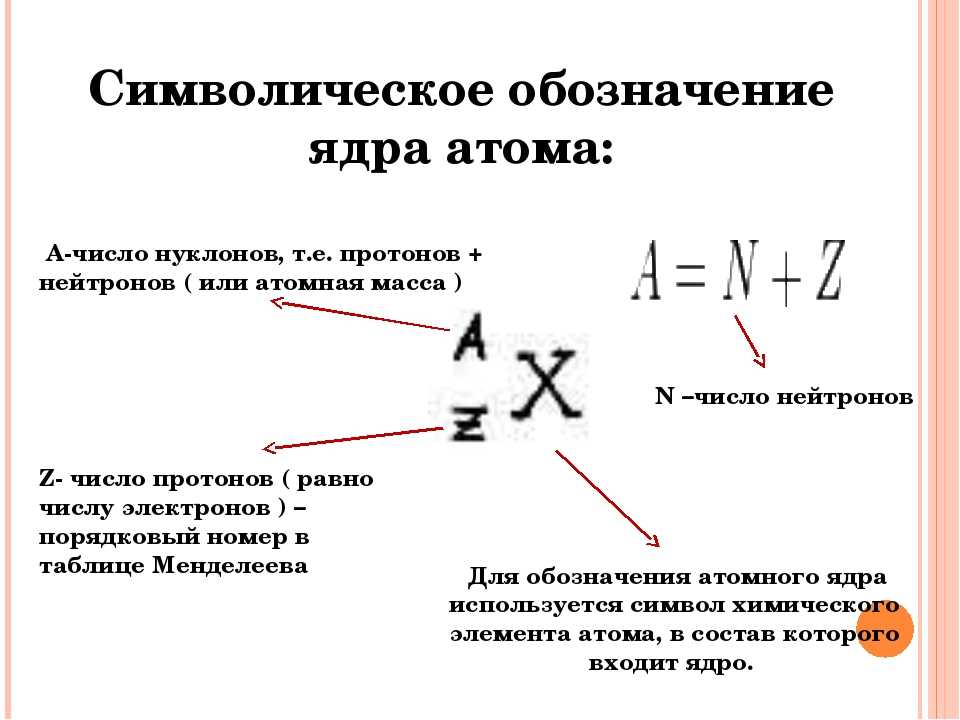 е.м. обозначает атомные единицы массы.
е.м. обозначает атомные единицы массы.
Количество протонов, присутствующих в ядре атома, можно определить по его атомному номеру (символ Z).
С другой стороны, общее количество протонов и нейтронов, присутствующих в атомном ядре, представлено как его массовое число (символ A).
Периодическая таблица представляет собой расположение атомных элементов в порядке возрастания атомного номера.
Следующие шаги помогут вам найти количество протонов, электронов и нейтронов элемента из периодической таблицы.
Шаг I: Прочитайте Периодическую таблицу слева направо и определите данный элемент по его символу.
Например, символом элемента натрия является Na. Он расположен в начале Периодической таблицы в первом столбце (группа IA) и третьем ряду (период № 3).
Шаг II: Число в верхней части символа элемента представляет собой атомный номер (Z). Найдите протоны, присутствующие в элементе, используя уравнение 1.9.0016
Атомный номер Z= количество протонов, присутствующих в атомах этого элемента. (Уравнение 1)
Число над Na равно 11. Таким образом, в атоме натрия присутствует 11 протонов.
Шаг III: Найдите количество электронов, присутствующих в этом элементе. В незаряженном нейтральном атоме количество электронов равно количеству протонов.
Итак, в нейтральном атоме натрия присутствует 11 электронов.
Шаг IV: Найти количество нейтронов, присутствующих в элементе, по формуле 1.
Количество нейтронов = Массовое число (A) — Атомный номер (Z). (Формула 1)
Массовое число – это ближайшее целое значение числа, записанного под символом элемента в Периодической таблице.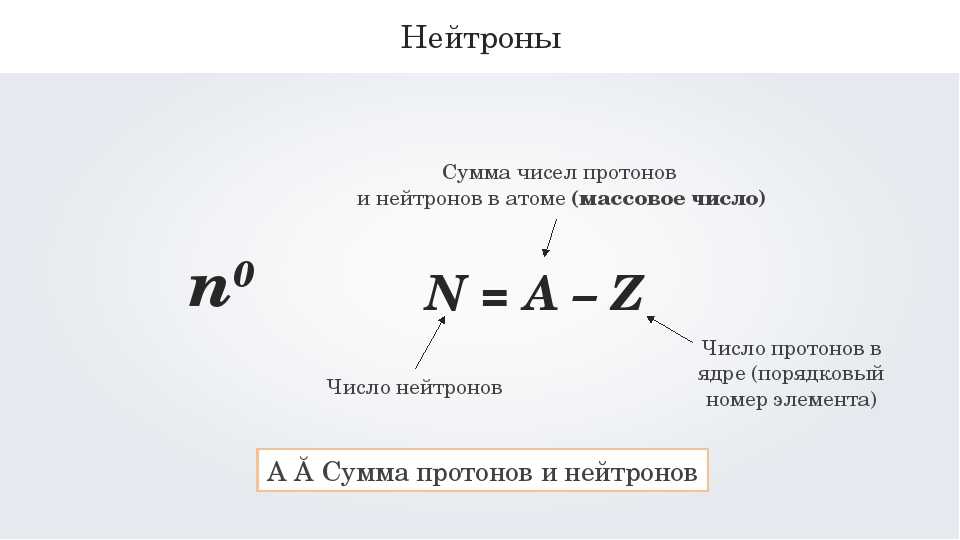 Поскольку массовое число представляет собой сумму протонов и нейтронов, количество нейтронов, присутствующих в атомном элементе, можно определить, вычитая Z из A.
Поскольку массовое число представляет собой сумму протонов и нейтронов, количество нейтронов, присутствующих в атомном элементе, можно определить, вычитая Z из A.
Массовое число натрия равно 23. Таким образом, атом натрия имеет 23-11=12 нейтронов. .
Таким образом, атом натрия (Na) имеет 11 электронов, 11 протонов и 12 нейтронов соответственно.
Как найти количество электронов, протонов и нейтронов, присутствующих в изотопе?Изотопы — это разные формы одного и того же элемента с одинаковым атомным номером, но разными массовыми числами. По этому определению два или более изотопов элемента имеют одинаковое количество протонов и электронов, но количество присутствующих в них нейтронов различается.
Зная обозначения изотопов, а также атомные и массовые числа различных изотопов элемента, мы можем легко найти количество электронов, протонов и нейтронов, присутствующих в них, выполнив все шаги, описанные в предыдущем разделе. .
.
Давайте лучше разберемся в этой концепции с помощью некоторых соответствующих примеров.
Пример №1:
Протий ( 1 1 H), дейтерий ( 1 2 H) и тритий ( 1 3 H) — три изотопа элемента водорода.
для профия ( 1 1 H)
Число протонов = Атомное число = 1
НЕМЕРИЯ НЕКОЛОГО НЕМЕРТА = НОМЕР ОМЕЛА = 1
НЕЧЕСКОЕ НЕЧЕСКОЕ НЕЧИНГА = ПРОТОН = 1
НЕЧЕСКОЕ НЕЧЕР = РИКОН = 1
. атомный номер = 1-1 =0.
Для дейтерия ( 1 2 H)
Количество протонов = атомный номер = 1
Количество электронов = Количество протонов = 1
Количество нейтронов = Массовое число – атомный номер = 2-1 =1.
Для трития ( 1 3 H)
Количество протонов = атомный номер = 1
Количество электронов = количество протонов = 1 1=2.
Итак, теперь вы можете видеть, что все изотопы водорода имеют одинаковое количество присутствующих в них протонов и электронов (т.е. 1 и 1), в то время как нейтроны, присутствующие в них, различаются, т.е.
Пример № 2:
6 12 C, 6 13 C, и 908 908 908 908 908050505050. и 9080505050. и 90805050. и 90. и C, 6 .
Найдем их протоны, электроны и нейтроны.
Для 6 12 C
Количество протонов = атомный номер = 6
Количество электронов = количество протонов = 6
Для 6 13 C
Количество протонов = атомный номер = 6
Количество электронов = количество протонов = 6
Для 6 14 C
Количество протонов = атомный номер = 6
Количество электронов = количество протонов = 6 8.
Все элементы обычно представляют собой комбинацию своих многочисленных изотопов, но относительное содержание определенного изотопа может быть намного больше, чем у других. Поэтому вы, должно быть, заметили, что относительную атомную массу (Ar) элемента обычно записывают в десятичных знаках, а его массовое число принимают за целое число.
Например, Ar углерода составляет 12,011. Но массовое число (A), записанное над индексом C, равно 12, потому что 12 C присутствует в гораздо большей пропорции, чем любой из изотопов 13 C или 14 C в элементе углерода. Относительное содержание изотопа 12 С в углероде составляет 98,89 %, а его изотопа 13 С — 1,11 %. Однако изотоп 14 C присутствует только в следовых количествах.
Массовое число элемента – это его относительная атомная масса (Ar), округленная до ближайшего целого числа. Поэтому всегда следует помнить, что мы используем массовое число, а не относительную атомную массу элемента, чтобы вычислить количество присутствующих в нем нейтронов.
Нейтроны — субатомные частицы; они всегда существуют как целые числа и не могут быть представлены дробями или десятичными точками.
Как найти количество электронов, протонов и нейтронов, присутствующих в ионе?Мы уже говорили вам, что в нейтральном атоме присутствует равное количество протонов и электронов. Но в ионе это не так.
Атомы приобретают электрические заряды и превращаются в ионы путем приобретения или потери одного или нескольких электронов. Прирост электронов приводит к образованию отрицательно заряженных ионов, называемых анионами. С другой стороны, потеря электронов приводит к образованию положительно заряженных ионов, называемых катионами.
Количество протонов и нейтронов, присутствующих в атоме, остается неизменным в его ионной форме. Наоборот, количество присутствующих в нем электронов изменяется в зависимости от приобретенного заряда.
Чтобы найти электроны, присутствующие в ионе:
- Если заряд положительный: Вычтите величину заряда из атомного номера.

- Если заряд отрицательный: Добавьте величину заряда к атомному номеру.
2 Пример № 1:
Ион натрия (NA + ) образуется от атома натрия (NA)
A. Положительный наклон. или количество присутствующего заряда = 1
Атомный номер (Z) атома натрия равен 11
Количество электронов, присутствующих в Na + ион = Атомный номер – величина заряда = 11 -1 = 10
Число протонов и нейтронов, присутствующих в Na 9Ион 0049 + остается прежним, т.е. 11 и 12 соответственно.
Нейтроны являются электрически нейтральными частицами, поэтому они не участвуют в расчетах. Однако потеря одного электрона приводит к дефициту электронов, следовательно, ион Na + имеет больше протонов, чем электронов.
Пример #2:
Ион нитрида (N 3- ) образуется из атома азота (N)
N присутствует отрицательный заряд на
0049 3-Величина или количество присутствующего заряда = 3
Атомный номер (Z) атома азота равен 7
Количество электронов, присутствующих в N 3- ион = Атомный номер + величина заряда = 7+3 = 10
Количество протонов, присутствующих в N 3- = Атомный номер (Z) = 7.
Количество нейтронов, присутствующих в N 3- = Массовое число – атомный номер = 14-7 =7
Прирост трех электронов делает N 3- разновидностью, богатой электронами, поэтому в ней больше электронов, чем протонов.
Как найти количество электронов, протонов и нейтронов в соединении?Соединение определяется как химическое вещество, образованное комбинацией атомов, принадлежащих двум или более различным элементам .
Пример:
Двуокись углерода (CO 2 ) представляет собой соединение, состоящее из одного атома углерода и двух атомов кислорода.
Давайте обсудим, как мы можем найти общее количество электронов, протонов и нейтронов, присутствующих в этом соединении.
Шаг I: Найдите количество электронов, протонов и нейтронов, присутствующих в атоме каждого отдельного элемента соединения.
CO 2 состоит из двух отдельных элементов, т. е. углерода (C) и кислорода (O) Количество нейтронов = массовое число – атомный номер = 12-6 = 6
е. углерода (C) и кислорода (O) Количество нейтронов = массовое число – атомный номер = 12-6 = 6
Кислород
Количество протонов = атомный номер = 8
Количество электронов = количество протонов = 8
Количество нейтронов = массовое число — атомный номер = 16-8 = 8
Шаг II: Определите, сколько атомов каждого элемента присутствуют в соединении.
В CO 1 атом углерода, а в CO 2 атома кислорода 2 .
Этап III: Умножьте количество протонов, электронов и нейтронов, рассчитанное на этапе I, на количество атомов каждого элемента.
1 атом углерода
1 х (6 протонов) = 6 протонов
1 х (6 нейтронов) = 6 нейтронов
1 х (6 электронов) = 6 электронов
2 атома кислорода 9
6 ( 8 протонов ) = 16 протонов
2 x (8 нейтронов ) = 16 нейтронов
2 x (8 электронов) = 16 электронов
Шаг IV: Возьмите сумму всех рассчитанных протонов, нейтронов и электронов.
Общее количество протонов = 6 + 16= 22
Общее количество нейтронов = 6 +16 = 22
Общее количество электронов = 6 + 16 = 22
Итак, всего в CO 2 присутствует 22 протона, 22 нейтрона и 22 электрона.
Количество протонов, электронов и нейтронов в первых 30 элементах периодической таблицы?Periodic Element | Atomic number | Mass number | Protons | Electrons | Neutrons | |||
Hydrogen (H) | 1 | 1 | 1 | 1 | 0 | |||
Helium (He) | 2 | 4 | 2 | 2 | 2 | |||
Lithium (Li) | 3 | 7 | 3 | 3 | 4 | |||
Beryllium (Be) | 4 | 9 | 4 | 4 | 5 | |||
Boron (B) | 5 | 11 | 5 | 5 | 6 | |||
Carbon (C) | 6 | 12 | 6 | 6 | 6 | |||
Nitrogen (N) | 7 | 14 | 7 | 7 | 7 | |||
Oxygen (O) | 8 | 16 | 8 | 8 | 8 | |||
Fluorine (F) | 9 | 19 | 9 | 9 | 10 | |||
Neon (Ne) | 10 | 20 | 10 | 10 | 10 | |||
Sodium (Na) | 11 | 23 | 11 | 11 | 12 | |||
Магний (мг) | 12 | 24 | 12 | 12 | 12 12 | 12 | 0029 | 12 |
Aluminum (Al) | 13 | 27 | 13 | 13 | 14 | |||
Silicon (Si) | 14 | 28 | 14 | 14 | 14 | |||
14 | ||||||||
14 14 | ||||||||
14 14 | ||||||||
14 | ||||||||
14 | ||||||||
15 | 31 | 15 | 15 | 16 | ||||
Sulfur (S) | 16 | 32 | 16 | 16 | 16 | |||
Chlorine (Cl) | 17 | 35 | 17 | 17 | 18 | |||
Argon (Ar) | 18 | 40 | 18 | 18 | 22 | |||
Potassium (K) | 19 | 39 | 19 | 19 | 20 | |||
Calcium (Ca) | 20 | 40 | 20 | 20 | 20 | |||
Scandium (Sc) | 21 | 45 | 21 | 21 | 24 | |||
Titanium (Ti) | 22 | 48 | 22 | 22 | 26 | |||
Vanadium (V) | 23 | 51 | 23 | 23 | 28 | |||
Chromium (Cr) | 24 | 52 | 24 | 24 | 28 | |||
Manganese (Mn) | 25 | 55 | 25 | 25 | 30 | |||
Iron (Fe) | 26 | 56 | 26 | 26 | 30 | |||
Cobalt (Co) | 27 | 59 | 27 | 27 | 32 | |||
Nickel (Ni) | 28 | 59 | 28 | 28 | 31 | |||
Copper (Cu) | 29 | 64 | 29 | 29 | 35 | |||
Zinc (Zn) | 30 | 65 | 30 | 30 | 35 |
| Кто открыл атомный номер (Z)? |
Так как нейтральный (незаряженный) атом имеет одинаковое количество протонов и электронов, то атомный номер (Z) = количество протонов = количество электронов. |
| Что такое массовое число (А)? |
| Массовое число (А) определяется как общее количество протонов и нейтронов, присутствующих в ядре атома. Он рассчитывается путем взятия относительной атомной массы (Ar) элемента из периодической таблицы и округления ее до ближайшего целого числа. |
| Как найти число нейтронов атома по его массовому числу (А)? |
Итак, в ядре атома брома содержится 45 нейтронов. |
| Как найти количество протонов и электронов, когда ион имеет положительный или отрицательный заряд? |
В случае отрицательного заряда: количество электронов = атомный номер + величина заряда. |
| Сколько протонов, нейтронов и электронов присутствует в криптоне, представлено числом 36 83,8 Кр ? |
Количество нейтронов = 84-36 = 48. |
| Как много всего протонов, нейтронов и электронов присутствуют в воде (H 2 O) Molecula, а электроны присутствуют в воде (H 2 O) Molecule? И электроны? |
Итак, молекула H 2 O имеет всего 2+ 8 = 10 протонов, 0 + 8 = 8 нейтронов и 2 + 8 = 10 электронов. |
- Атом состоит из субатомных частиц. Протоны — это положительно заряженные частицы, а нейтроны — нейтральные частицы.
- В ядре атома присутствуют как протоны, так и нейтроны.
- Электроны — это отрицательно заряженные частицы, которые вращаются вокруг ядра на определенных энергетических уровнях.
- Протон и электрон имеют одинаковый, но противоположный заряд.
- Атомный номер (Z) элемента представляет собой общее количество протонов, присутствующих в атоме этого элемента.
- Количество протонов в атоме = Количество электронов = Атомный номер (Z).
- Массовое число (A) представляет собой общее количество протонов и нейтронов, присутствующих в ядре атома.
- Количество нейтронов = массовое число (A) – атомный номер (Z).
- Из периодической таблицы можно определить как атомный, так и массовый номер.



 5 меньше, чем количество известных элементов, поэтому наш ответ правдоподобен.
5 меньше, чем количество известных элементов, поэтому наш ответ правдоподобен. 17 — целое число, поэтому наш ответ правдоподобен.
17 — целое число, поэтому наш ответ правдоподобен.