Атомное ядро | Физика
Итак, атом состоит из атомного ядра и обращающихся вокруг него электронов. А из чего состоит атомное ядро?
В 1932 г. было установлено, что атомное ядро состоит из протонов и нейтронов.
Протон представляет собой положительно заряженную частицу с массой, которая в 1836 раз превышает массу электрона. Электрический заряд протона совпадает по модулю с зарядом электрона:
q = e = 1,6·10–19 Кл.
Ядра разных атомов содержат разное число протонов. Например, в ядре атома водорода лишь один протон, в ядре атома кислорода восемь, в ядре атома урана девяносто два.
Число протонов в ядре совпадает с порядковым номером соответствующего элемента в таблице Д. И. Менделеева. С этим же номером совпадает и число электронов в атоме. А раз так, то число протонов в ядре равно числу электронов, обращающихся вокруг этого ядра, и потому обозначается той же буквой:
Z — число протонов в ядре.
Помимо порядкового номера, в таблице Д. И. Менделеева для каждого химического элемента указано еще одно число, которое, будучи округленным до целого числа, показывает общее число частиц (протонов и нейтронов) в атомном ядре (см. форзац). Оно обозначается буквой А и называется массовым числом:
Менделеева для каждого химического элемента указано еще одно число, которое, будучи округленным до целого числа, показывает общее число частиц (протонов и нейтронов) в атомном ядре (см. форзац). Оно обозначается буквой А и называется массовым числом:
A — массовое число ядра.
Нейтрон представляет собой нейтральную частицу с массой, которая в 1839 раз превышает массу электрона. Электрический заряд нейтрона равен нулю:
qn = 0.
Число нейтронов в атомном ядре обозначается буквой N. Оно находится по формуле
N = A – Z.
Чтобы найти число нейтронов в ядре, надо из массового числа этого ядра вычесть число протонов в нем.
Поскольку нейтроны не имеют заряда, то электрический заряд атомного ядра совпадает с суммарным зарядом протонов, находящихся в данном ядре.
Протоны и нейтроны удерживаются в ядре особыми — ядерными — силами. Эти силы в сто раз превосходят электрические и потому не дают одноименно заряженным протонам разлететься в разные стороны. Характеристикой устойчивости атомного ядра является его энергия связи (Eсв). Так называют энергию, которую необходимо затратить, чтобы расщепить ядро на отдельные частицы. В ядерной физике эту энергию принято измерять в мегаэлектронвольтах (МэВ):
Характеристикой устойчивости атомного ядра является его энергия связи (Eсв). Так называют энергию, которую необходимо затратить, чтобы расщепить ядро на отдельные частицы. В ядерной физике эту энергию принято измерять в мегаэлектронвольтах (МэВ):
1 МэВ = 1,6 · 10-13 Дж (табл. 1).
Элементарные частицы (электроны, протоны и др.), а также атомные ядра невозможно увидеть ни в один микроскоп, даже электронный. Тем не менее с помощью специальных приборов о них можно узнать много важного. Например, пролетая через так называемую камеру Вильсона, заряженная частица ионизирует встречные молекулы пара, которым наполнена камера, и тем самым создает вдоль своего пути цепочку ионов. В результате конденсации на этих ионах пара образуется трек — туманный след из капелек воды. Изучение этого трека позволяет определить многие характеристики пролетевшей частицы. В других приборах (например, счетчиках Гейгера) прохождение каждой частицы вызывает кратковременное появление электрического тока, что позволяет вести их счет. Некоторые из подобных приборов используют в качестве дозиметров — устройств для определения доз облучения, знание которых необходимо для обеспечения безопасности работы при наличии ионизирующих излучений.
Некоторые из подобных приборов используют в качестве дозиметров — устройств для определения доз облучения, знание которых необходимо для обеспечения безопасности работы при наличии ионизирующих излучений.
При столкновениях атомных ядер друг с другом, а также с какими-либо иными частицами эти ядра могут превратиться в ядра других атомов. Например, при столкновении ядра атома урана с нейтроном могут образоваться ядра атомов ксенона и стронция, а также два новых нейтрона:
n + U → Xe + Sr + 2n, (4.1)
а в результате столкновения ядра атома водорода с ядром атома углерода может появиться ядро атома азота:
H + C → N. (4.2)
Подобные превращения называют ядерными реакциями. При этом реакции типа (4.1), при которых тяжелые ядра превращаются в более легкие, называют реакциями деления, а реакции типа (4.2), при которых из легких ядер образуются более тяжелые,— реакциями синтеза.
Превращения атомных ядер не могут быть какими угодно. В природе происходят только такие ядерные реакции, при которых сохраняется общий электрический заряд частиц, а также их суммарное массовое число.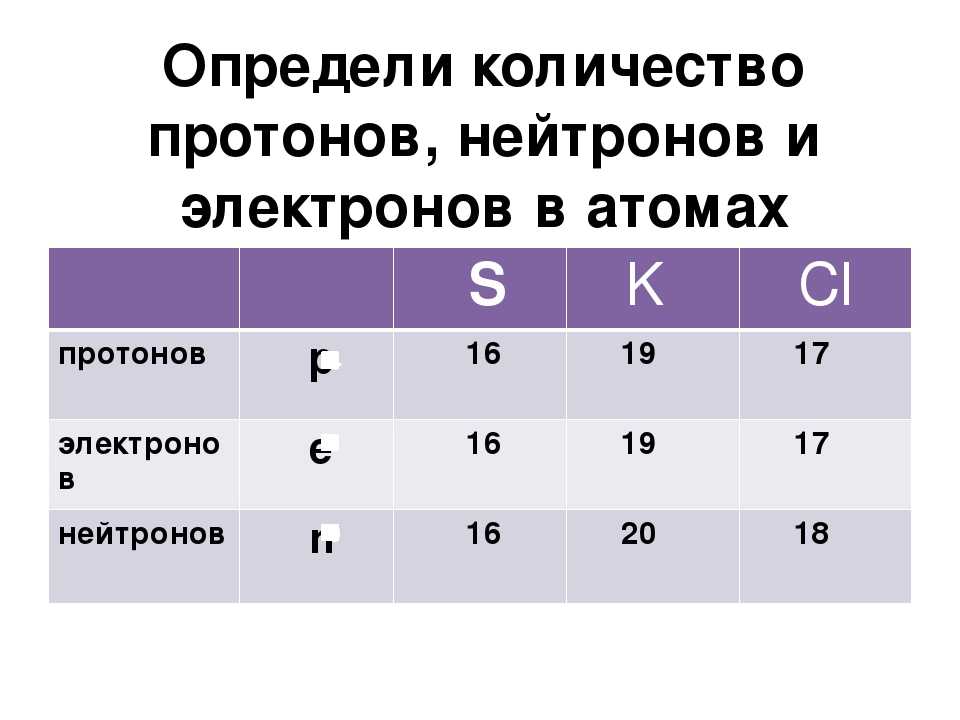
В ходе ядерных реакций может выделяться значительная энергия. Например, при делении атомных ядер, содержащихся в 1 г урана, выделяется примерно такая же энергия, что и при сжигании 3 т угля! Благодаря этому ядерные реакции находят широкое применение в атомной энергетике (АЭС).
??? 1. Из каких частиц состоит атомное ядро? Что вы знаете об этих частицах? 2. Как находится число протонов в ядре? 3. Что такое массовое число? 4. Как находится число нейтронов в ядре? 5. Что представляют собой ядерные реакции? Приведите примеры таких реакций. 6. Почему ядерные реакции находят широкое применение в атомной энергетике? 7. С помощью каких приборов регистрируют и изучают заряженные частицы? 8. Сколько частиц входит в состав ядра атома водорода? 9. В курсе физики старших классов будет доказано, что энергия, выделяющаяся в той или иной ядерной реакции, равна разности суммарных энергий связи образующихся и исходных ядер. Воспользовавшись этим фактом, определите, какая энергия выделяется в реакциях (4. 1) и (4.2).
1) и (4.2).
Атомы химических элементов
- Строение атома
- Электронная формула
- Металлические и неметаллические свойства
- Электроотрицательность
- Ковалентная неполярная химическая связь
- Ковалентная полярная химическая связь
- Ионная химическая связь
- Металлическая связь
Строение атома
Сегодня мы поговорим об атоме, его строении и свойствах атомов.
Каждый атом состоит из ядра и оболочки.
Ядро атома состоит из протонов и нейтронов. Протон это частица, которая имеет заряд +1 и атомную массу 1.
Нейтроны не имеют заряда (они нейтральны), но имеет массу, равную единице. Сумма всех протонов ядра называется зарядом ядра и обозначается заглавной буквой Z. Сумма нейтронов обозначается заглавной буквой М. Нетрудно догадаться, что так как нейтроны нейтральны, а протон имеет заряд плюс один, то все ядро будет заряжено положительно.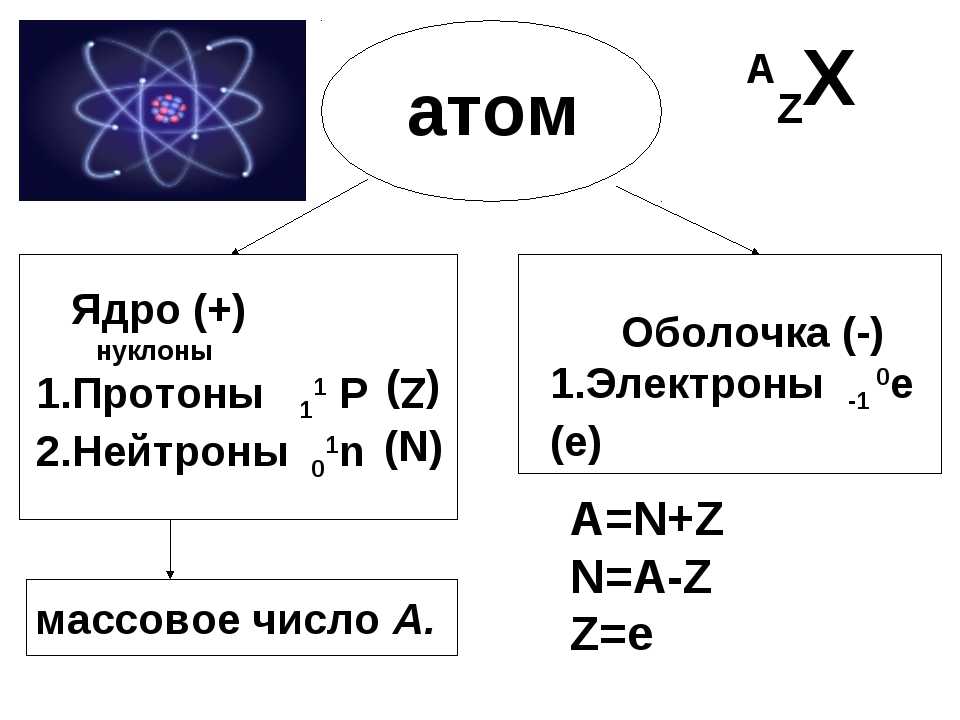
Так как и протоны, и нейтроны имеют массу, равную единице, то существует какая-то величина, выражающая массу ядра. Она называется массовым числом и обозначается заглавной буквой А. Оно равно сумме протонов и нейтронов.
В периодической системе Менделеева вещества расположены в конкретном порядке. В каждой ячейке рядом с обозначением элемента есть цифры.
Есть цифра, которая обозначают заряд ядра (Z), то есть количество протонов. Есть цифра, которая, обозначает массовое число A.
AXZ
Химическим элементом называются атомы веществ, которые содержат одинаковое количество протонов.
Ядра химических элементов неустойчивы, и количество нейтронов в них может меняться, они могут приходить и уходить.
Если количество протонов в некоторых атомах одинаковое, а количество нейтронов разное, то и массовое число у них тоже будет разным. Такие атомы называются изотопами. Например, существуют изотопы лития
6Li37Li3
Также существуют такие химические элементы, у которых будут одинаковое массовое число, но разное число протонов. Такие элементы называются изобары. Конечно же, это разные химические элементы.
Такие элементы называются изобары. Конечно же, это разные химические элементы.
40К1940Ca20
Вокруг ядра присутствует оболочка электронов. Электроны имеют настолько маленькую массу, что в некоторых случаях мы говорим, что она равна нулю.
Электрон имеет отрицательный заряд. И есть такое правило, что в нормальном состоянии количество протонов должно равняться количеству электронов. И этого следует, что наш атом будет заряжен нейтрально, то есть отрицательный заряд будет равен положительному.
Электронная формула
Давайте посмотрим, как можно записать электронную формулу, которая будет отображать структуру электронных оболочек в атоме.
Мы говорили, что существуют энергетические уровни, число которых равно номеру периода. В этом энергетическом уровне есть подуровни.
В каждом подуровне есть орбитали. В первом s-подуровне 1 орбиталь, в p-подуровне 3 орбитали, в d-подуровне 5 орбиталей и в f-подуровне 7 орбиталей.
Как же они обозначаются?
s(1) = _
p(3) = _ _ _
d(5) = _ _ _ _ _
f(7) = _ _ _ _ _ _ _
Электронная формула химического элемента отражает то, как электроны в атоме химического элемента располагаются по энергетическим уровням и на орбиталях в подуровнях.
Давайте возьмем водород, у которого есть только один электрон, и который находится в 1 периоде и 1 группе. У него 1 уровень и 1 подуровень. Количество орбиталей тоже равно 1.
Электронную формулу водорода можно записать в таком виде
1H 1s1
Существует три принципа составление электронных формул:
- Первый принцип гласит, что электроны заполняют орбитали в порядке возрастания энергии. Сначала заполняется s-подуровень, затем p-подуровень и т.д.
- Второй принцип Паули говорит о том, что в одной орбитали может быть не более двух электронов.
- Третье правило говорит о том, что сначала электроны будут заполнять свободные орбитали по одному, а зачем, если останутся лишние электроны, они будут по второму кругу заполнять орбитали.

Индекс около знака подуровня (s2, p3) обозначает количество электронов на орбиталях этого подуровня.
Давайте попробуем составить формулу электронную лития.
3Li — 1s22s1
Литий имеет номер 3, то есть у него всего 3 электрона. Он находится во втором периоде, значит у него два уровня. Он находится в первой группе, значит у него один внешний электрон.
Номер группы говорит о том, сколько внешних валентных электронов в нашем атоме. Валентные электроны участвуют в образовании химической связи.
Рассмотрим также элемент кальций.
20Ca — 1s22s2p63s2p64s2
В общем случае электроны располагаются по орбиталям по правилу Клечковского и в соответствии с принципами, описанными выше.
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d и т.д.
Металлические и неметаллические свойства
Металлические свойства элементов — это свойство атомов отдавать электроны.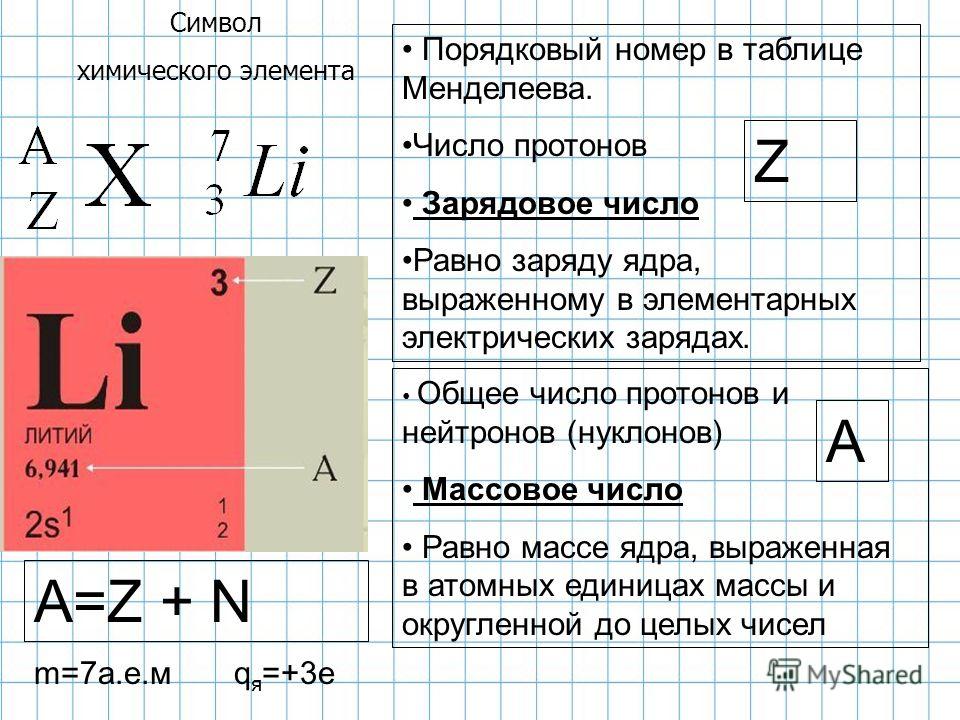 Например, у металлов, как правило, на внешнем энергетическом уровне находится от одного до трех электронов.
Например, у металлов, как правило, на внешнем энергетическом уровне находится от одного до трех электронов.
Неметаллические свойства — это способность принимать на себя электроны. У этих элементов на внешнем энергетическом уровне будет находиться от 4 до 8 электронов.
Давайте разберемся, как по периодической системе элементов можно понять, какими свойствами обладает тот или иной элемент.
Мы знаем, что в одном периоде у атомов одинаковое количество электронных слоёв, но количество электронов увеличивается. Электронов становится больше и они с большей силой притягиваются к ядру. Следовательно, терять электроны атому будет намного сложнее. А свойство принимать электроны будет увеличиваться.
В одной группе, наоборот, у атомов одинаковое количество внешних электронов, но увеличивается количество электронных слоев. Электроны располагаются от ядра все дальше, следовательно, больше шанс потери электронов у атома. Способность принимать чужие электроны у атома уменьшается.
В итоге, в периодической системе в группе сверху вниз и в периоде справа налево увеличиваются металлические свойства элементов, а в группе снизу вверх и в периоде справа налево увеличиваются неметаллические свойства.
Таким образом, мы теперь можем сравнивать разные элементы по их свойствам.
Электроотрицательность
Когда два атома взаимодействуют с образованием химической связи, один из атомов либо притягивает на себя электроны, либо отталкивает в зависимости от его неметаллических свойств.
Электроотрицательность — это способность перетягивать на себя электроны другого атома. Она выражается в конкретных числах, но слишком сложна для запоминания. Поэтому для удобства взяли за единицу электроотрицательность лития и остальные все элементы выражаются относительно этого элемента.
Li=1
Na=0,9
C=2,5
O=3,5
F=4
Таким образом, зная электроотрицательность элементов, можно делить их на металлы и неметаллы.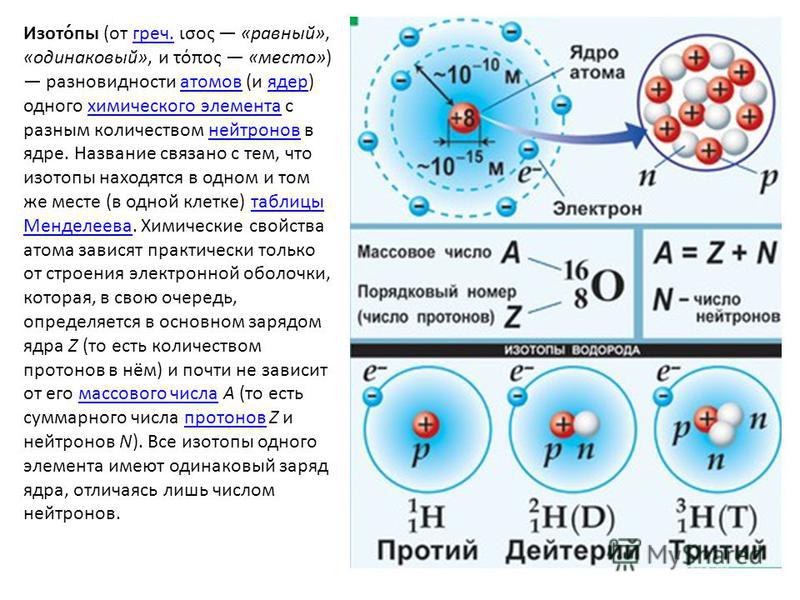 Как правило, у металлов электроотрицательности не превышает 2. У неметаллов она больше 2.
Как правило, у металлов электроотрицательности не превышает 2. У неметаллов она больше 2.
При образовании химической связи вещество с большей электроотрицательностью будет притягивать к себе электроны другого атома с меньшей электроотрицательностью. В этом и заключается основная сущность химической связи, про которую мы поговорим далее.
Химическая связь между атомами может быть четырех видов:
- когда у двух элементов одинаковая электроотрицательность (ковалентная неполярная)
- когда у двух элементов электроотрицательность разная, но разница несущественная (ковалентная полярная)
- когда электроотрицательность сильно различается (ионная)
- металлическая связь
Ковалентная неполярная химическая связь
Первый вид связи, а именно ковалентная неполярная химическая связь, может быть у двух одинаковых элементов неметаллов. Так образуются газы водород (H2), азот (N2), кислород (О2).
Давайте посмотрим, как это происходит на примере водорода. У водорода один электрон, он находится в первом периоде и 1 группе. Соответственно, для заполнения внешнего уровня ему не хватает всего одного электрона. Чтобы его забрать он взаимодействует с другим атомом водородом с образованием общей электронной пары. Таким образом, эта общая электронная пара становится общей для того и для другого атома водорода, и в какой-то момент эти уровни заполняются до последнего.
H. + H. = H:H
Такой вид связи будет называться классическая ковалентная неполярная, так как эта общая электронная пара не будет смещаться ни к тому, ни к другому атому, потому что их электроотрицательность одинаковая.
Более сложный пример — это атом азота.
N… + N… = N:::N
Мы знаем, что у азота на внешнем уровне три неподеленных электрона. Чтобы заполнить до конца этот внешний уровень ему нужно ещё три электрона, которые он берёт у такого же атома азота.
Ковалентная полярная химическая связь
Рассмотрим вид химической связи, когда электроотрицательность различается несущественно на примере галогеноводородов, а именно взаимодействии водорода и хлора.
Вспомним, что у водорода один электрон на внешней оболочке, хлор находится в третьем периоде и 7-й группе. У него на внешнем уровне 7 неспаренных электронов.
Ковалентная полярная связь будет выглядеть следующим образом:
Можно увидеть, что единственный электрон водорода сместился к хлору, потому что у хлора большая электроотрицательность. Атом хлора сильнее притягивает на себя электрон водорода. У этих атомов получаются неполные частичные заряды. У атома хлора установится частичный отрицательный заряд, а у водорода, от которого немного отсоединился электрон, появляется частично положительный заряд.
Эти частичные заряды частичные, и поэтому они меньше единицы, при этом атомы не становятся ионами.
Ионная химическая связь
Ионные химические связи образуется между атомами, у которых очень большая разница в электроотрицательности. Эти элементы находятся в периодах и в группах периодической системы далеко друг от друга.
Рассмотрим этот вид связи на примере взаимодействия натрия и фтора.
Электроотрицательность натрия равна 0,9, а у фтора 4. Это довольно большая разница.
У натрия, который находится в первой группе, на внешнем энергетическом уровне находится один Электрон, у фтора на внешнем энергетическом уровне находятся семь электронов, так как он находится в седьмой группе.
Для заполнения и того, и другого внешнего слоя они необходимы друг другу. Но так как у них достаточно большая разница в электроотрицательности, натрий отдает фтору свой внешний электрон полностью и становится заряженным положительно. Атом фтора с стильными металлические свойствами этот электрон забирает и становится заряженным отрицательно.
Na0 + F0 = Na+F—
Наши атомы стали положительно заряженными и отрицательно заряженными.
Атомы, которые меняют свой заряд в зависимости от того, принимают они на себя электронный заряд или отдают, называются ионами, поэтому и химическая связь называется ионная.
Металлическая связь
Металлы не находятся в природе в виде отдельных атомов. Вы никогда не увидите отдельно лежащий атом натрия или алюминия. Металлы находятся в природе в виде кристаллов и имеют структуру в виде кристаллической решетки.
Давайте разберем это на примере пластинки алюминия.
Если мы посмотрим в периодическую таблицу, мы увидим, что алюминий находится в третьей группе. Это значит, что на внешнем энергетическом уровне у него три электрона. Эти электроны могут свободно открепляться от нашего атома, и атом алюминия будет превращаться в положительно заряженный ион.
Это происходит не у всех атомов алюминия, то есть некоторые атомы отдают свои три электрона, а некоторые пока остаются в неизменном виде.
Свободно циркулирующие по металлической решетке электроны присоединяться к другим положительно заряженным ионам алюминия.
Положительно заряженные ионы алюминия будут превращаться опять в обычные атомы алюминия.
В чём же сходство и отличие металлической связи от ионной и ковалентной связи?
Как и ионная, металлическая связь тоже образована ионами, но в металлической связи присутствуют только положительно заряженные ионы и нейтральные атомы.
Связь между ними осуществляется с помощью электронов, которой движутся вокруг них.
неорганическая химия — Расчет числа нейтронов в образце
спросил
Изменено 5 лет, 11 месяцев назад
Просмотрено 5к раз
Что из следующего содержит один моль нейтронов? 9{23}_{10}Не}$
Вот вопрос, на который я не знаю, как ответить. Я попытался использовать уравнение:
Я попытался использовать уравнение:
моль = масса/мр
, но это не соответствовало данному ответу, то есть (C). Я продолжаю делать 2/24, что не похоже на 1 моль.
- неорганическая химия
- атомы
$\endgroup$
0
$\begingroup$
Формула
$$\text{количество вещества} = \frac{\text{масса}}{\text{молярная масса}}$$
говорит вам, что у вас есть 1/12 моля магния , так как вы взяв массу магния (2 г) и разделив на молекулярную массу магния (24 г/моль). Однако вопрос не задается о количестве молей магния .
Каждый атом магния имеет 24 — 12 = 12 нейтронов. Следовательно, 1/12 моля магния содержит (1/12)(12) = 1 моль нейтронов.
$\endgroup$
$\begingroup$
Ответ A не имеет нейтронов
Ответ B содержит 1/12 моля углерода с 6 молями нейтронов на моль.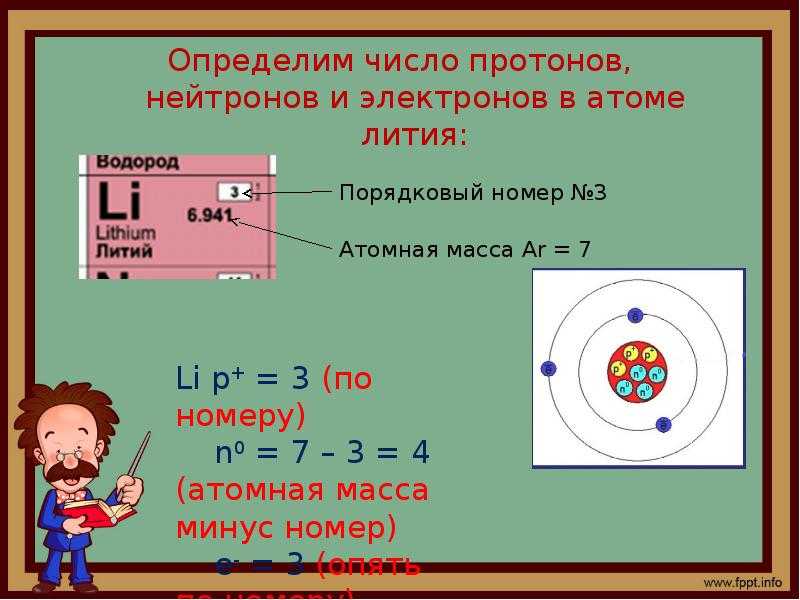 Итак, есть только половина моля нейтронов.
Ответ C содержит 2/24 или 1/12 моля Mg с 12 молями нейтронов (и 12 молями протонов) на моль Mg. 12/12 = 1, ответ.
Ответ D содержит 2/23 моля Ne с 23-10 молями нейтронов на моль Ne. Значит в ответе больше 1 моля нейтронов.
Итак, есть только половина моля нейтронов.
Ответ C содержит 2/24 или 1/12 моля Mg с 12 молями нейтронов (и 12 молями протонов) на моль Mg. 12/12 = 1, ответ.
Ответ D содержит 2/23 моля Ne с 23-10 молями нейтронов на моль Ne. Значит в ответе больше 1 моля нейтронов.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Рассчитать количество протонов и нейтронов в изотопах азота 13N, 14N, 15N, 16N и 17N
Вопрос: Азот (атомный номер 7) имеет стабильные изотопы (период полураспада более 1 секунды) с массовыми числами 13, 14, 15, 16 и 17. Рассчитайте количество протонов и нейтронов в каждом из изотопов азота.Решение:
Атомный номер (Z) азота равен 7. Атомный номер всегда равен количеству протонов. А число протонов всегда равно числу электронов в незаряженном атоме, так что атом электрически нейтрален.
Следовательно, незаряженный атом азота всегда имеет 7 протонов и 7 электронов.
Изотоп образуется при изменении числа нейтронов в атоме одного и того же элемента. Это изменяет массовое число в ядре атома, поскольку массовое число А представляет собой сумму протонов и нейтронов. Число протонов остается неизменным.
массовое число A= количество протонов (p) + количество нейтронов (n)
массовое число записывается в виде надстрочного индекса рядом с символом элемента, например,
So, the number of neutrons in different Nitrogen isotopes 13 N, 14 N, 15 N, 16 N, and 17 N is-
13 N Изотоп:
Массовое число = 13 (Дано)
Массовое число (A) = число протонов (p) + число нейтронов (n)
A= p+ n
Следовательно, n= A-p = 13 -7 = 6.
Решение с использованием таблицы журнала-
n= A-p
Applying log 10 on both sides
log 10 n= log (A-Z)
log 10 n= log 10 (13-7) =log 10 6 = 0,7782
Применение антилога,
n = антилога (0,7782)
6.001 = 6
Количество нейтронов в 13 N Изотоп составляет 6, а количество протонов составляет 7,
919191919191919191919191991 гг. 14 N Изотоп
Массовое число = 14 (Дано)
Массовое число (A) = число протонов (p) + число нейтронов (n)
A= p+ n
Следовательно, n= A-p = 14-7 = 7.
Решение с использованием журнала Table-
N = A-P
Применение log 10 с обеих сторон
Log 10 n = log 9014 (140009
10 n = log 9014 4
. -7) = log 10 7 =0,8451
Применение антилогарифмического,
n = антилогарифмическое (0,8451) = 7
Количество нейтронов в 14 N изотоп составляет 7, а количество протонов составляет 7.
15
MASS Number = 15 (данный)
9 массовое число (A) = количество протонов (p) + количество нейтронов (n)A= p+ n
Следовательно, n= A-p = 15 — 7 = 8.
Решение с использованием логарифмической таблицы- n= A-p
Бревно для нанесения 10 с обеих сторон
log 10 n = log (a-z)
log 10 n = log 10 (14-7) = log 10 8 = 0,9031
. = 8
Количество нейтронов в 15 N Изотоп составляет 8, а количество протонов составляет 7.
16 N Изотоп
Масса
массовое число (A) = количество протонов (p) + количество нейтронов (n)
A = P+ N
Следовательно, n = A-P = 16- 7 = 9.

